Method Article
マウス頭蓋組織および非除電骨の組織調製と免疫染色
* これらの著者は同等に貢献しました
要約
ここでは、マウス頭蓋組織を例に免疫染色することにより、頭蓋顔面形態/病因の間のタンパク質レベルを検出し、定量するための詳細なプロトコルを提示する。また、免疫染色のための若いマウスからの非デカル化された硬質組織の調製および凍結切除の方法について説明する。
要約
組織免疫染色は、所定の組織内の目的のタンパク質の非常に特異的で信頼性の高い検出を提供します。ここでは、マウス頭蓋組織を例にした頭蓋骨形成/病因の間にタンパク質発現を検出するための完全で簡単なプロトコルについて説明する。このプロトコルは、組織の調製および凍結切除、間接免疫蛍光、画像取得、および定量化で構成されます。また、免疫染色のための非デカール化硬組織の調製および凍結切除のための方法が記載されており、例として頭蓋顔面組織および長骨を用いる。これらの方法は、頭蓋骨形成/病因の間に様々な組織におけるタンパク質発現および形態学的/解剖学的変化を決定する鍵となる。それらは適切な変更を加える他の組織にも適用可能である。血管学の知識とセクションの高品質は、実験的な結果から科学的な結論を引き出すために重要です。この方法論の潜在的な制限には、抗体の特異性および定量化の困難が含まれるが、これらに限定されない。
概要
顔は人間のアイデンティティの重要な部分であり、上皮、筋肉、骨、軟骨、歯など、いくつかの異なるタイプの組織で構成されています。これらの組織は、外胚芽、内皮、中胚芽1、2の3つの胚芽層すべてに由来する。頭蓋組織の適切なパターン化と開発のためには、細胞増殖、死亡および分化は、Wnt、Fgf、HhおよびBmp経路3、4などの特定のシグナル伝達経路によって高度に調整され、調節される必要がある。、5.細胞の増殖、生存または分化の欠陥は、最も頻繁に発生する先天性先天性欠損の一つである頭蓋骨の奇形につながります。トランスジェニックマウスは、頭蓋骨形成および病態1、2、3、4、5のメカニズムを研究するのに有用なツールである。発達と病因の間の頭蓋の構造の変化を理解することは、主要な発達原理と頭蓋顔面奇形のメカニズムを明らかにするのに役立ちます1,2,3 、4、5.
特定の抗体を用いたマウント全体または断面組織の染色は、目的のタンパク質6の空間分布を決定するための非常に貴重な技術である。正式には、組織免疫染色は、免疫組織化学(IHC)または免疫蛍光(IF)のいずれかに依存することができます。IHCによる3,3'-Diaminobenziジン(DAB)などの発色基板で生成された不透明反応生成物と比較して、IFは蛍光顕微鏡で見える蛍光コンジュゲートの使用を含む。したがって、IFは明らかにポジティブな細胞をバックグラウンドノイズから区別し、ImageJやAdobe Photoshop 7、8などのソフトウェアによって画像を定量的に分析し、強化することができる。全体のマウント染色アプローチは、セクション9、10からの再建を必要とせずにタンパク質/抗原の位置に関する3次元情報を提供することができ、組織の小さなブロック(厚さ5ミリメートル未満)で動作します。.しかし、組織切片と比較して、マウント免疫染色全体は時間がかかり、大量の抗体溶液を必要とします。すべての抗体が基本的なマウントアプローチと互換性があるわけではありません。さらに、抗体の不完全な浸透は、不均一な染色または偽陰性染色をもたらす。ここでは、切除組織上のタンパク質/抗原の免疫蛍光検出に焦点を当てます。硬い組織(例えば、頭部、歯、長骨)の場合、発症/病因の間のカルシウム沈着は、サンプルを切除しにくくし、免疫染色治療中に容易にすすいでくるぐる。現在利用可能なプロトコルのほとんどは、セクション化を容易にするために埋め込む前に硬い組織をデカール化し、これは時間がかかり、不適切に扱われた場合、サンプルの形態および抗原を破壊する可能性があります11,12.この問題を克服するために、脱石せずに硬質組織を凍結切除するアプローチを最適化し、その形態の可視化とシグナル伝達タンパク質の分布を改善しました。
ここで説明するプロトコルは、BMPトランスジェニックマウスの頭蓋骨組織における形態学的および組織学的変化を決定するために使用されている。具体的には、プロトコルは、(1)頭部組織の収穫と解剖、(2)実験マーカーの切片および免疫染色(Ki67、pSmad1/5/9)およびTUNEL染色、(3)蛍光顕微鏡を用いた切片のイメージング、および最後に(4)を含む。結果の分析と定量化を行います。デカル化せずに硬質組織を調作および凍結切除するプロトコルも13について説明する。これらの方法は頭蓋顔面組織用に最適化されています。それらはまた適切な修飾が付いているサンプルのさまざまな年齢からの他のティッシュに適用可能である。
プロトコル
すべてのマウス実験は、ミシガン大学のガイドラインに従って、動物の人道的ケアと研究における動物の使用をカバーして行われました。この研究で使用されるすべての動物の手順は、ミシガン大学の機関動物ケアおよび使用委員会(IACUC)によって承認されました(プロトコル#PRO00007715)。
1. 組織製剤
-
胚組織の調製
- 10cm皿1枚とリン酸緩衝生理食(PBS)を含む3.5cmの皿を1つと、妊娠マウスごとにPBSに2mL 4%パラホルムアルデヒド(PFA)を含む12ウェル培養プレートを1つ用意します。すべてのペトリ皿とプレートを氷の上に置きます。
注:ヒュームフードで4%PFAを取り扱います。 - 前述の14.14のように、妊娠中のマウスから鉗子とはさみで氷冷PBSで胚を解剖する。
- 簡単に言えば、CO2で妊娠マウスを安楽死させ、鉗子で腹の中心の下の皮膚をつかみ、皮膚だけを切り取り、その後、腹部の筋肉壁の下からそれを分離するために皮膚を穏やかに引っ張る。
- 次に、皮膚切開の同じラインに続いて腹腔に切り込む。胚の文字列を含む子宮を取り除き、子宮壁をそっと切り取って胚を取り除く。黄身嚢やアムニオンなどの胚外組織が除去されます。
- 各胚から頭部を切断し、分離する。
- プラスチック転写ピペットまたは鉗子で4%のPFAを含む12ウェルプレートの各ウェルに各ヘッドを転送します。4°Cで4°CのPFAで4°Cのサンプルを4°Cで4°Cで洗浄し、4°Cで4°Cのサンプルを12時間の穏やかな振盪で固定します。
注:胚の日16.5(E16.5)より若い胚の場合は、単離直後に4%のPFAで胚頭を固定する。E16.5以降の胚の場合は、皮膚および脂肪組織を頭部から廃棄し、固定前に氷冷PBSで数回すすいで除去する。 - クライオプロテクトヘッド。
- プラスチック転写ピペットまたは鉗子を使用してPBSで30%ショ糖の2 mLを含む新しい12ウェルプレートに各ヘッドを転送します。頭が皿の底に沈むまで4°Cで穏やかに攪拌する。
- ヘッドを埋め込む。
- 凍結保護されたヘッドを最適な切断温度(OCT)化合物を含む金型に移します。OCTで数分間サンプルを平衡化します。鉗子でサンプルの位置と方向を調整します。
- ドライアイスの上に金型を置き、凍結させます。クライオセクションの準備ができるまで、-80°Cのビニール袋に得られたクライオモルドを保管してください。
注:サンプルのトリミングされた側は、埋め込み金型の底部に面している必要があります。
- 10cm皿1枚とリン酸緩衝生理食(PBS)を含む3.5cmの皿を1つと、妊娠マウスごとにPBSに2mL 4%パラホルムアルデヒド(PFA)を含む12ウェル培養プレートを1つ用意します。すべてのペトリ皿とプレートを氷の上に置きます。
-
出生後の非デカール化硬組織の調製
- CO2で3週間または3ヶ月齢のマウスで安楽死させる。皮膚と脂肪組織を取り除きます。頭や長い骨をマウスから切り取って分離します。
- ステップ1.1.3-1.1.4に記載されているように、マウスの頭部または長い骨を修正し、凍結保護する。
- ステップ1.1.5と同様の方法で8%ゼラチンに埋め込む。凍結切除まで-80°Cのビニール袋にクライモルドを保管してください。
注:ここではデカルシングは必要ありません。8%のゼラチンを調分するには、8gのゼラチンを100mLのPBSと混ぜ、電子レンジで沸騰させます。混合物は簡単に沸騰していることに注意してください。
2. クライオ断面
- クヨスタット温度を、OCTに埋め込まれた軟部組織の場合は-18 °C、ゼラチンに埋め込まれた非割り分けされた硬質組織の場合は-18 °C に設定します。クライオスタット温度に平衡化するために、約30分間クライオスタット室でサンプルを保持します。
- ブロックをクライモルドから追い出します。OCTドロップで取り付けによって試料チャック(ティッシュホルダー)にブロックを凍結します。サンプルのトリミングされた側面をチャックから最も遠く(オペレータに向かって)に保ちます。
- ブロックマウントチャックをクライオスタットオブジェクトホルダーにロードします。ブレードホルダーを調整して、ブレードの角度をサンプルに対して3°~5°にします。
- コーティングされた顕微鏡スライドに10 μmのセクションを集める。RTで完全に乾燥したセクションを、-80 °Cに保存します。
3. 組織染色と顕微鏡イメージング
- 免疫蛍光染色
- -80 °Cからスライドを取り出します。RTで1時間のスライドをエアドライセクションに保管してください。0.1%PBST(PBSのポリエチレングリコールテルトオクチルフェニルエーテル、材料の表を参照)で0.1%のスライドを洗い流し、OCTを洗い流し、セクションを透過します。
- 必要に応じて、抗原検索を実行する(オプション)。
- クエン酸バッファー(10mMクエン酸ナトリウムpH6)を蒸し器または水浴で95〜100°Cに染色皿に入れます。ク硝子バッファーにスライドを浸し、10分間インキュベートする。
- スチーマーや水風呂からRTに染色皿を取り出し、RTで20分以上15分のスライドを冷却します。
注:代替手段として、トリス-EDTAバッファー(10 mMトリスベース、1mM EDTA、0.05%ツイーエン20、pH 9.0)またはEDTAバッファー(1mM EDTA、0.05%トウェン20、pH 8.0)を熱誘発抗原回収に使用します。熱スチーマーに加えて、熱誘発抗原検索には圧力鍋、電子レンジ、または水浴を使用してください。トリプシンまたはペプシンを用いて酵素誘発抗原検索は別の選択肢である。有害なセクションを避けるために酵素検索の濃度と治療時間を最適化します。抗体/抗原の組み合わせごとに抗原検索方法を最適化します。
- RTで200μLのブロッキング溶液(0.1%PBSTで希釈した5%)で各スライドをインキュベートし、すすりせずにブロッキング溶液を除去します。
- 100 μLの一次抗体または抗体を100μLでインキュベートし、4°CでRTまたはO/Nで1時間のブロッキング溶液で希釈します。RTでそれぞれ10分間、PBSで3回スライドをすすいで下します。
- RTで1時間のブロッキング溶液中で希釈した二次抗体の100μLで各スライドを100μLでインキュベートし、RTでそれぞれ10分間PBSのリンススライドを3回、光からスライドを保護します。
- スライドをマウントします。
- スライド上にDAPI(4'、6-diamidino-2-フェニリンドール)を持つアンチフェード媒体の2滴を追加します。その後、カバースリップでカバーします。
- 画像化する準備ができるまで、暗い4°Cで保存します。
注:代替として、最初にRTでPBSで1:2,000を希釈したDAPIまたはHoechst 33324色素で核を標識し、次にグリセロールでマウントする。
- 末端デオキシヌクレオチジルトランスフェラーゼdUTPニックエンドラベリング(TUNEL)染色。
注:3'-ヒドロキシルターミニニ(3'OH DNAテルミニ)を持つ二本鎖DNAは、細胞内のアポトーシス中に形成されます。ここでは、市販キットを用いて特異的染色によりジゴキシゲニン-ヌクレオチド(TdT)を用いてDNA断片を標識することにより、その中の自由な3'OH DNAターミニーニに標識するプロトコルを提供する(材料の表参照)。 ).- 必要に応じて、TUNEL染色の前に一次およびAlexa Fluor-488標識二次抗体を含む染色セクション。PBSのスライドをそれぞれ10分間3回すすいで下します。
注:このステップは、同じスライド内のタンパク質とTUNELの二重染色のために任意である。 - 100 μL プロテインナーゼ K (10 mM トリス pH 7.5 および 5 mM EDTA で 10 μg/mL) で各スライドを RT で 10 分間 PBS を使用して 5 分間インキュベートします。
注:組織タイプごとにプロテインタネセKのインキュベーション時間と温度を調整します。4%PFAで固定された胚頭部の10 μmセクションについては、RTで5分間インキュベートする。プロテパラーゼKを使用する方法に加えて、(1)新鮮に調製された0.1%ポリエチレングリコールテルトオクチルフェニルエーテル、0.1%クエン酸ナトリウム、37°Cで10分を含む、必要に応じて代替治療を使用します。(2) HCl中0.25%~0.5%ペプシン(pH2)または0.25%トリプシン、37°Cで10分。(3)0.1Mクレートバッファー(pH6)を含むマイクロ波照射を行った。 - 各スライドに200μLのブロッキング溶液(0.1%PBSTで希釈したロバ血清5%)を塗布し、RTで30分間インキュベートし、すすりせずにブロッキング溶液をタップします。
- キットが提供する平衡バッファの50 μLをRTの各スライドに少なくとも10s.すすせずにバッファをタップします。
- TdT酵素とキットが供給する反応バッファーを3:7の比で混合して反応混合物(作動強度TdT酵素)を調製する。各スライドに反応混合物の50 μLを適用し、37 °Cで1時間インキュベートし、すすせずにバッファーをタップします。
- キットが提供するストップバッファの200 μL(ddH2 Oで1:30希釈)を各スライドに塗布し、RTで10分間リンススライドを10分間インキュベートし、それぞれ10分間PBSで3回インキュベートします。
- ロダミン抗体を用いた標識。
- 各スライドに50 μLの予め温められた(RT)抗ジゴキシゲニンコンジュゲート(ロダミン)(ブロッキング溶液で1:1希釈)を適用します。暗闇の中で30分間RTでインキュベートします。
- PBSでスライドを10分間3回ずつすすいで下します。スライドをステップ 3.1.6 としてマウントします。
- 必要に応じて、TUNEL染色の前に一次およびAlexa Fluor-488標識二次抗体を含む染色セクション。PBSのスライドをそれぞれ10分間3回すすいで下します。
4. イメージング取得
- 陽性コントロール(標的抗原に対して陽性の組織)を使用して、シグナル標識および陰性コントロール(一次抗体、アイソタイプコントロール、または標的抗原に対して陰性の組織を省略)をチェックし、蛍光下の画像の背景を評価する。顕微鏡。
- ネガティブコントロールとポジティブコントロールの信号強度に基づいて、イメージング用の機器とカメラの状態(露出やその他の一般的な設定)を設定します。
注:これらの条件は、(1)イメージングに使用されるカメラと顕微鏡、(2)抗体、および(3)各実験の組織によって異なります。頭蓋組織に使用される一般的な条件は、抗体の品質および特異性に依存する1/100 sから1sまでの露光時間を持つISO 200である。適切な倍率は、サンプルのサイズと実験の目的によって異なります。 - 従来のエピ蛍光顕微鏡または共焦点顕微鏡で画像を取得します。各カラーチャンネルの同じ条件で画像(対応するコントロールを含む)を取得します。同じ形式の画像を保存します (tiff は情報を保持するのに最適です)。
5. 蛍光定量
注:異なるグループ間の染色を統計的に比較することは、多くの場合、より有益になります。免疫蛍光画像を用いて、シグナル密度を測定し、陽性細胞を数えたり、陽性領域を計算したりして、タンパク質の相対レベルを定量化する。統計分析の場合、生物学的に独立したサンプルの最小数は 3 です。一般的な方法は、各サンプルから少なくとも 3 つのセクションを生成し、各セクションの少なくとも 3 つの代表的な領域の画像を撮影することです。
-
ImageJを用いた蛍光強度の定量
- ソフトウェアを開き、[解析]> [測定値の設定] を使用して、エリアと集積密度のみが選択されていることを確認します。ファイル>を使用して、分析する画像を開きます。
- ツールバーを使用して、左端の正方形または円のアイコンを選択します。選択ツールを使用して、画像上で解析する領域を選択します。[分析];[測定]を使用して、[結果]ウィンドウで選択した領域と統合密度の読み出しを取得します。背景を読み取るために蛍光のない正のセルの横の領域を選択します。
- 手順 5.1.2 を繰り返して、他の画像を分析します。分析する領域を最初の画像の領域と一致するように調整しました。
- [結果] ウィンドウのすべてのデータをコピーし、分析が完了したらスプレッドシートに貼り付けます。
- 補正された蛍光強度(CTCF)を統合密度として計算する — (選択した細胞の面積 x バックグラウンド測定値の平均蛍光値)サンプル間の補正された全細胞蛍光の差を比較し、グラフを作成します。
-
ImageJを用いた蛍光画像の陽性細胞数の定量化
- 手動セルカウント。
- ImageJ > プラグイン >分析を使用して、セルカウンタプラグインをインストールします。
- ファイル>を使用して、分析する画像を開きます。プラグイン>分析>セル カウンタを使用して、カウンタ ウィンドウと結果ウィンドウを開きます。
注:セル カウンタはスタックでは機能しません。スタックをカウントする場合は、プラグインプロット Z 軸プロファイルを使用し、イメージ>スタック> プロットZ 軸プロファイルを使用して、パーティクル トラッキング ツールを使用して移動する ROI の強度を監視します。このツールは、手動または自動のいずれかです。 - [カウンター] ウィンドウの下部にあるボタンのいずれかをクリックしてカウントを開始します。終了までカウントするセル/オブジェクトを直接クリックします。
- [カウント]ウィンドウの [結果]ボタンをクリックします。カウントされたセルの合計数が [結果]ウィンドウに表示されます。結果ログをスプレッドシートとして保存し、分析します。
- 自動セルカウント。
- ファイル>を使用して、分析する画像を開きます。続行する前に、RGB イメージをグレースケール イメージに変換します。
- [イメージ>しきい値を調整]を使用して、カウントする必要があるすべての領域を選択します。
- [解析>パーティクルの分析]を使用して、セル/パーティクルの数を取得します。特定の範囲内のセル/パーティクルをカウントするには、デフォルトの 0-Infinity の代わりに、有効なパーティクル サイズ (100-Infinity など) の範囲を設定します。結果ログをスプレッドシートとして保存し、分析します。
注:画像からその他の情報を取得するには、エリアの他の情報を取得するには、[測定値を分析] に移動し、必要な情報の横にあるボックスを選択します。
- 手動セルカウント。
結果
胚頭蓋組織切片
上記のステップに続いて、頭部を対照(P0-Cre)または変異体(神経堤細胞におけるBmpr1a、P0-Cre;caBmpr1a)胚(E)16.5または18.5で解剖した。 4時間のPFAで4%PFAを固定した後、サンプルをOCTに埋め込み、冠状動脈に凍結切除した。得られた切片は、pSmad1/5/9(下流BMPシグナル伝達因子)またはKi67(細胞増殖マーカー)に対する抗体で免疫染色し、プロトコルに従って抗原検索を行わずに行った。図に示すように、pSmad1/5/9(図1A)およびKi67(図1C)は対照胚の前頭骨において陽性であった。変異胚では、pSmad1/5/9のレベルが増加し(図1B)、Ki67のレベルは前頭骨で減少した(図1D)。これらのサンプル中の細胞死もプロトコルに従ってチェックされた。図示したように、変異胚の前頭骨では、対照胚のものよりも多くのアポトーシス細胞が観察された(図1E,F)。
非デカール化された頭蓋骨組織または長い骨のセクション
上記の非除電硬組織に対する上記のステップに続いて、3週齢マウス(P0-Cre;mTmG(膜トマトおよび膜GFP))からの頭部を4%PFAで固定し、8%ゼラチンに埋め込んだ。冠状動脈凍結切片をPBSTで洗浄し、DAPIを搭載したアンチフェード媒体を搭載した。図 2ABは、ゼラチンが切除組織からの蛍光シグナルを妨げなしないことを実証する。
3週齢または3ヶ月齢のマウスの頭部およびフェモラを用いて、ゼラチン埋め込み未除の組織がIFに対して良好であるかどうかを確認した。全体の頭部とフェモラは、プロトコルに従って処理され、断面されました。得られたセクションは、SOX9免疫染色(図3)またはOSXおよびE11/ポドプラニン二重免疫染色(図4)に用いた。図に示すように、大腿骨の線維および皮質区画(図3A、B、図4A-D)、前頭骨(図4E、図4E)を含む3週間の硬質組織のほとんどから良好な品質のセクションが得られた。F)、切開部(図3E、F、図4I、J)、鼻組織(図3C、D)、および鼻前上顎縫合糸および周囲の骨を含む頭蓋骨(図4G、H))の頭部。一方、3ヶ月前のサンプルでは、大腿骨の線維柱帯を含む硬質組織の一部(図3G、H、図4K、L)、鼻組織(図3I)でのみ良好な品質のセクションが得られた。 ,J)、および頭部の鼻前顎骨および周囲の骨(図4M、N)を含む頭蓋骨。図3に示すように、SOX9陽性細胞は、大腿骨から成長板(図3B)と関節(図3H)、および鼻中隔(図3D、J)の軟骨細胞において特異的に検出された。3週齢の切開部では、間葉細胞でSOX9が検出された(図3F)。OSXおよびE11二重染色結果は、OSXが骨芽細胞で検出され、E11が大腿骨および頭部からの骨細胞で検出されたことを示した(図4B、D、H、L、N)。3週間の切開では、OSXはオドントブラストにおいて陽性であったが、E11は卵胞間葉系細胞において陽性であった(図4J)。これらの結果は、ゼラチンを埋め込んだ非デカル化された硬組織が抗原機能を十分に保存していることを示している。
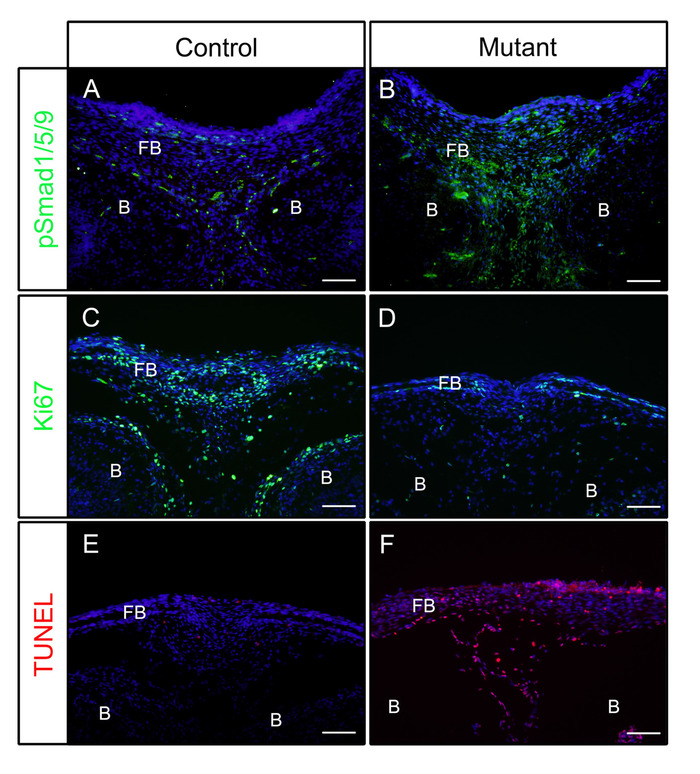
図1:bMP活性を増強した対照胚および変異胚におけるpSmad1/5/9、Ki67またはTUNELのIF結果の例。構成的に活性化されたBmpr1a(caBmpr1a)マウスをP0-Creマウスと交配し、神経堤細胞(NcC)におけるBMPシグナル伝達活性を増加させた。 制御の頭(P0-Cre; caBmpr1a+/+) と変異体 (P0-Cre; caBmpr1afx/+) 胚をE16.5またはE18.5で解剖し、4時間のPFAで固定し、1日間30%のスクロースで凍結保護し、OCTに埋め込んだ。-18 °Cで凍結切除した。前頭骨の切片(眼と同様のレベル)は、pSmad1/5/9、Ki67、またはTUNEL染色に対する免疫検出に使用された。(A, B) pSmad1/5/9 (緑色) E16.5の対照骨(A)または変異体(B)胚における染色パターン。(C, D)コントロールの前頭骨(C)または変異体(D)胚におけるKi67(緑色)染色パターン(E18.5)。(E, F)コントロール(E)または変異体(F)胚の前頭骨におけるTUNEL(赤色)染色パターン(E18.5)。核はDAPI(青色)で染色した。FB =前頭骨、B=脳。スケールバー = 100 μm。この図のより大きなバージョンを表示するには、ここをクリックしてください。
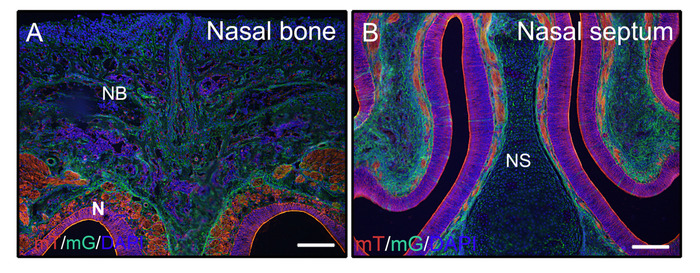
図2:mTmGレポーターの信号結果の例は、頭部の未解明組織の結果である。膜トマトと膜GFP(mTmG)レポーターを用いた3週齢のP0-Creマウスの頭部を解剖し、4時間のPFAで固定し、2日間30%ショ糖で凍結保護し、8%ゼラチンに埋め込み、-25°Cで凍結切除した。頭部切片は、鼻骨および鼻組織(A,B)におけるGFP(緑色、クレクレ組換え陽性)およびトマト(赤、クレリコンビネーション陰性)シグナルを明確に示す。核はDAPI(青色)で染色した。NB=鼻骨、N=鼻組織、NS=鼻中隔。スケールバー = 250 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
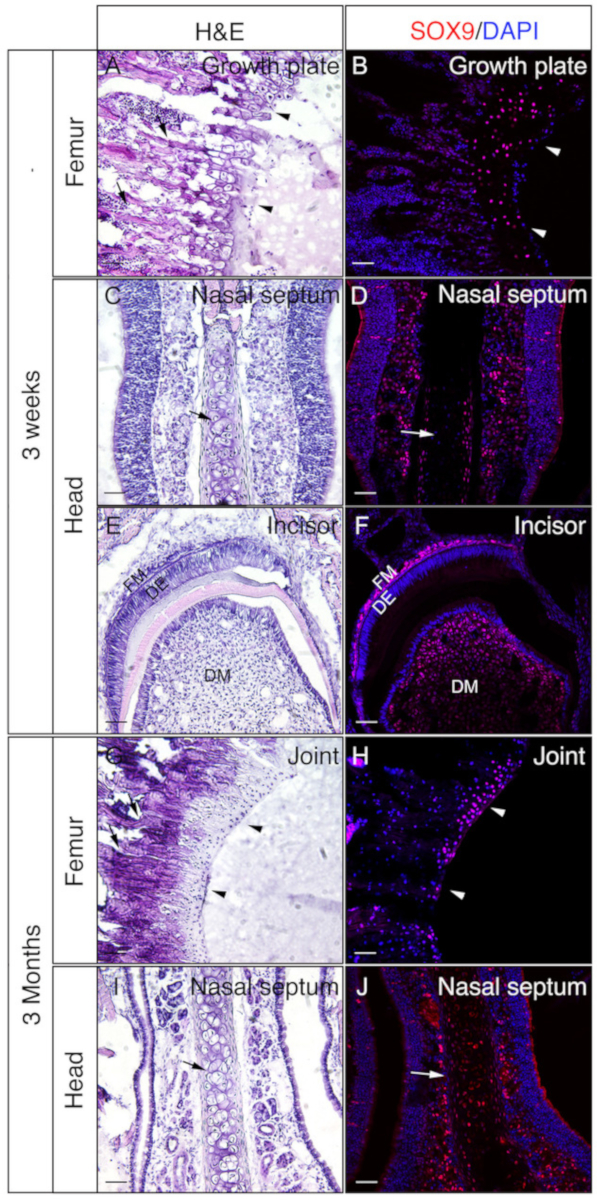
図3:頭部およびフェモラにおける非除色組織のSOX9免疫染色結果の例。頭部およびフェモラを3週間または3ヶ月齢マウスから解剖し、4時間のPFAで固定し、2日間30%ショ糖で凍結保護し、8%ゼラチンに埋め込み、-25°Cで凍結切除した。スライドはSOX9(赤色)に対する免疫検出に用いた。核はDAPI(青色)(B、D、F、H、J)で染色した。これらの組織の隣接するセクションは、ヘマトキシリン&エオシン(H&E)染色(A、C、E、G、I)に使用した。A及びBの矢印ヘッドは成長板およびGおよびHにおいて、関節軟骨を示す。 AおよびGの矢印は、線維柱帯骨およびC、D、I、およびJ、鼻中隔を示す。DM=歯科間葉、DE=歯科上皮、FM=卵胞間葉。スケールバー = 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
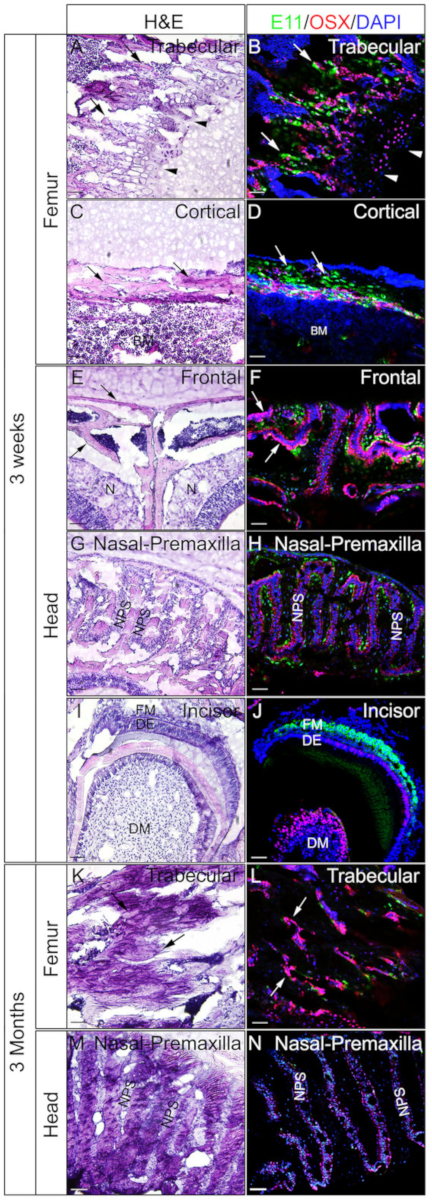
図4:頭部およびフェモラにおける非除電組織のOSXおよびE11二重免疫染色結果の例。頭部およびフェモラを3週齢または3ヶ月齢のマウスから解剖し、4時間のPFAで固定し、2日間30%ショ糖で凍結保護し、8%ゼラチンに埋め込み、-25°Cで凍結切除した。切片は、OSX(赤)およびE11/ポドプラニン(緑)に対する抗体を用いた二重免疫染色に用いた。核はDAPI(青色)(B、D、F、H、J、L、N)で染色した。これらの組織の隣接するセクションは、H&E染色(A、C、E、G、I、K、M)に用いた。A、B、K、およびLの矢印は、大腿骨の線維柱帯区画を示す。CおよびD、大腿骨の皮質コンパートメント; そして、EおよびFでは、前頭骨。AとBの矢印は成長プレートを示す。BM=骨髄、N=鼻組織、DM=歯科間葉、DE=歯科上皮、FM=卵胞間葉、NPS=鼻前上顎縫合糸。前頭骨(E,F)および鼻前上顎縫合および周囲の骨(G、H、M、N)も示される。スケールバー = 50 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、マウスヘッドと非デカル化された骨組織の調製のための詳細なプロトコルと、細胞増殖、細胞死、およびBMPシグナル伝達マーカーの免疫染色のための凍結切除を提供する。また、免疫蛍光画像から定量的データを得るための戦略についても詳しく述べる。これらの方法は、適切な修飾を有する他の組織にも適用可能である。
組織調製の条件は、組織の大きさと種類によって異なります。固定と凍結保護時間は、通常、一晩に数時間を必要とします。固定後、組織はパラフィンに埋め込まれ、マイクロトーム16で切断することもできる。パラフィンとOCTの両方が免疫染色のためにうまく動作しますが、それらの間にいくつかの違いがあります。パラフィンブロックはRTで複数年保持することができ、OCTブロックは-80°Cで1年間保持できます。パラフィンは組織形態を保持し、OCT埋め込み中に形成された氷結晶は組織構造に悪影響を及ぼす可能性がある。パラフィンは時々抗原のエピトープをマスクし、OCTは酵素活性と抗原エピトープを保存します。したがって、4%PFAで4時間以下で固定し、OCTに埋め込まれた場合、ほとんどの抗体に対して抗原検索の必要はありません。しかし、陽性対照が凍結切除で良好な染色結果を示さなかった場合、抗原検索によってより良い結果を得ることは依然として可能である。
ホークスト染料とDAPIの両方が核の逆染色に使用することができます。それらは、(1)両方がUV励起、総DNA含有量に比例する信号を放出するマイナーな溝結合化学物質であり、(2)長時間露光後に光漂白を受けるので、類似性を有する。しかしながら、Hoechst染料は、通常、その高い透過性のために生細胞内のDNA含有量を染色するために使用される。DAPIは、通常、その低い膜透過性のために固定細胞でDNAを染色するために使用されます。さらに、DAPIは、Hoechstよりも強く、より安定した信号を生成します。
IF には適切な制御が不可欠です。すべての新しい抗体の特異性は、該当する場合は、ウェスタンブロット分析によって確認されるべきである。特定の一次抗体の最適な働き方濃度は、シリアル希釈を用いて決定されるべきである。陽性対照(タンパク質/抗原を発現することが証明された組織または細胞)は、抗体のIFプロセスおよび特異性をチェックするために含まれるべきである。陰性対照も含まれるべきである、例えば、一次抗体の不在、または一次抗体に対する同じ種からの正常IgGの置換、または標的抗原に対して陰性の組織が含まれるべきである。写真を撮るときは、二次抗体を含まないサンプル(バックグラウンドコントロール)を各チャネルで個別に調べ、最終的なイメージングに適合する信号ゲインとオフセットの限界を設定する必要があります。複数のラベルを検出するには、スペクトルオーバーラップアーティファクトを避けるために、バックグラウンド コントロールと単一ラベルコントロールを準備する必要があります。複数ラベルサンプルの画像を得るために使用されるすべてのチャネルは、各チャネルの自己蛍光レベルが大きく異なるため、独立した背景補正を受ける必要があります。
また、ゼラチンに埋め込まれた非デカル化された硬質組織の調製および凍結切除のためのプロトコルも提供します。OCT埋め込まれたデカール化された硬い組織のために、硬いティッシュセクションのほとんどは、スライド上の接着性が低いため、免疫染色手順中にスライドメガネから切り離されます。凍結切除を容易にするように設計された粘着テープは良質のセクションを作り出すのに役立つ。しかし、テープが剥がれると、これらの部分は簡単に破損します。ゼラチン埋め込み組織の場合、良好な品質のセクションを生成するためにテープ転送システムは必要ありません。埋め込み媒体として、ゼラチンはサンプルによく浸透し、OCTと比較して粘度が低いが、ゼラチンは、脳組織17、18、細胞の超薄膜切片などの他の組織学的用途で使用されている。免疫細胞化学用19.ここで、ゼラチンを用いて未除骨格を埋め込み、OCTよりも凍結切除しやすいブロックを生成した。ゼラチン埋め込み非割り込みハード組織の良いセクションを得るためにいくつかの小さなヒントがあります。重要なステップは、OCTの代わりにゼラチンを埋め込むことである。より良い浸透を得るために、サンプルが底に沈んだ後、もう1日30%ショ糖でサンプルを保ちます。温度を通常より低い-25°C程度に設定することが同様に重要です。超鋭利な刃は必要ありません。低いクライオ温度(-25°C)は、OCT埋め込まれた非除細化された硬組織の凍結切除のためのいくつかの改善を行いますが、組織構造の良好な完全性を得ることは依然として困難です。図2、図3、および図4に示すように、免疫染色に適用可能な良好な品質セクションは、ゼラチン埋め込まれた硬組織(例えば、線維柱帯骨、皮質骨、頭蓋骨、鼻組織、および切開部)から得られた。これらの結果は、ゼラチン埋め込みがハード組織切片の検体の完全性を著しく向上させるだけでなく、スライド眼鏡へのセクションの接着性を高めることを証明した。また、ゼラチンは抗原機能を保持し、蛍光シグナルや免疫染色との相性を示します。ただし、この手法は、最大 3 か月前のサンプルに対してのみ適しています。この方法の潜在的な改善は、(1)組織の構造を簡単にするために、他の部分から標的組織を分離するためにサンプルをさらに解剖することである(歯の場合、マンディブルまたは上顎は頭全体の代わりに解剖し、固定されるべきである)(2)凍結保護の前にわずか2-3日間組織をデカールするために10%EDTAを使用する。この短いデカルシング時間は、免疫染色結果を損なうものではありません。もう一つの懸念は、非水性埋め込み媒体として、ゼラチンをスライドから容易に除去することができず、染色方法(例えば、H&E染色)に応じてより高い背景につながる可能性がある。
免疫染色の結果は定量化しにくいので、通常は半定量的に使用されます。頭蓋組織の免疫染色の定量化の困難と限界は、以下に限定されないが、(1)頭蓋組織の構造の複雑さのためにカウントされる領域を定義することは困難である。(2)免疫染色の非線形性質による標識領域または標識細胞の定義が困難である。(3)信号のダイナミックレンジに関する情報は限られています。(4)画像取得時の蛍光信号のフェード化による画像またはグループ間の信号の強度を比較することは困難である。(5)シグナルの背景は、抗体、スライド、およびサンプルの間で大きく変化する可能性があります。定量結果の信頼性を高めるために、実験は慎重かつ厳密に行われるべきである。すべてのサンプルは、同じ条件で処理する必要があります。免疫染色の間、シグナルの背景を評価し、シグナルの正の領域または細胞を定義するために、様々な制御が必要です。説得力のある代表的な画像を取り、カウントする領域を明確に示し、良好なコントラストを持つ細胞を標識します。また、画像取得時には、カメラの設定と機器の設定を一貫して維持する必要があります。
一緒に、我々は、特に非除色硬組織のためのマウス頭蓋組織上の免疫蛍光のための簡単な標準プロトコルを提示する。頭蓋組織の免疫染色分析は、発達中の形態形成のメカニズムを理解するのに役立つだけでなく、病因形成中の変化を示すのに役立ちます。さらに、免疫染色は、細胞増殖、細胞死、およびBMPシグナル伝達経路の他のシグナル伝達経路リガンド、受容体、またはその他の表現型マーカーの発現パターンを研究するためにも使用することができる。しかし、免疫染色実験の重要なステップは、特定の染色を得るために、抗原/抗体または組織ごとに適切に変更され、非特異的なバックグラウンドシグナルを最小限に抑える必要があります。
開示事項
著者は何も開示していない。
謝辞
この研究は、国立衛生研究所(R01DE020843 to Y.M.)、国際FOP協会(Y.M.)、および中国国立自然科学財団(31500788からJ.Y.)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
参考文献
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved