Method Article
Preparación de tejidos e inmunomanchación de tejidos craneofaciales de ratón y hueso no descalcificado
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo detallado para detectar y cuantificar los niveles de proteínas durante la morfogénesis/patogénesis craneofacial mediante inmunoutilización utilizando tejidos craneofaciales de ratón como ejemplos. Además, describimos un método para la preparación y criosección de tejidos duros no descalcificados de ratones jóvenes para inmunostaining.
Resumen
La inmunomanchación de tejidos proporciona una detección muy específica y fiable de proteínas de interés dentro de un tejido determinado. Aquí describimos un protocolo completo y simple para detectar la expresión de proteínas durante la morfogénesis/patogénesis craneofacial utilizando los tejidos craneofaciales de ratón como ejemplos. El protocolo consiste en la preparación y criosección de tejidos, inmunofluorescencia indirecta, adquisición de imágenes y cuantificación. Además, se describe un método para la preparación y criosección de tejidos duros no descalcificados para la inmunomancha, utilizando tejidos craneofaciales y huesos largos como ejemplos. Estos métodos son clave para determinar la expresión de proteínas y los cambios morfológicos/anatómicos en diversos tejidos durante la morfogénesis/patogénesis craneofacial. También son aplicables a otros tejidos con modificaciones apropiadas. El conocimiento de la histología y la alta calidad de las secciones son fundamentales para extraer conclusiones científicas de los resultados experimentales. Las posibles limitaciones de esta metodología incluyen, entre otras, la especificidad de los anticuerpos y las dificultades de cuantificación, que también se discuten aquí.
Introducción
La cara es una parte clave de la identidad humana, y se compone de varios tipos diferentes de tejidos, tales como epitelio, músculo, hueso, cartílago, diente. Esos tejidos se derivan de las tres capas germinales: ectoderm, endoderm y mesodermo1,2. Para un correcto patrón y desarrollo de los tejidos craneofaciales, la proliferación celular, la muerte y la diferenciación deben estar altamente coordinadas y reguladas por vías de señalización específicas, como las vías Wnt, Fgf, Hh y Bmp3,4 ,5. Los defectos en la proliferación, supervivencia o diferenciación de las células conducirán a malformaciones craneofaciales, que se encuentran entre los defectos congénitos congénitos que ocurren con mayor frecuencia. Los ratones transgénicos son herramientas útiles para estudiar mecanismos de morfogénesis craneofacial y patogénesis1,2,3,4,5. Comprender los cambios en las estructuras craneofaciales durante el desarrollo y la patogénesis ayudará a aclarar los principios clave del desarrollo, así como los mecanismos de las malformaciones craneofaciales1,2,3 ,4,5.
La tinción de todo el montaje o tejidos seccionados con anticuerpos específicos es una técnica invaluable para determinar la distribución espacial de proteínas de interés 6. Formalmente, la inmunomanchación tisular puede depender de la inmunohistoquímica (IHC) o de la inmunofluorescencia (IF). En comparación con el producto de reacción opaco generado con un sustrato cromogénico como 3,3'-Diaminobenzidina (DAB) por IHC, IF implica el uso de conjugados fluorescentes visibles por microscopía de fluorescencia. Por lo tanto, IF puede diferenciar claramente las células positivas del ruido de fondo, y permite que las imágenes sean analizadas cuantitativamente y mejoradas de una manera sencilla por software como ImageJ y Adobe Photoshop7,8. El enfoque de tinción de montaje completo funciona en pequeños bloques de tejido (menos de 5 mm de espesor),que pueden proporcionar información tridimensional sobre la ubicación de las proteínas/antígenos sin necesidad de reconstrucción de las secciones 9,10 . Sin embargo, en comparación con las secciones de tejido, la inmunomancha de montaje completo consume mucho tiempo y requiere grandes volúmenes de soluciones de anticuerpos. No todos los anticuerpos son compatibles con el enfoque básico de montaje completo. Además, la penetración incompleta de anticuerpos dará lugar a manchas desiguales o falsas manchas negativas. Aquí nos centraremos en la detección de inmunofluorescencia de proteínas/antígenos en tejidos seccionados. Para los tejidos duros (por ejemplo, cabeza, diente, hueso largo), la deposición de calcio durante el desarrollo/patogénesis hace que la muestra sea difícil de seccionar y enjuagar fácilmente durante el tratamiento de inmunomancha11,12. La mayoría de los protocolos actualmente disponibles descalcifican los tejidos duros antes de incrustarlos para facilitar la sección, lo que consume mucho tiempo y puede destruir morfología y antígenos de las muestras si se manipulan incorrectamente11,12. Para superar los problemas, optimizamos un enfoque para la criosección de tejidos duros sin descalcificación, lo que conduce a una mejor visualización de su morfología y distribución de proteínas de señalización.
El protocolo descrito aquí se utiliza para determinar los cambios morfométricos e histológicos en los tejidos craneofaciales de los ratones transgénicos BMP. Específicamente, el protocolo incluye (1) la cosecha y disección de tejidos de la cabeza, (2) sección e inmunomanchación de marcadores experimentales (Ki67, pSmad1/5/9) junto con la tinción TUNEL, (3) imágenes de las secciones mediante microscopio de fluorescencia, y finalmente (4) analizar y cuantificar los resultados. El protocolo para preparar y criosección de tejidos duros sin descalcificación también se describe13. Estos métodos están optimizados para los tejidos craneofaciales. También son aplicables a otros tejidos de varias edades de muestras con modificaciones apropiadas.
Protocolo
Todos los experimentos con ratones se llevaron a cabo de acuerdo con las directrices de la Universidad de Michigan que cubren el cuidado humano y el uso de animales en la investigación. Todos los procedimientos animales utilizados en este estudio fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Michigan (Protocolo #PRO00007715).
1. Preparación de tejidos
-
Preparación de tejidos embrionarios
- Preparar un plato de 10 cm y varios platos de 3,5 cm que contengan solución salina tamponada de fosfato (PBS), y una placa de cultivo de 12 pocillos que contenga 2 ml de 4% de paraformaldehído (PFA) en PBS en cada pocil para cada pocto embarazada. Coloque todos los platos de Petri y el plato sobre hielo.
NOTA: Manipule 4% PFA en una campana de humo. - Diseccionar embriones de ratones embarazadas en PBS helado con fórceps y tijeras como se describió anteriormente14.
- Brevemente, eutanasia un ratónembarazada con CO 2, agarre la piel debajo del centro del vientre con fórceps y corte a través de la piel solamente, luego tire suavemente de la piel para separarla de la pared muscular abdominal subyacente.
- A continuación, cortar en la cavidad abdominal siguiendo la misma línea de la incisión de la piel. Retire el útero que contiene una cadena de embriones y retire los embriones cortando suavemente la pared uterina. Se extirparán los tejidos extraembrionarios, como el saco de yema y el amnion.
- Cortar y aislar la cabeza de cada embrión.
- Transfiera cada cabeza a cada pocal de una placa de 12 pocillos que contenga un 4% de PFA con una pipeta de transferencia de plástico o fórceps. Fijar las muestras en 4% pfA a 4 oC durante 4 h. Enjuague las muestras en PBS a 4 oC con un suave temblor durante 12 h.
NOTA: Para embriones menores que el día embrionario 16.5 (E16.5), fije cabezas de embrionario con 4% pfa directamente después del aislamiento. Para embriones a E16.5 o posterior, retire para desechar la piel y el tejido adiposo de la cabeza y enjuague varias veces en PBS helado antes de la fijación. - Cabezas de crioprotección.
- Transfiera cada cabeza a una nueva placa de 12 pocillos que contenga 2 ml de sacarosa al 30% en PBS utilizando una pipeta de transferencia de plástico o fórceps. Agitar suavemente a 4 oC hasta que la cabeza se hunda hasta la parte inferior del plato.
- Cabezales incrustados.
- Transfiera la cabeza crioprotegida a un molde que contenga el compuesto de temperatura de corte óptima (OCT). Equilibrar muestras en OCT durante varios minutos. Ajuste la ubicación y la dirección de las muestras con fórceps.
- Coloque el molde sobre hielo seco para congelarlo. Almacene los criomoldes resultantes en una bolsa de plástico a -80 oC hasta que estén listos para la criosección.
NOTA: El lado recortado de las muestras debe estar frente a la parte inferior del molde de incrustación.
- Preparar un plato de 10 cm y varios platos de 3,5 cm que contengan solución salina tamponada de fosfato (PBS), y una placa de cultivo de 12 pocillos que contenga 2 ml de 4% de paraformaldehído (PFA) en PBS en cada pocil para cada pocto embarazada. Coloque todos los platos de Petri y el plato sobre hielo.
-
Preparación de tejidos duros no descalcificados postnatales
- Eutanasia a 3 semanas o 3 meses de edad ratón con CO2. Retire la piel y los tejidos adiposos. Cortar y aislar la cabeza o huesos largos del ratón.
- Fijar y crioproteger la cabeza o hueso largo de los ratones como se describe en los pasos 1.1.3–1.1.4.
- Incruste en un 8% de gelatina de manera similar al paso 1.1.5. Mantener los criomoldes en una bolsa de plástico a -80 oC hasta la criosección.
NOTA: La descalcificación no es necesaria aquí. Para preparar 8% gelatina, mezcle 8 g de gelatina con 100 ml de PBS y hierva con un microondas. Tenga en cuenta que la mezcla hierve fácilmente.
2. Criosección
- Establezca la temperatura del criostato en -18 oC para los tejidos blandos incrustados en LOS PTU o a -25 oC y más bajo para los tejidos duros no descalcificados incrustados en la gelatina. Mantenga las muestras en la cámara de criostato durante unos 30 minutos para equilibrar las temperaturas del criostato.
- Expulsar el bloque del criomold. Congele el bloque en el mandril de la muestra (soporte de tejido) mediante el montaje con una gota de OCT. Mantenga el lado recortado de la muestra más alejado del mandril (frente al operador).
- Cargue el mandril montado en bloque en el soporte del objeto criostato. Ajuste el soporte de la hoja para que el ángulo de la hoja sea de 3 a 5o en relación con la muestra.
- Recoger secciones de 10 m en portaobjetos recubiertos del microscopio. Seque completamente las secciones en RT, luego guárdelas a -80 oC.
3. Tinción histológica e imágenes microscópicas
- Tinción de inmunofluorescencia
- Saca las diapositivas de -80oC. Mantenga los portaobjetos en RT durante 1 h a secciones secas. Enjuague las diapositivas en 0,1% PBST (0,1% éter de polietilenglicol tert-octilfenilo en PBS; ver Tabla de materiales)tres veces durante 5 minutos cada una para lavar oct y permeabilizar secciones.
- Opcionalmente, realice la recuperación de antígenos (opcional).
- Tampón de citrato de precalentamiento (10 mM de citrato de sodio pH 6) en el plato de tinción con vapor o baño de agua a 95-100 oC. Sumergir las diapositivas en el tampón de citrato, incubar durante 10 min.
- Lleve el plato de tinción de vapor o baño de agua a RT. Enfríe los toboganes a RT durante 20 minutos o más15.
NOTA: Como alternativas, utilice el tampón Tris-EDTA (10 mM Tris base, 1mM EDTA, 0.05% Tween 20, pH 9.0) o buffer EDTA (1 mM EDTA, 0.05% Tween 20, pH 8.0) para la recuperación de antígeno inducido por calor. Utilice una olla a presión, microondas o baño de agua para la recuperación de antígenos inducidos por el calor, además del vapor caliente. Otra alternativa es la recuperación de antígenos inducidos por enzimas mediante tripsina o pepsina. Optimizar la concentración y el tiempo de tratamiento de la recuperación enzimática para evitar dañar las secciones. Optimice el método de recuperación de antígenos para cada combinación de anticuerpos y antígenos.
- Incubar cada diapositiva con 200 ml de solución de bloqueo (5% suero de burro diluido en 0,1% PBST) a RT durante 30 minutos, luego retire la solución de bloqueo sin enjuagar.
- Incubar cada tobogán con 100 ml de anticuerpo primario o anticuerpos diluidos en solución de bloqueo durante 1 h a RT u O/N a 4 oC. Enjuague los portaobjetos con PBS tres veces durante 10 minutos cada uno en RT.
- Incubar cada diapositiva con 100 l de anticuerpo secundario diluido en solución de bloqueo durante 1 h en RT. Enjuague las diapositivas en PBS tres veces durante 10 minutos cada una en RT. Proteja las diapositivas de la luz.
- Monte los portaobjetos.
- Añadir dos gotas de medio anti-fade con DAPI (4', 6-diamidino-2-phenylindole) en la diapositiva. A continuación, cubrir con un cubreobjetos.
- Conservar a 4oC en la oscuridad hasta que esté listo para la imagen.
NOTA: Como alternativa, etiquete los núcleos con dAPI o hoechst 33324 diluido 1:2.000 en PBS en RT primero, luego montar con glicerol.
- Terminal desoxinucleorden transferasa dUTP tinción de filo de nick end (TUNEL).
NOTA: El ADN de doble cadena con 3'-hidroxilo termini (3'OH DNA termini) se formará durante la apoptosis en la célula. Aquí, proporcionamos un protocolo que etiqueta el 3'OH DNA termini in situ gratuito mediante el etiquetado de fragmentos de ADN con el digoxigenin-nucleótido utilizando la transferasa de desoxinucleotidyl terminal (TdT) mediante tinción específica utilizando un kit comercial (ver Tabla de Materiales ).- Opcionalmente, las secciones de manchas con anticuerpos secundarios primarios y Alexa Fluor-488 etiquetados antes de la tinción TUNEL. Enjuague las diapositivas en PBS tres veces durante 10 minutos cada una.
NOTA: Este paso es opcional para una doble tinción de una proteína y TUNEL en la misma diapositiva. - Incubar cada tobogán con 100 l de proteinasa K (10 g/ml en 10 mM Tris pH 7,5 y 5 mM EDTA) durante 5 min a RT. Enjuague los portaobjetos con PBS tres veces durante 10 minutos cada uno a RT.
NOTA: Ajuste el tiempo de incubación y la temperatura de Proteinase K para cada tipo de tejido. Para secciones de 10 m de cabezas de embriones fijadas en 4% pfa, incubar durante 5 min a RT. Además del método que utilice Proteinase K, utilice tratamientos alternativos según sea necesario, incluyendo (1) éter de polietilenglicol tert-octilfenilo recién preparado, 0,1% de citrato de sodio, 10 min a 37 oC; (2) 0,25%–0,5% Pepsina en HCl (pH 2) o 0,25% de trippsina, 10 min a 37oC; y (3) irradiación por microondas con tampón de citrato de 0,1 M (pH 6). - Aplicar 200 l de solución de bloqueo (5% suero de burro diluido en 0,1% PBST) a cada diapositiva, incubar a RT durante 30 minutos, toque la solución de bloqueo sin enjuagar.
- Aplicar 50 s del tampón de equilibrio suministrado por el kit a cada diapositiva en RT durante al menos 10 s. Toque fuera del búfer sin enjuagar.
- Preparar la mezcla de reacción (enzima TdT de fuerza de trabajo) mezclando TdT Enzyme con el tampón de reacción suministrado por el kit en la proporción de 3:7. Aplicar 50 s de la mezcla de reacción en cada diapositiva e incubar a 37 oC durante 1 h. Toque fuera del tampón sin envolver.
- Aplicar 200 l del tampón de parada (1:30 diluido en ddH2O) suministrado por el kit a cada diapositiva, luego incubar a RT durante 10 min.
- Etiqueta con anticuerpo Rhodamine.
- Aplicar 50 ml de conjugado antidigoxigenina precalentado (RT) (rhodamina) (1:1 diluido en solución de bloqueo) a cada diapositiva. Incubar a RT durante 30 minutos en la oscuridad.
- Enjuague los portaobjetos con PBS tres veces durante 10 minutos cada uno. Monte las diapositivas como paso 3.1.6.
- Opcionalmente, las secciones de manchas con anticuerpos secundarios primarios y Alexa Fluor-488 etiquetados antes de la tinción TUNEL. Enjuague las diapositivas en PBS tres veces durante 10 minutos cada una.
4. Adquisición de imágenes
- Utilice controles positivos (tejidos positivos para el antígeno objetivo) para comprobar el etiquetado de la señal y los controles negativos (omita el anticuerpo primario, el control de isotipos o los tejidos negativos para el antígeno objetivo) para evaluar el fondo de las imágenes bajo el fluorescente Microscopio.
- Ajuste las condiciones del equipo y de la cámara (exposiciones y otros ajustes generales) para la toma de imágenes en función de la intensidad de la señal de los controles negativos y positivos.
NOTA: Estas condiciones varían según (1) las cámaras y microscopios utilizados para la toma de imágenes, (2) anticuerpos y (3) tejidos para cada experimento. Las condiciones comunes utilizadas para los tejidos craneofaciales son ISO 200 con un tiempo de exposición que oscila entre 1/100 s y 1 s dependen de la calidad y especificidad de los anticuerpos. Las ampliaciones adecuadas varían dependiendo del tamaño de las muestras y el propósito de los experimentos. - Adquiera imágenes con el microscopio de epifluorescencia convencional o el microscopio confocal. Adquirir imágenes (incluidas las de los controles correspondientes) en las mismas condiciones para cada canal de color. Guardar imágenes con el mismo formato (tiff es mejor conservar la información).
5. Cuantificación de Fluorescencia
NOTA: La comparación estadística de la tinción entre diferentes grupos será más informativa en muchos casos. Con las imágenes de inmunofluorescencia, cuantifique el nivel relativo de la proteína midiendo la densidad de la señal, contando células positivas o calculando áreas positivas. Para el análisis estadístico, el número mínimo de muestras biológicamente independientes es 3. Un método típico consiste en generar al menos tres secciones de cada muestra y tomar imágenes para al menos tres áreas representativas en cada sección.
-
Cuantificación de la intensidad de la fluorescencia utilizando ImageJ
- Abra el software y utilice Analizar > Establecer mediciones para comprobar que solo se seleccionan el área y la densidad integrada. Utilice Archivo > Abrir para abrir las imágenes que se van a analizar.
- Utilice la barra de herramientas para seleccionar el icono cuadrado o circular en el extremo izquierdo. Seleccione el área que desea analizar en la imagen utilizando la herramienta de selección. Utilice Analizar > Medir para obtener la lectura del área seleccionada y la densidad integrada en la ventana Resultados. Seleccione una región junto a una celda positiva que no tenga fluorescencia para leer el fondo.
- Repita el paso 5.1.2 para analizar otras imágenes. Se ha ajustado el área a analizar para que coincida con la de la primera imagen.
- Copie todos los datos en la ventana Resultados y péguelos en una hoja de cálculo cuando termine de analizar.
- Calcule la intensidad de fluorescencia corregida (CTCF) como Densidad Integrada — (área de la celda seleccionada x Fluorescencia media de las lecturas de fondo). Compare la diferencia de la fluorescencia total de células corregida entre las muestras y haga un gráfico.
-
Cuantificación del número celular positivo de imágenes fluorescentes utilizando ImageJ
- Conteo manual de celdas.
- Utilice ImageJ > Plugins > Análisis para instalar el plugin Cell Counter.
- Utilice Archivo > Abrir para abrir las imágenes que se van a analizar. Utilice Plugins > Análisis > Contador de celdas para abrir la ventana Contador y la ventana Resultados.
NOTA: El contador de celdas no funciona en pilas. Para contar pilas, plugin Trazar perfil de eje Zy, a continuación, utilice Imagen > Pilas > Trazar perfil de eje Z para supervisar la intensidad de un ROI en movimiento mediante una herramienta de seguimiento de partículas. Esta herramienta puede ser manual o automática. - Haga clic en uno de los botones en la parte inferior de la ventana Contador para iniciar el recuento. Haga clic directamente en una celda/objeto para que esté contando hasta el final.
- Haga clic en el botón Resultados de la ventana Recuento. El número total de celdas contadas se mostrará en la ventana Resultados. Guarde el registro de resultados como hoja de cálculo y analice.
- Recuento automático de células.
- Utilice Archivo > Abrir para abrir las imágenes que se van a analizar. Convierta la imagen RGB en una imagen en escala de grises antes de continuar.
- Utilice Imagen > Ajustar > Umbral para seleccionar todas las áreas que deben contarse.
- Utilice Analizar > Analizar partículas para obtener el número de celdas/partículas. Establezca un rango del tamaño de partícula válido (por ejemplo, 100-Infinity) en lugar del valor predeterminado de 0-Infinity para contar celdas/partículas dentro de un rango específico. Guarde el registro de resultados como hoja de cálculo y analice.
NOTA: Para obtener otra información de la imagen, además del área, vaya a Analizar > Establecer medidas y seleccione la casilla junto a la información necesaria.
- Conteo manual de celdas.
Resultados
Secciones del tejido craneofacial embrionario
Siguiendo los pasos anteriores, las cabezas fueron diseccionadas del control (P0-Cre) o mutante (activado constitutivamente Bmpr1a en células de cresta neural, P0-Cre; caBmpr1a) embriones en el día embrionario (E) 16.5 o 18.5. Después de la fijación en 4% PFA durante 4 h, las muestras se incrustaron en OCT y crioseccionado coronally. Las secciones resultantes fueron inmunomanchadas con anticuerpos contra pSmad1/5/9 (factores de señalización BMP aguas abajo) o Ki67 (un marcador de proliferación celular) sin recuperación de antígenos según el protocolo. Como se muestra, pSmad1/5/9 (Figura1A)y Ki67 (Figura1C)fueron positivos en los huesos frontales de los embriones de control. En los embriones mutantes, los niveles de pSmad1/5/9 se incrementaron (Figura1B),mientras que los de Ki67 disminuyeron (Figura1D)en los huesos frontales. La muerte celular en esas muestras también se comprobó de acuerdo con el protocolo. Como se muestra, se observaron más células apoptoticas en loshuesos frontales de embriones mutantes que en los embriones de control (Figura 1E,F).
Tejidos craneofaciales no descalcificados o secciones óseas largas
Siguiendo los pasos anteriores para los tejidos duros no descalcificados, los cabezas de ratones de 3 semanas de edad(P0-Cre; mTmG (membrana-tomate y membrana GFP)) se fijaron con 4% pfa e incrustado en 8% de gelatina. Las criosecciones coronales fueron lavadas con PBST y montadas con medio anti-fade con DAPI. Figura 2A ,B demostrar que la gelatina no interfiere con las señales fluorescentes de los tejidos seccionados.
Se emplearon cabezas y fémures de ratones de 3 semanas o 3 meses para comprobar si los tejidos no descalcificados incrustados en gelatina son buenos para IF. Todas las cabezas y femoras fueron procesadas y seccionadas de acuerdo con el protocolo. Las secciones resultantes se utilizaron para la inmunomancha SOX9 (Figura 3) o OSX y E11/Podoplanin doble inmunostaining (Figura4). Como se muestra, se obtuvieron secciones de buena calidad de la mayoría de los tejidos duros de 3 semanas, incluyendo los compartimentos trabeculares y corticales del fémur (Figura3A, B, Figura 4A–D),los huesos frontales (Figura4E, F), el incisivo (Figura3E,F, Figura 4I,J), los tejidos nasales (Figura3C,D),y el cráneo incluyendo la sutura nasal-premaxilar y los huesos circundantes (Figura4G,H ) de la cabeza. Mientras que, con muestras de 3 meses de edad, secciones de buena calidad sólo se obtuvieron en algunos de los tejidos duros, incluyendo los compartimentos trabeculares del fémur (Figura3G, H, Figura 4K,L), tejidos nasales (Figura3I ,J), y el cráneo incluyendo la sutura nasal-premaxilar y los huesos circundantes (Figura4M,N) de la cabeza. Como se muestra en la Figura 3, las células positivas SOX9 se detectaron específicamente en los condrocitos de la placa de crecimiento (Figura3B)y la articulación (Figura3H)del fémur, y el tabique nasal (Figura 3D,J). En el incisivo de 3 semanas, SOX9 se detectó en las células mesenquimales (Figura3F). Los resultados de doble tinción OSX y E11 mostraron que OSX se detectó en osteoblastos, mientras que E11 se detectó en osteocitos de huesos del fémur y la cabeza (Figura4B,D,H,L,N). En el incisivo de 3 semanas, OSX fue positivo en odontoblastos, mientras que E11 fue positivo en células mesenquimales folículos (Figura4J). Esos resultados indican que los tejidos duros no descalcificados incrustados con gelatina conservan bien las funciones del antígeno.
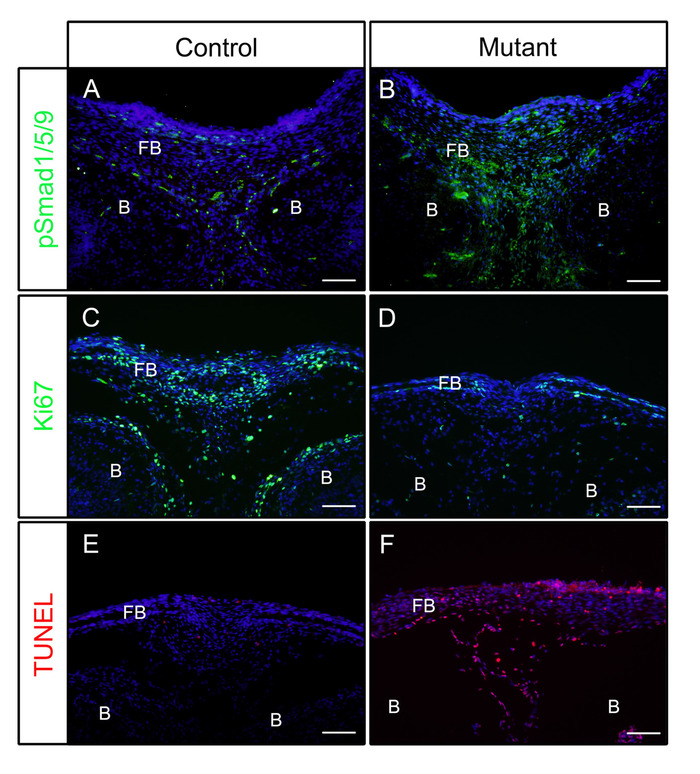
Figura 1: Ejemplos de resultados IF de pSmad1/5/9, Ki67 o TUNEL en embriones de control y embriones mutantes con actividad BMP mejorada. Los ratones Bmpr1a (caBmpr1a)activados constitutivamente se cruzaron con ratones P0-Cre para aumentar la actividad de señalización de BMP en células de cresta neural (NCC). Las cabezas de control(P0-Cre;caBmpr1a+/+) y mutantes (P0-Cre; caBmpr1afx/+) embriones fueron diseccionados en E16.5 o E18.5, fijo con 4% PFA para 4h, crioprotegido con 30% sacarosa durante 1 día, incrustado en OCT, y criodisección a -18oC. Se utilizaron secciones del hueso frontal (nivel similar con el ojo) para la inmunodetección contra la tinción pSmad1/5/9, Ki67 o TUNEL. (A, B) pSmad1/5/9 (verde) patrones de tinción en los huesos frontales de control (A) o mutantes (B) embriones en E16.5. (C, D) Patrones de tinción Ki67 (verde) en los huesos frontales de los embriones de control (C) o mutantes (D) en E18.5. (E, F) Patrones de tinción TUNEL (rojo) en los huesos frontales de los embriones de control (E) o mutantes (F) en E18.5. Los núcleos se tiñieron con DAPI (azul). FB - hueso frontal, B - cerebro. Barras de escala a 100 m. Haga clic aquí para ver una versión más grande de esta figura.
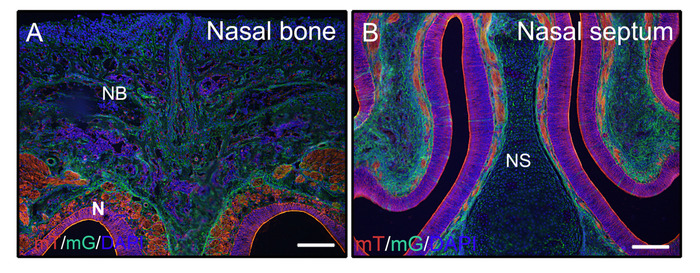
Figura 2: Ejemplos de resultados de señal de reportero mTmG de tejidos no descalcificados en la cabeza. Los cabezales de ratones P0-Cre de 3 semanas de edad con membrana-tomate y membrana GFP (mTmG) reportero fueron diseccionados, fijados con 4% PFA para 4h, crioprotegido sin 30% sacarosa durante 2 días, incrustado en 8% gelatina, y criodisección a -25 oC. Las secciones de la cabeza muestran claramente la señal de GFP (verde, Cre recombinación positiva) y tomate (rojo, cre recombinación negativa) en el hueso nasal y los tejidos nasales (A, B). Los núcleos se tiñieron con DAPI (azul). NB - hueso nasal, N á tejidos nasales, NS - tabique nasal. Barras de escala a 250 m. Haga clic aquí para ver una versión más grande de esta figura.
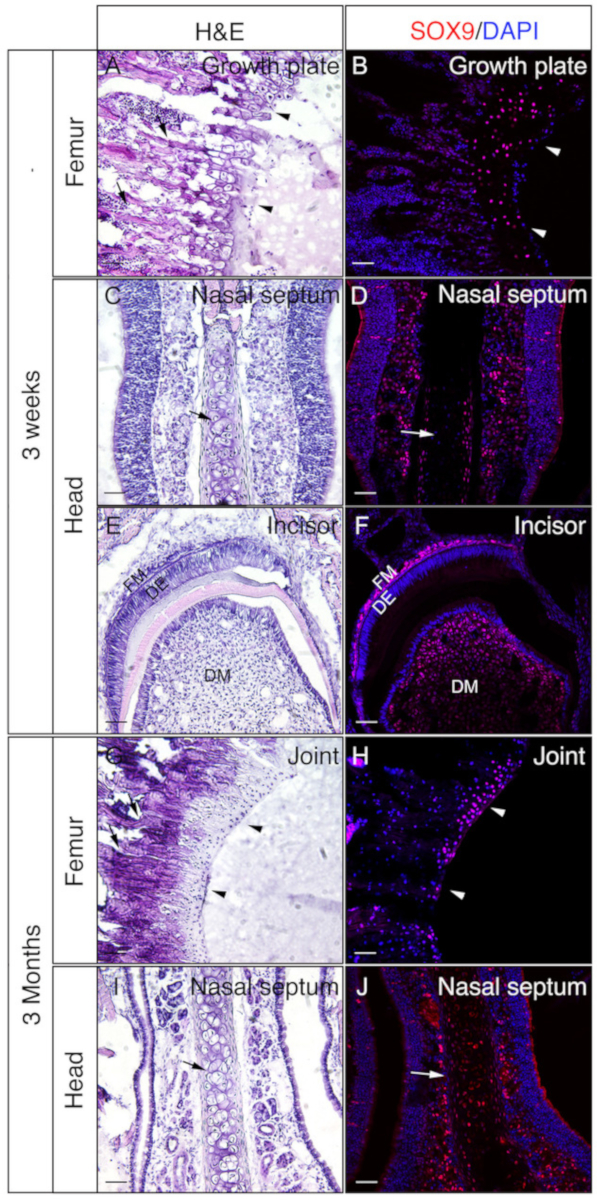
Figura 3: Ejemplos de resultados de inmunomancha SOX9 de tejidos no descalcificados en la cabeza y el fémur. Las cabezas y el femora se diseccionaron a partir de ratones de 3 semanas o 3 meses de edad, fijados con 4% de PFA para 4h, crioprotegidos con 30% de sacarosa durante 2 días, incrustados en 8% de gelatina, y criodisección a -25 oC. Se utilizaron diapositivas para la inmunodetección contra SOX9 (rojo). Los núcleos se tiñieron con DAPI (azul) (B, D, F, H, J). Las secciones adyacentes de esos tejidos se utilizaron para la tinción de hematoxilina y eosina (H&E) (A, C, E, G, I). Las cabezas de flecha en A y B indican la placa de crecimiento y en G y H,cartílago articular. Las flechas en A y G indican huesos trabeculares y en C, D, I y J,tabique nasal. DM - mesenquimo dental, DE - epitelio dental, FM - mesenquimo folículo. Barras de escala a 50 m. Haga clic aquí para ver una versión más grande de esta figura.
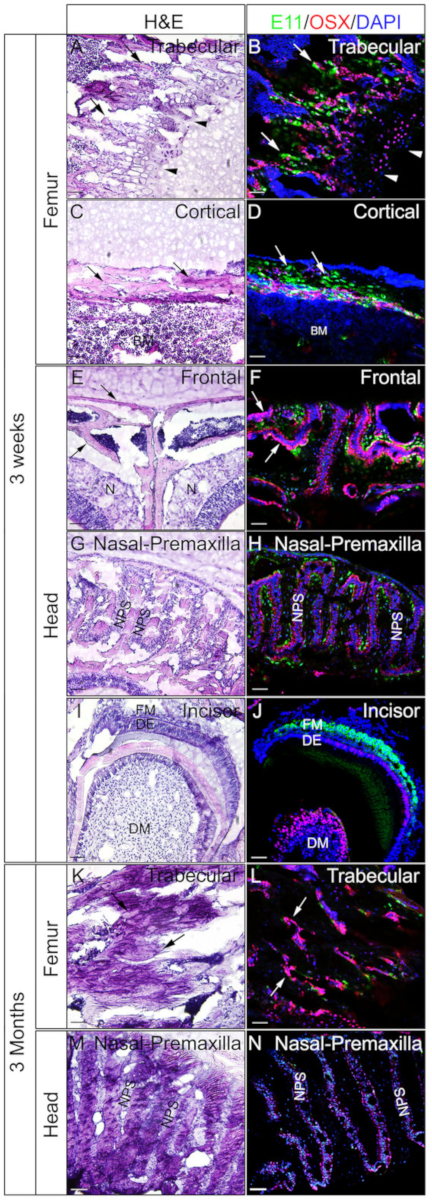
Figura 4: Ejemplos de resultados de inmunomancha doble OSX y E11 de tejidos no descalcificados en la cabeza y el fémur. Las cabezas y el femora se diseccionaron de ratones de 3 semanas o 3 meses de edad, fijados con 4% de PFA durante 4h, crioprotegidos con 30% de sacarosa durante 2 días, incrustados en gelatina del 8% y crioditos a -25 oC. Las secciones se utilizaron para la doble inmunomanchación con anticuerpos contra OSX (rojo) y E11/Podoplanin (verde). Los núcleos se tiñieron con DAPI (azul) (B, D, F, H, J, L, N). Las secciones adyacentes de esos tejidos se utilizaron para la tinción de H&E (A, C, E, G, I, K, M). Las flechas en A, B, K y L indican compartimentos trabeculares del fémur; C y D, compartimentos corticales del fémur; y en E y F,los huesos frontales. Las puntas de flecha en A y B indican la placa de crecimiento. BM - médula ósea, N á tejidos nasales, DM - mesenquime dental, DE - epitelio dental, FM - mesenquimo folículo, NPS - sutura de premaxilar nasal. También se muestran los huesos frontales (E, F) y la sutura nasal-premaxilar y los huesos circundantes (G, H, M, N). Barras de escala a 50 m. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí proporcionamos un protocolo detallado para la preparación de la cabeza del ratón y los tejidos óseos no descalcificados, y la criosección para la inmunopreservación de la proliferación celular, la muerte celular y los marcadores de señalización BMP. También detallamos la estrategia para obtener datos cuantitativos de imágenes inmunofluorescentes. Estos métodos también pueden ser aplicables a otros tejidos con modificaciones apropiadas.
Las condiciones para la preparación del tejido varían según el tamaño y el tipo de tejidos. La fijación y el tiempo de crioprotección generalmente necesitan varias horas para pasar la noche. Después de la fijación, el tejido también se puede incrustar en parafina y seccionado con un microtome16. Aunque tanto la parafina como la OCT funcionan bien para la inmunomancha, hay algunas diferencias entre ellos. Los bloques de parafina se pueden mantener durante varios años en RT, mientras que los bloques OCT están por 1 año a -80 oC. La parafina preserva la morfología del tejido, mientras que el cristal de hielo formado durante la incrustación de PTU puede afectar negativamente a las estructuras tisulares. La parafina a veces enmascara los epítopos de los antígenos, mientras que la OCT preserva las actividades enzimáticas y los epítopos de antígeno. Por lo tanto, no hay necesidad de recuperación de antígeno para la mayoría de los anticuerpos si se fija en 4% PFA para sólo 4 h o menos e incrustado en PTU. Sin embargo, todavía es posible obtener mejores resultados mediante la recuperación de antígenos, si los controles positivos no mostraron buenos resultados de tinción en criosecciones.
Tanto el tinte Hoechst como el DAPI se pueden utilizar para la contramancha nuclear. Tienen similitudes, ya que ambos (1) son químicos menores que se unen a las ranuras excitados por los rayos UV para emitir señales proporcionales al contenido total de ADN, y (2) se someten a fotoblanqueo después de una larga exposición. Sin embargo, los colorantes Hoechst se utilizan típicamente para manchar el contenido de ADN en células vivas debido a su alta permeabilidad. DAPI se utiliza típicamente para la tinción de ADN en células fijas debido a su baja permeabilidad de la membrana. Además, DAPI genera una señal más fuerte y estable que Hoechst.
Los controles adecuados son esenciales para IF. La especificidad de cada nuevo anticuerpo debe confirmarse mediante el análisis de manchas occidentales, si procede. La concentración de trabajo óptima de un anticuerpo primario determinado debe determinarse mediante el uso de diluciones en serie. Se debe incluir un control positivo (tejido o célula que se demuestre que expresa la proteína/antígeno) para comprobar el proceso IF y la especificidad del anticuerpo. También debe incluirse un control negativo, por ejemplo, la ausencia del anticuerpo primario o la sustitución de IgG normal de la misma especie por el anticuerpo primario, o tejidos negativos para el antígeno objetivo. Al tomar fotografías, la muestra sin anticuerpos secundarios (control de fondo) debe examinarse independientemente con cada canal para establecer los límites de ganancia de señal y desplazamiento que se adaptarán para la toma de imágenes final. Para la detección de varias etiquetas, el control de fondo y los controles de etiqueta única deben estar preparados para evitar artefactos de superposición espectral. Todos los canales que se utilizarán para obtener una imagen de una muestra de múltiples etiquetas deben estar sujetos a una corrección de fondo independiente, ya que el nivel de autofluorescencia en cada canal varía sustancialmente.
También proporcionamos el protocolo para la preparación y criosección de tejidos duros no descalcificados incrustados en gelatina. Para los tejidos duros descalcificados incrustados oct, la mayoría de las secciones de tejido duro se separarán de los vasos deslizantes durante los procedimientos de inmunomancha, debido a su carácter de baja adhesión en la diapositiva. La cinta adhesiva diseñada para facilitar la criosección ayuda a generar secciones de buena calidad. Sin embargo, esas secciones se dañan fácilmente cuando la cinta se está despegando. Para los tejidos incrustados de gelatina, no hay necesidad de un sistema de transferencia de cinta para generar secciones de buena calidad. Como medio de incrustación, la gelatina puede infiltrarse bien en la muestra, aunque tiene una viscosidad más baja en comparación con oct. Gelatina se ha utilizado en otras aplicaciones histológicas, como el tejido cerebral17,18 y secciones ultrafinas de las células para la inmunocitoquímica19. Aquí, la gelatina se utilizó para incrustar hueso no descalcificado, que genera bloques más fáciles de criosección que OCT. Hay varias puntas pequeñas para obtener buenas secciones de gelatina incrustada sin descalcificar tejidos duros. El paso crítico es incrustar con gelatina en lugar de OCT. Para obtener una mejor penetración, mantenga las muestras en 30% sacarosa un día más después de que las muestras se hundan hasta el fondo. Es igualmente importante ajustar la temperatura más baja de lo habitual a unos -25 oC. Una hoja ultra-afilada no es necesaria. Aunque una temperatura criológica más baja (-25 oC) hace algunas mejoras para la criosección de los tejidos duros incrustados en OCT, todavía es difícil obtener una buena integridad de las estructuras tisulares. Como se muestra en la Figura 2, Figura 3y Figura 4, se obtuvieron secciones de buena calidad aplicables para la inmunomanchación a partir de tejidos duros incrustados de gelatina (por ejemplo, huesos trabeculares, huesos corticales, huesos del cráneo, tejidos nasales e incisivo). Esos resultados demostraron que la incrustación de gelatina mejora significativamente la integridad de la muestra de las secciones de tejido duro, pero también mejora la adhesión de las secciones a los vasos deslizantes. Además, la gelatina conserva las funciones del antígeno y exhibe compatibilidad con señales fluorescentes e inmunomanchas. Sin embargo, esta técnica solo funciona bien para muestras de hasta 3 meses de edad. Las posibles mejoras de este método son (1) diseccionar las muestras aún más para separar el tejido diana de otras partes para hacer la estructura del tejido simple (en el caso de los dientes, la mandíbula o maxilar debe ser diseccionada y fijada en lugar de toda la cabeza) y (2) usar 10% EDTA para descalcificar los tejidos sólo 2-3 días antes de la crioprotección. Este corto período de descalcificación no comprometerá los resultados de inmunostaining. Otra preocupación es que, como medio de incrustación no acuoso, la gelatina no se puede eliminar fácilmente de las diapositivas, lo que puede conducir a un fondo más alto dependiendo de los métodos de tinción (por ejemplo, la tinción de H&E).
Los resultados de inmunomancha no son fáciles de cuantificar, por lo que generalmente se utilizan semicuantitativamente. Las dificultades y limitaciones de la cuantificación de la inmunomanchación de los tejidos craneofaciales incluyen, entre otras, las siguientes: (1) es difícil definir el área a contar debido a la complejidad de la estructura de los tejidos craneofaciales; 2) es difícil definir el área etiquetada o las células etiquetadas debido a la naturaleza no lineal de la inmunomancha; (3) hay información limitada para el rango dinámico de la señal; (4) es difícil comparar la intensidad de las señales entre imágenes o grupos debido al desvanecimiento de la señal fluorescente durante la adquisición de la imagen; y (5) el fondo de la señal puede cambiar significativamente entre anticuerpos, diapositivas y muestras. Para aumentar la fiabilidad de los resultados de cuantificación, el experimento debe realizarse cuidadosamente y estrictamente. Todas las muestras deben procesarse en las mismas condiciones. Durante la inmunomancha, se requieren varios controles para evaluar el fondo de la señal y definir el área positiva o las células para la señal. Tome imágenes convincentes y representativas para mostrar claramente el área a contar y etiquetar las celdas con buen contraste. Además, durante la adquisición de la imagen, el ajuste de la cámara y el ajuste del equipo deben mantenerse constantes.
En conjunto, presentamos un protocolo estándar simple para la inmunofluorescencia en tejidos craneofaciales de ratón, especialmente para tejidos duros no descalcificados. El análisis de inmunomanchas de los tejidos craneofaciales no sólo ayudará a entender el mecanismo de la morfogénesis durante el desarrollo, sino que también ilustrará los cambios durante la patogénesis. Además, la inmunomancha también se puede utilizar para estudiar el patrón de expresión de otros ligandos de la vía de señalización, receptores u otros marcadores fenotípicos, además de la proliferación celular, la muerte celular y la vía de señalización BMP. Sin embargo, los pasos críticos de un experimento de inmunomanchación deben modificarse adecuadamente para que cada antígeno/anticuerpo o tejido obtenga manchas específicas y se minimicen las señales de fondo no específicas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud (R01DE020843 a Y.M.), la Asociación Internacional de FOP (Y.M.), y una beca en ayuda de la Fundación Nacional de Ciencias Naturales de China (31500788 a J.Y.).
Materiales
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
Referencias
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados