Method Article
小鼠颅面组织和未切除骨骼的组织制备及免疫染色
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一个详细的协议,以小鼠颅面组织为例,通过免疫染色来检测和量化颅面形态形成/发病机制期间的蛋白质水平。此外,我们描述了一种制备和冷冻方法,从幼鼠的未分化硬组织免疫染色。
摘要
组织免疫染色提供对给定组织内感兴趣的蛋白质的高度特定和可靠的检测。在这里,我们描述了一个完整和简单的协议,以小鼠颅面组织为例,用于检测颅面形态形成/发病过程中的蛋白质表达。该方案包括组织制备和冷冻、间接免疫荧光、图像采集和定量。此外,还介绍了一种制备和冷冻未分化的硬组织进行免疫染色的方法,以颅面组织和长骨为例。这些方法是确定颅面形态形成/发病过程中各种组织中的蛋白质表达和形态/解剖变化的关键。它们也适用于具有适当修改的其他组织。组织学知识和各节的高质量对于从实验结果中得出科学结论至关重要。该方法的潜在局限性包括但不限于抗体的特异性和定量困难,这里还讨论了这些缺陷。
引言
面部是人类身份的关键部分,由几种不同的组织组成,如上皮、肌肉、骨骼、软骨、牙齿。这些组织来自所有三个生殖层、内皮和中代1、2。为了正确形成颅面组织,细胞增殖、死亡和分化需要高度协调和由特定的信号通路调节,如Wnt、Fgf、Hh和Bmp通路3、4 , 5.细胞增殖、存活或分化的缺陷会导致颅面畸形,这是最常见的先天性先天缺陷之一。转基因小鼠是研究颅面形态形成和发病机制的有用工具,其作用是1、2、3、4、5。了解颅面结构在发育和发病过程中的变化将有助于澄清关键的发育原理以及颅面畸形的机制1,2,3 ,4,5.
用特定抗体染色整个安装或切片组织是确定感兴趣的蛋白质的空间分布的宝贵技术。从形式上讲,组织免疫染色可以依赖于免疫组织化学 (IHC) 或免疫荧光 (IF)。与IHC用3,3'-Diaminobenzidine(DAB)等致色基质产生的不透明反应产物相比,IF涉及使用荧光显微镜可见的荧光结合物。因此,IF 可以清楚地区分正细胞和背景噪声,并允许通过 ImageJ 和 Adobe Photoshop7、8等软件以简单的方式对图像进行定量分析和增强。整个安装染色方法适用于小块组织(厚度小于 5 mm),可提供蛋白质/抗原位置的三维信息,而无需从第9节、第 10 节开始重建.然而,与组织部分相比,整个安装免疫染色是耗时的,需要大量的抗体溶液。并非所有抗体都与基本的整体安装方法兼容。此外,抗体的不完全渗透将导致不均匀的染色或错误的阴性染色。在这里,我们将重点介绍切片组织上蛋白质/抗原的免疫荧光检测。对于硬组织(如头部、牙齿、长骨),钙在发育/发病过程中沉积使样品难以分段,在免疫染色治疗期间容易冲洗掉11、12。目前可用的大多数协议在嵌入之前对硬组织进行标记,使切片更容易,这非常耗时,如果处理不当,可以破坏样品的形态和抗原。为了克服这些问题,我们优化了一种在不去钙化的情况下冷冻硬组织的方法,从而改进了信号蛋白的形态和分布的可视化。
此处描述的方案用于确定BMP转基因小鼠颅面组织的形态学和组织学变化。具体来说,该方案包括(1)收获和解剖头组织,(2)实验标记的截面和免疫染色(Ki67,pSmad1/5/9)以及TUNEL染色,(3)使用荧光显微镜成像部分,最后(4)分析和量化结果。准备和冷冻硬组织没有去钙化的协议也描述了13。这些方法针对颅面组织进行了优化。它们也适用于不同年龄的样品的其他组织,并作适当的修改。
研究方案
所有小鼠实验都按照密歇根大学关于人道护理和动物在研究中使用的指导方针进行。这项研究中使用的所有动物程序都通过了密歇根大学(协议#PRO00007715)的机构动物护理和使用委员会(IACUC)。
1. 组织准备
-
胚胎组织制剂
- 为每个怀孕的小鼠准备一个 10 厘米的盘子和几个含有磷酸盐缓冲盐水 (PBS) 的 3.5 厘米菜,以及一个含有 2 mL 4% 甲醛 (PFA) 的 12 孔培养板。将所有培养皿和盘子放在冰上。
注:在烟罩中处理 4% PFA。 - 从冰冷的PBS中用钳子和剪刀从怀孕的老鼠身上解剖胚胎,如前文14所述。
- 简单地说,用CO2安乐死怀孕的老鼠,用钳子抓住腹部中心下方的皮肤,只切过皮肤,然后轻轻地拉在皮肤上,将其与腹部肌肉壁的底层分离。
- 接下来,按照皮肤切口的同一条线切入腹腔。取出含有一串胚胎的子宫,轻轻切掉子宫壁,取出胚胎。外胚胎组织,如蛋黄囊和羊年将被移除。
- 从每个胚胎中切割和分离头部。
- 将每个头转移到包含 4% PFA 的 12 孔板的每个孔中,带有塑料转移移液器或钳子。将4%PFA中的样品固定在4°C4小时,在4°C下冲洗PBS中的样品,轻轻摇动12小时。
注:对于胚胎年龄小于胚胎的16.5 (E16.5),在分离后直接用4%PFA固定胚胎头。对于E16.5或更高版本的胚胎,从头部取出皮肤和脂肪组织,在固定前在冰冷的PBS中冲洗几次。 - 冷冻保护头。
- 使用塑料转移移液器或钳子将每个头转移到新的 12 孔板中,该板含有 2 mL 的 30% 蔗糖。在 4°C 下轻轻搅拌,直到头部下沉到盘子底部。
- 嵌入头。
- 将防低温头转移到含有最佳切削温度 (OCT) 化合物的模具中。在OCT中对样品进行几分钟的均衡。使用钳子调整样品的位置和方向。
- 将模具放在干冰上进行冷冻。将产生的冷冻物储存在-80°C的塑料袋中,直到准备好进行冷冻切片。
注:样品的修剪侧必须面向嵌入模具的底部。
- 为每个怀孕的小鼠准备一个 10 厘米的盘子和几个含有磷酸盐缓冲盐水 (PBS) 的 3.5 厘米菜,以及一个含有 2 mL 4% 甲醛 (PFA) 的 12 孔培养板。将所有培养皿和盘子放在冰上。
-
产后未衰退硬组织的准备
- 在3周或3个月大的小鼠与CO2安乐死。去除皮肤和脂肪组织。从鼠标中剪切和隔离头部或长骨骼。
- 修复和冷冻保护小鼠的头部或长骨,如步骤 1.1.3_1.1.4 所述。
- 嵌入 8% 明胶,方式与步骤 1.1.5 类似。将冷冻物放在-80°C的塑料袋中,直到冷冻。
注:在这里,不需要去钙化。要制备 8% 明胶,将 8 克明胶与 100 mL 的 PBS 混合,并使用微波炉煮沸。请注意,混合物很容易沸腾。
2. 冷冻切片
- 将嵌入在OCT或-25°C中的软组织低温温度设置为-18°C,为嵌入明胶的未分化硬组织设置低温。将样品保存在冷冻室中约30分钟,以平衡到低温。
- 将方块从低温中排出。通过用 OCT 滴安装将块冻结在试样夹头(组织支架)上。保持样品的修剪侧离夹头最远(面向操作员)。
- 将块安装夹头加载到低温对象支架上。调整刀片支架,使刀片式服务器相对于样品的角度为 3°[5]。
- 将 10 μm 截面收集到涂层显微镜幻灯片上。在RT处完全干燥部分,然后储存在-80°C。
3. 组织染色和显微成像
- 免疫荧光染色
- 从 -80 °C 取下幻灯片。将幻灯片在 RT 处保留 1 小时到通风部分。在 0.1% PBST(PBS 中的 0.1% 聚乙烯乙二醇三聚苯醚中;参见材料表)中冲洗幻灯片,每次 5 分钟,以冲洗 OCT 和渗透部分。
- 可选择执行抗原检索(可选)。
- 用蒸煮机或水浴将柠气酸液缓冲液(10mM柠酸酸钠pH6)预热至95~100°C。将滑梯浸入水酸盐缓冲液中,孵育10分钟。
- 把染色盘从蒸腾机或水浴中拿出来,到RT.在RT冷却幻灯片20分钟或更长时间15分钟。
注:作为替代品,使用 Tris-EDTA 缓冲液(10 mM Tris 碱基、1mM EDTA、0.05% 补间 20、pH 9.0)或 EDTA 缓冲液(1 mM EDTA,0.05% Tween 20,pH 8.0)进行热诱导抗原检索。除热蒸蒸机外,使用压力锅、微波炉或水浴进行热感应抗原回收。使用胰蛋白酶或胰蛋白酶进行酶诱导抗原检索是另一种选择。优化酶检索的浓度和治疗时间,避免损伤截面。优化每种抗体/抗原组合的抗原检索方法。
- 用200μL的阻滞溶液(5%驴血清在0.1%PBST中稀释)在RT孵育30分钟,然后去除阻滞溶液,无需冲洗。
- 用100μL的原抗体或抗体在阻断溶液中孵育每张幻灯片,在RT或O/N4°C下孵育1小时。在 RT 上用 PBS 冲洗幻灯片三次,每次 10 分钟。
- 在RT下用100μL的二级抗体在阻断溶液中孵育每张幻灯片1小时。在RT上冲洗PBS中的幻灯片三次,每次10分钟。保护幻灯片免受光线照射。
- 安装幻灯片。
- 在幻灯片上添加两滴防褪色介质,其中 DAPI(4'、6-二酰胺-2-phenylindole)。然后用盖玻片盖住。
- 在黑暗中储存在4°C,直到准备好成像。
注:作为替代方案,首先在RT处在PBS中用DAPI或Hoechst 33324染料标记核,然后加入甘油。
- 端子脱氧核糖核酸酯转移酶 dUTP 刻末标签 (TUNEL) 染色。
注:在细胞凋亡期间,双链DNA与3'-羟基基特尼(3'OH DNA终点)将形成。在这里,我们提供一个协议,通过标记DNA片段与二核苷酸利用终端脱氧核糖核酸转移酶(TdT)在原位标记自由3'OH DNA术语基尼原位(参见材料表)).- 在TUNEL染色之前,有原发抗体和Alexa Fluor-488标记的二级抗体的染色部分可选。在 PBS 中冲洗幻灯片三次,每次 10 分钟。
注:此步骤是可选的,在同一张幻灯片中双染色蛋白质和 TUNEL。 - 在 RT 上用 100 μL 蛋白酶 K(10 mM Tris pH 7.5 和 5 mM EDTA)孵育每张幻灯片 5 分钟。在 RT 上用 PBS 冲洗幻灯片三次,每次 10 分钟。
注:调整每种组织类型的蛋白酶 K 的孵育时间和温度。对于固定在4%PFA的10μm部分的胚胎头,在RT孵育5分钟。除使用蛋白酶K的方法外,根据需要使用替代治疗,包括(1)新鲜制备的0.1%聚乙烯乙二醇三聚苯醚、0.1%柠酸钠,37°C时10分钟;(2) 0.25%~0.5% HCl (pH 2) 或 0.25% 胰蛋白酶中的胰蛋白酶,在 37 °C 时 10 分钟;和 (3) 微波辐照与 0.1 M 云酸盐缓冲液 (pH 6)。 - 将200 μL的阻滞溶液(5%驴血清稀释0.1%PBST)涂到每张幻灯片上,在RT下孵育30分钟,无需冲洗即可敲开堵塞溶液。
- 在RT处将套件提供的50 μL平衡缓冲液涂抹到每张幻灯片上至少10s。无需冲洗即可轻触缓冲液。
- 通过将 TdT 酶与试剂盒提供的反应缓冲液以 3:7 的比例混合制备反应混合物(工作强度 TdT 酶)。将50μL的反应混合物涂到每张幻灯片上,在37°C孵育1小时。无需下皮。
- 将套件提供的停止缓冲液(ddH2O 中 1:30 稀释)的 200 μL 涂抹到每张幻灯片上,然后在 RT 孵育 10 分钟。
- 标签与罗达明抗体。
- 将50μL的预加热(RT)抗二角激素联结(罗达明)(1:1稀释在阻滞溶液中)涂抹到每张幻灯片上。在黑暗中在RT孵育30分钟。
- 用 PBS 冲洗幻灯片三次,每次 10 分钟。将幻灯片安装为步骤 3.1.6。
- 在TUNEL染色之前,有原发抗体和Alexa Fluor-488标记的二级抗体的染色部分可选。在 PBS 中冲洗幻灯片三次,每次 10 分钟。
4. 成像采集
- 使用正对照(组织对靶抗原呈阳性)检查信号标记和阴性对照(省略主要抗体、等型控制或目标抗原的组织阴性),以评估荧光下图像的背景显微镜。
- 根据负控制和正控制的信号强度设置成像设备和摄像机条件(曝光和其他常规设置)。
注:这些条件因 (1) 用于成像的照相机和显微镜、(2) 抗体和 (3) 每个实验的组织而异。用于颅面组织的常见条件为 ISO 200,暴露时间从 1/100 s 到 1 s s 取决于抗体的质量和特异性。适当的放大率因样品大小和实验目的而异。 - 使用传统的表氟显微镜或共聚焦显微镜获取图像。在每个颜色通道的相同条件下获取图像(包括相应控件的图像)。保存格式相同的图像(tiff 最好保留信息)。
5. 荧光定量
注:统计比较不同组之间的染色在许多情况下将更丰富。使用免疫荧光图像,通过测量信号密度、计算正细胞或计算正面积来量化蛋白质的相对水平。进行统计分析时,生物独立样本的最小数量为3。典型的方法是从每个样本中生成至少三个部分,并为每个部分中至少三个代表性区域拍摄图像。
-
使用 ImageJ 对荧光强度进行定量
- 打开软件,并使用"分析>设置测量"检查仅选择"面积"和"集成密度"。使用"文件>打开"打开要分析的图像。
- 使用工具栏选择最左侧的正方形或圆形图标。使用选择工具选择要在图像上分析的区域。使用"分析>测量"在"结果"窗口中获取所选区域和集成密度的读出。选择没有荧光的阳性细胞旁边的区域来读出背景。
- 重复步骤 5.1.2 分析其他图像。调整了要分析的区域,以匹配第一个图像的区域。
- 复制"结果"窗口中的所有数据,并在完成分析后粘贴到电子表格中。
- 将校正的荧光强度 (CTCF) 计算为集成密度 = (选定细胞面积 x 背景读数的平均荧光)。比较样品之间校正的总细胞荧光的差异,并绘制一个图表。
-
使用 ImageJ 对荧光图像的正细胞数进行定量
- 手动细胞计数。
- 使用ImageJ >插件>分析来安装单元计数器插件。
- 使用"文件>打开"打开要分析的图像。使用插件>分析>单元格计数器打开计数器窗口和结果窗口。
注:单元格计数器在堆栈上不起作用。对于计数堆栈,插件绘图 Z 轴配置文件,然后使用图像>堆栈>绘图 Z 轴配置文件,以监控移动 ROI 的强度使用粒子跟踪工具。此工具可以是手动的,也可以是自动的。 - 单击计数器窗口底部的一个按钮以启动计数。直接单击要计数的单元格/对象,直到完成。
- 单击"计数"窗口中的"结果"按钮。计数的单元格总数将显示在"结果"窗口中。将结果日志保存为电子表格并进行分析。
- 自动细胞计数。
- 使用"文件>打开"打开要分析的图像。在继续操作之前,将 RGB 图像转换为灰度图像。
- 使用图像>调整>阈值选择需要计数的所有区域。
- 使用"分析>分析粒子"获取细胞/粒子的数量。设置有效粒子大小的范围(例如,100-无穷大),而不是默认的 0-无穷大,以计算特定范围内的单元格/粒子。将结果日志保存为电子表格并进行分析。
注:要从图像中获取其他信息,除区域外,请转到"分析>设置测量",然后选择所需信息旁边的框。
- 手动细胞计数。
结果
胚胎颅面组织部分
按照上述步骤,在胚胎日(E)16.5或18.5时,从对照(P0-Cre)或突变体(神经峰细胞中形成激活的Bmpr1a,P0-Cre;caBmpr1a)胚胎中解剖头部。 在4%PFA中固定4小时后,样品嵌入OCT和低温分度。结果部分被免疫染色的抗体对pSmad1/5/9(下游BMP信号因子)或Ki67(细胞增殖标记)没有抗原检索根据协议。如图所示,pSmad1/5/9(图1A)和Ki67(图1C)在对照胚胎的前骨骼中呈阳性。在突变胚胎中,pSmad1/5/9水平增加(图1B),而Ki67的水平低(图1D)在前骨中减少。这些样本中的细胞死亡也按照协议进行了检查。如图所示,在突变胚胎的前骨中观察到的凋亡细胞比对照胚胎的细胞多(图1E,F)。
未分化的颅面组织或长骨部分
按照上述步骤对未去切的硬组织,从3周大小鼠(P0-Cre;mTmG(膜番茄和膜GFP)的头部固定与4%PFA和嵌入8%明胶。冠状冷冻片用PBST洗涤,并安装与DAPI的抗褪色介质。图 2A,B证明明胶不会干扰来自切片组织的荧光信号。
使用3周大或3个月大的小鼠的头部和女性来检查明胶嵌入未贴切组织是否对IF有利。根据协议,对整头和女头进行了处理和分割。结果部分用于SOX9免疫染色(图3)或OSX和E11/波多普宁双重免疫染色(图4)。如图所示,从3周硬组织的大部分中获得了高质量的部分,包括股骨的眼皮和皮质隔间(图3A,B,图4A+D),前骨骼(图4E),F),切口(图3E,F,图4I,J),鼻组织(图3C,D),和头骨包括鼻前缝合和周围骨骼(图4G,H) 头部。而,在3个月大的样本中,只有一些硬质组织获得高质量的部分,包括股骨的眼腔(图3G,H,图4K,L),鼻组织(图3I) ,J),头骨包括鼻前缝合和周围骨骼(图4M,N)的头部。如图3所示,SOX9阳性细胞在股骨和鼻腔(图3D,J)的生长板的软骨细胞(图3B)和关节(图3H)中被专门检测到。在3周大的切口中,SOX9在中位细胞中被检测到(图3F)。OSX和E11双染色结果显示OSX在成骨细胞中检测到,而E11在股骨和头部骨细胞中检测(图4B,D,H,L,N)。在3周的切口中,OSX在卵泡细胞中呈阳性,而E11在卵泡中质细胞中呈阳性(图4J)。这些结果表明,未分化的硬组织嵌入明胶很好地保存抗原功能。
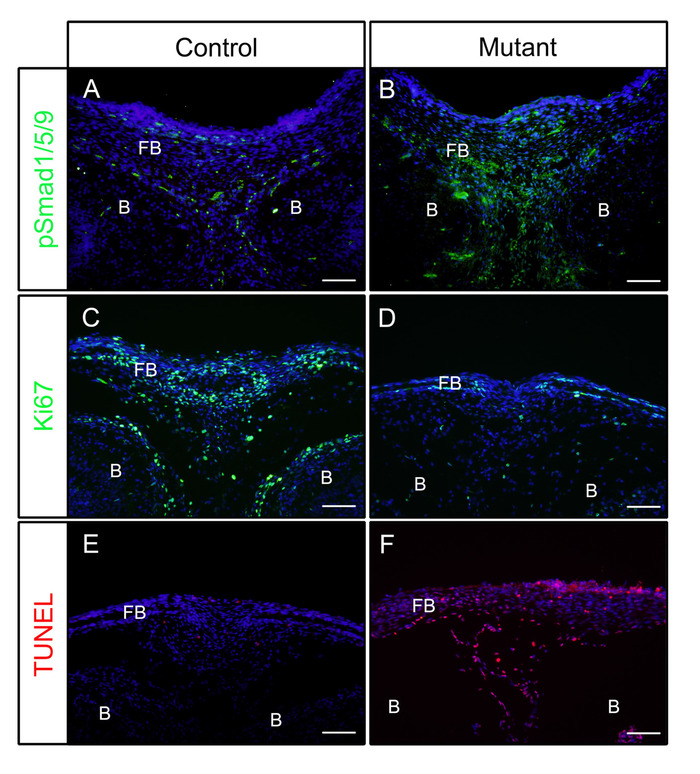
图1:控制胚胎和突变胚胎中具有增强BMP活性的PSmad1/5/9、Ki67或TUNEL的IF结果示例。组织激活的Bmpr1a (caBmpr1a) 小鼠与P0-Cre小鼠交叉,以增加神经峰细胞(NcCs)中的BMP信号活性。控制头(P0-Cre;caBmpr1a[/]) 和突变体 (P0-Cre;caBmpr1afx/+) 胚胎在 E16.5 或 E18.5 下解剖,用 4% PFA 固定 4 小时,冷冻用 30% 蔗糖1天,嵌入 OCT 中,并在-18°C下冷冻。前骨部分(与眼睛相似水平)用于对pSmad1/5/9、Ki67或TUNEL染色进行免疫检测。(A, B) pSmad1/5/9 (绿色) 在E16.5的控制前骨骼 (A) 或突变 (B) 胚胎中的染色模式.(C, D)Ki67 (绿色) 在控制前骨 (C) 或突变 (D) 胚胎在 E18.5 的染色模式.(E, F)在E18.5处控制前骨骼(E)或突变(F)胚胎中的TUNEL(红色)染色模式。核被DAPI(蓝色)弄脏了。FB = 前骨,B = 大脑。刻度条 = 100 μm。请点击此处查看此图的较大版本。
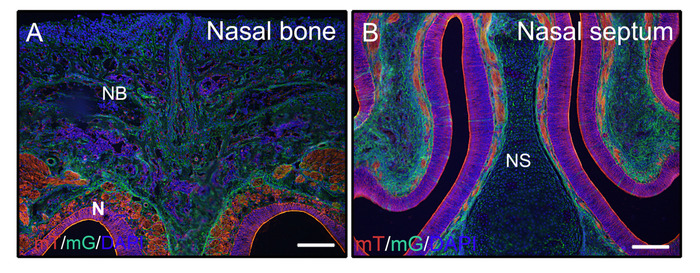
图2:mTmG报告器信号结果未分化在头部。从3周老的P0-Cre小鼠与膜番茄和膜GFP(mTmG)报告被解剖,固定与4%PFA4小时,冷冻保护与30%蔗糖2天,嵌入8%明胶,并在-25°C冷冻。头部部分清楚地显示GFP(绿色,克雷重组阳性)和番茄(红色,克雷重组阴性)信号在鼻骨和鼻组织(A,B)。核被DAPI(蓝色)弄脏了。NB = 鼻骨,N = 鼻组织,NS = 鼻隔膜。刻度条 = 250 μm。请点击此处查看此图的较大版本。
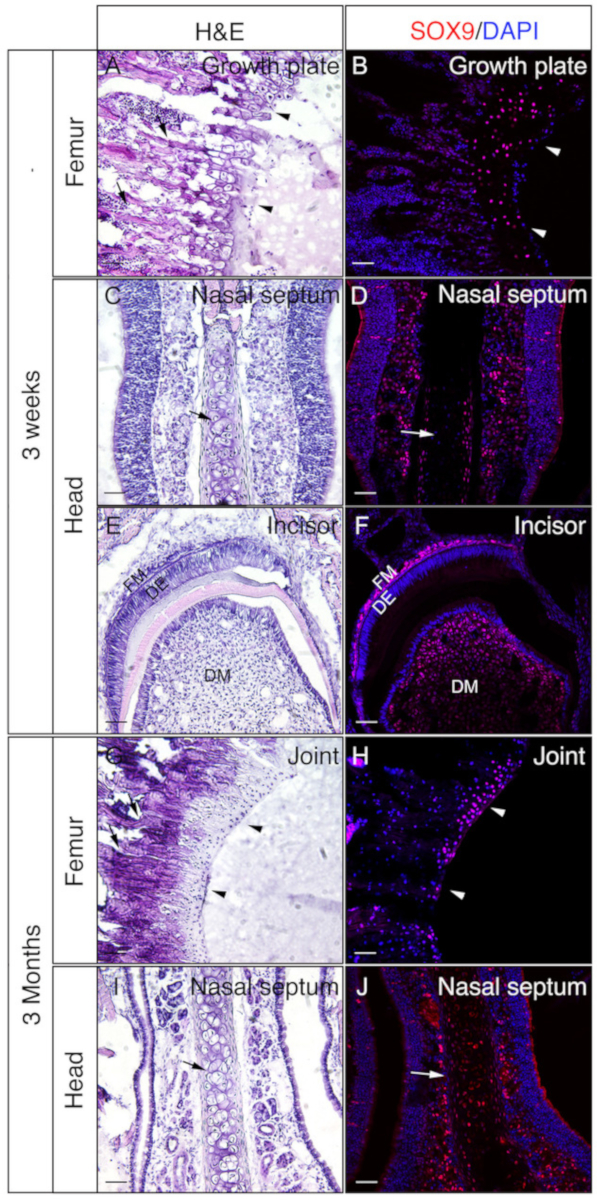
图3:头部和女性未分化组织的SOX9免疫染色结果示例。头部和femora从3周或3个月大的小鼠中解剖,4小时固定4%PFA,冷冻30%蔗糖2天,嵌入8%明胶,在-25°C冷冻。幻灯片用于针对 SOX9(红色)的免疫检测。核被染上了DAPI(蓝色) (B, D, F, H, J).这些组织的相邻部分用于血氧林和Eosin(H&E)染色(A,C,E,G,I)。A和B中的箭头表示生长板和G和H,关节软骨。A和G中的箭头表示骨骼和C、D、I和J的鼻隔膜。DM = 牙科间质,DE = 牙科上皮,FM = 卵泡间质。刻度条 = 50 μm。请点击此处查看此图的较大版本。
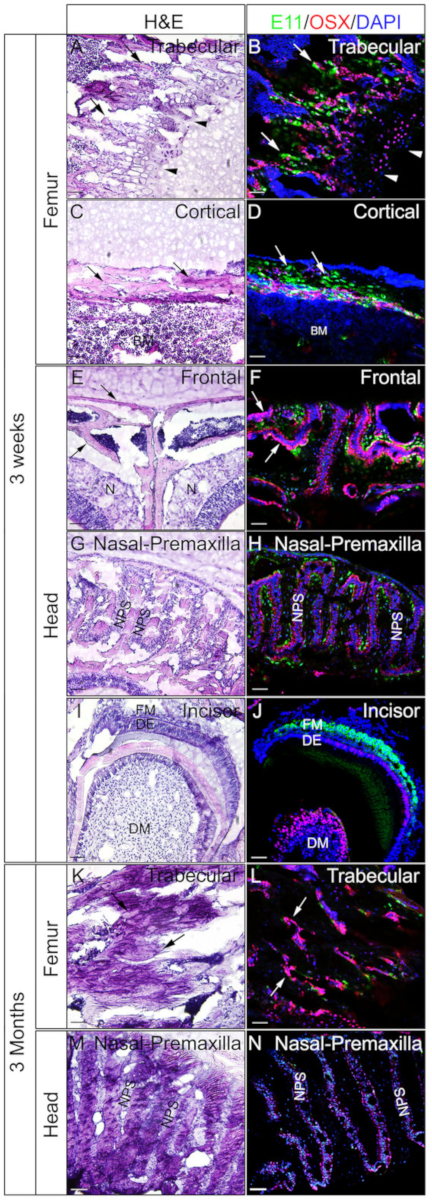
图4:OSX和E11在头部和女性未分化组织的双重免疫染色结果的示例。头部和femora从3周大或3个月大的小鼠中解剖,4小时固定4%PFA,冷冻30%蔗糖2天,嵌入8%明胶,在-25°C冷冻。部分用于对OSX(红色)和E11/波多普宁(绿色)的抗体进行双重免疫染色。核被染上DAPI(蓝色) (B, D, F, H, J, L, N)。这些组织的相邻部分用于H&E染色(A,C,E,G,I,K,M)。A、B、K和L中的箭头表示股骨的眼腔室;C和D,股骨的皮质隔间; 在E和F,正面骨骼。 A和B中的箭头表示生长板。BM = 骨髓,N = 鼻组织,DM = 牙齿间质,DE = 牙上皮,FM = 卵泡间质,NPS = 鼻前颌骨缝合。前骨 (E, F) 和鼻前缝合和周围的骨骼 (G, H, M, N) 也显示.刻度条 = 50 μm。请点击此处查看此图的较大版本。
讨论
在这里,我们提供了一个详细的协议,用于制备小鼠头和未去切骨组织,以及用于细胞增殖、细胞死亡和BMP信号标记的免疫染色的冷冻切片。我们还详细介绍了从免疫荧光图像获取定量数据的策略。这些方法也适用于具有适当修改的其他组织。
组织制备的条件因组织的大小和类型而异。固定和冷冻保护时间通常需要几个小时到一夜之间。固定后,组织也可以嵌入石蜡和切片与微托姆16。虽然石蜡和OCT在免疫染色方面都很好,但它们之间还是有一些区别的。石蜡块可在RT处保存多年,而OCT块在-80°C下可保存1年。石蜡可保留组织形态,而在OCT嵌入期间形成的冰晶可能对组织结构产生负面影响。石蜡有时掩盖抗原的表征,而OCT保留酶活动和抗原表位。因此,如果固定在4%PFA中,只需4小时或更少,并嵌入OCT中,则大多数抗体无需抗原检索。然而,如果阳性对照在冷冻科没有显示出良好的染色效果,通过抗原检索仍有可能获得更好的结果。
Hoechst 染料和 DAPI 都可用于核反染色。它们有相似之处,因为 (1) 是紫外线激发、微小的凹槽结合化学品,可发出与总 DNA 含量成正比的信号,(2) 在长时间接触后进行光漂白。然而,Hoechst染料由于其高渗透性,通常用于染色活细胞中的DNA含量。DAPI 通常用于在固定细胞中染色 DNA,因为其膜渗透性较低。此外,DAPI 产生的信号比 Hoechst 更强、更稳定。
正确的控制对于 IF 至关重要。每种新抗体的特异性应通过西方印斑分析(如果适用)予以确认。应使用连续稀释来确定特定原抗体的最佳工作浓度。应包括阳性对照(证明表达蛋白质/抗原的组织或细胞),以检查IF过程和抗体的特异性。还应包括阴性对照,例如,没有原抗体,或从同一物种替代正常IgG作为原抗体,或组织对靶抗原呈阴性。拍照时,应用每个通道独立检查无二级抗体(背景控制)的样品,以设置信号增益和偏移的极限,以便用于最终成像。为了检测多个标签,需要准备背景控制和单标记控件,以避免光谱重叠伪影。所有用于获取多标签样本图像的通道都必须进行独立的背景校正,因为每个通道中的自荧光水平差异很大。
我们还为嵌入明胶中的未分化硬组织的准备和冷冻提供方案。对于OCT嵌入式去化硬组织,大多数硬组织部分将在免疫染色过程中从滑动眼镜分离,因为它们在幻灯片上的粘附特性较低。专为促进冷冻切片而设计的胶带有助于生成高质量的截面。但是,当胶带脱落时,这些部分很容易损坏。对于明胶嵌入式组织,无需使用磁带传输系统来生成高质量的截面。作为嵌入介质,明胶可以很好地渗透样品,尽管它的粘度比OCT低。 明胶已用于其他组织学应用,如脑组织17、18和超薄部分的细胞用于免疫细胞化学19。在这里,明胶用于嵌入未贴片骨骼,从而产生比 OCT 更容易冷冻的块。有几个小提示,以获得明胶嵌入未贴片硬组织的良好部分。关键步骤是嵌入明胶而不是 OCT。为了获得更好的穿透力,在样品下沉到底部后,将样品保持在30%的蔗糖中。将温度设置为-25°C 与往常相比,也同样重要。不需要超锋利的刀片。虽然低温(-25°C)对OCT嵌入式未分化硬组织的冷冻切片有一些改进,但组织结构的完整性仍然难以实现。如图2所示,图3和图4,从明胶嵌入硬组织(如骨骼、皮质骨、头骨骨、鼻组织和切口)获得适用于免疫染色的优质部分。这些结果证明,明胶嵌入可显著提高硬组织部分的标本完整性,同时也增强了滑动眼镜部分的附着力。此外,明胶可保留抗原功能,并表现出与荧光信号和免疫染色的兼容性。然而,这种技术只适用于长达3个月的样品。这种方法的潜在改进是 (1) 进一步解剖样品,使目标组织与其他部分分离,使组织结构简单(在牙齿的情况下,下颌或颌片应解剖和固定,而不是整个头部)和 (2) 使用 10% EDTA 在冷冻保护前仅 2⁄3 天对组织进行去分化。这种短暂的脱钙时间不会损害免疫染色结果。另一个担忧是,作为非水嵌入介质,明胶不能轻易从幻灯片中去除,这可能导致更高的背景,具体取决于染色方法(例如,H&E 染色)。
免疫染色结果不容易量化,因此通常半定量使用。颅面组织免疫染色定量的困难和局限性包括但不限于:(1) 由于颅面组织结构的复杂性,难以界定要计数的区域;(2)由于免疫染色的非线性性质,难以界定标记面积或标记细胞;(3) 信号的动态范围信息有限;(4)由于图像采集过程中荧光信号的减弱,图像或组之间的信号强度难以比较;(5) 抗体、幻灯片和样品之间的信号背景可能显著变化。为了提高定量结果的可靠性,应认真、严格地进行实验。所有样品应在相同的条件下处理。在免疫染色期间,需要各种控制来评估信号背景并定义信号的正面积或细胞。采取令人信服和有代表性的图像,清楚地显示要计数的区域,并标记具有良好对比度的单元格。此外,在图像采集过程中,摄像机设置和设备设置必须保持一致。
综合起来,我们提出了一个简单的标准方案,用于小鼠颅面组织的免疫荧光,特别是未分化的硬组织。颅面组织的免疫染色分析不仅有助于了解发育过程中的形态形成机制,而且有助于说明发病机制发生过程中的变化。此外,除细胞增殖、细胞死亡和BMP信号通路外,免疫染色还可用于研究其他信号通路配体、受体或其他型型标记的表达模式。然而,免疫染色实验的关键步骤必须针对每个抗原/抗体或组织进行适当修改,以获得特定的染色和最小化非特异性背景信号。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究院(R01DE020843至Y.M.)、国际FOP协会(Y.M.)和中国国家自然科学基金资助(31500788至J.Y.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
参考文献
- Trinh, L. eA., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561(2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803(2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。