Method Article
إعداد الأنسجة وتلطيخ المناعة من أنسجة الفئران القحفية والعظام غير الصائق
* These authors contributed equally
In This Article
Summary
هنا، نقدم بروتوكول مفصل للكشف عن وقياس مستويات البروتين أثناء تكوين الجمجمة والوجه / مسببات الأمراض عن طريق التلطيخ المناعي باستخدام أنسجة الجمجمة والوجه الماوس كأمثلة. وبالإضافة إلى ذلك، فإننا نصف طريقة لإعداد واستئصال التبريد من الأنسجة الصلبة undecalcified من الفئران الشباب لتلطيخ المناعة.
Abstract
يوفر تلطيخ مناعة الأنسجة اكتشافًا محددًا للغاية وموثوقًا به للبروتينات ذات الأهمية داخل نسيج معين. هنا نقوم بوصف بروتوكول كامل وبسيط للكشف عن التعبير عن البروتين أثناء تكوين الجمجمة والوجه / مسببات الأمراض باستخدام أنسجة الجمجمة والوجه الماوس كأمثلة. ويتألف البروتوكول من إعداد الأنسجة وتشريحها بالتبريد بالتبريد، والفلورة المناعية غير المباشرة، والحصول على الصور، والقياس الكمي. وبالإضافة إلى ذلك، يتم وصف طريقة لإعداد واستئصال الأنسجة الصلبة غير الصائرة للبقع المناعي، وذلك باستخدام أنسجة الوجه القحفي والعظام الطويلة كأمثلة. هذه الأساليب هي المفتاح لتحديد التعبير البروتين والتغيرات المورفولوجية / التشريحية في الأنسجة المختلفة أثناء تكوين الجمجمة والوجه / مسببات الأمراض. كما أنها تنطبق على الأنسجة الأخرى مع التعديلات المناسبة. المعرفة بالأنسجة وجودة عالية من الأقسام أمر بالغ الأهمية لاستخلاص النتائج العلمية من النتائج التجريبية. وتشمل القيود المحتملة لهذه المنهجية، على سبيل المثال لا الحصر، خصوصية الأجسام المضادة وصعوبات التحديد الكمي، التي تناقش هنا أيضاً.
Introduction
الوجه هو جزء رئيسي من الهوية البشرية، ويتكون من عدة أنواع مختلفة من الأنسجة، مثل ظهارة، العضلات، العظام، الغضروف، الأسنان. هذه الأنسجة مشتقة من جميع الطبقات الجرثومية الثلاث: ectoderm، endoderm، وmesoderm1،2. لنمط وتطوير الأنسجة القحفية الوجهية بشكل صحيح، يجب أن يكون انتشار الخلايا والوفاة والتمايز منسقاً ومنظماً بشكل كبير من خلال مسارات إشارة محددة، مثل مسارات Wnt وFgf وHh وBMP3و4 ،5. العيوب في انتشار أو البقاء على قيد الحياة أو تمايز الخلايا سوف تؤدي إلى تشوهات في الوجه القحفي، والتي هي من بين العيوب الخلقية الخلقية الأكثر شيوعا. الفئران المعدلة وراثيا هي أدوات مفيدة لدراسة آليات تكوين الجمجمة والوجه ومسببات الأمراض1،2،3،4،5. فهم التغيرات في هياكل الجمجمة والوجه أثناء التنمية ومسببات الأمراض سيساعد على توضيح المبادئالتنموية الرئيسية وكذلك آليات تشوهات الوجه القحفي 1،2،3 ،4،5.
تلطيخ جبل كامل أو الأنسجة المقطعة مع الأجسام المضادة محددة هو تقنية لا تقدر بثمن لتحديد التوزيع المكاني للبروتينات ذات الأهمية 6. رسميا، يمكن أن تعتمد تلطيخ مناعة الأنسجة إما على الكيمياء المناعية (IHC) أو الفلورة المناعية (IF). بالمقارنة مع المنتج رد فعل مبهمة ولدت مع الركيزة كروموجينيك مثل 3,3'-Diaminobenzidine (DAB) من قبل IHC, IF ينطوي على استخدام البوابات الفلورية مرئية من قبل المجهر الفلوري. لذلك، إذا IF قد تميز بوضوح الخلايا الإيجابية من الضوضاء الخلفية، ويسمح الصور لتحليلها كميا وتعزيزها بطريقة مباشرة من قبل برامج مثل ImageJ وأدوبي فوتوشوب7،8. يعمل نهج تلطيخ الجبل بأكمله على كتل صغيرة من الأنسجة (أقل من 5 مم سميكة)، والتي يمكن أن توفر معلومات ثلاثية الأبعاد حول موقع البروتينات / المستضدات دون الحاجة إلى إعادة الإعمار من الأقسام9و10 . ومع ذلك، بالمقارنة مع أقسام الأنسجة، جبل كامل تلطيخ المناعة يستغرق وقتا طويلا ويتطلب كميات كبيرة من حلول الأجسام المضادة. ليست جميع الأجسام المضادة متوافقة مع نهج جبل كامل الأساسية. وبالإضافة إلى ذلك، فإن الاختراق غير الكامل للأجسام المضادة يؤدي إلى تلطيخ متفاوتة أو تلطيخ سلبي زائف. هنا سوف نركز على الكشف عن الفلورة المناعية من البروتينات / المستضدات على الأنسجة المقطعة. للأنسجة الصلبة (على سبيل المثال، الرأس، الأسنان، العظام الطويلة)، ترسب الكالسيوم أثناء التنمية / مسببات الأمراض يجعل العينة من الصعب قسم وشطف بسهولة قبالة خلال العلاج مناعة11،12. معظم البروتوكولات المتاحة حاليا الشارات الأنسجة الصلبة قبل التضمين لجعل القسم أسهل، وهو أمر يستغرق وقتا طويلا ويمكن أن تدمر مورفولوجيا ومستضدات العينات إذا تم التعامل معها بشكل غير صحيح11،12. للتغلب على هذه القضايا، قمنا بتحسين نهج للتشريح بالتبريد للأنسجة الصلبة دون الشارات، مما أدى إلى تحسين التصور من مورفولوجيا وتوزيع البروتينات إشارة.
البروتوكول الموصوف هنا يستخدم لتحديد التغيرات المورفولومترية والأنسجة في أنسجة الوجه القحفي للفئران المعدلة وراثيا ً BMP. وعلى وجه التحديد، يتضمن البروتوكول (1) حصاد وتشريح أنسجة الرأس، (2) قسم وتلطيخ المناعة للعلامات التجريبية (Ki67، pSmad1/5/9) جنبا إلى جنب مع تلطيخ TUNEL، (3) تصوير الأقسام باستخدام المجهر الفلوري، وأخيرا (4) تحليل النتائج وقياسها كمياً. كما يرد وصف بروتوكول إعداد واستئصال الأنسجة الصلبة دون الشارات13. هذه الطرق هي الأمثل للأنسجة القحفية الوجه. كما أنها تنطبق على الأنسجة الأخرى من مختلف الأعمار من العينات مع التعديلات المناسبة.
Protocol
وقد أجريت جميع تجارب الماوس وفقا للمبادئ التوجيهية لجامعة ميشيغان التي تغطي الرعاية الإنسانية واستخدام الحيوانات في البحوث. تمت الموافقة على جميع الإجراءات الحيوانية المستخدمة في هذه الدراسة من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC) في جامعة ميشيغان (البروتوكول #PRO00007715).
1. إعداد الأنسجة
-
إعداد الأنسجة الجنينية
- إعداد طبق واحد 10 سم والعديد من الأطباق 3.5 سم التي تحتوي على الفوسفات المخزنة المالحة (PBS)، ولوحة ثقافة 12 جيدا تحتوي على 2 مل 4٪ بارافورماليد (PFA) في PBS في كل بئر لكل فأر حامل. ضع جميع أطباق بيتري وطبق على الجليد.
ملاحظة: التعامل مع 4٪ PFA في غطاء محرك السيارة الدخان. - تشريح الأجنة من الفئران الحامل في الجليد الباردPBS مع ملقط ومقص كما سبق وصفه14.
- باختصار، قتل فأر حامل معCO 2، والاستيلاء على الجلد تحت وسط البطن مع ملقط وقطع من خلال الجلد فقط، ثم سحب بلطف على الجلد لفصلها عن جدار العضلات البطن الكامنة.
- بعد ذلك، قطع إلى تجويف البطن بعد نفس الخط من شق الجلد. إزالة الرحم الذي يحتوي على سلسلة من الأجنة وإزالة الأجنة عن طريق قطع بلطف بعيدا جدار الرحم. سيتم إزالة الأنسجة خارج الجنين مثل كيس صفار البيض وamnion.
- قطع وعزل الرأس عن كل جنين.
- نقل كل رأس إلى كل بئر من لوحة 12 جيدا تحتوي على 4٪ PFA مع ماصة نقل البلاستيك أو ملقط. إصلاح العينات في 4٪ PFA في 4 درجة مئوية لمدة 4 ح. شطف العينات في PBS في 4 درجة مئوية مع هز لطيف لمدة 12 ساعة.
ملاحظة: بالنسبة للأجنة التي تقل عن اليوم الجنيني 16.5 (E16.5)، قم بإصلاح رؤوس الأجنة مع 4% من PFA مباشرة بعد العزلة. بالنسبة للأجنة عند E16.5 أو في وقت لاحق، قم بإزالة التخلص من الجلد والأنسجة الدهنية من الرؤوس واشطفها عدة مرات في PBS الباردة الجليدية قبل التثبيت. - رؤساء الحماية بالتبريد.
- نقل كل رأس إلى لوحة جديدة 12 جيدا تحتوي على 2 مل من السكروز 30٪ في PBS باستخدام ماصة نقل البلاستيك أو ملقط. يُحرّك بلطف عند درجة حرارة 4 درجات مئوية حتى يغرق الرأس في الجزء السفلي من الطبق.
- تضمين الرؤوس.
- نقل الرأس المحمي بالتبريد إلى قالب يحتوي على درجة حرارة القطع المثلى (OCT) مركب. عينات متساوية في OCT لعدة دقائق. ضبط موقع واتجاه العينات مع ملقط.
- وضع القالب على الجليد الجاف لتجميد. تخزين القوالب المبردة الناتجة في كيس من البلاستيك عند -80 درجة مئوية حتى تصبح جاهزة للاستئصال بالتبريد.
ملاحظة: الجانب قلص من العينات يجب أن تواجه الجزء السفلي من العفن تضمين.
- إعداد طبق واحد 10 سم والعديد من الأطباق 3.5 سم التي تحتوي على الفوسفات المخزنة المالحة (PBS)، ولوحة ثقافة 12 جيدا تحتوي على 2 مل 4٪ بارافورماليد (PFA) في PBS في كل بئر لكل فأر حامل. ضع جميع أطباق بيتري وطبق على الجليد.
-
إعداد الأنسجة الصلبة غير الصائرة بعد الولادة
- القتل الرحيم في 3 أسابيع أو 3 أشهر الماوس القديم مع CO2. إزالة الجلد والأنسجة الدهنية. قطع وعزل الرأس أو العظام الطويلة من الماوس.
- إصلاح وحماية الرأس أو العظام الطويلة للفئران كما هو موضح في الخطوات 1.1.3-1.1.4.
- تضمين في الجيلاتين 8٪ بطريقة مماثلة للخطوة 1.1.5. الحفاظ على القوالب المبردة في كيس من البلاستيك في -80 درجة مئوية حتى الاستئصال بالتبريد.
ملاحظة: الشارات ليست ضرورية هنا. لإعداد الجيلاتين 8٪ ، مزيج 8 غرام من الجيلاتين مع 100 مل من PBS ويغلي باستخدام الميكروويف. يجب أن تدرك أن الخليط يغلي بسهولة.
2- الاستئصال بالتبريد
- تعيين درجة حرارة cryostat إلى -18 درجة مئوية للأنسجة الرخوة جزءا لا يتجزأ من OCT أو -25 درجة مئوية وأقل للأنسجة الصلبة undecalcified جزءا لا يتجزأ من الجيلاتين. الاحتفاظ عينات في غرفة cryostat لحوالي 30 دقيقة لequilibrate إلى درجة حرارة cryostat.
- طرد كتلة من cryomold. تجميد كتلة على تشاك عينة (حامل الأنسجة) عن طريق تصاعد مع انخفاض OCT. الحفاظ على الجانب قلص من العينة أبعد من تشاك (التي تواجه المشغل).
- قم بتحميل الظرف المثبت على الكتلة على حامل كائن cryostat. اضبط حامل الشفرة لجعل زاوية النصل 3°-5 درجة نسبة إلى العينة.
- جمع 10 أقسام ميكرومتر على الشرائح المجهر المغلفة. مقاطع جافة تماما في RT، ثم تخزينها في -80 درجة مئوية.
3. تلطيخ النسيج والتصوير المجهري
- تلطيخ الفلورة المناعية
- إخراج الشرائح من -80 درجة مئوية. احتفظ بالشرائح في RT لمدة ساعة واحدة إلى مقاطع airdry. شطف الشرائح في 0.1٪ PBST (0.1٪ البولي ايثيلين غليكول الإيثر الثنائي الفينيل ثلاثي ثماني الفينيل في PBS؛ انظر جدولالمواد) ثلاث مرات لمدة 5 دقائق لكل منهما لغسل OCT وأقسام نفاذية.
- بشكل اختياري، تنفيذ استرداد مستضد (اختياري).
- قم بتسخين حاجز سيترات (10 مليون متر من سيترات الصوديوم 6) في طبق تلطيخ مع باخرة أو حمام مائي إلى 95-100 درجة مئوية. تزج الشرائح في المخزن المؤقت سيترات، حضانة لمدة 10 دقيقة.
- خذ طبق تلطيخ من باخرة أو حمام مائي إلى RT. تبريد الشرائح في RT لمدة 20 دقيقة أو أكثر15.
ملاحظة: كبدائل، استخدم العازلة Tris-EDTA (قاعدة Tris 10 mM، 1mM EDTA، 0.05٪ توين 20، درجة الحموضة 9.0) أو EDTA العازلة (1 MEDTA، 0.05٪ توين 20، pH 8.0) لاسترداد مستضد الناجم عن الحرارة. استخدم طنجرة الضغط أو الميكروويف أو حمام الماء لاسترجاع المستضد الناجم عن الحرارة، بالإضافة إلى الباخرة الساخنة. استرداد مستضد الناجم عن الإنزيم باستخدام التربسين أو البيبسين هو بديل آخر. تحسين تركيز ووقت العلاج من الاسترجاع الأنزيمي لتجنب المقاطع الضارة. تحسين طريقة استرداد مستضد لكل تركيبة الأجسام المضادة/المستضد.
- احتضان كل شريحة مع 200 درجة مئوية من محلول حظر (5٪ مصل الحمار المخفف في 0.1٪ PBST) في RT لمدة 30 دقيقة، ثم إزالة محلول حظر دون شطف.
- احتضان كل شريحة مع 100 درجة مئوية من الأجسام المضادة الأولية أو الأجسام المضادة المخففة في حل حظر لمدة 1 ساعة في RT أو O / N في 4 درجة مئوية. شطف الشرائح مع PBS ثلاث مرات لمدة 10 دقائق لكل منهما في RT.
- احتضان كل شريحة مع 100 درجة مئوية من الأجسام المضادة الثانوية المخففة في حل حظر لمدة 1 ساعة في RT. شطف الشرائح في PBS ثلاث مرات لمدة 10 دقيقة لكل منهما في RT. حماية الشرائح من الضوء.
- تحميل الشرائح.
- إضافة قطرتين من وسائل مكافحة تتلاشى مع DAPI (4'، 6-دياميدينو-2-فينيليندول) على الشريحة. ثم تغطية مع غطاء.
- يُحفظ عند درجة حرارة 4 درجات مئوية في الظلام حتى يصبح جاهزًا للصورة.
ملاحظة: كبديل، تسمية النوى مع DAPI أو Hoechst 33324 صبغ المخفف 1:2000 في PBS في RT أولا، ثم جبل مع الجلسرين.
- محطة ديوكسينوكليوتيديديل ترانسفيراز dUTP نهاية وضع العلامات (TUNEL) تلطيخ.
ملاحظة: الحمض النووي المزدوج الذين تقطعت بهم السبل مع 3'-هيدروكسيل تيرميني (3'OH الحمض النووي تيرميني) سوف تشكل خلال المبرمج في الخلية. هنا، ونحن نقدم بروتوكول أن تسمية مجانا 3'OH الحمض النووي تيرميني في الموقع عن طريق وضع العلامات على شظايا الحمض النووي مع ديجوكجينين-نوكليوتيد باستخدام محطة ديوكسينوكليوديديل ترانسفيراز (TdT) عن طريق تلطيخ محددة باستخدام مجموعة تجارية (انظر جدول المواد ).- اختياريا، أقسام وصمة عار مع الأولية واليكسا فلور-488 وصفت الأجسام المضادة الثانوية قبل تلطيخ TUNEL. شطف الشرائح في PBS ثلاث مرات لمدة 10 دقيقة لكل منهما.
ملاحظة: هذه الخطوة اختيارية لتلطيخ مزدوج من البروتين وTUNEL في نفس الشريحة. - احتضان كل شريحة مع 100 ميكرولتر بروتيناز K (10 ميكروغرام / مل في 10 mM تريس درجة الحموضة 7.5 و 5 MM EDTA) لمدة 5 دقائق في RT. شطف الشرائح مع PBS ثلاث مرات لمدة 10 دقائق لكل منهما في RT.
ملاحظة: ضبط وقت الحضانة ودرجة الحرارة من Proteinase K لكل نوع الأنسجة. ل10 أقسام ميكرومتر من رؤوس الأجنة ثابتة في 4٪ PFA، حضانة لمدة 5 دقائق في RT. بالإضافة إلى الطريقة التي تستخدم Proteinase K، استخدم العلاجات البديلة حسب الحاجة، بما في ذلك (1) الإيثيلين غليكول الإيثر الثنائي الفينيل البولي ايثيلين الإيثيلي الأوكتنيل، 0.1٪ سيترات الصوديوم، 10 دقيقة عند 37 درجة مئوية؛ (2) 0.25٪-0.5٪ بيبسين في حمض الهيدروكلوريك (درجة الحموضة 2) أو 0.25٪ التربسين، 10 دقيقة في 37 درجة مئوية؛ و (3) التشعيع الميكروويف مع 0.1 M حاجز سيترات (درجة الحموضة 6). - تطبيق 200 € L من حل حظر (5٪ مصل الحمار المخفف في 0.1٪ PBST) على كل شريحة، حضانة في RT لمدة 30 دقيقة، والاستفادة من حل حظر دون شطف.
- تطبيق 50 μL من المخزن المؤقت التعادل التي توفرها المجموعة على كل شريحة في RT لمدة 10 ثانية على الأقل.
- إعداد خليط التفاعل (قوة العمل TdT إنزيم) عن طريق خلط إنزيم TdT مع العازلة رد الفعل المقدمة من قبل مجموعة بنسبة 3:7. تطبيق 50 درجة مئوية من خليط التفاعل على كل شريحة، وحضانة في 37 درجة مئوية لمدة 1 ساعة.
- تطبيق 200 € L من العازلة وقف (1:30 المخفف في ddH2O) التي قدمتها مجموعة لكل شريحة، ثم احتضان في RT لمدة 10 دقيقة. شطف الشرائح مع PBS ثلاث مرات لمدة 10 دقيقة لكل منهما.
- تسمية مع الجسم المضاد رودامين.
- تطبيق 50 درجة مئوية من قبل الاحماء (RT) المضادة للdigoxigenin conjugate (rhodamine) (1:1 المخففة في حل حظر) على كل شريحة. حضانة في RT لمدة 30 دقيقة في الظلام.
- شطف الشرائح مع PBS ثلاث مرات لمدة 10 دقيقة لكل منهما. تحميل الشرائح كخطوة 3.1.6.
- اختياريا، أقسام وصمة عار مع الأولية واليكسا فلور-488 وصفت الأجسام المضادة الثانوية قبل تلطيخ TUNEL. شطف الشرائح في PBS ثلاث مرات لمدة 10 دقيقة لكل منهما.
4. اقتناء الصور
- استخدام عناصر التحكم الإيجابية (الأنسجة الإيجابية للمستضد الهدف) للتحقق من وضع العلامات على الإشارة والضوابط السلبية (حذف الأجسام المضادة الأساسية أو التحكم في نوع isotype أو الأنسجة سلبية للمستضد الهدف) لتقييم خلفية الصور تحت الفلورسنت المجهر.
- تعيين المعدات وظروف الكاميرا (التعرض والإعدادات العامة الأخرى) للتصوير استناداً إلى شدة إشارة الضوابط السلبية والإيجابية.
ملاحظة: تختلف هذه الحالات حسب (1) الكاميرات والمجاهر المستخدمة في التصوير، (2) الأجسام المضادة، و (3) الأنسجة لكل تجربة. الظروف الشائعة المستخدمة في أنسجة الوجه القحفي هي ISO 200 مع وقت التعرض تتراوح بين 1/100 ق إلى 1 ق تعتمد على نوعية وخصوصية الأجسام المضادة. وتختلف التكبيرات المناسبة تبعاً لحجم العينات والغرض من التجارب. - الحصول على الصور مع المجهر اللاإثراء التقليدية أو المجهر البؤري. الحصول على الصور (بما في ذلك تلك الضوابط المقابلة) في نفس الشروط لكل قناة ملونة. حفظ الصور بنفس التنسيق (tiff هو الأفضل للحفاظ على المعلومات).
5- القياس الكمي للفلورة
ملاحظة: ومن الناحية الإحصائية، فإن المقارنة الإحصائية بين التلطيخ بين المجموعات المختلفة ستكون أكثر إفادة في كثير من الحالات. مع الصور المناعية، قم بقياس المستوى النسبي للبروتين عن طريق قياس كثافة الإشارة، أو عد الخلايا الإيجابية، أو حساب المناطق الإيجابية. وبالنسبة للتحليل الإحصائي، فإن الحد الأدنى لعدد العينات المستقلة بيولوجيا هو 3. طريقة نموذجية هي إنشاء ثلاثة مقاطع على الأقل من كل عينة وأخذ الصور لثلاثة مناطق تمثيلية على الأقل في كل مقطع.
-
التحديد الكمي لشدة الفلورة باستخدام ImageJ
- افتح البرنامج، واستخدم تحليل > تعيين القياسات للتحقق من تحديد المنطقة والكثافة المتكاملة فقط. استخدم ملف > فتح لفتح الصور لتحليلها.
- استخدم شريط الأدوات لتحديد رمز المربع أو الدائرة في أقصى اليسار. حدد المنطقة المراد تحليلها على الصورة باستخدام أداة التحديد. استخدم تحليل > قياس للحصول على قراءة المنطقة المحددة والكثافة المتكاملة في نافذة النتائج. حدد منطقة بجوار خلية موجبة ليس لديها الفلورة لقراءة الخلفية.
- كرر الخطوة 5.1.2 لتحليل الصور الأخرى. ضبط المنطقة ليتم تحليلها لتتناسب مع تلك الصورة الأولى.
- نسخ كافة البيانات في إطار النتائج ولصقفي جدول بيانات عند الانتهاء من تحليل.
- حساب كثافة الفلورة المصوبة (CTCF) ككثافة متكاملة — (مساحة الخلية المحددة x متوسط الفلورة من قراءات الخلفية). قارن الفرق بين الفلورة الخلية الإجمالية المصححة بين العينات وجعل الرسم البياني.
-
تحديد كمية عدد الخلايا الموجبة من الصور الفلورية باستخدام ImageJ
- عد الخلايا اليدوي.
- استخدام ImageJ > الإضافات > تحليل لتثبيت البرنامج المساعد عداد الخلية.
- استخدم ملف > فتح لفتح الصور لتحليلها. استخدم الإضافات > التحليل > عداد الخلية لفتح نافذة العداد ونافذة النتائج.
ملاحظة: لا يعمل عداد الخلية على مكدسات. لحساب الأكوام، البرنامج المساعد مؤامرة Z محورالشخصي، ثم استخدام صورة > مكدسات > مؤامرة Z محور الشخصي لمراقبة كثافة عائد الاستثمار تتحرك باستخدام أداة تتبع الجسيمات. يمكن أن تكون هذه الأداة إما يدوية أو تلقائية. - النقر فوق أحد الأزرار في أسفل إطار العداد لبدء العد. انقر مباشرة على خلية / كائن ليتم العد حتى الانتهاء.
- انقر فوق الزر نتائج في الإطار "عدد". سيتم عرض العدد الإجمالي للخلايا التي تم حسابها في إطار النتائج. حفظ سجل النتائج كجدول بيانات وتحليل.
- عد الخلايا الآلي.
- استخدم ملف > فتح لفتح الصور لتحليلها. حوّل صورة RGB إلى صورة ذات مقياس رمادي قبل المتابعة.
- استخدم الصورة > ضبط > عتبة لتحديد كافة المناطق التي تحتاج إلى حساب.
- استخدام تحليل > تحليل الجسيمات للحصول على عدد من الخلايا / الجسيمات. تعيين نطاق من حجم الجسيمات صالحة (على سبيل المثال، 100-إنفينيتي) بدلاً من الافتراضي 0-إنفينيتي لحساب الخلايا / الجسيمات ضمن نطاق معين. حفظ سجل النتائج كجدول بيانات وتحليل.
ملاحظة: للحصول على معلومات أخرى من الصورة، إلى جانب المنطقة، انتقل إلى تحليل > تعيين القياسات وحدد المربع بجوار المعلومات المطلوبة.
- عد الخلايا اليدوي.
النتائج
أقسام الأنسجة القحفية الجنينية
بعد الخطوات المذكورة أعلاه، تم تشريح الرؤوس من السيطرة(P0-Cre)أو متحولة (تنشيط بشكل تأسيسي Bmpr1a في خلايا القمم العصبية، P0-Cre؛ caBmpr1a)الأجنة في اليوم الجنيني (E) 16.5 أو 18.5. بعد تحديد في 4٪ PFA لمدة 4 ساعة، تم تضمين العينات في OCT وcryosectioned coronally. وكانت المقاطع الناتجة ملطخة بالأجسام المضادة ضد pSmad1/5/9 (عوامل الإشارة إلى المصب BMP) أو Ki67 (علامة انتشار الخلايا) دون استرجاع مستضد وفقا للبروتوكول. كما هو مبين، pSmad1/5/9 (الشكل1A)وKi67 (الشكل1C)كانت إيجابية في العظام الأمامية للأجنة السيطرة. في الأجنة المتحولة، تم زيادة مستويات pSmad1/5/9 (الشكل 1B)،في حين تم تخفيض تلك من Ki67 (الشكل1D)في العظام الأمامية. كما تم فحص موت الخلايا فى تلك العينات وفقا للبروتوكول . كما هو مبين، لوحظت خلايا أبوبوتيكية في العظام الأمامية للأجنة المتحولة من تلك التي للأجنة السيطرة (الشكل1E،F).
أنسجة الجمجمة أو أقسام العظام الطويلة غير الصائرة
بعد الخطوات المذكورة أعلاه للأنسجة الصلبة غير الشارات، تم إصلاح رؤساء من الفئران القديمة 3 أسابيع(P0-Cre؛ mTmG (غشاء الطماطم وغشاء GFP)) مع 4٪ PFA وجزءا لا يتجزأ من الجيلاتين 8٪. تم غسل المقاطع الباردة الإكليلية مع PBST وشنت مع المتوسطة المضادة للتلاشي مع DAPI. الشكل 2 ألف ، B تثبت أن الجيلاتين لا تتداخل مع إشارات الفلورسنت من الأنسجة المقطعة.
تم استخدام رؤساء وفيمورا من 3 أسابيع أو 3 أشهر من الفئران للتحقق من ما إذا كان الجيلاتين جزءا لا يتجزأ من الأنسجة غير الشارات جيدة لIF. تمت معالجة جميع الرؤوس وfemora وتقسيمها وفقا للبروتوكول. وقد استخدمت أقسام الناتجلل لSOX9مناعة (الشكل 3) أو OSX و E11 / Podoplanin تلطيخ المناعة المزدوجة (الشكل4). كما هو مبين، تم الحصول على أقسام ذات نوعية جيدة من معظم الأنسجة الصلبة 3 أسابيع، بما في ذلك المقصورات trabecular والقشرية من عظم الفخذ (الشكل3A،B، الشكل 4A-D)،والعظام الأمامية (الشكل4E، F)،القواطع (الشكل3E،F، الشكل 4I،J)، أنسجة الأنف (الشكل3C،D)، والجمجمة بما في ذلك خياطة الأنف premaxilla والعظام المحيطة بها (الشكل4G،H ) من الرأس. في حين، مع عينات عمرها 3 أشهر، تم الحصول على أقسام ذات نوعية جيدة فقط في بعض الأنسجة الصلبة، بما في ذلك المقصورات trabecular من عظم الفخذ (الشكل3G،H، الشكل 4K،L)،أنسجة الأنف (الشكل3I ،J) ، والجمجمة بما في ذلك خياطة الأنف premaxilla والعظام المحيطة بها (الشكل4M،N) من الرأس. كما هو مبين في الشكل 3، تم الكشف عن الخلايا الإيجابية SOX9 على وجه التحديد في chondrocytes من لوحة النمو (الشكل3B)والمفصل (الشكل3H)من عظم الفخذ ، والحاجز الأنفي (الشكل3D،J). في القواطع 3 أسابيع من العمر، تم الكشف عن SOX9 في الخلايا mesenchymal (الشكل3F). وأظهرت نتائج OSX وE11 تلطيخ مزدوجة أن تم الكشف عن OSX في osteoblasts، في حين تم الكشف عن E11 في osteocytes من العظام من عظم الفخذ والرأس (الشكل4B،D، H، L،N). في ال [3] أسبوع قاطع, كان [أسإكس] إيجابيّة في [أودونتوبلاستس], بينما [إ11] كان إيجابيّة في صيلات [ميسّينكمل] خلايا (شكل4[ج]). وتشير هذه النتائج إلى أن الأنسجة الصلبة غير الشارات جزءا لا يتجزأ من وظائف المستضد الجيلاتين جيدا الحفاظ عليها.
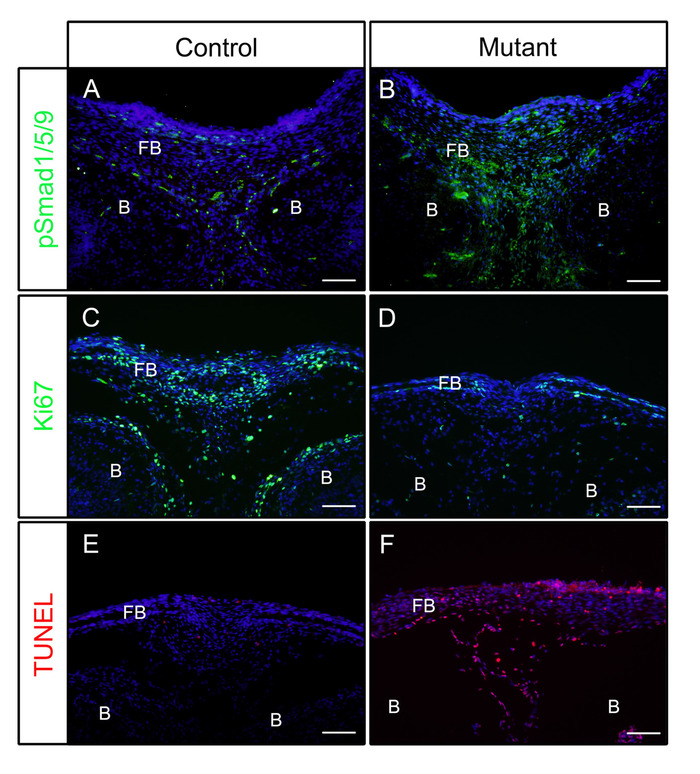
الشكل 1: أمثلة على نتائج pSmad1/5/9 أو Ki67 أو TUNEL في الأجنة المسيطرة والأجنة المتحولة مع تعزيز نشاط BMP. تم عبور الفئران التي تم تنشيطها بشكل تأسيسي Bmpr1a (caBmpr1a)مع الفئران P0-Cre لزيادة نشاط إشارة BMP في خلايا القمم العصبية (NCCs). رؤساء السيطرة(P0-Cre; caBmpr1a+/+) ومتحولة (P0-Cre; caBmpr1afx/+) تم تشريح الأجنة في E16.5 أو E18.5، ثابتة مع 4٪ PFA لمدة 4H، بالتبريد مع السكروز 30٪ لمدة يوم واحد، جزءا لا يتجزأ من OCT، واستئصالها بالتبريد عند -18 درجة مئوية. تم استخدام أجزاء من العظام الأمامية (مستوى مماثل مع العين) للكشف المناعي ضد pSmad1/5/9، Ki67، أو تلطيخ TUNEL. (أ،ب) pSmad1/5/9 (الأخضر) أنماط تلطيخ في العظام الأمامية للسيطرة (أ) أو متحولة (ب) الأجنة في E16.5. (جيم،دال) Ki67 (الأخضر) أنماط تلطيخ في العظام الأمامية للسيطرة (C) أو متحولة (D ) الأجنة في E18.5. (E,F) TUNEL (الأحمر) أنماط تلطيخ في العظامالأمامية للسيطرة (E) أو متحولة (F) الأجنة في E18.5. كانت النوى ملطخة DAPI (الأزرق). FB = العظام الأمامية، B = الدماغ. قضبان مقياس = 100 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
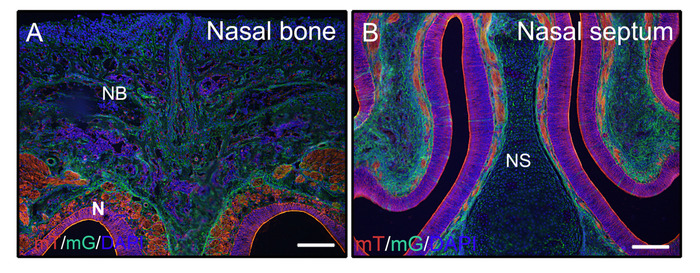
الشكل 2: أمثلة على نتائج إشارة مراسل mTmG للأنسجة غير الصائرة في الرأس. تم تشريح رؤساء من 3 أسابيع الفئران P0-Cre القديمة مع غشاء الطماطم وغشاء GFP(mTmG)مراسل، ثابتة مع 4٪ PFA ل4H، بالتبريد مع السكروز 30٪ لمدة 2 أيام، جزءا لا يتجزأ من الجيلاتين 8٪، واستئصالبالتبريد في -25 درجة مئوية. تظهر أقسام الرأس بوضوح GFP (الأخضر، Cre إعادة تركيب إيجابية) والطماطم (الأحمر، Cre إعادة تركيب السلبية) إشارة في العظام الأنفية والأنسجة الأنفية(A، B). كانت النوى ملطخة DAPI (الأزرق). NB = عظم الأنف، N = أنسجة الأنف، NS = الحاجز الأنفي. قضبان مقياس = 250 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
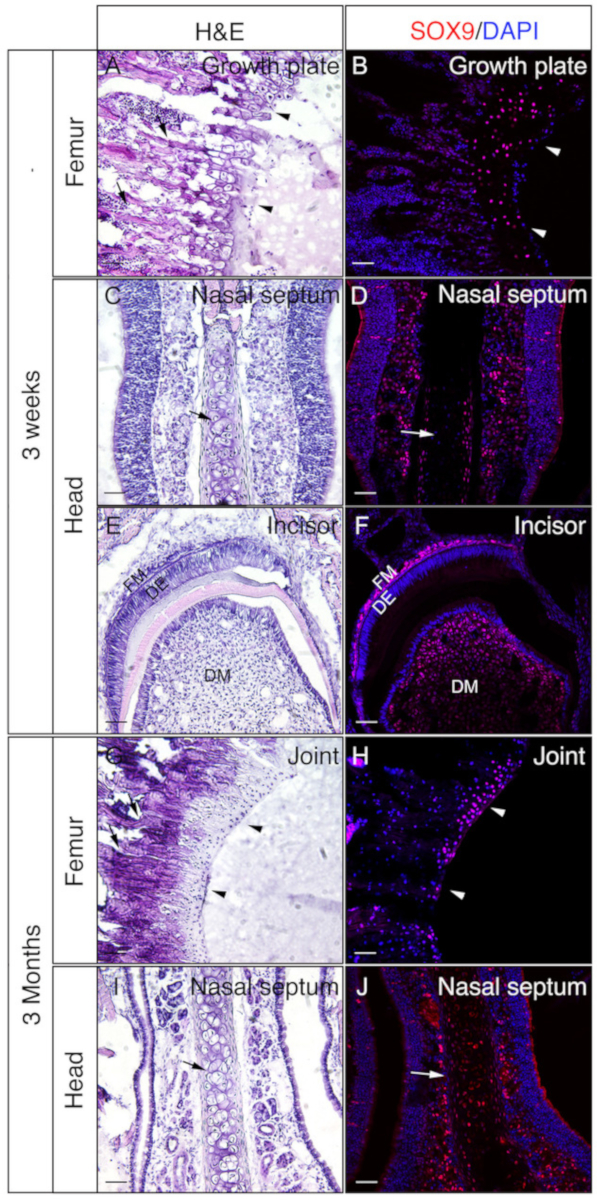
الشكل 3: أمثلة على نتائج تلطيخ المناعة SOX9 من الأنسجة غير الصائق في الرأس وفيمورا. تم تشريح رؤساء وفيمورا من 3 أسابيع أو 3 أشهر الفئران القديمة، ثابتة مع 4٪ PFA ل4H، بالتبريد محمية مع 30٪ السكروز لمدة 2 أيام، جزءا لا يتجزأ من الجيلاتين 8٪، واستئصالها بالتبريد في -25 درجة مئوية. تم استخدام الشرائح للكشف المناعي ضد SOX9 (الأحمر). كانت ملطخة النوى مع DAPI (الأزرق)(B، D، F، H،J). واستخدمت المقاطع المجاورة من تلك الأنسجة لهيماتوكسيلين ويوسين (H & E) تلطيخ(A، C، E، G،I). رؤوس الأسهم في A و B تشير إلى لوحة النمو وفي G و H، غضروف مفصلي. السهام في A و G تشير إلى العظام trabecular وفي C، D، I، و J،الحاجز الأنفي. DM = mesenchyme الأسنان، DE = ظهارة الأسنان، FM = mesenchyme بصيلات. قضبان مقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
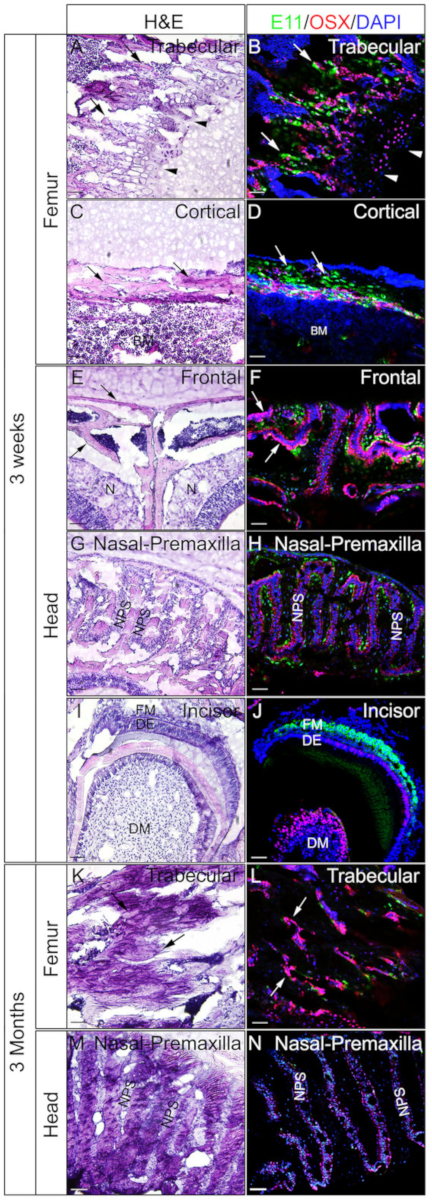
الشكل 4: أمثلة على نتائج التلطيخ المناعي المزدوج لـ OSX وE11 للأنسجة غير الصائرة في الرأس والفيمورا. تم تشريح رؤساء وفيمورا من 3 الفئران منذ أسبوع أو 3 أشهر، ثابتة مع 4٪ PFA لمدة 4H، محمية بالتبريد مع 30٪ السكروز لمدة 2 أيام، جزءا لا يتجزأ من الجيلاتين 8٪، واستئصالها بالتبريد في -25 درجة مئوية. تم استخدام أقسام لتلطيخ المناعة المزدوجمع الأجسام المضادة ضد OSX (الأحمر) و E11/Podoplanin (الأخضر). كانت ملطخة النوى مع DAPI (الأزرق)(B، D، F، H، J، L،N). واستخدمت المقاطع المجاورة من تلك الأنسجة لتلطيخ H & E(A، C، E، G، I، K،M). الأسهم في A، B، K، و L تشير إلى مقصورات trabecular من عظم الفخذ. C و D، مقصورات القشرية من عظم الفخذ. وفي E و F، والعظام الأمامية. رؤوس الأسهم في A و B تشير إلى لوحة النمو. BM = نخاع العظام، N = أنسجة الأنف، DM = mesenchyme الأسنان، DE = ظهارة الأسنان، FM = مسينشيم الجريب، NPS = خياطة بريماسيلا الأنف. كما تظهر العظام الأمامية(E,F) وخياطة الأنف premaxilla والعظام المحيطة بها (G,H, M,N). قضبان مقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا نقدم بروتوكول مفصل لإعداد رأس الماوس وأنسجة العظام غير الصائق، واستئصال التبريد لتلطيخ المناعة من انتشار الخلايا، وموت الخلايا، وعلامات إشارات BMP. كما نقوم بتفصيل استراتيجية الحصول على البيانات الكمية من الصور المناعية الفلورية. ويمكن أيضا أن تنطبق هذه الأساليب على الأنسجة الأخرى مع التعديلات المناسبة.
تختلف ظروف إعداد الأنسجة حسب حجم ونوع الأنسجة. عادة ما يحتاج وقت التثبيت والحماية بالتبريد إلى عدة ساعات إلى ليلة وضحاها. بعد التثبيت، يمكن أيضا أن تكون جزءا لا يتجزأ من الأنسجة في البارافين ومقطعة مع ميكروتومي16. على الرغم من أن كلا من البارافين وOCT تعمل بشكل جيد لتلطيخ المناعة، وهناك بعض الاختلافات بينهما. يمكن الاحتفاظ كتل البارافين لعدة سنوات في RT، في حين أن كتل OCT لمدة 1 سنة في -80 درجة مئوية. البارافين يحافظ على مورفولوجيا الأنسجة، في حين أن الكريستال الجليد شكلت خلال تضمين OCT قد تؤثر سلبا على هياكل الأنسجة. البارافين يخفي في بعض الأحيان epitopes من المستضدات، في حين يحافظ OCT على أنشطة الإنزيم والepitopes المستضد. لذلك، ليست هناك حاجة لاسترداد مستضد لمعظم الأجسام المضادة إذا ثابتة في 4٪ PFA لمدة 4 ساعة فقط أو أقل وجزءا لا يتجزأ من OCT. ومع ذلك، لا يزال من الممكن الحصول على نتائج أفضل عن طريق استرجاع المستضد، إذا لم تظهر الضوابط الإيجابية نتائج تلطيخ جيدة في عمليات التبريد.
ويمكن استخدام كل من صبغ ة هويشت وDAPI لمكافحة تلطيخ النووية. لديهم أوجه التشابه، كما كلاهما (1) هي الأشعة فوق البنفسجية متحمس، والمواد الكيميائية طفيفة الأخدود ملزمة لتنبعث إشارات تتناسب مع محتوى الحمض النووي الكلي، و (2) تتعرض لتبييض الصور بعد التعرض لفترة طويلة. ومع ذلك، عادة ما تستخدم الأصباغ Hoechst لتلطيخ محتوى الحمض النووي في الخلايا الحية بسبب نفاذيتها العالية. يستخدم DAPI عادة لتلطيخ الحمض النووي في الخلايا الثابتة بسبب نفاذية الغشاء منخفضة. وبالإضافة إلى ذلك، DAPI يولد إشارة أقوى وأكثر استقرارا من Hoechst.
الضوابط المناسبة ضرورية لIF. وينبغي تأكيد خصوصية كل جسم مضاد جديد من خلال تحليل وصمة عار الغربية، إذا كان ذلك ممكنا. وينبغي تحديد التركيز الأمثل للعمل لجسم مضاد أولي معين من خلال استخدام التخفيفات التسلسلية. يجب تضمين عنصر تحكم إيجابي (الأنسجة أو الخلية التي ثبت أنها تعبر عن البروتين / مستضد) للتحقق من عملية IF وخصوصية الأجسام المضادة. وينبغي أيضا إدراج رقابة سلبية، على سبيل المثال، عدم وجود الأجسام المضادة الأولية، أو استبدال IgG العادي من نفس الأنواع للجسم المضاد الأولي، أو الأنسجة السلبية للمستضد المستهدف. عند التقاط الصور، يجب فحص العينة بدون الأجسام المضادة الثانوية (التحكم في الخلفية) بشكل مستقل مع كل قناة لتحديد حدود كسب الإشارة وإزاحة ليتم تكييفها للتصوير النهائي. وللكشف عن تسميات متعددة، يلزم إعداد التحكم في الخلفية والضوابط ذات العلامات الفردية لتجنب التراكب الطيفي. يجب أن تخضع جميع القنوات التي سيتم استخدامها للحصول على صورة عينة متعددة العلامات لتصحيح خلفية مستقلة، لأن مستوى الفلورة الذاتية في كل قناة يختلف اختلافاكبيرا.
كما نقدم بروتوكول لإعداد واستئصال التبريد من الأنسجة الصلبة غير الصائق جزءا لا يتجزأ من الجيلاتين. بالنسبة للأنسجة الصلبة المدمجة في OCT، سيتم فصل معظم أقسام الأنسجة الصلبة من نظارات الشرائح أثناء إجراءات التلطيخ المناعي، بسبب طابع التصاق منخفض على الشريحة. الشريط اللاصق المصمملتسهيل الاستئصال بالتبريد يساعد على توليد أقسام ذات نوعية جيدة. ولكن، يتم تلف هذه المقاطع بسهولة عندما يتم تقشير الشريط. للأنسجة الجيلاتين جزءا لا يتجزأ، ليست هناك حاجة لنظام نقل الشريط لتوليد أقسام ذات نوعية جيدة. كوسيلة تضمين، الجيلاتين يمكن التسلل إلى العينة بشكل جيد، على الرغم من أن لديها أقل اللزوجة مقارنة مع OCT. وقد استخدمت الجيلاتين في التطبيقات النسيجية الأخرى، مثل أنسجة الدماغ17،18 وأقسام رقيقة جدا من الخلايا للكيمياء المناعية19. هنا، تم استخدام الجيلاتين لتضمين العظام undecalcified، الذي يولد كتل أسهل للاستئصال بالتبريد من OCT. هناك العديد من النصائح الصغيرة للحصول على أقسام جيدة من الجيلاتين جزءا لا يتجزأ من الأنسجة الصلبة undecalcified. الخطوة الحاسمة هي تضمين مع الجيلاتين بدلا من OCT. للحصول على اختراق أفضل، والحفاظ على عينات في 30٪ السكروز يوم واحد أكثر بعد العينات تغرق في القاع. من المهم بنفس القدر تعيين درجة الحرارة أقل من المعتاد في حوالي -25 درجة مئوية. شفرة فائقة الحدة ليست ضرورية. على الرغم من أن انخفاض درجة حرارة التبريد (-25 درجة مئوية) يجعل بعض التحسينات للاستئصال بالتبريد من OCT جزءا لا يتجزأ من الأنسجة الصلبة غير الشارات، فإنه لا يزال من الصعب الحصول على سلامة جيدة من هياكل الأنسجة. كما هو مبين في الشكل 2، الشكل 3، والشكل 4، تم الحصول على أقسام ذات نوعية جيدة تنطبق على تلطيخ المناعة من الجيلاتين الأنسجة الصلبة جزءا لا يتجزأ (على سبيل المثال ، العظام trabecular ، والعظام القشرية ، وعظام الجمجمة ، والأنسجة الأنفية ، والقواطع). أثبتت تلك النتائج أن تضمين الجيلاتين يحسن بشكل كبير سلامة العينة من أقسام الأنسجة الصلبة، ولكن أيضا يعزز الالتصاق من الأقسام إلى النظارات الشريحة. وبالإضافة إلى ذلك، الجيلاتين يحافظ على وظائف مستضد، ويعرض التوافق مع إشارات الفلورسنت وتلطيخ المناعة. ومع ذلك، فإن هذه التقنية تعمل بشكل جيد فقط لمدة تصل إلى 3 عينات من العمر. التحسينات المحتملة لهذه الطريقة هي (1) لتشريح العينات كذلك لفصل الأنسجة المستهدفة من أجزاء أخرى لجعل هيكل الأنسجة بسيطة (في حالة الأسنان، يجب تشريح الفك السفلي أو الفك العلوي وإصلاحه بدلا من الرأس كله) و(2) لاستخدام 10٪ EDTA لالأنسجة الشارات لمدة 2-3 أيام فقط قبل الحماية بالتبريد. هذا الوقت القصير من الشارات لن يعرض للخطر نتائج تلطيخ المناعة. وثمة شاغل آخر هو أنه، كوسائط تضمين غير مائية، لا يمكن إزالة الجيلاتين بسهولة من الشرائح، مما قد يؤدي إلى خلفية أعلى اعتمادا على أساليب تلطيخ (على سبيل المثال، H & E تلطيخ).
نتائج تلطيخ المناعة ليست سهلة لتحديد كمي، لذلك عادة ما تستخدم شبه كمية. وتشمل الصعوبات والقيود في التحديد الكمي للتلطيخ المناعي للأنسجة القحفية الوجهية على سبيل المثال لا الحصر ما يلي: (1) من الصعب تحديد المنطقة التي يتعين حسابها بسبب تعقيد هيكل أنسجة الوجه القحفي؛ (2) من الصعب تحديد المنطقة التي يتعين حسابها بسبب تعقيد هيكل الأنسجة القحفية والوجهية؛ (2) من الصعب تحديد المنطقة التي يتعين حسابها بسبب تعقيد هيكل الأنسجة القحفية الوجهية؛ (3) من الصعب تحديد المنطقة التي يتعين حسابها بسبب تعقيد هيكل الأنسجة القحفية للوجه؛ (3) من الصعب تحديد المنطقة التي يتعين حسابها بسبب تعقيد هيكل الأنسجة القحفية والوجهية. (2) من الصعب تحديد المنطقة المسماة أو الخلايا المسماة بسبب الطبيعة غير الخطية للتلطيخ المناعي؛ (3) هناك معلومات محدودة عن النطاق الديناميكي للإشارة؛ (4) من الصعب مقارنة شدة الإشارات بين الصور أو المجموعات بسبب تلاشي إشارة الفلورسنت أثناء الحصول على الصور؛ و(5) قد تتغير خلفية الإشارة بشكل كبير بين الأجسام المضادة والشرائح والعينات. ولزيادة موثوقية نتائج القياس الكمي، ينبغي إجراء التجربة بعناية ودقة. وينبغي معالجة جميع العينات في نفس الظروف. أثناء التلطيخ المناعي، هناك حاجة إلى ضوابط مختلفة لتقييم خلفية الإشارة وتحديد المنطقة الإيجابية أو الخلايا للإشارة. التقاط صور مقنعة وتمثيلية لإظهار بوضوح المنطقة التي سيتم عدها ووصفت الخلايا مع تباين جيد. بالإضافة إلى ذلك، أثناء الحصول على الصور، يجب الحفاظ على إعداد الكاميرا وإعداد المعدات متناسقين.
إذا أخذنا معا، نقدم بروتوكول اوجه موحد للمناعة على أنسجة الوجه القحفي ة الماوس، وخاصة بالنسبة للأنسجة الصلبة غير الصائق. تحليل التلطيخ المناعي للأنسجة القحفية الوجهية لن يساعد فقط على فهم آلية تكوين مورفوجينيس أثناء التنمية، ولكن أيضا توضيح التغيرات أثناء الإمراض. وبالإضافة إلى ذلك، يمكن أيضا استخدام تلطيخ المناعة لدراسة نمط التعبير من الأربطة مسار إشارة أخرى، والمستقبلات، أو غيرها من علامات phenotypic، إلى جانب انتشار الخلايا، وموت الخلية، ومسار إشارة BMP. ومع ذلك، يجب تعديل الخطوات الحرجة لتجربة تلطيخ المناعة بشكل مناسب لكل مستضد / الأجسام المضادة أو الأنسجة للحصول على تلطيخ محددة وتقليل إشارات الخلفية غير المحددة.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (R01DE020843 إلى Y.M.)، والرابطة الدولية للموارد المالية، ومنحة في المعونة من المؤسسة الوطنية للعلوم الطبيعية في الصين (31500788 إلى J.Y.).
Materials
| Name | Company | Catalog Number | Comments |
| Adhesive tape | Leica | #39475214 | |
| Alexa fluor 488-goat anti-Rabbit secondary antibody | Invitrogen | A-11034 | |
| Antifade Mountant with DAPI | Invitrogen | P36931 | |
| Bovine serum albumin | Sigma | A2153 | |
| Coverslips | Fisher Brand | 12-545-E | |
| Cryostat | Leica | CM1850 | |
| EDTA | Sigma | E6758 | |
| Fluorescence microscope | Olympus | BX51 | |
| Gelatin | Sigma | G1890 | |
| In Situ Cell Death Detection Kit | Millipore | S7165 | |
| Microscope slides | Fisher Brand | 12-550-15 | |
| OCT Compound | Fisher Healthcare | 23-730-571 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Phosphate buffered saline (PBS) | Sigma | P4417 | |
| Polyethylene glycol tert-octylphenyl ether | Sigma | T9284 | Triton X-100 |
| Proteinase K | Invitrogen | AM2542 | |
| Rabbit anti-Ki67 antibody | Cell Signaling Technology | 9129 | Lot#:3; RRID:AB_2687446 |
| Rabbit anti-pSmad1/5/9 antibody | Cell Signaling Technology | 13820 | Lot#:3; RRID:AB_2493181 |
| Sodium citrate | Sigma | 1613859 | |
| Sucrose | Sigma | S9378 | |
| Tris | Sigma | 10708976001 |
References
- Trinh, L. e. A., Fraser, S. E. Imaging the cell and molecular dynamics of craniofacial development: challenges and new opportunities in imaging developmental tissue patterning. Current Topics in Developmental Biology. 115, 599-629 (2015).
- Marcucio, R., et al. Facial morphogenesis: physical and molecular interactions between the brain and the face. Current Topics in Developmental Biology. 115, 299-320 (2015).
- Graf, D., et al. Common mechanisms in development and disease: BMP signaling in craniofacial development. Cytokine & Growth Factor Reviews. 27, 129-139 (2016).
- Snider, T. N., Mishina, Y. Cranial neural crest cell contribution to craniofacial formation, pathology, and future directions in tissue engineering. Birth Defects Research Part C: Embryo Today. 102 (3), 324-332 (2014).
- Mishina, Y., Snider, T. N. Neural crest cell signaling pathways critical to cranial bone development and pathology. Experimental Cell Research. 325 (2), 138-147 (2014).
- Van Hecke, D. Routine Immunohistochemical Staining Today: Choices to Make, Challenges to Take. Journal of Histotechnology. 1, 45-54 (2002).
- Xiao, C., Dan-Bi, C. Double staining immunohistochemistry. North American Journal of Medical Sciences. 2 (5), 241-245 (2010).
- Zongli, Q., et al. Comparison of immunofluorescence and immunohistochemical staining with anti-insulin antibodies on formalin-fixed paraffin-embedded human pancreatic tissue microarray sections. International Journal of Clinical and Experimental Pathology. 10 (3), 3671-3676 (2017).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. Journal of Visualized Experiments. (107), e53561 (2016).
- Dun, X. P., Parkinson, D. B. Whole mount immunostaining on mouse sciatic nerves to visualize events of peripheral nerve regeneration. Methods in Molecular Biology. 1739, 339-348 (2018).
- Akkiraju, H., et al. An Improved Immunostaining and Imaging Methodology to Determine Cell and Protein Distributions within the Bone Environment. Journal of Histochemistry & Cytochemistry. 64 (3), 168-178 (2016).
- González-Chávez, S. A., et al. Assessment of different decalcifying protocols on Osteopontin and Osteocalcin immunostaining in whole bone specimens of arthritis rat model by confocal immunofluorescence. International Journal of Clinical and Experimental Pathology. 6 (10), 1972-1983 (2013).
- Kapelsohn, K. Improved Methods for Cutting, Mounting, and Staining Tissue for Neural Histology. Protocol Exchange. , (2015).
- Kalaskar, V. K., Lauderdale, J. D. Mouse embryonic development in a serum-free whole embryo culture system. Journal of Visualized Experiments. (85), e50803 (2014).
- Shi, S. R., et al. Antigen retrieval techniques: current perspectives. Journal of Histochemistry & Cytochemistry. 49 (8), 931-937 (2001).
- Adell, T., et al. Immunohistochemistry on paraffin-embedded planarian tissue sections. Methods in Molecular Biology. 1774, 367-378 (2018).
- Griffioen, H. A., et al. Gelatin embedding to preserve lesion-damaged hypothalami and intracerebroventricular grafts for vibratome slicing and immunocytochemistry. Journal of Neuroscience Methods. 43, 43-47 (1992).
- Sarkar, S., et al. In situ demonstration of Fluoro-Turquoise conjugated gelatin for visualizing brain vasculature and endothelial cells and their characterization in normal and kainic acid exposed animals. Journal of Neuroscience Methods. 219 (2), 276-284 (2013).
- Oorschot, V., et al. A novel flat‐embedding method to prepare ultrathin cryosections from cultured cells in their in situ orientation. Journal of Histochemistry & Cytochemistry. 50, 1067-1080 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved