血液回収 II
概要
ソース: ケイ ・ スチュワート、RLATG、RVT CMAR;ヴァレリー A. シュレーダー、RVT、RLATG。ノートルダムのノートルダム大学
マウスおよびラットの解析から血のコレクションは、さまざまな方法を通じて行うことができます。コレクションの各メソッドには、プロシージャの侵襲性と全身麻酔の必要性、必要な拘束の種類のバリエーションがあります。1歴史的に、レトロな軌道洞キャビティ内の使用が使用されています、論争がないわけで。潜在的な組織損傷に関連する論争またはレトロ軌道出血によって引き起こされる、さらには失明がマウスを出血顔面と顎下の静脈の開発につながっています。マウスとラットの両方で大伏在静脈からの採血は、開発されている別の手法です。これらの手順では、麻酔を必要としないし、したがって、適切な麻酔薬の使用を混同するかもしれない血の結果またはその他のデータ。
原則
頬、眼の神経叢から実行されるマウスで顔面静脈と下顎に沿って実行される顎静脈があります。両方の船は、頸静脈が簡単にアクセスできるように、あごのラインのすぐ下に収束します。シリアル サンプルは、利用する側を交互にどちらかの船から撮影することができます。ただし、どちらの側 5-7 日間よりより頻繁に使用される必要があります。2
注意事項は、顔面静脈出血を実行しながら撮影する必要があります。ランセット先端が尾の方に指示された場合、外耳道は顔面静脈の近くにある、運河がピアスでしょう。これは耳から血を引き起こしているサイフォン効果になります。それにもかかわらず、血液を集めることができるとマウスは永続的な害を被るれません。しかし、これが原因その揺れに動物頭、檻の中の血が飛び散る。
顎下の静脈からの出血、針の挿入深さが重要です。4 5.5 mm を超える挿入深さは筋肉, 神経, と頭、首、口腔内にある他の船舶が外傷であります。後の合併症減少、口の中で流体による溺死に終って過度の出血を含めるし、食べたり飲んだりを妨げる口腔の構造にダメージを与えます。
動物の拘束は顔面静脈と顎静脈のプロシージャの両方の成功した裁ち落としのため重要です。首筋のグリップがあまりにもタイトの場合顔面の静脈への血流を制限できます。これは、収集量の削減になります。コレクション ボリュームは顔面静脈と顎静脈出血の両方によって異なります。制度政策に従って生存血のコレクションの最大音量と承認された動物プロトコルを超えないようにコレクション ボリュームを制限することが不可欠です。希望の金額を収集後止血を確認追加または余分な血損失を防止します。2
大伏在静脈からの採血は、シリアル裁ち落としを設定別の実行可能な代替です。外側伏在静脈は背部に, 実行する表面的な容器と足根骨の関節の間で横方向に。3この手順は、必要な準備のためレトロ軌道出血よりより審美的に受け入れられる可能性がありますが-このメソッドの麻酔の使用されない場合が実際に動物に多くのストレスと。伏在ブリードから生じる可能性のある合併症は、穿刺部位に関連しています。針穿刺は容器に直接は、血腫、皮下、血がプールします。あざができ、感染の可能性と四肢の優遇は、他の可能な問題です。このメソッドに、トレーニングが必要ですが、簡単に把握します。このメソッドで収集されたボリュームは 10-150 μ L、サンプリングの周波数に応じての間です。4サンプルは、組織の製品を含めることが品質の変数です。以上 4 つの血液サンプルは、同じ脚から 24 時間以内撮影必要があります。
大腿静脈は、ラットの血のコレクションの別のオプションです。大腿静脈は脚の付け根から膝を渡ると横方向の伏在、アクセスが容易になる前に膝関節に後ろ足の内側側面に実行します。この手順は、麻酔薬を使用せず行うことができます、それが 1 つ 2 つの人々 を必要と人が脚や腹部の静脈穿刺を行い他血を収集しながら、静脈を閉塞し接続ポイントで、脚を開催。
大腿静脈を使用する利点より大きなボリュームがそれから、伏在静脈よりもからより簡単に収集されることです。ただし、大腿静脈が大きいので、血腫形成しやすいです。これは、追加あざの原因となる足の余りにもしっかりグリップによって悪化することができます。この血の収集方法、抜針後の出血のための血液量の変化があります。この余分な血損失を防ぐために止血を確認することが不可欠です。
手順
1. 顔面静脈出血マウス
- 機器
- 血のコレクションは、血液チューブやエッペン チューブに無料キャッチからです。場合によっては、血液をヘマトクリット管に直接収集することをお勧めします。
- アキノキリンソウ ランセットは、年齢や性別によると動物の適切なサイズに基づいて選択されます。
- ランセットはマウスの年齢やサイズによると、次のとおり選択されます。
4 mm ランセット: 3-4 週齢マウス (15 グラム未満の体重)
5 mm ランセット: 雌マウス下 10 週間 (〜 20 グラム未満の体重)
5 mm ランセット: 雄マウス未満 6 週間 (〜 20 グラム未満の体重)
5 mm ランセット: (血液塗抹) の一滴のサンプル
5.5 mm ランセット: 雌マウス 10 週間以上 (〜 20 グラム以上本体重量)
5.5 mm ランセット: 雄マウスで 6 週間 (〜 20 グラム以上本体重量)
5.5 mm ランセット: 大規模なサンプル
- ランセットはマウスの年齢やサイズによると、次のとおり選択されます。
- 拘束
- マウスがスクラッフィング テクニックを使用して拘束されます。
- ヘッドのサイド ・ ツー ・ サイド動きを最小化することが重要です。これにより 『 ランセット 』 での正確かつ安全な穿刺です。
- 血液回収
- 適切なサイズのランセットは、皮膚の表面に垂直が開催されます。
- ランセット ポイント少し鼻の方を向いて先端角度です。
- ランセット刃が垂直に適しています。
- マウスを抑制しながら尾の方に眼の下の目の長さと目の幅を測定することによって顔面静脈のおおよその領域を探します。
- 『 ランセット 』 のポイントは、顎骨を終了するポイントに優しく感じる。
- 容器に穴をあけるの精度を上げるため横方向の臥床でマウスします。
- その時点では、ランセットの肩に皮膚を貫通します。これは、事務所のプッシュでダーツを投げではなく行われます。
- 『 ランセット 』 の除去は、時に血が流れ始めます。
- 血流を支援するために中心部より低い頭でマウスを置きます。
- 目的のコレクションの容器に血液を収集します。
- 止血の首筋の穿刺サイト、リリース圧力をしみ。
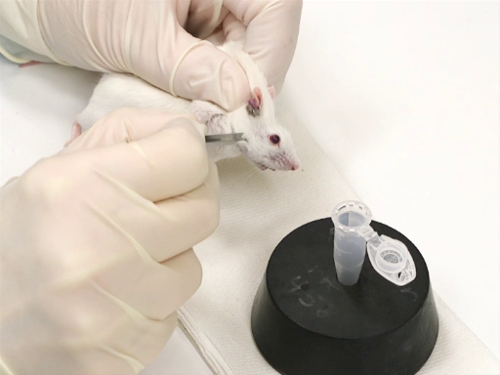
図 1。マウスで顔面静脈出血。
2 マウスの顎下出血: 機器の変化と出血ここでは微妙な違いがありますが顔面静脈出血の手法に非常に似ていますが。
- 機器
- 血のコレクションは、血液チューブやエッペン チューブに無料キャッチからです。いくつかのケースでは、ヘマトクリット管に直接収集することをお勧めします。
- 18-22 ゲージ針は、年齢や性別によると動物の適切なサイズに基づいて選択されます。
- 針がマウスの年齢やサイズによると、次のとおり選択されます。
22 ゲージ: 3-4 週齢マウス (15 グラム未満の体重)
20 ゲージ: 雌マウス下 10 週間 (〜 20 グラム未満の体重)
20 ゲージ: 雄マウス未満 6 週間 (〜 20 グラム未満の体重)
20 ゲージ: (血液塗抹) の一滴のサンプル
18 ゲージ: 雌マウス 10 週間以上 (〜 20 グラム以上本体重量)
18 ゲージ: 雄マウスで 6 週間 (〜 20 グラム以上本体重量)
18 ゲージ: 大規模なサンプル
- 針がマウスの年齢やサイズによると、次のとおり選択されます。
- 拘束
- マウスがスクラッフィング テクニックを使用して拘束されます。
- ヘッドのサイド ・ ツー ・ サイド動きを最小化することが重要です。これは針で正確かつ安全な穿刺を保証します。
- 血液回収
- 針は、皮膚の表面に垂直が開催されます。
- マウスを抑制しながら口のコーナーからのラインが目の眼からのラインと交差するポイントで顎下の静脈のおおよその領域を探します。これは、あごのラインで若干上下口の隅に尾を発見、毛のない小型ディンプルと一致します。
- 容器に穴をあけるの精度を上げるため横方向の臥床でマウスします。
- この時点で針の先端で皮膚に穴を開けます。これは、事務所のプッシュでダーツを投げではなく行われます。
- 針は、傾斜面の先端を越えて挿入されていません。
- 針の除去、時に血が流れ始めます。
- 血流を支援するために中心部より低い頭でマウスを置きます。
- 目的のコレクションの容器に血液を収集します。
- 穿刺部位のしみし、止血の首筋の圧力を解放します。

図 2。マウスの顎下腺静脈出血。
3. 大伏在ブリード
- 機器
- 透明なプラスチックで柔軟な拘束の円錐形は、マウスまたはラットに使用できます。マウスの変更 50 ミリリットル プラスチック円錐管は拘束に使用できます。ラット、プレキシ グラス拘束チューブを変更-スロットを持つワイド後肢足ことを拡張するための十分な使用します。
- プラスチック製のコーンを活用し、それは、動物の体の長さに対して、測定し、太もものレベルで楕円形の穴をカットします。
- 円錐管は、呼吸穴を許可するように管の端を切り落とすことによりこの血の収集方法のマウスで変更できます。スロットは、1/2 インチ幅の 2 インチ長いチューブのキャップの端からカットされます。エッジは布テープで覆われているか、動物の安全のため平滑化します。
- 止血帯は、3 cc の注射器と 2-0 裁断縫合の長さを使用して製造されています。3
- トリプル抗生物質軟膏や白色ワセリンは、皮膚上の防湿バリアとして使用されます。
- 22 g 針、静脈穿刺のため最寄りのサイズです。
- 血液をヘマトクリット管に直接収集します。
- 拘束
- 柔軟なプラスチック コーン
- マウスまたはラットが鼻最初円錐形に配置されます。
- 円錐形の端は折り返されているし、動物が拘束コーンを終了しないようにする小型バインダー クリップを使用して閉じる。
- 後ろ足は優しく鼠径部に楕円形を引っ張られる。
- マウス用コニカル チューブ
- マウスは、チューブの鼻最初に配置されます。
- 後脚は、スロットに優しく導かれます。
- 中指は、マウスがチューブを終了するを防ぐために管の端に配置されます。
- 人差し指と親指は、マウスの脚を安定させます。
- ラット用のプレキシ グラス拘束チューブ
- ラットは、チューブの鼻最初に配置されます。
- 後脚は、スロットに優しく導かれます。
- チューブの端は、バックアップおよびチューブの復帰からネズミを防ぐために保護されます。
- 人差し指と親指は、ラットの足を安定させます。
- 柔軟なプラスチック コーン
- 血液回収
- 髪の毛は、抑圧に飛節から足の外側面から削除されます。これは、摘採、シェービングや脱毛クリームを使用して行うことができます。
- 髪を削除すると、少量の軟膏が適用され、無毛エリアに非常に薄い層に 。
- ターニケットが可能と強化まで頭側として適用されます。
- 足首に膝から足の外側の表面を渡って実行する伏在容器を埋めるために開始され、調達と視覚化を容易になります。
- 針は、血管の上に直接皮膚の表面に垂直が開催されます。血管を穿刺します。筋肉を穿刺または骨を打撃を避けるために、足に針を深く挿入しないように注意します。
- 血液のヘマトクリット管を持つコレクションの脚の表面にビーズを。
- 血液が集められると、止血帯を緩め、止血、穿刺の圧迫します。
- 出血が止まり、一度、動物を拘束から外し、このホームのケージに戻る。
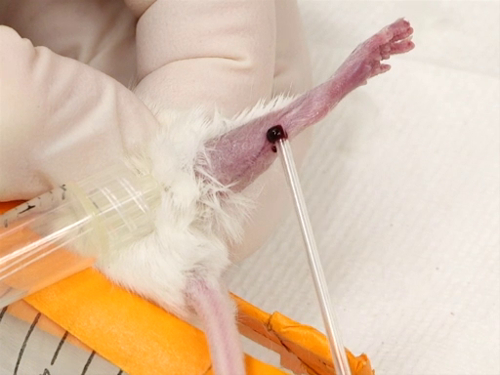
図 3。マウスの伏在静脈出血。
4 ラット用大腿静脈
- 機器
- 血液をヘマトクリット管に採血します。
- トリプル抗生物質軟膏は、皮膚/髪と血しぶき間の障壁を作成する必要です。
- 22 ゲージ針を使用して、静脈を穿刺します。
- 約 1"幅の刃では小さい、携帯用のバリカンを使用して、足から毛をクリップします。
- 拘束
- ラットは、明確な柔軟な塑性拘束のコーンを使用して拘束されます。
- プラスチック製のコーンは、ボディーの長さ、太もものレベルでカット楕円形の穴に対して測定されます。コーンは、後ろ足は静脈へのアクセスと体外できますようにカットされています。
- 血液回収
- 膝から脚の付け根から足の内側面から髪の毛は剃毛します。
- トリプル抗生物質軟膏は、穿刺部位に薄い層に適用されます。
- 拘束者は静脈が見えなくなり、瀉血専門医が直面している脚の内部の表面でラットを保持します。
- 静脈を穿刺するのに針を使用します。針が血管に垂直を開催され、穿刺、静脈に直接行われます。
- 穿刺は、できるだけ、最初の血液のコレクション サイトの前方追加サンプリングを可能にする膝の近くに作られています。
- 船は表面的です。したがって、穿刺の深さは、針の傾斜面の長さよりも深くはなりません。
- 血流を支援するためにラット心臓より下の脚の位置します。
- それは皮膚の表面にビーズ ヘマトクリット管に血液を収集します。
- 足の圧力を解放し、止血して穿刺部位に圧力を適用します。
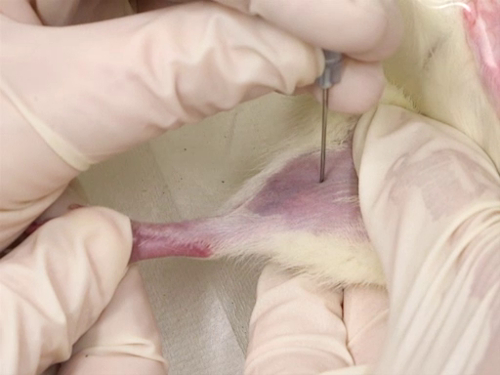
図 4。ラット大腿静脈出血。
申請書と概要
血のコレクションのメソッドは、サンプルの分析で変化を引き起こすことが。サンプルの収集を実行する技術者のスキルレベルは、サンプルの品質と動物の福祉に影響を及ぼします。麻酔薬の使用には、サンプルの質も影響します。ここで説明する方法はすべて麻酔を使用せず実行されます、したがってその変数が消去されています。また、これらすべての技法は動物に最小限の不快感でシリアルをサンプリングするために使用できます。
参考文献
- Fernandez, I., Arantza, P., Del Teso, N., Perez, V. and Rodriguez-Cuesta, J. 2010. Clinical biochemistry parameters in C57BL/6J mice after blood collection from the submandibular vein and retroorbital plexus. Journal of American Association of Laboratory Animal Science. 49:2. 202-210.
- Joslin, O.T. 2009. Blood collection techniques in exotic small animals. Journal of Exotic Pet Medicine. 18:2. 117-139.
- Hem, A., Smith, A.J. and Solberg, P. 1998. Saphenous vein puncture for blood sampling of the mouse, rat, hamster, gerbil, guinea pig, ferret and mink. Laboratory Animals. 32. 364-368.
- Diehl, K-H., Hull, R., Morton, D., Pfister, R. Rabemampianina, Y., Smith, D., Vidal, J-M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
血液回収 II
Lab Animal Research
72.7K 閲覧数

齧歯動物の処理と抑制技術
Lab Animal Research
173.2K 閲覧数

基本的なケア手順
Lab Animal Research
27.6K 閲覧数

繁殖と離乳の基本
Lab Animal Research
35.5K 閲覧数

齧歯動物識別私
Lab Animal Research
54.4K 閲覧数

齧歯動物識別 II
Lab Animal Research
25.5K 閲覧数

化合物の管理私
Lab Animal Research
99.9K 閲覧数

複合管理 II
Lab Animal Research
34.6K 閲覧数

複合行政 III
Lab Animal Research
31.2K 閲覧数

化合物の管理 IV
Lab Animal Research
51.2K 閲覧数

撤退の血私
Lab Animal Research
170.7K 閲覧数

麻酔導入とメンテナンス
Lab Animal Research
50.0K 閲覧数

齧歯動物の外科に関する考慮事項
Lab Animal Research
22.3K 閲覧数

剖検診断と組織の収穫
Lab Animal Research
57.8K 閲覧数

滅菌のティッシュの収穫
Lab Animal Research
34.7K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved