Method Article
視床下部-下垂体-精巣軸 を介した ラットの乏疹精子症の治療におけるShu-Mu脳-腎臓ツボのメカニズム
要約
この研究は、ラットの乏疹精子症に対するShu-Mu脳腎臓ツボの治療効果を検証し、視床下部-下垂体-精巣(HPT)軸を通じてその根底にあるメカニズムを探ることを目的としています。
要約
乏疹精子症は、男性不妊の一般的な原因です。視床下部-下垂体-精巣(HPT)軸は、生殖ホルモンの合成と放出を通じて性腺の分化と成熟を調節し、男性の生殖能力に重要な役割を果たします。HPT軸の安定性が乱れると、精子の産生が損なわれ、精液の質が低下します。HPT軸調節に対する電気鍼治療の影響を調査することで、乏疹精子症の治療に関する洞察が得られる可能性があります。50匹の8週齢の雄SDラットを、ブランク群、モデル群、Shu-Mu脳腎臓群、非ツボ群、およびL-カルニチン群に無作為に分けた(n = 10/群)。ブランクグループを除いて、ラットはモデルを確立するために28日間胃内にアデニンを投与されました。モデリング後、Shu-Mu Brain-Kidney グループは指定されたツボで電気鍼治療を受け、非ツボグループは毎日 30 分間偽治療を受けました。L-カルニチン群は、L-カルニチン(10mL/kg)を1日1回胃内に投与されました。治療は28日間続けられました。一般的な状態、臓器係数、および精液の質を評価しました。HE染色は組織形態を分析し、ELISAは血清ホルモンの変化を検出しました。モデル群と比較して、Shu-Mu、脳-腎臓、L-カルニチン群は、体重の増加に伴い、精神、食事、排便に有意な改善を示したが、非ツボ群は有意な変化を示さなかった。腎臓器係数は、Shu-Mu、脳-腎臓、L-カルニチン群で有意に減少しましたが、非ツボ群では変化しませんでした。.精巣臓器係数は、治療群間で有意差を示さなかった。精子の数、密度、生存率、および運動性は、Shu-Mu Brain-Kidney グループと L-カルニチングループで有意に改善しましたが、非ツボグループでは改善しませんでした。H&E染色では、Shu-Mu Brain-Kidney グループと L-カルニチングループで腎臓および精巣組織の損傷が改善したことが示されました。ELISAは、これらのグループでT、GnRH、およびINHBの増加とLH、FSH、E2、およびPRLレベルの減少を明らかにしました(p < 0.001)、非ツボグループでは有意な変化はありませんでした。これらの知見は、Shu-Mu Brain-Kidney ツボ療法が HPT 軸を調節することにより精子の質を改善し、精子減少症の潜在的な治療法を提供することを示しています。
概要
「精子減少症」と「精子減少症」に分けられる精子減少症は、男性不妊症の一般的なタイプの1つであり、男性不妊症の発症率は男性不妊症の約75%を占めています1。乏疹精子症は、主に精巣の精子密度と運動性の減少を特徴とし、主に精子形成障害、精子数の減少、精子の運動性の低下として臨床的に現れます2,3。近年、乏児精子症の発生率は年々増加しています4.効果的な治療をしなければ、患者の心身の健康、さらには家族の調和にさえ長期的な悪影響を及ぼすでしょう5。遺伝的問題6、生殖内分泌障害7、泌尿生殖器感染症8、化学薬品9は、精子の生産と成熟に影響を及ぼし、精液の質を低下させることが研究で示されています。現在、損傷した精子の質を向上させることは、医療現場での課題となっています。
視床下部-下垂体-精巣(HPT)軸は、体内の生殖調節の主要な経路であり、視床下部、下垂体、および精巣に関連する生殖ホルモンの合成と放出を刺激することにより生殖腺の分化と成熟を調節でき、正常な男性の生殖機能を維持する上で重要な役割を果たします10。.HPT軸機能の安定性が損なわれると、精巣分泌がテストステロンの生理学的濃度に達するのに十分になり、精巣内の精子の数と質が低下する11。したがって、乏血球精子症の治療は、主にHPT軸の機能を調節し、関連する内分泌ホルモンのバランスを維持する目的を達成することを目的としており、それによって精液中の精子の数を増やし、精子の活動を強化し、精液の質を改善します。
乏疹精子症の臨床治療では、現代医学は主に手術や抗酸化薬などの方法を採用し、精子の運動性を高めます12,13、一方、電気鍼治療は伝統的な中国の鍼治療と現代の医療生体電気を組み合わせたものです。それは、迅速かつ正確であること、明らかな治療効果を有すること、副作用がほとんどないこと、適切な疾患の広い範囲、および低い治療費を有すること、および乏血饚精子症14,15に対する良好な治療効果を有するという利点を有する。「背中は陽、腹部は陰です。」Shu-Muツボの組み合わせは、シュウポイントとムーポイントを組み合わせ、フロントとバックに1つずつ、陰と陽を1つずつ組み合わせ、一緒に働く、フロントバックツボの組み合わせ方法としても知られています。伝統的な中国医学(TCM)は、腎臓が出生前の本質の根源であり、病気は腎臓にあると信じています。腎臓のフロントムーポイントであるJingmen(GB25)とBack-shuポイントであるShenshu(BL23)が選択され、腎臓を温め、陽を助け、陰16,17内で陽を求める効果があります。腎臓はエッセンスを貯蔵し、骨髄の生産を支配し、脳は骨髄の海であり、すべての陽の出会いの場であり、Taixi(KI3)は足のShaoyin腎臓経絡の源点であり、肝臓と腎臓を調節および緊張させ、陰に栄養を与え、骨髄を生成することができます18。Epangsanxian(MS4)と組み合わせることで、TCM19の「Shu-Mu脳-腎臓ツボの組み合わせ」のアイデアを反映して、腎臓と脳をつなぎ、治療効果は通常の鍼治療よりも明白です。
精液の質に関する現在の治療研究は、主に精巣の構造と機能の改善に焦点を当てていますが、視床下部-下垂体-精巣(HPT)軸20のさまざまな組織にわたる血清ホルモンレベルの調節に関する研究は限られています。予備研究では、RNAシーケンシング(RNA-Seq)を使用して、健康なラットとアデニン誘発性乏精子症モデルラットの視床下部、下垂体、および精巣組織内の精液質調節に関与する候補遺伝子と調節経路を特定しました21。さらに、精液質検査と精巣組織の組織学的分析が両方のグループで行われました。これらの知見は、アデニン誘発性乏醒菌ラットの精液質の根底にある分子メカニズムに関する洞察をもたらしました。遠方近似ツボを用いた電気鍼治療は、HPT軸を調節することにより、乏靭精子症ラットの精子の質を改善する可能性があり、その効果は酸化ストレスのプロセスに関連しています22。しかし、Shu-Mu Brain-Kidney ツボがHPT軸を調節することにより、ラットの精液の質を改善できるかどうかは不明です。この研究では、乏血麩子症ラットの精液質を改善する調節メカニズムと効果的な治療法をさらに調査するために、アデニン誘発ラットモデルである乏血症のアデニン誘発ラットモデルを使用し、Epangsanxian、Shenshu、Jingmen、Taixiの4つのツボを選択して、ラットのオリゴアステノスペルミアに対するShu-Mu Brain-Kidney Pickpointの治療効果の関連メカニズムをHPT軸の観点から調査しました。 臨床治療のためのより科学的な基盤を提供します。
プロトコル
すべての動物実験は、寧夏医科大学の動物倫理委員会(承認番号:IACUC-NYLAC-2021-130)によって審査され、承認されました。この研究は、動物実験に関するARRIVEガイドライン2.0に厳密に従って実施され、NIHの実験動物のケアと使用に関するガイドに記載されている動物福祉の原則を遵守しました。このランダム化比較動物試験は、一元配置分散分析を採用し、2023年3月から5月にかけて寧夏医科大学の動物実験センターで実施されました。この研究では、体重180〜220gの8週齢のSPFグレードの雄SDラットを使用しました。使用した試薬や機器の詳細は 、資料表に記載されています。
1. 動物モデルの構築と治療手順
- 実験動物・団体
- 体重180〜220gの8週齢のSPFグレードの雄SDラットを50匹入手します。
- すべてのラットを標準的な条件下で飼育し、室温を22〜25°C、湿度を50%〜60%に保ち、標準的なげっ歯類の飼料と水に無料でアクセスできるようにします。
- 適応の1週間後、乱数表法を使用して、ラットを空白(B )グループ(n = 10)とモデリンググループ(n = 40)にランダムに分けます。経口強制経口投与により、ブランク群に生理食塩水を投与し、モデリング群にアデニンを投与します。
- 28日後、モデリンググループをモデル(M)グループ、Shu-Mu脳腎臓(S)グループ、非ツボ(N)グループ、およびL-カルニチン(L)グループ(n = 1グループあたり10)にランダムに分けます。モデル・グループは未処理のままにします。
- Shu-Mu Brain-Kidney ツボマッチング法を使用して電気鍼治療介入を Shu-Mu Brain-Kidney グループに適用します。非ツボ群には非ツボ治療を、L-カルニチン群には強制経口投与します。すべてのグループを28日間連続して治療します。
- モデル構築
注:研究によると、高用量のアデニンはラットの精巣機能に影響を及ぼし、性ホルモンの異常な分泌、HPT軸の機能安定性の乱れ、および精子の質の低下につながることが示されています23。したがって、アデニンは一般的に雄動物の不妊モデルを確立するために使用されます。- 正常生理食塩水(1 mL / 100 g体重)をブランクグループに投与し、アデニン(20 mg / 100 g体重)をモデルグループに経口強制経口投与します(図1A)。.
- アデニンの沈殿と強制針の閉塞を防ぐために、強制経口投与中の連続的な攪拌を確保してください。治療は28日間毎日1回行われます。
- 1.3 治療手順
- Shu-Mu Brain-Kidney グループ
- モデリング後の最初の日から介入を開始します。両側のポイントに使い捨ての滅菌鍼を使用して鍼治療を行います。ラットを固定した後、鍼治療部位を露出させて消毒します。
- 左手で経穴部位の皮膚を固定し、右手の使い捨て滅菌鍼で経穴をすばやく突き刺します。電気刺激装置を接続します。電気鍼治療の周波数2Hz、刺激強度1.5mA、局所筋肉のわずかな振戦で拡張波を適用します。
- 電気鍼治療を1日1回、30分間、連続して28日間行います(図1B)。
注:Yong Tangの Experimental Acupuncture and Moxibustion Science、付録II、「実験動物で一般的に使用される経穴」を参照し、比較解剖学的ポイント選択法19と組み合わせて、ラットの経穴を選択します。次のポイントが選択されました:(1)Epangsanxian(MS4):Touweiポイントの下3mmと4mm外側にあります。操作:まっすぐに1-2 mmを刺します。(2)神舟(BL23):脊椎領域、第2腰椎の下部棘突起の両側、正中背線の6mm横にあります。操作:6mmストレートに刺します。(3)Jingmen(GB25):サイドウエスト、下側の13番目のリブの自由端にあります。操作:まっすぐに1-2 mmを刺します。(4)Taixi(KI3):足の内側、内側足首の高い点とアキレス腱の後縁の間のくぼみにあります。操作:3mmストレートに刺します。
- 非ツボグループ
- 経穴1、2、および3は、Shu-Mu Brain-Kidney グループと同じ方法で選択して操作します (図 1B)。
注:非ツボは経絡に沿ったポイント選択の原則に従っていないため、および伝統的な中国医学(TCM)理論と長期臨床観察によれば、これら3つのツボは精子減少症の患者にほとんど治療効果がありません24。(1)非ツボ1:肘の肘の先端と脇の下を結ぶ線の中間点、肘の内側に位置するもの。操作:まっすぐに1-2 mmを刺します。(2)非ツボ2:上腕骨の内側上顆と尺骨の手首の中点、尺骨縁にあります。操作:まっすぐに1-2 mmを刺します。(3)非ツボ3:内側の腕の三角筋前筋と上腕二頭筋の交点に位置する。操作:1〜2mmまっすぐ刺します。
- 経穴1、2、および3は、Shu-Mu Brain-Kidney グループと同じ方法で選択して操作します (図 1B)。
- L-カルニチン基
- レボカルニチン経口液を経口強制経口投与し、1日1回、1日1回、28日間連続して投与します(図1A)。.
- Shu-Mu Brain-Kidney グループ
- 安楽死
- 治療後、すべてのラットを24時間絶食させ、2%ペントバルビタールナトリウム(40mg / kg体重、施設的に承認されたプロトコルに従う)の腹腔内注射によって麻酔をかけ、使い捨ての静脈内採血針21,24を使用して心臓の頂点から血液を採取します。
- 斬首による死後、精巣上体の片側を切除して精液の質を測定します。腎臓組織と精巣組織を採取し、秤量して記録し、パラホルムアルデヒド固定液に室温で48時間固定してから、パラフィン24に埋め込みます。
2. 観測指標
- 一般的な観察:ラットの精神状態、食事、排便を観察し、毎日体重を監視します。
- 臓器係数:死後、腎臓組織と精巣組織の両方から表面脂肪と結合組織を慎重に取り除き、生理食塩水ですすぎ、濾紙で乾燥させ、天秤にかけ、臓器係数の計算のための測定値を記録します。臓器係数(%)=(臓器重量[g]/体重[g])×100%。
- 精液の品質
- 余分な脂肪を取り除いた後、各ラットの精巣上体の片側を取り出して、37°Cの恒温水浴に5分間置きます。次に、サンプルを切断し、ろ過し、穏やかに吹き付け、よく混合します。
- 希釈した精子懸濁液の10μLアリコートを取り、予熱した計数プレートのカバーガラスの端に落とすと、精子懸濁液が自動的に計数チャンバーに浸透します。
- CASA(コンピュータ支援精液分析)システム21を使用して、精子数、密度、生存率、および運動性率を測定する。
- ヘマトキシリンおよびエオシン(H&E)染色
注:手順の詳細については、Yang, N. et al.21を参照してください。- 固定したティッシュを流水ですすぎ、脱水して埋め込みます。
- パラフィン切片(厚さ5 μm)をミクロトームで切片し、65°Cで4時間焼きます。
- 切片を脱ろうし、水で再水和します。
- 切片をヘマトキシリン染色溶液で3分間染色し、流水ですすいでください。
- 切片を95%エタノールで1分間脱水し、次にエオシン溶液で2分間染色します。
- スライドをシールした後、スライドスキャナーでスキャンを行い、画像を収集して解析します。
- 酵素結合免疫吸着アッセイ(ELISA)
注:手順の詳細については、Yang, N. et al.21を参照してください。- 血清を調製するには、標準物質ウェルおよび測定サンプルウェルに標準物質および対応する濃度の血清を添加し、続いて酵素標識試薬を添加します。
- インキュベーション、洗浄、発色、および終了のステップを実行します。
- 酵素標識装置を使用して450nmの波長での吸光度を決定し、テストステロン(T)、ゴナドトロピン放出ホルモン(GnRH)、インヒビンB(INHB)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、エストラジオール(E2)、およびプロラクチン(PRL)の発現レベルを計算します。
3. 統計分析
- 統計ソフトウェアを使用して実験データを分析し、各グループの結果を平均±標準偏差(平均±SD)として提示します。
- 一元配置分散分析を使用して、正規性と分散の等質性の仮定を満たす複数のグループ間でサンプル平均を比較します。
- t検定は2つのグループ間の比較に使用し、ノンパラメトリック検定は上記の仮定を満たさないデータに使用します。
- pが0.05の場合<統計的に有意な差を考慮します。
結果
モデル評価
モデリング後、ラットを観察して、無気力、しゃがんだ姿勢、手足の冷え、食べるのをためらう、体重減少、尿量の増加、軟便、および腎臓陽欠損の症候群と一般的に一致するその他の症状について観察します。
解剖後、腎臓が硬く、白く、重いことを確認します。H&E染色により、モデルラットの腎臓組織と精巣組織は深刻な損傷を受けており、不規則な糸球体形状、腎尿細管間質性炎症、多数の上皮細胞が変性、さらには線維化を受けていることが明らかになりました。精巣内の精細管はより萎縮して変形し、精子形成細胞が無秩序または存在しないことさえあり(図2)、モデル確立が成功したことを示しています。
ラットの一般的な状態
空白のグループでは、ラットは元気で、敏感な反応、光沢のある髪、および正常な食事と排便を示しました。解剖後、腎臓は赤褐色で柔らかく見えました。モデル群では、ラットは無気力、背中のしゃがみ、体の冷え、食欲不振、体重減少(p < 0.001)、排尿の増加、および軟便を示しました。解剖後、腎臓は頑丈で、「大きな白い腎臓」の外観が観察されました(図2A)。モデル群と比較して、上記の症状はShu-Mu Brain-Kidinグループで有意に改善し、非ツボグループでは有意に改善せず、L-カルニチングループでも有意に改善しました。グループ間の体重の比較を 図3に示します。
腎臓および精巣臓器の係数
図4に示すように、ブランク群と比較して、モデル群のラットの腎臓器係数は有意に増加(p < 0.01)し、両側精巣臓器係数(p > 0.05)には有意差は認められず、モデリング後に両精巣の質が低下したことが示されました。モデル群と比較して、Shu-Mu Brain-Kidin群とL-カルニチン群の腎臓器係数は有意に減少しました(p < 0.05)が、非ツボ群では有意差は認められませんでした(p > 0.05)。モデル群と比較して、Shu-Mu脳腎臓群、L-カルニチン群、非ツボ群の両側精巣臓器係数に有意差は認められず(p > 0.05)、Shu-Mu脳腎臓群とL-カルニチン群で両側精巣腫瘤が増加したのに対し、非ツボ群では有意な変化は認められなかった。
精液質分析
図5に示すように、ブランク群と比較して、モデル群では精子数、密度、生存率、運動率が有意に減少しました(p<0.001)。モデル群と比較して、Shu-Mu脳-腎臓群とL-カルニチン群では精子数、精子密度、生存率、運動率が有意に増加した(p < 0.001)が、非ツボ群では有意差は認められなかった。
腎臓の形態学的変化
図6に示すように、ブランク群のラットの腎臓組織は完全な構造と正常な形状をしていました。糸球体は丸くていっぱいで、腎嚢にしっかりと結合しており、腎尿細管は規則正しく整然と配置されていました。ブランク群と比較して、モデル群は重篤な腎組織損傷、不規則な糸球体形態、萎縮、縮小、重度の尿細管間質性炎症、多数の上皮細胞の変性、および重度の線維症を示しました。モデル群と比較して、Shu-Mu Brain-Kidney および L-カルニチン群では、腎臓組織の損傷の程度が有意に改善され、より規則的な糸球体の形状、腎嚢からのわずかな分離、いくつかの尿細管上皮細胞の変性、軽度の腎尿細管間質細胞浸潤と線維化が見られました。モデル群と比較して、腎組織の損傷の程度は、非ツボ群ではあまり明白ではなく、より規則的な糸球体の形状、腎嚢からの分離、腎尿細管上皮細胞の変性と障害の増加、糸球体周辺と腎尿細管間質への中等度の炎症性細胞浸潤、および線維化が多かった。
精巣の形態学的変化
図7に示すように、ブランク群のラットの精巣は、完全な組織構造、正常な形態、きちんとした精細管、および規則的な精子形成細胞を持っていました。ブランク群と比較して、モデル群では精巣組織の損傷が深刻で、精細管の萎縮と変形が進み、精子形成細胞が無秩序または存在しないことさえありました。モデル群と比較して、精巣組織の損傷の程度はShu-Mu Brain-KidinグループとL-カルニチングループで有意に改善し、ほとんどの精細管はきれいに配置され、精子形成細胞は規則的に配置されました。モデル群と比較して、精巣組織の損傷の程度は非ツボ群で有意に減少せず、一部の精細管は萎縮と変形、細胞壊死、液胞、および無秩序で存在しない精子形成細胞を示しました。
血清ホルモンレベルの比較
図8に示すように、ブランク群と比較して、血清中のテストステロン(T)、ゴナドトロピン放出ホルモン(GnRH)、およびインヒビンB(INHB)のレベルはモデル群で減少しました(p < 0.001)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、エストラジオール(E2)、およびプロラクチン(PRL)は増加しました(p < 0.001)。モデル群と比較して、Shu-Mu脳-腎臓群とL-カルニチン群でT、GnRH、INHBが増加し(p < 0.001)、LH、FSH、E2、PRLのレベルが減少(p < 0.001)したが、非経穴群では有意差は認められなかった。
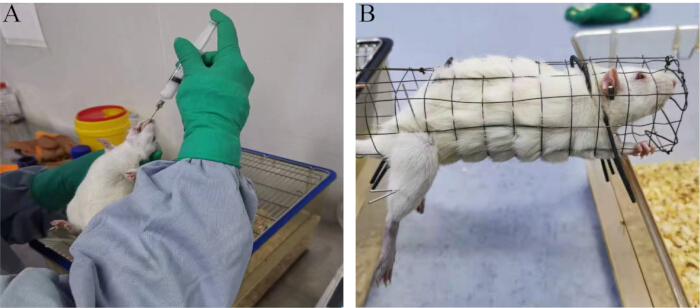
図1:実験方法(A)経口強制経口投与。(B)電気鍼治療を含む治療法。この図の拡大版を表示するには、ここをクリックしてください。
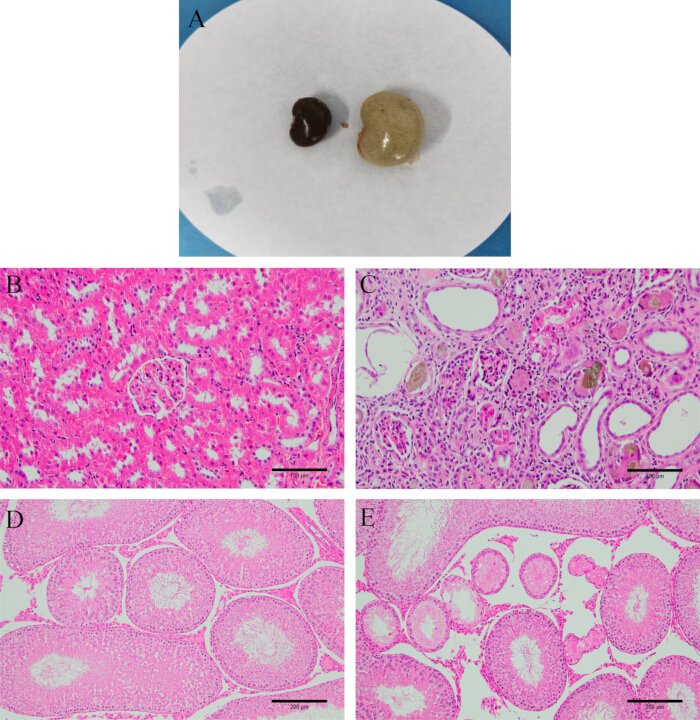
図2:モデルの検証 (A)モデリング前後の腎臓の外観。(B)正常な腎臓組織。(C)モデリング後の腎臓組織(HE染色、200x、スケールバー:100μm)。(D)正常な精巣組織。(E)モデリング後の精巣組織(HE染色、100x、スケールバー:200μm)。 この図の拡大版を表示するには、ここをクリックしてください。
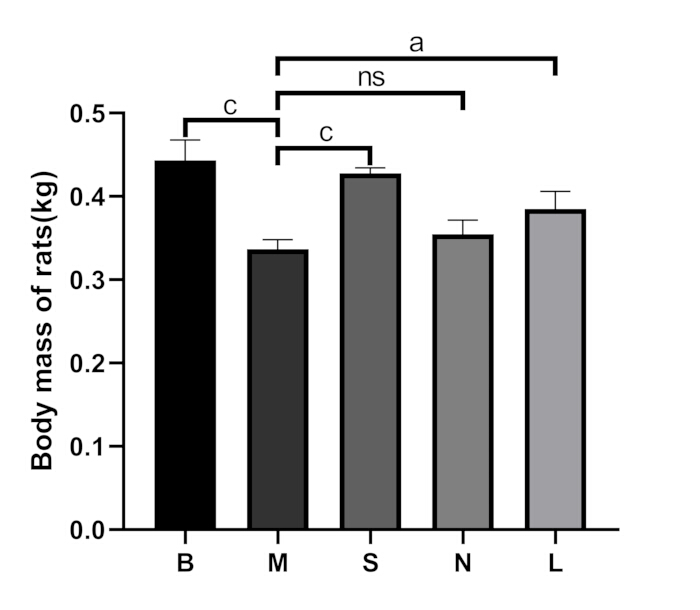
図3:グループ間の体重の比較。 B:ブランク群、M:モデル群、S:Shu-Mu脳腎臓群、N:非ツボ群、L:L-カルニチン群。データは平均±標準偏差(n = 3)として表示されます。 ap < 0.05、 bp < 0.01、 cp < 0.001、 nsp > 0.05。 この図の拡大版を表示するには、ここをクリックしてください。

図4:グループ間の腎臓器官と精巣器官の係数の比較(A)左腎器官の係数。(B)右腎臓器係数。(C)左精巣臓器係数。(D)右精巣臓器係数。B:ブランク群、M:モデル群、S:Shu-Mu脳腎臓群、N:非ツボ群、L:L-カルニチン群。臓器係数(%)=臓器重量(g)/体重(g)×100%。データは平均±標準偏差(n = 3)として表示されます。ap < 0.05、bp < 0.01、cp < 0.001、nsp > 0.05。この図の拡大版を表示するには、ここをクリックしてください。
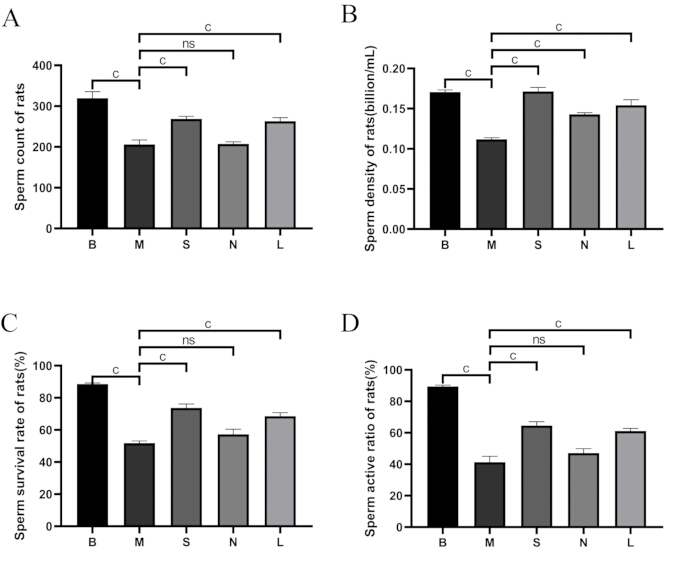
図5:グループ間の精子の質の比較(A)精子数。(B)精子密度。(C)精子の生存率。(D)精子活性率。B:ブランク群、M:モデル群、S:Shu-Mu脳腎臓群、N:非ツボ群、L:L-カルニチン群。精子生存率(%)=運動性精子数/総精子数×100%。データは平均±標準偏差(n = 3)として表示されます。ap < 0.05、bp < 0.01、cp < 0.001、nsp > 0.05。この図の拡大版を表示するには、ここをクリックしてください。
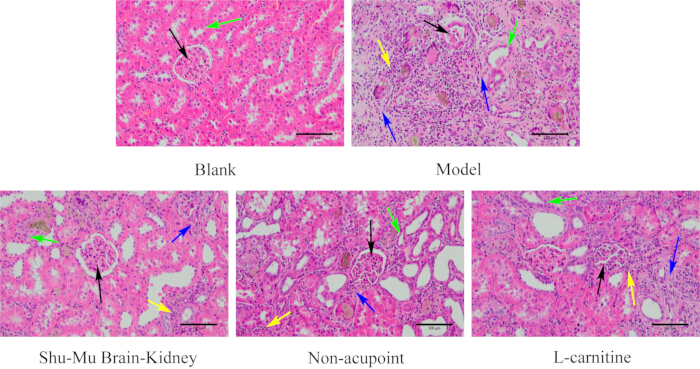
図6:各群における腎臓の形態学的変化( HE染色、200×、スケールバー:100μm)。黒い矢印は糸球体、緑の矢印は腎尿細管、黄色の矢印は炎症細胞、青い矢印は線維症を示します。 この図の拡大版を表示するには、ここをクリックしてください。
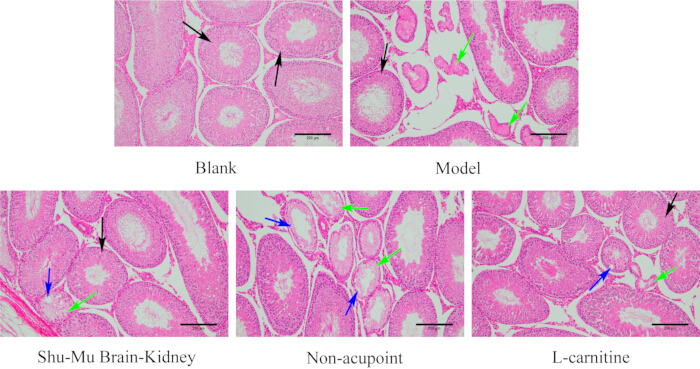
図7:各グループの精巣の形態学的変化。 (HE染色、100×、スケールバー:200μm)。黒い矢印は正常な精細管、緑の矢印は壊死、青い矢印は液胞を示します。 この図の拡大版を表示するには、ここをクリックしてください。
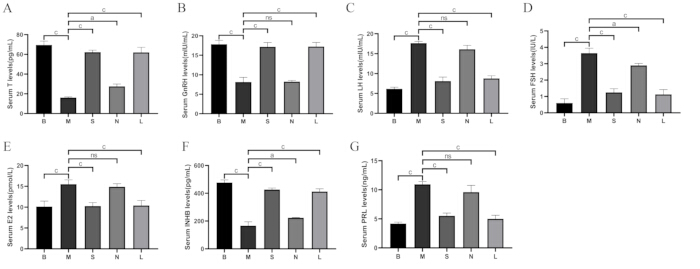
図8:グループ間の血清ホルモンレベルの比較。 (A)血清テストステロン(T)レベル。(B)血清GnRHレベル。(C)血清LHレベル。(D)血清FSHレベル。(E)血清E2レベル。(F)血清INHBレベル。(G)血清PRLレベル。B:ブランク群、M:モデル群、S:Shu-Mu脳腎臓群、N:非ツボ群、L:L-カルニチン群。データは平均±標準偏差(n = 3)として表示されます。 ap < 0.05、bp < 0.01、cp < 0.001、nsp > 0.05。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
TCMでは、「腎臓」は、現代医学における泌尿器系の機能を指す「内腎臓」と、視床下部-下垂体-性腺軸および解剖学的外部生殖器官を指す「外腎臓」から構成される25。雄の精嚢は「外腎臓」に属し、その成分には精巣、精巣上体、精嚢などが含まれます26。TCMはエッセンスを人体の物質的基盤と考えており、「腎臓エッセンス」には、親から受け継いだ「出生前エッセンス」と、脾臓と胃が水と穀物エッセンスを変換して生成される「出生後エッセンス」が含まれ、5つの内臓と6つの腸に栄養を与えるために使用されます。その中で、出生前エッセンスは胚を構成する元の物質であり、生命の基盤です。出生後のエッセンスは、5つの内臓と6つの腸のエッセンスを豊かにし、残りの部分は腎臓に蓄えられます。この2つは相互に依存しており、腎臓内で密接に組み合わされて「腎臓の本質」を形成します。腎臓のエッセンスが不十分な場合、つまり精嚢がいっぱいにならない場合、「精子減少症」につながります。生殖の本質が正常に排出されることができる場合、つまり、精嚢が精子を生成、保存、排出する機能を発揮できる場合、それは腎臓陰の収斂性の性質と腎臓の陽の興奮性の性質が相互に調整された結果です。腎臓の陽が不足して弱い場合、収斂機能が過剰になり、興奮機能が不十分になり、冷え性エッセンスと「精子症」を引き起こします。したがって、乏疹精子症の症状は、「腎臓エッセンス欠乏症および腎陽欠乏症」のTCM症候群タイプに対応します。この実験では、モデル化されたすべてのラットが基本的に腎臓陽欠損症型の乏疹アステノスペルミアの症状を満たしており、治療は「腎臓の緊張、陽の補助、エッセンスの充填、骨髄の栄養補給」に焦点を当てるべきです。Epangsanxian、Shenshu、Jingmen、Taixiの組み合わせは、Shu-Mu脳腎臓ツボの陰と陽を調整し、腎臓と脳をつなぎ、最終的に「陰陽バランス」の目的を達成します。
精子形成はHPT軸の内分泌活動によって調節され、HPT軸の調節は主に視床下部、下垂体、および精巣27で発現する関連ホルモンと受容体遺伝子に依存し、これは主に視床下部からのGnRHの拍動放出によって支配されます。これにより、下垂体前葉が刺激され、LH、FSH、およびPRL11が分泌されます。その中で、GnRHはHPT軸の最も重要な調節因子であり、そのレベルは間接的にHPT軸の状態と精子を生成する精巣の能力を反映することができます28。LHは精巣間質細胞からのTの放出を媒介し、精子の発生はTの刺激に依存します。T分泌が不十分な場合、精子の数と質は減少します29。FSHはセルトリ細胞表面の受容体に結合し、T細胞とともに作用して精子の増殖を促進し、精子形成を維持するためのINHBを産生します30。INHBは、精巣セルトリ細胞および生殖細胞で合成される糖タンパク質であり、雄性生殖腺の重要な調節因子であり、これは、次に、下垂体を活性化してFSHを産生し、FSHと相互作用してHPT軸31,32,33を共に調節することができる。しかし、PRLは精子の運動性に影響を与える重要な要素である34。過剰なPRLは性腺軸の分泌を阻害し、したがって精子形成を阻害する可能性があります35。E2は生殖腺と脳から分泌され、LHとFSH36に負のフィードバック効果があります。E2レベルが高いと、セルトリ細胞と精巣間質細胞が損傷し、周囲の結合組織の脂肪症を引き起こし、男性の精細管の直径が縮小し、患者の生殖能力が損なわれます37。Tripterygium wilfordiiによって誘導されたオリガステノスペルミアラットのFSHおよびLHの血清レベルは、モデリング後に有意に増加したことがわかっています。麒麟ピルによる60日間の治療後、これら2つのホルモンのレベルはモデルグループ38と比較して大幅に減少し、これはこの研究の結果と一致していました。.他の研究では、HPT軸機能障害は、アデニンによって引き起こされる腎臓陽欠損症候群のラットで発生し、関連する性ホルモン分泌レベルも変化することが示されています39。
本研究では、ブランク群と比較して、モデル群のラットは概して状態が悪く、精液の質は有意に低下した(p < 0.001)。H&E染色では、腎臓組織と精巣組織に深刻な損傷が見られ、アデニン調節ラットが乏血精子症の基準を満たしていることが示されました。モデル群と比較して、上記の条件はShu-Mu脳-腎臓群とL-カルニチン群で有意に改善した(p < 0.05)のに対し、非ツボ群では有意な改善はなく、Shu-Mu脳-腎臓群とL-カルニチン群で精子の質と臓器形態と構造が改善されたことが示されました。ブランク群と比較して、モデル群ではT、GnRH、INHBが減少(p < 0.001)しており、モデリング成功後に乏血精子症ラットではT、GnRH、INHBを分泌する能力が低下したことが示されました。LH、FSH、E2、PRLはすべて増加し(p < 0.001)、モデリングが成功した後にLH、FSH、E2、PRLの分泌が増加し、精巣の精子形成機能が弱まったことを示しています。モデル群と比較して、T、GnRH、INHBは増加(p < 0.001)、Shu-Mu Brain-Kidin群とL-カルニチン群ではLH、FSH、E2、PRLの分泌量が減少(p < 0.001)したが、非ツボ群では有意差は認められなかった。これは、電気鍼治療とL-カルニチンの両方がラットのHPT軸のホルモンレベルを調節し、ラットの乏人精子症の改善に良い効果をもたらすことを示しています。
L-カルニチンは、細胞のエネルギー代謝に参加し、精子40の抗酸化損傷を減らすことができる哺乳類の天然抗酸化物質です。多くの研究により、L-カルニチンは精子の運動性、形態、および集中性を大幅に改善し、HPT軸関連ホルモンのレベルを増加させることができることが証明されています41。この実験では、L-カルニチンを正の薬物対照群として使用し、Shu-Mu Brain-Kidney グループと比較しました。実験データでは、両群間の各種指標の比較に有意差はなく、「Epangsanxian、Shenshu、Jingmen、Taixi」の電気鍼治療が乏血精子症ラットに良好な効果を有することが確認されました。さらに、鍼治療は内臓の陰と陽を調整し、体の健康な気を高めて病原性の気に抵抗し、安全で効果的で、副作用が少なく毒性の低いものにすることができます。電気鍼治療は、通常の鍼治療よりも治療効果を高め、乏疹精子症の臨床管理に安全で効果的な治療法を提供することができます。非ツボ群のラットは経絡に沿った点選択の原理に従わなかったため、Shu-Mu Brain-Kidney 群とはさまざまな実験データが有意に異なり、「エパンサンシアン、シェンシュ、ジンメン、タイシー」の4つのポイントの適合性の有意性が検証されました。
要約すると、「エパンサンシアン、シェンシュ、ジンメン、タイシー」の4つのポイントでの電気鍼治療は、関連ホルモンのレベルを調節することにより、ラットのHPT軸の機能を改善することができ、それによってラットの精子の質を改善し、最終的に乏疹精子症の治療目的を達成します。それは、乏人精子症の臨床管理のための別の安全で効果的な治療法を提供します。
しかし、技術や資金が不足しているため、この研究はHPT軸上の血清ホルモンレベルの研究に限定されており、検出方法も限られていました。今後の実験では、クロマトグラフィーなど様々な手段を用いてホルモンレベルの変化をさらに検証することを検討し、トランスクリプトミクスやメタボロミクスを用いて、遺伝子レベル以降の電気鍼治療によるHPT軸の制御についてさらに研究を進めていきます。
開示事項
著者は何も開示していません。
謝辞
この研究は、寧夏回族自治区の主要研究開発プロジェクト(2021BEG02041)の支援を受け、男性の生殖機能障害の治療における「視床下部-下垂体-精巣軸」を調節する鍼治療のツボ適合性に関するエビデンスに基づく評価と臨床研究、プロジェクトリーダー:Huisheng Ma;2024年一級規律建設プロジェクト(ZY0019110305)、プロジェクトリーダー:Huisheng Ma;中国医学院(YZ-202128)、プロジェクトリーダー:Huisheng Ma.
資料
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
参考文献
- Punab, M., et al. Causes of male infertility: A 9-year prospective monocentre study on 1737 patients with reduced total sperm counts. Hum Reprod. 32 (1), 18-31 (2017).
- Nordkap, L., Joensen, U. N., Blomberg Jensen, M., Jørgensen, N. Regional differences and temporal trends in male reproductive health disorders: Semen quality may be a sensitive marker of environmental exposures. Mol Cell Endocrinol. 355 (2), 221-230 (2012).
- Daneshmandpour, Y., et al. MicroRNAs association with azoospermia, oligospermia, asthenozoospermia, and teratozoospermia: A systematic review. J Assist Reprod Genet. 37 (4), 763-775 (2020).
- Cipriani, S., et al. Trend of change of sperm count and concentration over the last two decades: A systematic review and meta-regression analysis. Andrology. 11 (6), 997-1008 (2023).
- Agarwal, A., et al. Male infertility. Lancet. 397 (10271), 319-333 (2021).
- Jensen, C. F. S., Fode, M., Østergren, P. B., Sønksen, J. A refined view on the association between y-chromosome microdeletions and sperm concentration. Eur Urol. 76 (5), 637-638 (2019).
- Pivonello, R., et al. Metabolic disorders and male hypogonadotropic hypogonadism. Front Endocrinol (Lausanne). 10, 345(2019).
- Guiton, R., Drevet, J. R. Viruses, bacteria and parasites: Infection of the male genital tract and fertility. Basic Clin Androl. 33 (1), 19(2023).
- Beeder, L. A., Samplaski, M. K. Effect of antidepressant medications on semen parameters and male fertility. Int J Urol. 27 (1), 39-46 (2020).
- Babalola, A. A., et al. Attenuation of doxorubicin-induced hypothalamic-pituitary-testicular axis dysfunction by diphenyl diselenide involves suppression of hormonal deficits, oxido-inflammatory stress and caspase 3 activity in rats. J Trace Elem Med Biol. 79, 127254(2023).
- Yang, Y., et al. Nickel chloride induces spermatogenesis disorder by testicular damage and hypothalamic-pituitary-testis axis disruption in mice. Ecotoxicol Environ Saf. 225, 112718(2021).
- Alahmar, A. T., Naemi, R. Predictors of pregnancy and time to pregnancy in infertile men with idiopathic oligoasthenospermia pre- and post-coenzyme q10 therapy. Andrologia. 54 (5), e14385(2022).
- Seiler, F., Kneissl, P., Hamann, C., Jünemann, K. P., Osmonov, D. Laparoscopic varicocelectomy in male infertility: Improvement of seminal parameters and effects on spermatogenesis. Wien Klin Wochenschr. 134 (1-2), 51-55 (2022).
- Cui, T. W., et al. Effect of electroacupuncture on spermatogenesis in rats with oligozoospermia of insufficiency of shen (kidney) essence syndrome. Chin J Integr Med. 25 (4), 292-297 (2019).
- Wang, Z., et al. Efficacy and safety of nonpharmacological strategies for the treatment of oligoasthenospermia: A systematic review and bayesian network meta-analysis. Eur J Med Res. 28 (1), 6(2023).
- Chuang, H. -N., et al. Effect of injecting adipose stem cells combined with platelet-rich fibrin released at Shenshu acupoint (BL23) on acute kidney injury in rabbits. Front Pharmacol. , 16(2025).
- Fu, C., et al. Acupuncture improves peri-menopausal insomnia: A randomized controlled trial. Sleep. 40 (11), (2017).
- Li, C. R., et al. Effects of acupuncture at taixi acupoint (ki3) on kidney proteome. Am J Chin Med. 39 (4), 687-692 (2011).
- Ma, L. Acupuncture treatment of kidney deficiency and essence deficiency based on the theory of kidney storing essence' clinical study of oligoasthenospermia. , (2023).
- Sheng, W., Xu, W., Hu, H., Xiao, D., He, Q. Effects of tortoise-shell glue on rat oligoasthenospermia model. Chin Med J (Engl). 135 (6), 732-734 (2022).
- Yang, N., et al. Transcriptomic analysis of the HPT axis in a model of oligoasthenozoospermia induced by adenine in rats. Exp Mol Pathol. 141, 104948(2025).
- Hongyu, L., et al. Assessment of electroacupuncture therapy with distant-approximal acupoints based on the HPT axis in rats with oligoasthenospermia through transcriptomic analysis. Reprod Sci. , (2025).
- Adachi, Y., et al. Influence of adenine-induced chronic renal failure on testicular function in the rat. Andrologia. 30 (2), 115-118 (1998).
- Zhao, Z., et al. Regulatory mechanism of electroacupuncture on hypothalamic-pituitary-testicular axis in oligospermic rats. Chin J Tissue Eng Res. 29 (26), 5563-5571 (2025).
- Chen, Y., Han, Z., Sun, Z., Huang, F. Analysis of male reproduction based on the "inner kidney and outer kidney" theory advanced by nation-famous Chinese medicine Professor XU Fu-song. Nat J Androl. 30 (02), 163-166 (2024).
- Ma, D., et al. Biological basis of premature ejaculation based on Theory of "Brain-heart-kidney-semen Chamber" Axis. Ch J Exp Tradit Med Formul. 30 (10), 203-209 (2024).
- Qi, L., et al. Toxic effects of ketamine on reproductive system via disrupting hypothalamic-pituitary-testicular axis. Eur Rev Med Pharmacol Sci. 21 (8), 1967-1973 (2017).
- Ryan, G. E., et al. Androgen receptor positively regulates gonadotropin-releasing hormone receptor in pituitary gonadotropes. Mol Cell Endocrinol. 530, 111286(2021).
- Jasuja, R., et al. Modulation of circulating free testosterone fraction by testosterone, dihydrotestosterone, and estradiol during testosterone replacement therapy. Andrology. 13 (3), 439-436 (2024).
- Dimmick, H., Kumar, T. R. Follicle-stimulating hormone. Trends Endocrinol Metab. 35 (9), 848-849 (2024).
- Negri, F., et al. The importance of discordant follicle stimulating hormone and inhibin b levels in primary infertile men: Findings from a cross-sectional study. World J Mens Health. 43 (1), 134-141 (2025).
- Li, J., et al. Development of a nomogram to predict fertilisation rate of infertile males with borderline semen by using semen parameters combined with AMH and INHB. Andrologia. 53 (9), e14182(2021).
- Liu, L., et al. Relationship between semen parameters, serum INHB, and insl-3 levels, and the degree of varicocele. Clinics (Sao Paulo). 79, 100339(2024).
- Akhigbe, R. E., Hamed, M. A., Odetayo, A. F. Haart and anti-koch's impair sexual competence, sperm quality, and offspring quality when used singly and in combination in male Wistar rats. Andrologia. 53 (2), e13951(2021).
- Liu, Y., Wang, G., Zhang, F., Dai, L. Correlation between serum levels of reproductive hormones and testicular spermatogenic function in men with azoospermia. Andrologia. 54 (10), e14182(2022).
- Russell, N., Grossmann, M. Mechanisms in endocrinology: Estradiol as a male hormone. Eur J Endocrinol. 181 (1), R23-R43 (2019).
- Leavy, M., et al. Effects of elevated β-estradiol levels on the functional morphology of the testis - new insights. Sci Rep. 7, 39931(2017).
- Jiao, W., et al. Improvement of qilin pills on male reproductive function in tripterygium glycoside-induced oligoasthenospermia in rats. Andrologia. 53 (4), e13923(2021).
- Zeng, Y., et al. Effects of Haima Duobian pill in a rat model of kidney yang deficiency syndrome. Evid Based Complement Alternat Med. 2021, 6696234(2021).
- Kooshesh, L., Nateghian, Z., Aliabadi, E. Evaluation of l-carnitine potential in improvement of male fertility. J Reprod Infertil. 24 (2), 69-84 (2023).
- Ma, L., Sun, Y. Comparison of l-carnitine vs. Coq10 and vitamin E for idiopathic male infertility: A randomized controlled trial. Eur Rev Med Pharmacol Sci. 26 (13), 4698-4704 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved