Method Article
Mécanisme de l’acupoint cerveau-rein Shu-Mu dans le traitement de l’oligoasthénospermie chez le rat via l’axe hypothalamo-hypophyso-testiculaire
Dans cet article
Résumé
Cette étude vise à vérifier l’effet thérapeutique de l’acupoint Shu-Mu Brain-Kidney sur l’oligoasthénospermie chez le rat et à explorer son mécanisme sous-jacent à travers l’axe hypothalamo-hypophyso-testiculaire (HPT).
Résumé
L’oligoasthénospermie est une cause fréquente d’infertilité masculine. L’axe hypothalamo-hypophyso-testiculaire (HPT) régule la différenciation et la maturation des gonades par la synthèse et la libération d’hormones de reproduction, jouant un rôle essentiel dans la fertilité masculine. La perturbation de la stabilité de l’axe HPT nuit à la production de spermatozoïdes, réduisant ainsi la qualité du sperme. L’étude de l’effet de l’électroacupuncture sur la régulation de l’axe HPT peut fournir des informations sur le traitement de l’oligoasthénospermie. Cinquante rats SD mâles âgés de 8 semaines ont été divisés au hasard en groupes blancs, modèles, Shu-Mu Cerveau-Rein, sans points d’acupuncture et L-carnitine (n = 10 par groupe). À l’exception du groupe blanc, les rats ont reçu de l’adénine par voie intragastrique pendant 28 jours pour établir le modèle. Après la modélisation, le groupe Shu-Mu Brain-Kidney a subi une électroacupuncture à des points d’acupuncture désignés, tandis que le groupe sans acupoint a reçu un traitement simulé pendant 30 minutes par jour. Le groupe L-carnitine a reçu de la L-carnitine (10 mL/kg) par voie intragastrique une fois par jour. Les traitements se sont poursuivis pendant 28 jours. Les conditions générales, les coefficients organiques et la qualité du sperme ont été évalués. La coloration HE a analysé la morphologie des tissus et ELISA a détecté des changements hormonaux sériques. Par rapport au groupe modèle, les groupes Shu-Mu Brain-Kidney et L-carnitine ont montré des améliorations significatives de l’esprit, de l’alimentation et des selles, avec une augmentation du poids corporel, tandis que le groupe sans point d’acupuncture n’a montré aucun changement significatif. Les coefficients des organes rénaux ont diminué de manière significative dans les groupes Shu-Mu Brain-Kidney et L-carnitine, mais sont restés inchangés dans le groupe sans points d’acupuncture. Les coefficients des organes testiculaires n’ont montré aucune différence significative entre les groupes de traitement. Le nombre, la densité, la survie et les taux de motilité des spermatozoïdes se sont considérablement améliorés dans les groupes Shu-Mu Brain-Kidney et L-carnitine, mais pas dans le groupe sans point d’acupuncture. La coloration H&E a montré une amélioration des lésions rénales et testiculaires dans les groupes Shu-Mu Brain-Kidney et L-carnitine. L’ELISA a révélé une augmentation de la T, de la GnRH et de l’INHB et une diminution des taux de LH, FSH, E2 et PRL dans ces groupes (p < 0,001), sans changement significatif dans le groupe sans point d’acupuncture. Ces résultats indiquent que la thérapie Shu-Mu Brain-Kidney acupoint améliore la qualité des spermatozoïdes en régulant l’axe HPT, offrant ainsi un traitement potentiel pour l’oligoasthénospermie.
Introduction
L’oligoasthénospermie, divisée en « oligospermie » et « asthénospermie », est l’un des types courants d’infertilité masculine, avec un taux d’incidence représentant environ 75 % des cas d’infertilité masculine1. L’oligoasthénospermie se caractérise principalement par une diminution de la densité et de la motilité des spermatozoïdes dans les testicules et se manifeste principalement cliniquement par un trouble de la spermatogenèse, une réduction du nombre de spermatozoïdes et une faible motilité des spermatozoïdes 2,3. Ces dernières années, l’incidence de l’oligoasthénospermie a augmenté d’année en année. En l’absence d’un traitement efficace, elle aura des effets néfastes à long terme sur la santé physique et mentale des patients, voiresur l’harmonie familiale5. Des études ont montré que les problèmes génétiques6, les troubles endocriniens de la reproduction7, les infections du tractus urogénital8 et les médicaments chimiques9 peuvent affecter la production et la maturation des spermatozoïdes, entraînant une baisse de la qualité du sperme. Actuellement, l’amélioration de la qualité des spermatozoïdes endommagés est devenue un problème difficile dans le domaine médical.
L’axe hypothalamo-hypophyso-testiculaire (HPT) est la principale voie de régulation de la reproduction dans le corps, qui peut réguler la différenciation et la maturation des gonades en stimulant la synthèse et la libération d’hormones reproductives liées à l’hypothalamus, à l’hypophyse et aux testicules, et joue un rôle important dans le maintien d’une fonction reproductive masculine normale10. Si la stabilité de la fonction de l’axe HPT est perturbée, la sécrétion testiculaire sera insuffisante pour atteindre la concentration physiologique de testostérone, ce qui entraînera une diminution du nombre et de la qualité des spermatozoïdes dans le testicule11. Par conséquent, le traitement de l’oligoasthénospermie vise principalement à réguler la fonction de l’axe HPT et à atteindre l’objectif de maintenir l’équilibre des hormones endocriniennes associées, augmentant ainsi le nombre de spermatozoïdes dans le sperme, augmentant l’activité des spermatozoïdes et améliorant la qualité du sperme.
Dans le traitement clinique de l’oligoasthénospermie, la médecine moderne adopte principalement des méthodes telles que la chirurgie et les médicaments anti-oxydants et améliorent la motilité des spermatozoïdes12,13, tandis que la thérapie par électroacupuncture combine l’acupuncture traditionnelle chinoise et la bioélectricité médicale moderne. Il présente les avantages d’être rapide et précis, d’avoir un effet curatif évident, d’avoir peu d’effets indésirables, un large éventail de maladies appropriées et un faible coût de traitement, et d’avoir un bon effet de traitement sur l’oligoasthénospermie14,15. « Le dos est yang et l’abdomen est yin. » La combinaison de points d’acupuncture Shu-Mu combine les points Shu avec les points Mu, un à l’avant et un à l’arrière, un yin et un yang, travaillant ensemble, également connue sous le nom de méthode de combinaison d’acupoints avant-arrière. La médecine traditionnelle chinoise (MTC) croit que le rein est la racine de l’essence prénatale et que la maladie est située dans le rein. Le point Front-mu du rein, Jingmen (GB25), et le point Back-shu, Shenshu (BL23), sont sélectionnés, ce qui a pour effet de réchauffer le rein, d’aider le yang et de rechercher le yang dans le yin16,17 ; le rein stocke l’essence et régit la production de moelle, le cerveau est la mer de moelle et le lieu de rencontre de tous les yang, et Taixi (KI3) est le point source du méridien du rein Shaoyin du pied, qui peut réguler et tonifier le foie et les reins, nourrir le yin et générer la moelle18. Combiné avec l’Epangsanxian (MS4), il relie le rein et le cerveau, reflétant l’idée de la « combinaison de points d’acupuncture Shu-Mu Brain-Kidney » dans la MTC19, et l’effet thérapeutique est plus évident que celui de l’acupuncture ordinaire.
Les études de traitement actuelles sur la qualité du sperme se concentrent principalement sur l’amélioration de la structure et de la fonction testiculaires, tandis que des recherches limitées ont été menées sur la régulation des taux d’hormones sériques dans différents tissus de l’axe hypothalamo-hypophyso-testiculaire (HPT)20. Dans le cadre de recherches préliminaires, le séquençage de l’ARN (RNA-Seq) a été utilisé pour identifier les gènes candidats et les voies régulatrices impliquées dans la régulation de la qualité du sperme dans les tissus hypothalamiques, hypophysaires et testiculaires de rats sains et de rats modèles d’oligozoospermie induite par l’adénine21. De plus, des tests de qualité du sperme et une analyse histologique des tissus testiculaires ont été effectués dans les deux groupes. Ces résultats ont permis de mieux comprendre les mécanismes moléculaires sous-jacents à la qualité du sperme chez les rats atteints d’oligoasthénospermie induite par l’adénine. La thérapie d’électroacupuncture avec un point d’acupuncture approximatif à distance pourrait améliorer la qualité des spermatozoïdes chez les rats oligoasthénospermes en régulant l’axe HPT, et l’effet est lié au processus de stress oxydatif22. Cependant, on ne sait pas si l’acupoint Shu-Mu Brain-Kidney peut améliorer la qualité du sperme des rats en régulant l’axe HPT. Afin d’explorer davantage le mécanisme régulateur de l’amélioration de la qualité du sperme chez les rats oligoasthénospermes et les méthodes de traitement efficaces, cette étude a utilisé un modèle d’oligoasthénospermie induite par l’adénine chez le rat et a sélectionné quatre points d’acupuncture, Epangsanxian, Shenshu, Jingmen et Taixi, pour explorer le mécanisme associé de l’effet thérapeutique de l’acupoint Shu-Mu Cerveau-Rein sur l’oligoasthénospermie chez le rat du point de vue de l’axe HPT. fournissant une base plus scientifique pour le traitement clinique.
Protocole
Toutes les expériences sur les animaux ont été examinées et approuvées par le Comité d’éthique animale de l’Université médicale du Ningxia (numéro d’approbation : IACUC-NYLAC-2021-130). L’étude a été réalisée en stricte conformité avec les directives ARRIVE 2.0 pour l’expérimentation animale et a adhéré aux principes de bien-être animal décrits dans le Guide des NIH pour le soin et l’utilisation des animaux de laboratoire. Cette étude contrôlée randomisée sur des animaux a utilisé une analyse de variance à un facteur et a été menée au Centre d’expérimentation animale de l’Université de médecine du Ningxia de mars à mai 2023. Des rats SD mâles de 180 à 220 g, âgés de huit semaines, pesant de 180 à 220 g ont été utilisés pour cette étude. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Procédures d’établissement et de traitement des modèles animaux
- Animaux d’expérimentation et groupes
- Obtenez cinquante rats SD mâles de 8 semaines pesant de 180 à 220 g.
- Hébergez tous les rats dans des conditions standard, en maintenant une température ambiante de 22-25 °C, une humidité de 50 à 60 % et en leur offrant un accès gratuit à de la nourriture et à de l’eau standard pour rongeurs.
- Après une semaine d’adaptation, divisez au hasard les rats en un groupe blanc (B) (n = 10) et un groupe modèle (n = 40) à l’aide d’une méthode de table de nombres aléatoires. Administrer une solution saline normale au groupe blanc et de l’adénine au groupe modelage par gavage oral.
- Après 28 jours, divisez au hasard le groupe de modélisation en un groupe modèle (M), un groupe Shu-Mu Cerveau-Rein (S), un groupe sans point d’acupuncture (N) et un groupe L-carnitine (L) (n = 10 par groupe). Laissez le groupe de modèles non traité.
- Appliquez l’intervention d’électroacupuncture à l’aide de la méthode d’appariement des points d’acupuncture Shu-Mu Brain-Kidney au groupe Shu-Mu Brain-Kidney. Administrer un traitement sans acupoint au groupe sans acupoint et un liquide oral de L-carnitine par gavage au groupe L-carnitine. Traitez tous les groupes en continu pendant 28 jours.
- Construction de modèles
REMARQUE : Des études ont montré que de fortes doses d’adénine peuvent affecter la fonction testiculaire chez les rats, entraînant une sécrétion anormale d’hormones sexuelles, une perturbation de la stabilité fonctionnelle de l’axe HPT et une baisse de la qualité du sperme23. Par conséquent, l’adénine est couramment utilisée pour établir des modèles d’infertilité chez les animaux mâles.- Administrer une solution saline normale (1 mL/100 g de poids corporel) au groupe blanc et de l’adénine (20 mg/100 g de poids corporel) au groupe modèle par gavage oral (figure 1A).
- Assurer une agitation continue pendant le gavage pour éviter la précipitation de l’adénine et le blocage de l’aiguille du gavage. Administrer le traitement une fois par jour pendant 28 jours.
- 1.3 Procédure de traitement
- Groupe Shu-Mu Cerveau-Rein
- Commencer l’intervention le premier jour après la modélisation. Effectuez l’acupuncture avec des aiguilles d’acupuncture stériles jetables sur des points bilatéraux. Après avoir réparé le rat, exposez et désinfectez le site d’acupuncture.
- Fixez la peau du site d’acupuncture avec la main gauche et percez rapidement le point d’acupuncture avec l’aiguille d’acupuncture stérile jetable dans la main droite. Connectez un stimulateur électrique. Appliquez des ondes de dilatation avec une fréquence d’électroacupuncture de 2 Hz, une intensité de stimulation de 1,5 mA et un léger tremblement du muscle local.
- Effectuez un traitement d’électroacupuncture pendant 30 minutes à chaque fois, une fois par jour, pendant 28 jours consécutifs (Figure 1B).
REMARQUE : Sélectionnez les points d’acupuncture chez le rat en vous référant à l’Experimental Acupuncture and Moxibustion Science de Yong Tang, Annexe II, « Points d’acupuncture couramment utilisés chez les animaux de laboratoire », combiné à une méthode de sélection de points anatomiques comparative19. Les points suivants ont été sélectionnés : (1) Epangsanxian (MS4) : situé à 3 mm en dessous et 4 mm à l’extérieur du point Touwei. Opération : Piqûre droite de 1 à 2 mm ; (2) Shenshu (BL23) : Situé dans la région de la colonne vertébrale, des deux côtés de l’apophyse épineuse inférieure de la deuxième vertèbre lombaire, à 6 mm de la ligne dorsale médiane. Opération : Piqûre de 6 mm droite ; (3) Jingmen (GB25) : Situé sur le côté de la taille, à l’extrémité libre de la 13e côte sur le côté inférieur. Opération : Piqûre droite de 1 à 2 mm ; (4) Taixi (KI3) : Situé sur la face interne du pied, dans la dépression entre le point haut de la cheville médiale et le bord postérieur du tendon d’Achille. Fonctionnement : Piqûre de 3 mm droite.
- Groupe sans points d’acupuncture
- Sélectionnez et utilisez les points non acuculaires 1, 2 et 3 de la même manière que le groupe Shu-Mu Cerveau-Rein (Figure 1B).
REMARQUE : Parce que les non-points d’acupuncture ne suivent pas le principe de sélection des points le long des méridiens, et selon la théorie de la médecine traditionnelle chinoise (MTC) et l’observation clinique à long terme, ces trois points d’acupuncture ont peu d’effet thérapeutique sur les patients atteints d’oligoasthénozoospermie24. (1) Non-point d’acupuncture 1 : Situé au milieu de la ligne entre l’extrémité du coude et l’aisselle sur la face interne du coude. Opération : Piqûre droite de 1 à 2 mm ; (2) Non-acupoint 2 : Situé au milieu entre l’épicondyle médial de l’humérus et le poignet du cubitus, sur le bord ulnaire. Opération : Piqûre droite de 1 à 2 mm ; (3) Non-point d’acupuncture 3 : Situé à l’intersection du muscle deltoïde antérieur et du muscle biceps à l’intérieur du bras. Opération : Piqûre de 1 à 2 mm droite.
- Sélectionnez et utilisez les points non acuculaires 1, 2 et 3 de la même manière que le groupe Shu-Mu Cerveau-Rein (Figure 1B).
- Groupe L-carnitine
- Administrer la lévocarnitine liquide par voie orale par gavage oral à une dose de 10 mL/kg de poids corporel, une fois par jour, pendant 28 jours consécutifs (figure 1A).
- Groupe Shu-Mu Cerveau-Rein
- Euthanasie
- Après le traitement, laisser tous les rats à jeun pendant 24 heures, les anesthésier par injection intrapéritonéale de pentobarbital sodique à 2 % (40 mg/kg de poids corporel, conformément aux protocoles approuvés par l’établissement) et prélever du sang à l’apex du cœur à l’aide d’une aiguille de prélèvement de sang intraveineuse jetable21,24.
- Après la mort par décapitation, retirez un côté de l’épididyme pour mesurer la qualité du sperme. Récoltez les tissus rénaux et testiculaires, pesez-les et enregistrez-les, puis fixez-les dans un fixateur de paraformaldéhyde à température ambiante pendant 48 h avant de les intégrer dans de la paraffine24.
2. Indices d’observation
- Observation générale : Observez l’état mental, le régime alimentaire et les selles des rats, et surveillez quotidiennement leur poids corporel.
- Coefficients organiques : Après la mort, retirez soigneusement la graisse superficielle et le tissu conjonctif des tissus rénaux et testiculaires, rincez avec une solution saline normale, séchez avec du papier filtre, pesez sur une balance et enregistrez les mesures pour le calcul des coefficients organiques. Coefficient d’organe ( %) = (poids de l’organe [g] / poids corporel [g]) x 100 %.
- Qualité du sperme
- Après avoir retiré l’excès de graisse, retirez et placez un côté de l’épididyme de chaque rat dans un bain-marie à température constante à 37 °C pendant 5 min. Ensuite, coupez, filtrez, soufflez doucement et mélangez bien l’échantillon.
- Prenez une aliquote de 10 μL de la suspension de spermatozoïdes diluée et déposez-la sur le bord du verre de couverture d’une plaque de comptage préchauffée, permettant à la suspension de spermatozoïdes de pénétrer automatiquement dans la chambre de comptage.
- Mesurez le nombre, la densité, le taux de survie et le taux de motilité des spermatozoïdes à l’aide d’un système CASA (analyse de sperme assistée par ordinateur)21.
- Coloration à l’hématoxyline et à l’éosine (H&E)
REMARQUE : Pour plus de détails sur la procédure, veuillez consulter Yang, N. et al.21.- Rincez les tissus fixés à l’eau courante, déshydratez-les et incrustez-les.
- Coupez des tronçons de paraffine (5 m d’épaisseur) à l’aide d’un microtome et faites-les cuire au four à 65 °C pendant 4 h.
- Déparaffinez les sections et réhydratez-les avec de l’eau.
- Teindre les sections avec une solution de coloration à l’hématoxyline pendant 3 min, puis rincer à l’eau courante.
- Déshydratez les sections avec de l’éthanol à 95 % pendant 1 min, puis colorez avec une solution d’éosine pendant 2 min.
- Après avoir scellé les lames, effectuez la numérisation à l’aide d’un scanner de diapositives, puis collectez et analysez les images.
- Dosage immuno-enzymatique (ELISA)
REMARQUE : Pour plus de détails sur la procédure, veuillez consulter Yang, N. et al.21.- Pour préparer le sérum, ajoutez des substances étalons et du sérum des concentrations correspondantes dans les puits de substance standard et les puits d’échantillonnage à mesurer, puis ajoutez le réactif marqué par enzyme.
- Effectuer les étapes d’incubation, de lavage, de développement de la couleur et de terminaison.
- Déterminez l’absorbance à une longueur d’onde de 450 nm à l’aide d’un instrument marqué par des enzymes et calculez les niveaux d’expression de la testostérone (T), de l’hormone de libération des gonadotrophines (GnRH), de l’inhibine B (INHB), de l’hormone lutéinisante (LH), de l’hormone folliculo-stimulante (FSH), de l’œstradiol (E2) et de la prolactine (PRL).
3. Analyse statistique
- Analyser les données expérimentales à l’aide d’un logiciel statistique et présenter les résultats de chaque groupe sous forme de moyenne ± d’écart-type (moyenne ± écart-type).
- Utilisez l’ANOVA à un facteur pour comparer les moyennes d’échantillon entre plusieurs groupes qui répondent aux hypothèses de normalité et d’homogénéité de la variance.
- Utilisez le test t pour les comparaisons entre deux groupes et les tests non paramétriques pour les données qui ne répondent pas aux hypothèses ci-dessus.
- Considérez les différences comme statistiquement significatives lorsque p < 0,05.
Résultats
Évaluation du modèle
Après la modélisation, observez les rats pour la léthargie, la posture accroupie, les membres froids, la réticence à manger, la perte de poids, l’augmentation du volume d’urine, les selles molles et d’autres symptômes, qui s’alignent généralement avec le syndrome de carence en rein-yang.
Après la dissection, observez que les reins sont durs, blancs et plus lourds. La coloration H&E révèle que les tissus rénaux et testiculaires des rats modèles sont gravement endommagés, avec des formes glomérulaires irrégulières, une inflammation interstitielle des tubules rénaux et un grand nombre de cellules épithéliales subissant une dégénérescence et même une fibrose. Les tubules plus séminifères des testicules sont atrophiés et déformés, avec des cellules spermatogènes désordonnées ou même absentes (Figure 2), ce qui indique une réussite de l’établissement du modèle.
État général des rats
Dans le groupe blanc, les rats présentaient une bonne humeur, des réactions sensibles, des cheveux brillants et une alimentation et une défécation normales. Après dissection, leurs reins sont apparus brun rougeâtre et mous. Dans le groupe modèle, les rats ont montré une léthargie, le dos accroupi, des corps froids, une perte d’appétit, une perte de poids (p < 0,001), une augmentation de la miction et des selles molles. Après la dissection, leurs reins étaient durs et une apparence de « gros rein blanc » a été observée (figure 2A). Par rapport au groupe modèle, les symptômes ci-dessus se sont significativement améliorés dans le groupe Shu-Mu Cerveau-Rein ; ils ne se sont pas améliorés de manière significative dans le groupe sans points d’acupuncture », et ils se sont également améliorés de manière significative dans le groupe L-carnitine. La comparaison de la masse corporelle entre les groupes est illustrée à la figure 3.
Coefficients des organes rénaux et testiculaires
Comme le montre la figure 4, par rapport au groupe blanc, les coefficients des organes rénaux des rats du groupe modèle ont augmenté de façon significative (p < 0,01), tandis qu’aucune différence significative n’a été observée dans les coefficients bilatéraux des organes testiculaires (p > 0,05), ce qui indique que la qualité des deux testicules a diminué après la modélisation. Par rapport au groupe modèle, les coefficients des organes rénaux dans les groupes Shu-Mu Brain-Kidney et L-carnitine ont significativement diminué (p < 0,05), mais aucune différence significative n’a été observée dans le groupe sans acupoint (p > 0,05). Aucune différence significative n’a été observée dans les coefficients bilatéraux des organes testiculaires entre les groupes Shu-Mu Cerveau-Rein, L-carnitine et sans point d’acupuncture par rapport au groupe modèle (p > 0,05), indiquant que la masse testiculaire bilatérale a augmenté dans les groupes Shu-Mu Cerveau-Rein et L-carnitine, tandis qu’aucun changement significatif n’a été observé dans le groupe sans point d’acupuncture.
Analyse de la qualité du sperme
Comme le montre la figure 5, par rapport au groupe blanc, le nombre de spermatozoïdes, la densité, le taux de survie et le taux de motilité ont considérablement diminué dans le groupe modèle (p < 0,001). Par rapport au groupe modèle, le nombre de spermatozoïdes, la densité des spermatozoïdes, le taux de survie et le taux de motilité ont considérablement augmenté dans les groupes Shu-Mu Brain-Kidney et L-carnitine (p < 0,001), mais aucune différence significative n’a été observée dans le groupe sans point d’acupuncture.
Changements morphologiques dans le rein
Comme le montre la figure 6, le tissu rénal des rats du groupe blanc avait une structure complète et une forme normale. Les glomérules étaient ronds et pleins, étroitement liés aux capsules rénales, et les tubules rénaux étaient réguliers et soigneusement disposés. Par rapport au groupe blanc, le groupe modèle présentait de graves lésions du tissu rénal, une morphologie glomérulaire irrégulière, une atrophie, une réduction, une inflammation interstitielle sévère des tubules rénaux, une dégénérescence de nombreuses cellules épithéliales et une fibrose sévère. Par rapport au groupe modèle, le degré de lésion des tissus rénaux s’est considérablement amélioré dans les groupes Shu-Mu Brain-Kidney et L-carnitine, avec des formes glomérulaires plus régulières, une légère séparation des capsules rénales, une dénaturation de quelques cellules épithéliales tubulaires et une légère infiltration et fibrose des cellules interstitielles des tubules rénaux. Par rapport au groupe modèle, le degré de lésion du tissu rénal était moins apparent dans le groupe sans point d’acupuncture, avec des formes glomérulaires plus régulières, une séparation des capsules rénales, une plus grande dénaturation et un plus grand désordre des cellules épithéliales tubulaires rénales, une infiltration modérée de cellules inflammatoires autour des glomérules et dans l’interstitium des tubules rénaux, et plus de fibrose.
Modifications morphologiques des testicules
Comme le montre la figure 7, les testicules des rats du groupe blanc avaient une structure tissulaire complète, une morphologie normale, des tubes séminifères nets et des cellules spermatogènes régulières. Par rapport au groupe blanc, les lésions du tissu testiculaire étaient sévères dans le groupe modèle, avec plus d’atrophie et de déformation des tubules séminifères, et des cellules spermatogènes désordonnées, voire absentes. Par rapport au groupe modèle, le degré de lésion du tissu testiculaire s’est considérablement amélioré dans les groupes Shu-Mu Brain-Kidney et L-carnitine, avec la plupart des tubes séminifères disposés soigneusement et les cellules spermatogènes disposées régulièrement. Par rapport au groupe modèle, le degré de lésion du tissu testiculaire n’a pas diminué de manière significative dans le groupe sans point d’acupuncture, certains tubules séminifères présentant une atrophie et une déformation, une nécrose cellulaire, des vacuoles et des cellules spermatogènes désordonnées et absentes.
Comparaison des taux d’hormones sériques
Comme le montre la figure 8, par rapport au groupe blanc, les taux de testostérone (T), d’hormone de libération des gonadotrophines (GnRH) et d’inhibine B (INHB) dans le sérum ont diminué dans le groupe modèle (p < 0,001), tandis que l’hormone lutéinisante (LH), l’hormone folliculostimulante (FSH), l’œstradiol (E2) et la prolactine (PRL) ont augmenté (p < 0,001). Par rapport au groupe modèle, la T, la GnRH et l’INHB ont augmenté dans les groupes Shu-Mu Brain-Kidney et L-carnitine (p < 0,001), tandis que les niveaux de LH, FSH, E2 et PRL ont diminué (p < 0,001), mais aucune différence significative n’a été observée dans le groupe sans acupoint.
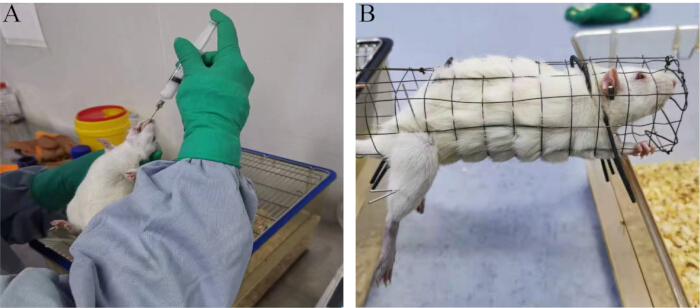
Figure 1 : Méthodes expérimentales. (A) Procédure de gavage oral. (B) Méthode de traitement impliquant l’électroacupuncture. Veuillez cliquer ici pour voir une version agrandie de cette figure.
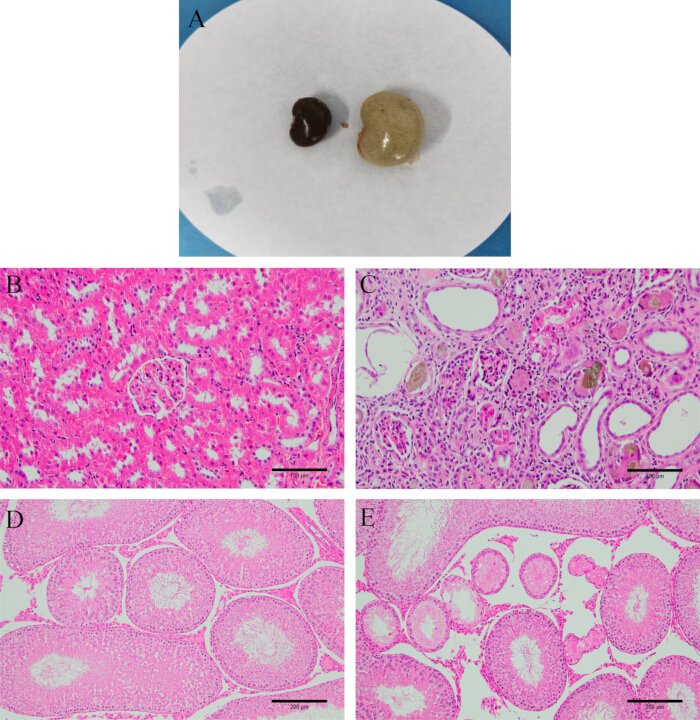
Figure 2 : Vérification du modèle. (A) Apparence du rein avant et après la modélisation. (B) Tissu rénal normal. (C) Tissu rénal après modélisation (coloration HE, 200x, barre d’échelle : 100 μm). (D) Tissu testiculaire normal. (E) Tissu testiculaire après modélisation (coloration HE, 100x, barre d’échelle : 200 μm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
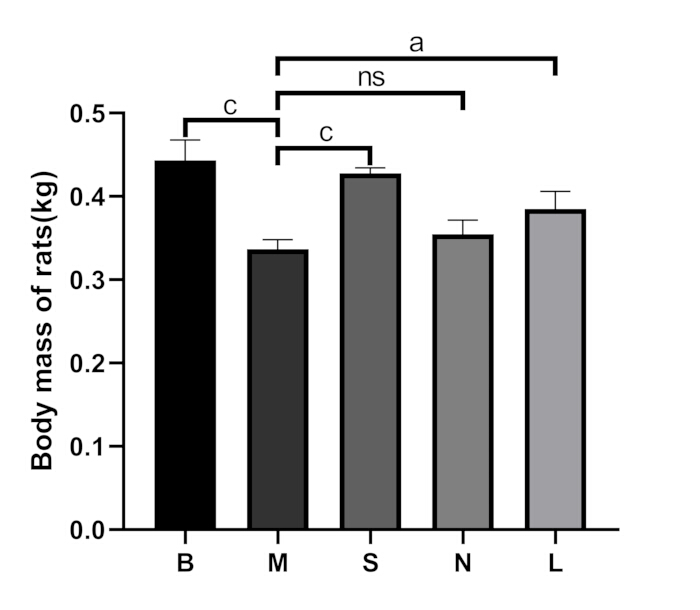
Figure 3 : Comparaison de la masse corporelle entre les groupes. B : groupe vide, M : groupe modèle, S : groupe Shu-Mu Cerveau-Rein, N : groupe sans point d’acupuncture, L : groupe L-carnitine. Les données sont présentées sous forme de moyenne ± d’écart-type (n = 3). ap < 0,05, bp < 0,01, cp < 0,001, nsp > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Comparaison des coefficients des organes rénaux et testiculaires entre les groupes. (A) Coefficients des organes rénaux gauches. (B) Coefficients de l’organe rénal droit. (C) Coefficients de l’organe testiculaire gauche. (D) Coefficients des organes testiculaires droits. B : groupe vide, M : groupe modèle, S : groupe Shu-Mu Cerveau-Rein, N : groupe sans point d’acupuncture, L : groupe L-carnitine. Coefficient d’organe ( %) = poids de l’organe (g) / poids corporel (g) × 100 %. Les données sont présentées sous forme de moyenne ± d’écart-type (n = 3). aP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
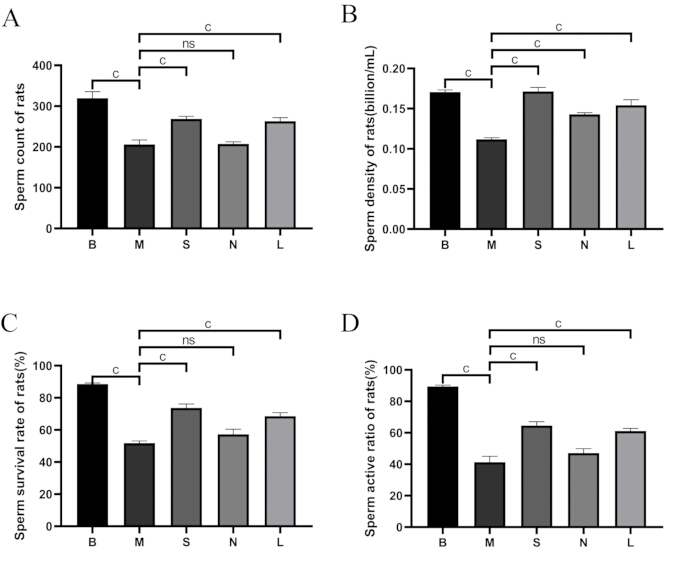
Figure 5 : Comparaison de la qualité du sperme entre les groupes. (A) Nombre de spermatozoïdes. (B) Densité des spermatozoïdes. (C) Taux de survie des spermatozoïdes. (D) Rapport d’activité des spermatozoïdes. B : groupe vide, M : groupe modèle, S : groupe Shu-Mu Cerveau-Rein, N : groupe sans point d’acupuncture, L : groupe L-carnitine. Taux de survie des spermatozoïdes ( %) = nombre de spermatozoïdes mobiles / nombre total de spermatozoïdes × 100 %. Les données sont présentées sous forme de moyenne ± d’écart-type (n = 3). aP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
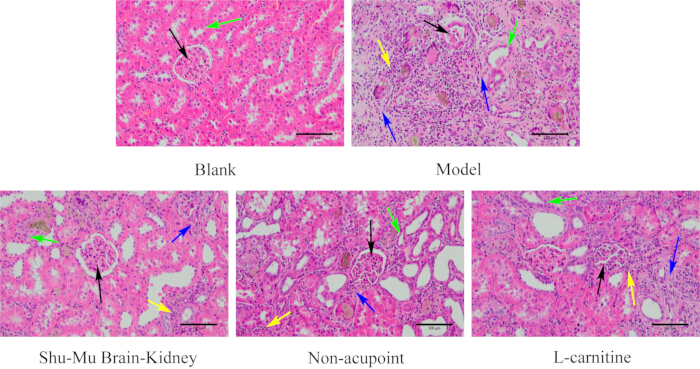
Figure 6 : Modifications morphologiques du rein dans chaque groupe (coloration HE, 200×, barre d’échelle : 100 μm). Les flèches noires indiquent les glomérules, les flèches vertes indiquent les tubules rénaux, les flèches jaunes indiquent les cellules inflammatoires et les flèches bleues indiquent la fibrose. Veuillez cliquer ici pour voir une version agrandie de cette figure.
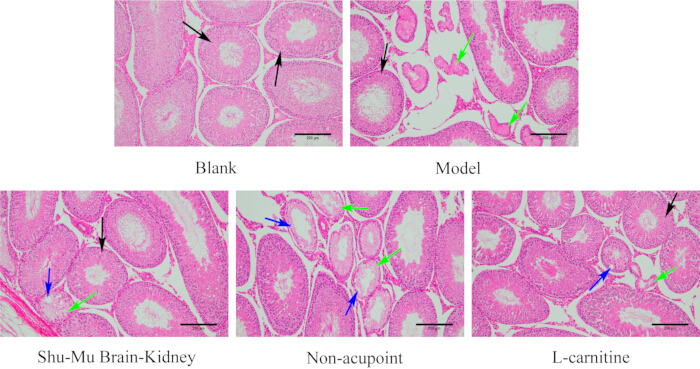
Figure 7 : Changements morphologiques des testicules dans chaque groupe. (Coloration HE, 100×, barre d’échelle : 200 μm). Les flèches noires indiquent les tubules séminifères normaux, les flèches vertes indiquent la nécrose et les flèches bleues indiquent les vacuoles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
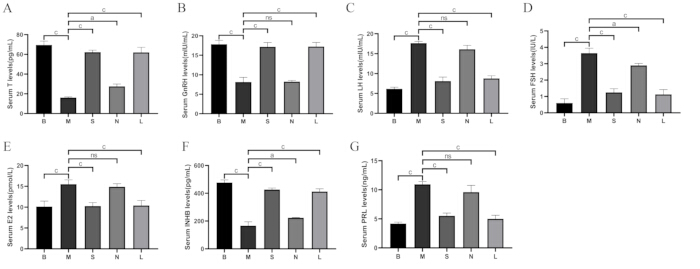
Figure 8 : Comparaison des taux d’hormones sériques entre les groupes. (A) Taux sérique de testostérone (T). (B) Taux sériques de GnRH. (C) Taux sériques de LH. (D) Taux sériques de FSH. (E) Taux sériques E2. (F) Taux sériques d’INHB. (G) Taux sériques de PRL. B : groupe vide, M : groupe modèle, S : groupe Shu-Mu Cerveau-Rein, N : groupe sans point d’acupuncture, L : groupe L-carnitine. Les données sont présentées sous forme de moyenne ± d’écart-type (n = 3). aP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
En MTC, le « rein » se compose du « rein interne », faisant référence aux fonctions du système urinaire dans la médecine moderne, et du « rein externe », faisant référence à l’axe hypothalamo-hypophyso-gonadique et aux organes reproducteurs externes anatomiques25. Les vésicules séminales mâles appartiennent au « rein externe » et leurs composants comprennent les testicules, les épididymes, les vésicules séminales, etc.26. La MTC considère l’essence comme la base matérielle du corps humain, et « l’essence rénale » comprend « l’essence prénatale » héritée des parents et « l’essence postnatale » produite par la transformation de la rate et de l’estomac en eau et en essence de grain, qui est utilisée pour nourrir les cinq viscères et les six intestins. Parmi elles, l’essence prénatale est la substance originelle qui constitue l’embryon et est le fondement de la vie ; L’essence postnatale enrichit l’essence des cinq viscères et des six intestins, et la partie restante est stockée dans le rein. Les deux sont interdépendants et étroitement combinés dans le rein pour former « l’essence rénale ». Si l’essence rénale est insuffisante, c’est-à-dire si les vésicules séminales ne peuvent pas être pleines, cela entraînera une « oligospermie » ; Si l’essence reproductrice peut être normalement déchargée, c’est-à-dire si les vésicules séminales peuvent exercer leurs fonctions de production, de stockage et de décharge des spermatozoïdes, c’est le résultat de la coordination mutuelle de la nature astringente du rein Yin et de la nature excitatrice du rein yang. Si le yang du rein est déficient et faible, la fonction astringente est excessive, tandis que la fonction excitatrice est insuffisante, ce qui entraîne une essence froide et une « asthénospermie ». Par conséquent, les manifestations de l’oligoasthénospermie correspondent aux types de syndrome MTC de « déficit en essence rénale et de déficit en yang du rein ». Dans cette expérience, tous les rats modélisés ont essentiellement rencontré les manifestations de l’oligoasthénospermie de type déficience rénale-yang, et le traitement devrait se concentrer sur « tonifier le rein, aider le yang, remplir l’essence et nourrir la moelle ». La combinaison d’Epangsanxian, de Shenshu, de Jingmen et de Taixi pour l’acupoint Shu-Mu Cerveau-Rein peut coordonner le yin et le yang et connecter le rein et le cerveau, atteignant finalement l’objectif de « l’équilibre yin-yang ».
La spermatogenèse est régulée par l’activité endocrinienne de l’axe HPT, et la régulation de l’axe HPT dépend principalement des hormones apparentées et des gènes récepteurs exprimés dans l’hypothalamus, l’hypophyse et les testicules27, qui est principalement dominé par la libération pulsatile de GnRH par l’hypothalamus. Cela stimule l’hypophyse antérieure à sécréter LH, FSH et PRL11. Parmi eux, la GnRH est le régulateur le plus critique de l’axe HPT, et son niveau peut refléter indirectement l’état de l’axe HPT et la capacité des testicules à produire des spermatozoïdes28. La LH médie la libération de T par les cellules stromales testiculaires, et l’apparition des spermatozoïdes dépend de la stimulation de la T. Si la sécrétion de T est insuffisante, le nombre et la qualité des spermatozoïdes diminuerontde 29. La FSH se lie aux récepteurs à la surface des cellules de Sertoli et agit avec le T pour favoriser la prolifération des spermatogonies et produire de l’INHB pour maintenir la spermatogenèse30. L’INHB, une glycoprotéine synthétisée dans les cellules testiculaires de Sertoli et les cellules germinales, est un régulateur important de la gonade mâle, qui peut, à son tour, activer l’hypophyse pour produire de la FSH et interagir avec la FSH pour réguler conjointement l’axe HPT 31,32,33. Cependant, la PRL est un facteur important affectant la motilité des spermatozoïdes34. Un excès de PRL peut inhiber la sécrétion de l’axe gonadique, inhibant ainsi la spermatogenèse35. E2 est sécrété par les gonades et le cerveau et a un effet de rétroaction négatif sur la LH et la FSH36. Des niveaux élevés d’E2 endommageront les cellules de Sertoli et les cellules interstitielles testiculaires, provoqueront une stéatose du tissu conjonctif environnant et réduiront le diamètre des tubes séminifères mâles, entraînant une altération de la fertilité des patients37. Il a été constaté que les taux sériques de FSH et de LH chez les rats oligasthénospermie induits par Tripterygium wilfordii étaient significativement augmentés après modélisation. Après 60 jours de traitement avec la pilule Qilin, les niveaux de ces deux hormones ont diminué de manière significative par rapport au groupe modèle38, ce qui était cohérent avec les résultats de cette étude. D’autres études ont montré que le dysfonctionnement de l’axe HPT se produit chez les rats atteints d’un syndrome de déficience rénale-yang causé par l’adénine, et que les niveaux de sécrétion d’hormones sexuelles associés changent également39.
Dans cette étude, par rapport au groupe blanc, les rats du groupe modèle étaient généralement en mauvais état et la qualité du sperme était significativement diminuée (p < 0,001). La coloration H&E a montré de graves lésions des reins et des tissus testiculaires, indiquant que les rats modulés par l’adénine répondaient aux critères d’oligonasthénospermie. Par rapport au groupe modèle, les conditions ci-dessus se sont significativement améliorées dans les groupes Shu-Mu Cerveau-Rein et L-carnitine (p < 0,05), tandis que l’amélioration n’était pas significative dans le groupe sans point d’acupuncture, indiquant que la qualité du sperme et la morphologie et la structure des organes se sont améliorées dans les groupes Shu-Mu Cerveau-Rein et L-carnitine. Par rapport au groupe blanc, la T, la GnRH et l’INHB ont diminué (p < 0,001) dans le groupe modèle, ce qui indique que la capacité à sécréter de la T, de la GnRH et de l’INHB a diminué chez les rats oligoasthénospermes après une modélisation réussie. LH, FSH, E2 et PRL ont tous augmenté (p < 0,001), indiquant que la sécrétion de LH, FSH, E2 et PRL a augmenté après une modélisation réussie, entraînant l’affaiblissement de la fonction spermatogène testiculaire. Par rapport au groupe modèle, les niveaux de T, de GnRH et d’INHB ont augmenté (p < 0,001), tandis que les niveaux de sécrétion de LH, FSH, E2 et PRL ont diminué (p < 0,001) dans les groupes Shu-Mu Brain-Kidney et L-carnitine, mais aucune différence significative n’a été observée dans le groupe sans acupoint. Cela illustre que l’électroacupuncture et la L-carnitine peuvent réguler les niveaux d’hormones de l’axe HPT chez le rat et avoir un bon effet sur l’amélioration de l’oligonasthénospermie chez le rat.
La L-carnitine est un antioxydant naturel chez les mammifères qui peut participer au métabolisme énergétique cellulaire et réduire les dommages antioxydants des spermatozoïdes40. De nombreuses études ont prouvé que la L-carnitine peut améliorer considérablement la motilité, la morphologie et la concentration des spermatozoïdes tout en augmentant le niveau d’hormones liées à l’axe HPT41. Dans cette expérience, la L-carnitine a été utilisée comme groupe témoin positif pour comparer avec le groupe Shu-Mu Brain-Kidney. Les données expérimentales n’ont montré aucune différence significative dans la comparaison des différents indices entre les deux groupes, confirmant que l’électroacupuncture à « Epangsanxian, Shenshu, Jingmen et Taixi » avait un bon effet sur les rats oligoasthénospermes. De plus, l’acupuncture peut coordonner le yin et le yang des viscères et améliorer le qi sain du corps pour résister au qi pathogène, ce qui la rend sûre, efficace et moins toxique avec moins d’effets secondaires. L’électroacupuncture peut améliorer l’effet curatif plus que l’acupuncture ordinaire et fournir un traitement sûr et efficace pour la gestion clinique de l’oligoasthénospermie. Étant donné que les rats du groupe sans point d’acupuncture n’ont pas suivi le principe de la sélection des points le long des méridiens, diverses données expérimentales étaient significativement différentes de celles du groupe Shu-Mu Brain-Kidney, vérifiant l’importance de la compatibilité des quatre points, « Epangsanxian, Shenshu, Jingmen et Taixi ».
En résumé, l’électroacupuncture aux quatre points, « Epangsanxian, Shenshu, Jingmen et Taixi », peut améliorer la fonction de l’axe HPT chez les rats en régulant le niveau d’hormones associées, améliorant ainsi la qualité des spermatozoïdes chez les rats et atteignant finalement l’objectif de traiter l’oligoasthénospermie. Il s’agit d’un autre traitement sûr et efficace pour la prise en charge clinique de l’oligonasthénospermie.
Cependant, en raison du manque de technologie et de fonds, cette étude s’est limitée à l’étude des taux d’hormones sériques sur l’axe HPT, et les méthodes de détection étaient limitées. Dans les expériences futures, nous envisagerons d’utiliser divers moyens, tels que la chromatographie, pour vérifier davantage les changements dans les niveaux d’hormones et d’utiliser la transcriptomique ou la métabolomique pour mener d’autres études sur la régulation de l’axe HPT par électroacupuncture au niveau des gènes et au-delà.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été soutenue par le projet clé de recherche et développement de la région autonome Hui du Ningxia (2021BEG02041), une évaluation fondée sur des preuves et une étude clinique sur la compatibilité des points d’acupuncture de la thérapie d’acupuncture régulant l’axe hypothalamo-hypophyso-testiculaire dans le traitement de la dysfonction reproductive masculine, chef de projet : Huisheng Ma ; 2024 Projet de construction disciplinaire de première classe (ZY0019110305), chef de projet : Huisheng Ma ; Académie chinoise des sciences médicales chinoises (YZ-202128), chef de projet : Huisheng Ma.
matériels
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon