Method Article
Mecanismo del punto de acupuntura cerebro-riñón Shu-Mu en el tratamiento de la oligoastenospermia en ratas a través del eje hipotálamo-hipófisis-testicular
En este artículo
Resumen
Este estudio tiene como objetivo verificar el efecto terapéutico del punto de acupuntura cerebro-riñón Shu-Mu sobre la oligoastenospermia en ratas y explorar su mecanismo subyacente a través del eje hipotálamo-hipófisis-testicular (HPT).
Resumen
La oligoastenospermia es una causa común de infertilidad masculina. El eje hipotálamo-hipófisis-testicular (HPT) regula la diferenciación y maduración gonadal a través de la síntesis y liberación de hormonas reproductivas, desempeñando un papel vital en la fertilidad masculina. La interrupción de la estabilidad del eje HPT perjudica la producción de espermatozoides, lo que reduce la calidad del semen. La investigación del efecto de la electroacupuntura en la regulación del eje HPT puede proporcionar información sobre el tratamiento de la oligoastenospermia. Cincuenta ratas SD macho de 8 semanas de edad se dividieron aleatoriamente en grupos en blanco, modelo, Shu-Mu Cerebro-Riñón, sin acupuntura y L-carnitina (n = 10 por grupo). A excepción del grupo en blanco, las ratas recibieron adenina por vía intragástrica durante 28 días para establecer el modelo. Después del modelado, el grupo Shu-Mu Cerebro-Riñón se sometió a electroacupuntura en los puntos de acupuntura designados, mientras que el grupo sin punto de acupuntura recibió un tratamiento simulado durante 30 minutos al día. El grupo de L-carnitina recibió L-carnitina (10 mL/kg) por vía intragástrica una vez al día. Los tratamientos continuaron durante 28 días. Se evaluaron las condiciones generales, los coeficientes orgánicos y la calidad del semen. La tinción HE analizó la morfología del tejido y el ELISA detectó cambios en las hormonas séricas. En comparación con el grupo modelo, los grupos Shu-Mu Cerebro-Riñón y L-carnitina mostraron mejoras significativas en el espíritu, la dieta y los movimientos intestinales, con un aumento del peso corporal, mientras que el grupo sin punto de acupuntura no mostró cambios significativos. Los coeficientes de los órganos renales disminuyeron significativamente en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, pero permanecieron sin cambios en el grupo sin punto de acupuntura. Los coeficientes de los órganos testiculares no mostraron diferencias significativas entre los grupos de tratamiento. El recuento, la densidad, la supervivencia y las tasas de motilidad de los espermatozoides mejoraron significativamente en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, pero no en el grupo sin punto de acupuntura. La tinción de H&E mostró una mejora en el daño renal y tisular testicular en los grupos Shu-Mu Cerebro-Riñón y L-carnitina. El ELISA reveló un aumento de T, GnRH e INHB y una disminución de los niveles de LH, FSH, E2 y PRL en estos grupos (p < 0,001), sin cambios significativos en el grupo sin punto de acupuntura. Estos hallazgos indican que la terapia de acupuntura cerebro-riñón Shu-Mu mejora la calidad del esperma al regular el eje HPT, lo que ofrece un tratamiento potencial para la oligoastenospermia.
Introducción
La oligoastenospermia, dividida en "oligospermia" y "astenospermia", es uno de los tipos comunes de infertilidad masculina, con una tasa de incidencia que representa alrededor del 75% de los casos de infertilidad masculina1. La oligoastenospermia se caracteriza principalmente por una disminución de la densidad y la motilidad de los espermatozoides en los testículos y se manifiesta clínicamente principalmente como un trastorno de la espermatogénesis, disminución del recuento de espermatozoides y baja motilidad de los espermatozoides 2,3. En los últimos años, la incidencia de oligoastenospermia ha aumentado año tras año4. Sin un tratamiento eficaz, tendrá efectos adversos a largo plazo en la salud física y mental de los pacientes e incluso en la armonía familiar5. Los estudios han demostrado que los problemas genéticos6, los trastornos endocrinos reproductivos7, las infecciones del tracto urogenital8 y los fármacos químicos9 pueden afectar la producción y maduración de los espermatozoides, lo que lleva a una disminución de la calidad del semen. Actualmente, mejorar la calidad de los espermatozoides dañados se ha convertido en un problema desafiante en el campo de la medicina.
El eje hipotálamo-hipófisis-testicular (HPT) es la principal vía de regulación reproductiva en el cuerpo, que puede regular la diferenciación y maduración de las gónadas estimulando la síntesis y liberación de hormonas reproductivas relacionadas con el hipotálamo, la glándula pituitaria y los testículos, y desempeña un papel importante en el mantenimiento de la función reproductiva masculina normal10. Si se interrumpe la estabilidad de la función del eje HPT, hará que la secreción testicular sea insuficiente para alcanzar la concentración fisiológica de testosterona, lo que resultará en una disminución en el número y la calidad de los espermatozoides en el testículo11. Por lo tanto, el tratamiento de la oligoastenospermia tiene como objetivo principal regular la función del eje HPT y lograr el propósito de mantener el equilibrio de las hormonas endocrinas relacionadas, aumentando así la cantidad de espermatozoides en el semen, mejorando la actividad de los espermatozoides y mejorando la calidad del semen.
En el tratamiento clínico de la oligoastenospermia, la medicina moderna adopta principalmente métodos como la cirugía y los medicamentos antioxidantes y mejoran la motilidad de los espermatozoides12,13, mientras que la terapia de electroacupuntura combina la acupuntura tradicional china y la bioelectricidad médica moderna. Tiene las ventajas de ser rápido y preciso, tener un efecto curativo evidente, tener pocas reacciones adversas, una amplia gama de enfermedades adecuadas y un bajo costo de tratamiento, y tener un buen efecto de tratamiento sobre la oligoastenospermia14,15. "La espalda es yang y el abdomen es yin". La combinación de puntos de acupuntura Shu-Mu combina los puntos Shu con los puntos Mu, uno en el frente y otro en la parte posterior, un yin y un yang, trabajando juntos, también conocido como el método de combinación de puntos de acupuntura delantero-trasero. La medicina tradicional china (MTC) cree que el riñón es la raíz de la esencia prenatal, y la enfermedad se localiza en el riñón. Se seleccionan el punto mu delantero del riñón, Jingmen (GB25), y el punto shu posterior, Shenshu (BL23), que tiene el efecto de calentar el riñón, ayudar al yang y buscar el yang dentro del yin16,17; el riñón almacena la esencia y gobierna la producción de médula, el cerebro es el mar de médula y el lugar de encuentro de todo el yang, y Taixi (KI3) es el punto de origen del meridiano del riñón Shaoyin del pie, que puede regular y tonificar el hígado y el riñón, nutrir el yin y generar médula18. Combinado con Epangsanxian (MS4), conecta el riñón y el cerebro, reflejando la idea de la "combinación de punto de acupuntura Shu-Mu Cerebro-Riñón" en TCM19, y el efecto terapéutico es más obvio que el de la acupuntura ordinaria.
Los estudios de tratamiento actuales sobre la calidad del semen se centran principalmente en mejorar la estructura y la función testicular, mientras que se han realizado investigaciones limitadas sobre la regulación de los niveles de hormonas séricas en diferentes tejidos del eje hipotálamo-hipófisis-testicular (HPT)20. En la investigación preliminar, se utilizó la secuenciación de ARN (RNA-Seq) para identificar genes candidatos y vías reguladoras involucradas en la regulación de la calidad del semen dentro de los tejidos hipotálamo, hipofisario y testicular de ratas sanas y ratas modelo de oligozoospermia inducida por adenina21. Además, se realizaron pruebas de calidad seminal y análisis histológico de los tejidos testiculares en ambos grupos. Estos hallazgos proporcionaron información sobre los mecanismos moleculares que subyacen a la calidad del semen en ratas con oligoastenospermia inducida por adenina. La terapia de electroacupuntura con punto de acupuntura aproximado distante podría mejorar la calidad del esperma en ratas oligoastenospermas mediante la regulación del eje HPT, y el efecto está relacionado con el proceso de estrés oxidativo22. Sin embargo, se desconoce si el punto de acupuntura cerebro-riñón Shu-Mu puede mejorar la calidad del semen de las ratas mediante la regulación del eje HPT. Para explorar más a fondo el mecanismo regulador de la mejora de la calidad del semen en ratas oligoastenospermas y los métodos de tratamiento efectivos, este estudio utilizó un modelo de rata inducida por adenina de oligoastenospermia y seleccionó cuatro puntos de acupuntura, Epangsanxian, Shenshu, Jingmen y Taixi, para explorar el mecanismo relacionado con el efecto terapéutico del punto de acupuntura cerebro-riñón Shu-Mu sobre la oligoastenospermia en ratas desde el aspecto del eje HPT. proporcionando una base más científica para el tratamiento clínico.
Protocolo
Todos los experimentos con animales fueron revisados y aprobados por el Comité de Ética Animal de la Universidad Médica de Ningxia (número de aprobación: IACUC-NYLAC-2021-130). El estudio se realizó en estricta conformidad con las Directrices ARRIVE 2.0 para experimentos con animales y se adhirió a los principios de bienestar animal descritos en la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio. Este estudio aleatorizado controlado en animales empleó un análisis unidireccional de la varianza y se llevó a cabo en el Centro de Experimentos Animales de la Universidad Médica de Ningxia de marzo a mayo de 2023. Para este estudio se utilizaron ratas SD macho de ocho semanas de edad con grado SPF que pesaron entre 180 y 220 g. Los detalles de los reactivos y equipos utilizados se enumeran en la Tabla de Materiales.
1. Procedimientos de establecimiento y tratamiento de modelos animales
- Animales de experimentación y grupos
- Obtenga cincuenta ratas SD macho de grado SPF de 8 semanas de edad con un peso de 180-220 g.
- Aloje a todas las ratas en condiciones estándar, manteniendo una temperatura ambiente de 22-25 °C, una humedad del 50% al 60% y proporcionando acceso libre a la alimentación y el agua estándar para roedores.
- Después de una semana de adaptación, divida aleatoriamente las ratas en un grupo en blanco (B) (n = 10) y un grupo de modelado (n = 40) utilizando un método de tabla de números aleatorios. Administrar solución salina normal al grupo blanco y adenina al grupo modelar por sonda nasogástrica oral.
- Después de 28 días, divida aleatoriamente el grupo de modelado en un grupo modelo (M), un grupo Shu-Mu Cerebro-Riñón (S), un grupo sin punto de acupuntura (N) y un grupo de L-carnitina (L) (n = 10 por grupo). Deje el grupo de modelos sin tratar.
- Aplique la intervención de electroacupuntura utilizando el método de coincidencia de puntos de acupuntura Shu-Mu Cerebro-Riñón al grupo Shu-Mu Cerebro-Riñón. Administrar tratamiento sin punto de acupuntura al grupo sin punto de acupuntura y líquido oral con L-carnitina por sonda nasogástrica al grupo con L-carnitina. Tratar a todos los grupos de forma continua durante 28 días.
- Construcción del modelo
NOTA: Los estudios han demostrado que altas dosis de adenina pueden afectar la función testicular en ratas, lo que conduce a una secreción anormal de hormonas sexuales, la interrupción de la estabilidad funcional del eje HPT y una disminución en la calidad del esperma23. Por lo tanto, la adenina se usa comúnmente para establecer modelos de infertilidad animal masculino.- Administrar solución salina normal (1 mL/100 g de peso corporal) al grupo en blanco y adenina (20 mg/100 g de peso corporal) al grupo modelo por sonda nasogástrica oral (Figura 1A).
- Asegure la agitación continua durante la sonda nasogástrica para evitar la precipitación de adenina y el bloqueo de la aguja de la sonda nasogástrica. Administrar el tratamiento una vez al día durante 28 días.
- 1.3 Procedimiento de tratamiento
- Grupo Shu-Mu Cerebro-Riñón
- Comience la intervención el primer día después del modelado. Realizar la acupuntura con agujas de acupuntura estériles desechables en puntos bilaterales. Después de arreglar la rata, exponga y desinfecte el sitio de acupuntura.
- Fije la piel del sitio de acupuntura con la mano izquierda y perfore rápidamente el punto de acupuntura con la aguja de acupuntura estéril desechable en la mano derecha. Conecte un estimulador eléctrico. Aplicar ondas dilatadoras con una frecuencia de electroacupuntura de 2 Hz, una intensidad de estimulación de 1,5 mA y un ligero temblor del músculo local.
- Realizar el tratamiento de electroacupuntura durante 30 minutos cada vez, una vez al día, durante 28 días consecutivos (Figura 1B).
NOTA: Seleccione los puntos de acupuntura en ratas con referencia a la Ciencia de la Acupuntura y la Moxibustión Experimental de Yong Tang, Apéndice II, "Puntos de Acupuntura Comúnmente Utilizados en Animales de Experimentación", combinado con un método comparativo de selección de puntos anatómicos19. Se seleccionaron los siguientes puntos: (1) Epangsanxian (MS4): Ubicado 3 mm por debajo y 4 mm fuera del punto Touwei. Operación: Pinche 1-2 mm recto; (2) Shenshu (BL23): Situado en la zona de la columna vertebral, a ambos lados de la apófisis espinosa inferior de la segunda vértebra lumbar, a 6 mm al lado de la línea dorsal media. Operación: Pinchazo de 6 mm recto; (3) Jingmen (GB25): Ubicado en la cintura lateral, en el extremo libre de la 13ª costilla en la parte inferior. Operación: Pinche 1-2 mm recto; (4) Taixi (KI3): Situado en la cara interna del pie, en la depresión entre el punto alto del tobillo medial y el borde posterior del tendón de Aquiles. Funcionamiento: Pinchar 3 mm recto.
- Grupo sin acupuntura
- Seleccione y opere los puntos de acupuntura 1, 2 y 3 que no son de la misma manera que el grupo Shu-Mu Cerebro-Riñón (Figura 1B).
NOTA: Debido a que los puntos de no acupuntura no siguen el principio de selección de puntos a lo largo de los meridianos, y de acuerdo con la teoría de la Medicina Tradicional China (MTC) y la observación clínica a largo plazo, estos tres puntos de acupuntura tienen poco efecto terapéutico en pacientes con oligoastenozoospermia24. (1) No punto de acupuntura 1: Ubicado en el punto medio de la línea entre la punta del codo y la axila en el lado interno del codo. Operación: Pinche 1-2 mm recto; (2) No punto de acupuntura 2: Situado en el punto medio entre el epicóndilo medial del húmero y la muñeca del cúbito, en el margen cubital. Operación: Pinche 1-2 mm recto; (3) No punto de acupuntura 3: Ubicado en la intersección del músculo deltoides anterior y el músculo bíceps en la parte interna del brazo. Funcionamiento: Pinchar 1-2 mm recto.
- Seleccione y opere los puntos de acupuntura 1, 2 y 3 que no son de la misma manera que el grupo Shu-Mu Cerebro-Riñón (Figura 1B).
- Grupo L-carnitina
- Administrar levocarnitina líquida oral por sonda nasogástrica oral a una dosis de 10 mL/kg de peso corporal, una vez al día, durante 28 días consecutivos (Figura 1A).
- Grupo Shu-Mu Cerebro-Riñón
- Eutanasia
- Después del tratamiento, permitir que todas las ratas ayunen durante 24 h, anestesiarlas mediante inyección intraperitoneal de pentobarbital sódico al 2% (40 mg/kg de peso corporal, siguiendo los protocolos aprobados institucionalmente) y recoger sangre del ápice del corazón utilizando una aguja de extracción de sangre intravenosa desechable21,24.
- Después de la muerte por decapitación, se extirpa un lado del epidídimo para medir la calidad del semen. Extraiga el riñón y los tejidos testiculares, péselos y regístrese, y fíjelos en fijador de paraformaldehído a temperatura ambiente durante 48 h antes de incorporarlos en parafina24.
2. Índices de observación
- Observación general: Observe el estado mental, la dieta y los movimientos intestinales de las ratas, y controle su peso corporal diariamente.
- Coeficientes de los órganos: Después de la muerte, retire cuidadosamente la grasa de la superficie y el tejido conectivo de los tejidos renales y testiculares, enjuague con solución salina normal, seque con papel de filtro, pese en una balanza y registre las mediciones para el cálculo de los coeficientes de los órganos. Coeficiente de órgano (%) = (peso del órgano [g] / peso corporal [g]) x 100%.
- Calidad del semen
- Después de eliminar el exceso de grasa, retire y coloque un lado del epidídimo de cada rata en un baño de agua a temperatura constante a 37 °C durante 5 min. Luego, corte, filtre, sople suavemente y mezcle bien la muestra.
- Tome una alícuota de 10 μL de la suspensión de esperma diluida y colóquela en el borde del cubreobjetos de una placa de recuento precalentada, permitiendo que la suspensión de esperma penetre automáticamente en la cámara de recuento.
- Mida el recuento, la densidad, la tasa de supervivencia y la tasa de motilidad de los espermatozoides utilizando un sistema CASA (análisis de semen asistido por computadora)21.
- Tinción de hematoxilina y eosina (H&E)
NOTA: Para más detalles sobre el procedimiento, consultar Yang, N. et al.21.- Enjuague los tejidos fijados con agua corriente, deshidrítelos e insértelos.
- Cortar trozos de parafina (5 μm de grosor) con un micrótomo y hornear a 65 °C durante 4 h.
- Desparafina las secciones y rehidrátalas con agua.
- Tiñe las secciones con solución de tinción de hematoxilina durante 3 minutos, luego enjuague con agua corriente.
- Deshidrate las secciones con etanol al 95% durante 1 min, luego tiña con solución de eosina durante 2 min.
- Después de sellar las diapositivas, escanee con un escáner de diapositivas y recopile y analice las imágenes.
- Ensayo de inmunoabsorción enzimática (ELISA)
NOTA: Para más detalles sobre el procedimiento, consultar Yang, N. et al.21.- Para preparar el suero, agregue sustancias patrón y suero de las concentraciones correspondientes a los pocillos de sustancia estándar y pocillos de muestra que se van a medir, seguido de la adición del reactivo marcado con enzimas.
- Lleve a cabo los pasos de incubación, lavado, desarrollo de color y terminación.
- Determine la absorbancia a una longitud de onda de 450 nm utilizando un instrumento marcado con enzimas y calcule los niveles de expresión de testosterona (T), hormona liberadora de gonadotropina (GnRH), inhibina B (INHB), hormona luteinizante (LH), hormona estimulante del folículo (FSH), estradiol (E2) y prolactina (PRL).
3. Análisis estadístico
- Analizar los datos experimentales utilizando software estadístico y presentar los resultados de cada grupo como media ± desviación estándar (media ± DE).
- Utilice el ANOVA de un factor para comparar las medias de las muestras entre varios grupos que cumplen los supuestos de normalidad y homogeneidad de la varianza.
- Utilice la prueba t para comparaciones entre dos grupos y pruebas no paramétricas para los datos que no cumplen con los supuestos anteriores.
- Considere las diferencias estadísticamente significativas cuando p < 0,05.
Resultados
Evaluación de modelos
Después de modelar, observe a las ratas en busca de letargo, postura agachada, extremidades frías, renuencia a comer, pérdida de peso, aumento del volumen de orina, heces blandas y otros síntomas, que generalmente se alinean con el síndrome de deficiencia de riñón-yang.
Después de la disección, observe que los riñones son duros, blancos y más pesados. La tinción con H&E revela que los tejidos renales y testiculares de las ratas modelo están seriamente dañados, con formas glomerulares irregulares, inflamación intersticial del túbulo renal y un gran número de células epiteliales en degeneración e incluso fibrosis. Los túbulos más seminíferos en los testículos están atrofiados y deformados, con células espermatogénicas desordenadas o incluso ausentes (Figura 2), lo que indica un establecimiento exitoso del modelo.
Estado general de las ratas
En el grupo en blanco, las ratas mostraron buen ánimo, reacciones sensibles, pelo brillante y alimentación y defecación normales. Después de la disección, sus riñones parecían de color marrón rojizo y blandos. En el grupo modelo, las ratas mostraron letargo, espaldas agachadas, cuerpos fríos, pérdida de apetito, pérdida de peso (p < 0,001), aumento de la micción y heces blandas. Después de la disección, sus riñones estaban duros y se observó una apariencia de "riñón grande y blanco" (Figura 2A). En comparación con el grupo modelo, los síntomas anteriores mejoraron significativamente en el grupo Shu-Mu Cerebro-Riñón, no mejoraron significativamente en el grupo sin punto de acupuntura y también mejoraron significativamente en el grupo de L-carnitina. La comparación de la masa corporal entre los grupos se muestra en la Figura 3.
Coeficientes de órganos renales y testiculares
Como se muestra en la Figura 4, en comparación con el grupo en blanco, los coeficientes de los órganos renales de las ratas en el grupo modelo aumentaron significativamente (p < 0,01), mientras que no se encontraron diferencias significativas en los coeficientes de los órganos testiculares bilaterales (p > 0,05), lo que indica que la calidad de ambos testículos disminuyó después del modelado. En comparación con el grupo modelo, los coeficientes de los órganos renales en los grupos Shu-Mu Cerebro-Riñón y L-carnitina disminuyeron significativamente (p < 0,05), pero no se encontraron diferencias significativas en el grupo sin punto de acupuntura (p > 0,05). No se encontraron diferencias significativas en los coeficientes bilaterales de los órganos testiculares entre los grupos Shu-Mu Cerebro-Riñón, L-carnitina y sin punto de acupuntura en comparación con el grupo modelo (p > 0,05), lo que indica que la masa testicular bilateral aumentó en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, mientras que no se observó ningún cambio significativo en el grupo sin punto de acupuntura.
Análisis de la calidad del semen
Como se muestra en la Figura 5, en comparación con el grupo en blanco, el recuento de espermatozoides, la densidad, la tasa de supervivencia y la tasa de motilidad disminuyeron significativamente en el grupo modelo (p < 0,001). En comparación con el grupo modelo, el recuento de espermatozoides, la densidad de espermatozoides, la tasa de supervivencia y la tasa de motilidad aumentaron significativamente en los grupos de Shu-Mu Cerebro-Riñón y L-carnitina (p < 0,001), pero no se encontraron diferencias significativas en el grupo sin punto de acupuntura.
Cambios morfológicos en el riñón
Como se muestra en la Figura 6, el tejido renal de las ratas en el grupo en blanco tenía una estructura completa y una forma normal. Los glomérulos eran redondos y llenos, fuertemente unidos a las cápsulas renales, y los túbulos renales eran regulares y estaban bien dispuestos. En comparación con el grupo en blanco, el grupo modelo mostró lesión grave del tejido renal, morfología glomerular irregular, atrofia, reducción, inflamación intersticial grave del túbulo renal, degeneración de numerosas células epiteliales y fibrosis grave. En comparación con el grupo modelo, el grado de daño del tejido renal mejoró significativamente en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, con formas glomerulares más regulares, ligera separación de las cápsulas renales, desnaturalización de algunas células epiteliales tubulares e infiltración leve de células intersticiales del túbulo renal y fibrosis. En comparación con el grupo modelo, el grado de lesión del tejido renal fue menos evidente en el grupo sin punto de acupuntura, con formas glomerulares más regulares, separación de las cápsulas renales, más desnaturalización y trastorno de las células epiteliales tubulares renales, infiltración moderada de células inflamatorias alrededor de los glomérulos y en el intersticio del túbulo renal, y más fibrosis.
Cambios morfológicos de los testículos
Como se muestra en la Figura 7, los testículos de las ratas en el grupo en blanco tenían una estructura tisular completa, morfología normal, túbulos seminíferos limpios y células espermatogénicas regulares. En comparación con el grupo en blanco, el daño del tejido testicular fue grave en el grupo modelo, con más atrofia y deformación de los túbulos seminíferos, y células espermatogénicas desordenadas o incluso ausentes. En comparación con el grupo modelo, el grado de daño del tejido testicular mejoró significativamente en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, con la mayoría de los túbulos seminíferos dispuestos ordenadamente y las células espermatogénicas dispuestas regularmente. En comparación con el grupo modelo, el grado de daño del tejido testicular no se redujo significativamente en el grupo sin punto de acupuntura, con algunos túbulos seminíferos que exhibieron atrofia y deformación, necrosis celular, vacuolas y células espermatogénicas desordenadas y ausentes.
Comparación de los niveles séricos de hormonas
Como se muestra en la Figura 8, en comparación con el grupo en blanco, los niveles de testosterona (T), hormona liberadora de gonadotropina (GnRH) e inhibina B (INHB) en el grupo modelo disminuyeron en el grupo modelo (p < 0,001), mientras que la hormona luteinizante (LH), la hormona estimulante del folículo (FSH), el estradiol (E2) y la prolactina (PRL) aumentaron (p < 0,001). En comparación con el grupo modelo, T, GnRH e INHB aumentaron en los grupos Shu-Mu Cerebro-Riñón y L-carnitina (p < 0,001), mientras que los niveles de LH, FSH, E2 y PRL disminuyeron (p < 0,001), pero no se encontraron diferencias significativas en el grupo sin punto de acupuntura.
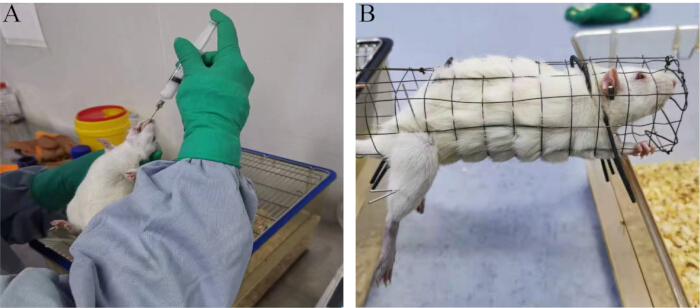
Figura 1: Métodos experimentales. (A) Procedimiento de sonda nasogástrica oral. (B) Método de tratamiento que involucra electroacupuntura. Haga clic aquí para ver una versión más grande de esta figura.
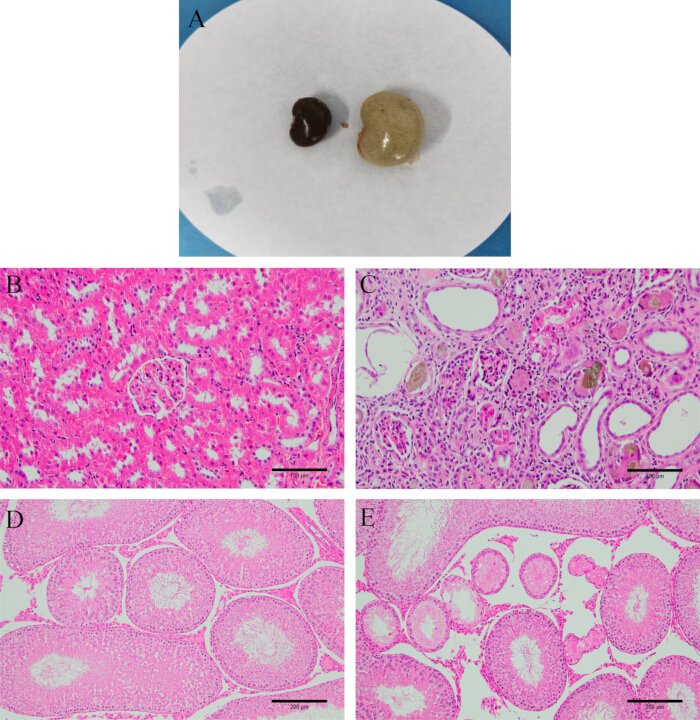
Figura 2: Verificación del modelo. (A) Aspecto del riñón antes y después del modelado. (B) Tejido renal normal. (C) Tejido renal después del modelado (tinción HE, 200x, barra de escala: 100 μm). (D) Tejido testicular normal. (E) Tejido testicular después del modelado (tinción HE, 100x, barra de escala: 200 μm). Haga clic aquí para ver una versión más grande de esta figura.
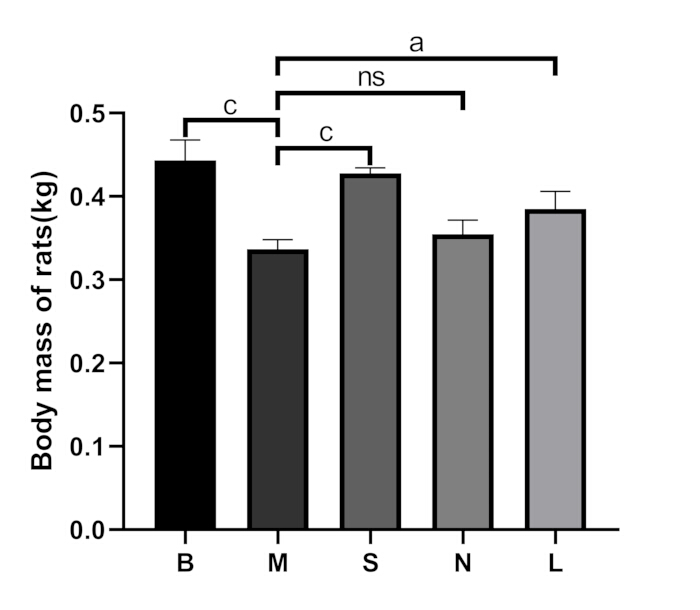
Figura 3: Comparación de la masa corporal entre grupos. B: grupo en blanco, M: grupo modelo, S: grupo Shu-Mu Cerebro-Riñón, N: grupo sin punto de acupuntura, L: grupo L-carnitina. Los datos se presentan como media ± desviación estándar (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Comparación de los coeficientes de órganos renales y testiculares entre los grupos. (A) Coeficientes de órganos renales izquierdos. (B) Coeficientes de órganos renales derechos. (C) Coeficientes de los órganos testiculares izquierdos. (D) Coeficientes de los órganos testiculares derechos. B: grupo en blanco, M: grupo modelo, S: grupo Shu-Mu Cerebro-Riñón, N: grupo sin punto de acupuntura, L: grupo L-carnitina. Coeficiente de órgano (%) = peso del órgano (g) / peso corporal (g) × 100%. Los datos se presentan como media ± desviación estándar (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Haga clic aquí para ver una versión más grande de esta figura.
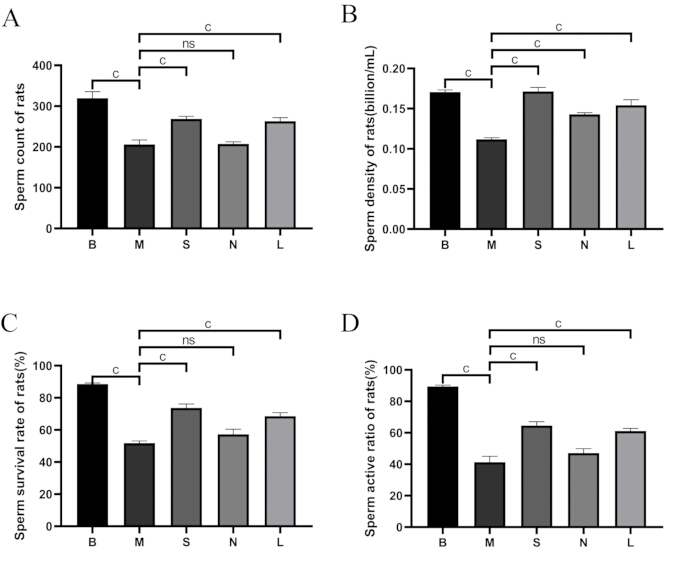
Figura 5: Comparación de la calidad del esperma entre grupos. (A) Recuento de espermatozoides. (B) Densidad de espermatozoides. (C) Tasa de supervivencia de los espermatozoides. (D) Tasa de actividad de los espermatozoides. B: grupo en blanco, M: grupo modelo, S: grupo Shu-Mu Cerebro-Riñón, N: grupo sin punto de acupuntura, L: grupo L-carnitina. Tasa de supervivencia de los espermatozoides (%) = recuento de espermatozoides móviles / recuento total de espermatozoides × 100%. Los datos se presentan como media ± desviación estándar (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Haga clic aquí para ver una versión más grande de esta figura.
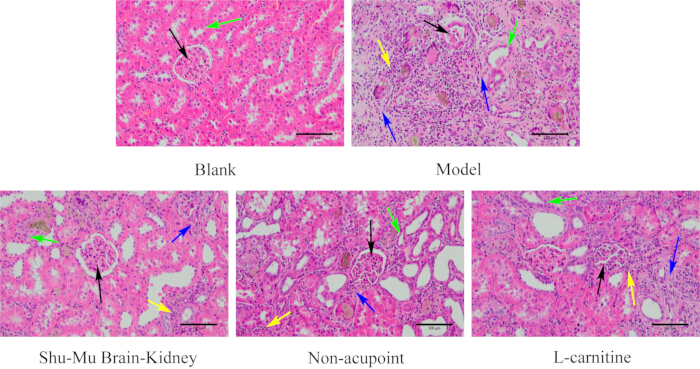
Figura 6: Cambios morfológicos en el riñón de cada grupo (tinción HE, 200×, barra de escala: 100 μm). Las flechas negras indican glomérulos, las flechas verdes indican túbulos renales, las flechas amarillas indican células inflamatorias y las flechas azules indican fibrosis. Haga clic aquí para ver una versión más grande de esta figura.
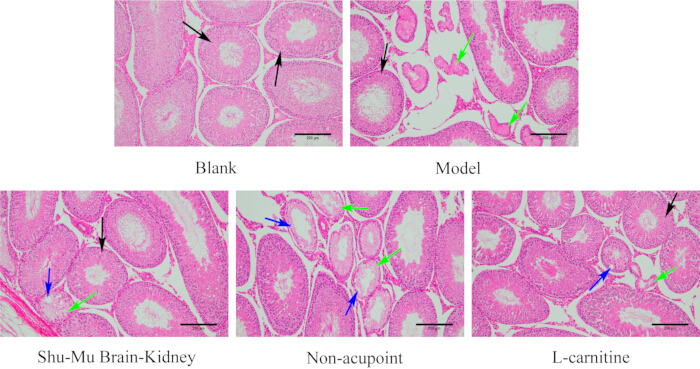
Figura 7: Cambios morfológicos en los testículos de cada grupo. (Tinción HE, 100×, barra de escala: 200 μm). Las flechas negras indican túbulos seminíferos normales, las flechas verdes indican necrosis y las flechas azules indican vacuolas. Haga clic aquí para ver una versión más grande de esta figura.
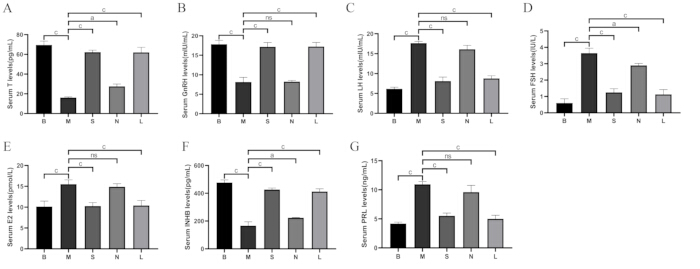
Figura 8: Comparación de los niveles de hormonas séricas entre grupos. (A) Niveles séricos de testosterona (T). (B) Niveles séricos de GnRH. (C) Niveles séricos de LH. (D) Niveles séricos de FSH. (E) Niveles séricos de E2. (F) Niveles séricos de INHB. (G) Niveles séricos de PRL. B: grupo en blanco, M: grupo modelo, S: grupo Shu-Mu Cerebro-Riñón, N: grupo sin punto de acupuntura, L: grupo L-carnitina. Los datos se presentan como media ± desviación estándar (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NsP > 0,05. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En la medicina tradicional china, el "riñón" consiste en el "riñón interno", refiriéndose a las funciones del sistema urinario en la medicina moderna, y el "riñón externo", refiriéndose al eje hipotálamo-hipófisis-gonadal y los órganos reproductores anatómicos externos25. Las vesículas seminales masculinas pertenecen al "riñón externo" y sus componentes incluyen los testículos, los epidídimos, las vesículas seminales, etc.26. La medicina tradicional china considera que la esencia es la base material del cuerpo humano, y la "esencia del riñón" incluye la "esencia prenatal" heredada de los padres y la "esencia postnatal" producida por la transformación del bazo y el estómago de la esencia de agua y grano, que se utiliza para nutrir las cinco vísceras y los seis intestinos. Entre ellas, la esencia prenatal es la sustancia original que constituye el embrión y es el fundamento de la vida; La esencia postnatal enriquece la esencia de las cinco vísceras y los seis intestinos, y la parte restante se almacena en el riñón. Los dos son interdependientes y se combinan estrechamente en el riñón para formar la "esencia del riñón". Si la esencia renal es insuficiente, es decir, si las vesículas seminales no pueden estar llenas, dará lugar a una "oligospermia"; Si la esencia reproductiva puede descargarse normalmente, es decir, si las vesículas seminales pueden ejercer sus funciones de producir, almacenar y descargar espermatozoides, es el resultado de la coordinación mutua de la naturaleza astringente del yin renal y la naturaleza excitatoria del yang renal. Si el yang del riñón es deficiente y débil, la función astringente es excesiva, mientras que la función excitatoria es insuficiente, lo que resulta en esencia fría y "astenospermia". Por lo tanto, las manifestaciones de la oligoastenospermia corresponden a los tipos del síndrome de la MTC de "deficiencia de esencia renal y deficiencia de yang renal". En este experimento, todas las ratas modeladas cumplieron básicamente con las manifestaciones de la oligoastenospermia de tipo deficiencia de riñón yang, y el tratamiento debe centrarse en "tonificar el riñón, ayudar al yang, llenar la esencia y nutrir la médula". La combinación de Epangsanxian, Shenshu, Jingmen y Taixi para el punto de acupuntura Shu-Mu Cerebro-Riñón puede coordinar el yin y el yang y conectar el riñón y el cerebro, logrando en última instancia el propósito del "equilibrio del yin-yang".
La espermatogénesis está regulada por la actividad endocrina del eje HPT, y la regulación del eje HPT depende principalmente de las hormonas relacionadas y los genes receptores expresados en el hipotálamo, la glándula pituitaria y los testículos27, que está dominado principalmente por la liberación pulsátil de GnRH desde el hipotálamo. Esto estimula la hipófisis anterior para secretar LH, FSH y PRL11. Entre ellos, la GnRH es el regulador más crítico del eje HPT, y su nivel puede reflejar indirectamente el estado del eje HPT y la capacidad de los testículos para producir espermatozoides28. La LH media la liberación de T de las células estromales testiculares, y la aparición de espermatozoides depende de la estimulación de la T. Si la secreción de T es insuficiente, el número y la calidad de los espermatozoides disminuirán29. La FSH se une a los receptores en la superficie de las células de Sertoli y actúa junto con la T para promover la proliferación de la espermatogonia y producir INHB para mantener la espermatogénesis30. La INHB, una glicoproteína sintetizada en las células testiculares de Sertoli y en las células germinales, es un importante regulador de la gónada masculina, que puede, a su vez, activar la glándula pituitaria para producir FSH e interactuar con la FSH para regular conjuntamente el eje HPT 31,32,33. Sin embargo, la PRL es un factor importante que afecta la motilidad de los espermatozoides34. Un exceso de PRL puede inhibir la secreción del eje gonadal, inhibiendo así la espermatogénesis35. El E2 es secretado por las gónadas y el cerebro y tiene un efecto de retroalimentación negativa sobre la LH y la FSH36. Los niveles altos de E2 dañarán las células de Sertoli y las células intersticiales testiculares, causarán esteatosis del tejido conectivo circundante y reducirán el diámetro de los túbulos seminíferos masculinos, lo que resultará en un deterioro de la fertilidad de los pacientes37. Se ha encontrado que los niveles séricos de FSH y LH en ratas oligastenospermia inducidas por Tripterygium wilfordii aumentaron significativamente después del modelado. Después de 60 días de tratamiento con Qilin Pill, los niveles de estas dos hormonas disminuyeron significativamente en comparación con el grupo modelo38, lo que fue consistente con los resultados de este estudio. Otros estudios han demostrado que la disfunción del eje HPT ocurre en ratas con síndrome de deficiencia de riñón-yang causada por adenina, y los niveles de secreción de hormonas sexuales relacionados tambiéncambian.
En este estudio, en comparación con el grupo en blanco, las ratas del grupo modelo estaban generalmente en malas condiciones y la calidad del semen disminuyó significativamente (p < 0,001). La tinción con H&E mostró daños graves en el tejido renal y testicular, lo que indica que las ratas moduladas con adenina cumplieron los criterios de oligonastenospermia. En comparación con el grupo modelo, las condiciones anteriores mejoraron significativamente en los grupos Shu-Mu Cerebro-Riñón y L-carnitina (p < 0,05), mientras que la mejora no fue significativa en el grupo sin punto de acupuntura, lo que indica que la calidad del esperma y la morfología y estructura de los órganos mejoraron en los grupos Shu-Mu Cerebro-Riñón y L-carnitina. En comparación con el grupo en blanco, T, GnRH e INHB disminuyeron (p < 0,001) en el grupo modelo, lo que indica que la capacidad de secretar T, GnRH e INHB disminuyó en ratas con oligoastenospermia después de un modelado exitoso. LH, FSH, E2 y PRL aumentaron (p < 0,001), lo que indica que la secreción de LH, FSH, E2 y PRL aumentó después de un modelado exitoso, lo que llevó al debilitamiento de la función espermatogénica testicular. En comparación con el grupo modelo, T, GnRH e INHB aumentaron (p < 0,001), mientras que los niveles de secreción de LH, FSH, E2 y PRL disminuyeron (p < 0,001) en los grupos Shu-Mu Cerebro-Riñón y L-carnitina, pero no se encontraron diferencias significativas en el grupo sin punto de acupuntura. Esto ilustra que tanto la electroacupuntura como la L-carnitina pueden regular los niveles hormonales del eje HPT en ratas y tener un buen efecto en la mejora de la oligonastenospermia en ratas.
La L-carnitina es un antioxidante natural en los mamíferos que puede participar en el metabolismo energético celular y reducir el daño antioxidante de los espermatozoides. Numerosos estudios han demostrado que la L-carnitina puede mejorar significativamente la motilidad, morfología y concentración de los espermatozoides, al tiempo que aumenta el nivel de hormonas relacionadas con el eje HPT41. En este experimento, se utilizó L-carnitina como grupo de control de fármaco positivo para compararlo con el grupo Shu-Mu Cerebro-Riñón. Los datos experimentales no mostraron diferencias significativas en la comparación de varios índices entre los dos grupos, verificando que la electroacupuntura en "Epangsanxian, Shenshu, Jingmen y Taixi" tuvo un buen efecto en las ratas oligoastenospermia. Además, la acupuntura puede coordinar el yin y el yang de las vísceras y mejorar el qi saludable del cuerpo para resistir el qi patógeno, lo que lo hace seguro, eficaz y menos tóxico con menos efectos secundarios. La electroacupuntura puede mejorar el efecto curativo más que la acupuntura ordinaria y proporcionar un tratamiento seguro y eficaz para el tratamiento clínico de la oligoastenospermia. Dado que las ratas en el grupo sin punto de acupuntura no siguieron el principio de selección de puntos a lo largo de los meridianos, varios datos experimentales fueron significativamente diferentes de los del grupo Shu-Mu Cerebro-Riñón, verificando la importancia de la compatibilidad de los cuatro puntos, "Epangsanxian, Shenshu, Jingmen y Taixi".
En resumen, la electroacupuntura en los cuatro puntos, "Epangsanxian, Shenshu, Jingmen y Taixi", puede mejorar la función del eje HPT en ratas al regular el nivel de hormonas relacionadas, mejorando así la calidad del esperma en ratas y, en última instancia, logrando el propósito de tratar la oligoastenospermia. Proporciona otro tratamiento seguro y eficaz para el manejo clínico de la oligonastenospermia.
Sin embargo, debido a la falta de tecnología y fondos, este estudio se limitó al estudio de los niveles de hormonas séricas en el eje HPT, y los métodos de detección fueron limitados. En futuros experimentos, consideraremos el uso de varios medios, como la cromatografía, para verificar aún más los cambios en los niveles hormonales y el uso de la transcriptómica o la metabolómica para realizar más estudios sobre la regulación del eje HPT mediante electroacupuntura a nivel genético y más allá.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue respaldada por el Proyecto Clave de Investigación y Desarrollo de la Región Autónoma de Ningxia Hui (2021BEG02041), evaluación basada en evidencia y estudio clínico sobre la compatibilidad del punto de acupuntura de la terapia de acupuntura que regula el "eje hipotálamo-hipófisis-testicular" en el tratamiento de la disfunción reproductiva masculina, líder del proyecto: Huisheng Ma; Proyecto de Construcción de Disciplina de Primera Clase 2024 (ZY0019110305), Líder del proyecto: Huisheng Ma; Academia China de Ciencias Médicas Chinas (YZ-202128), Líder del proyecto: Huisheng Ma.
Materiales
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
Referencias
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados