Method Article
Meccanismo dell'agopunto cervello-rene Shu-Mu nel trattamento dell'oligoastenospermia nei ratti attraverso l'asse ipotalamo-ipofisi-testicolo
In questo articolo
Riepilogo
Questo studio mira a verificare l'effetto terapeutico dell'agopunto Shu-Mu Brain-Kidney sull'oligoastenospermia nei ratti e ad esplorare il suo meccanismo sottostante attraverso l'asse ipotalamo-ipofisi-testicolare (HPT).
Abstract
L'oligoastenospermia è una causa comune di infertilità maschile. L'asse ipotalamo-ipofisi-testicolare (HPT) regola la differenziazione e la maturazione delle gonadi attraverso la sintesi e il rilascio di ormoni riproduttivi, svolgendo un ruolo vitale nella fertilità maschile. L'interruzione della stabilità dell'asse HPT compromette la produzione di spermatozoi, riducendo la qualità dello sperma. Lo studio dell'effetto dell'elettroagopuntura sulla regolazione dell'asse HPT può fornire informazioni sul trattamento dell'oligoastenospermia. Cinquanta ratti SD maschi di 8 settimane sono stati divisi casualmente in gruppi bianchi, modello, Shu-Mu Brain-Kidney, non-agopoint e L-carnitina (n = 10 per gruppo). Fatta eccezione per il gruppo bianco, i ratti hanno ricevuto adenina per via intragastrica per 28 giorni per stabilire il modello. Dopo la modellazione, il gruppo Shu-Mu Cervello-Rene è stato sottoposto a elettroagopuntura in punti di agopuntura designati, mentre il gruppo senza punti di agopuntura ha ricevuto un trattamento fittizio per 30 minuti al giorno. Il gruppo L-carnitina ha ricevuto L-carnitina (10 ml/kg) per via intragastrica una volta al giorno. I trattamenti sono continuati per 28 giorni. Sono state valutate le condizioni generali, i coefficienti degli organi e la qualità dello sperma. La colorazione HE ha analizzato la morfologia dei tessuti e l'ELISA ha rilevato cambiamenti ormonali sierici. Rispetto al gruppo modello, i gruppi Shu-Mu Brain-Renney e L-carnitina hanno mostrato miglioramenti significativi nello spirito, nella dieta e nei movimenti intestinali, con un aumento del peso corporeo, mentre il gruppo senza agopunti non ha mostrato cambiamenti significativi. I coefficienti degli organi renali sono diminuiti significativamente nei gruppi Shu-Mu Cervello-Rene e L-carnitina, ma sono rimasti invariati nel gruppo senza agopunti. I coefficienti degli organi testicolari non hanno mostrato differenze significative tra i gruppi di trattamento. Il numero di spermatozoi, la densità, la sopravvivenza e i tassi di motilità sono migliorati significativamente nei gruppi Shu-Mu cervello-rene e L-carnitina, ma non nel gruppo senza agopunti. La colorazione H&E ha mostrato un miglioramento del danno ai reni e ai tessuti testicolari nei gruppi Shu-Mu Brain-Kidney e L-carnitina. L'ELISA ha rivelato un aumento di T, GnRH e INHB e una diminuzione dei livelli di LH, FSH, E2 e PRL in questi gruppi (p < 0,001), senza cambiamenti significativi nel gruppo senza agopunti. Questi risultati indicano che la terapia con agopuntura Shu-Mu Brain-Kidney migliora la qualità dello sperma regolando l'asse HPT, offrendo un potenziale trattamento per l'oligoastenospermia.
Introduzione
L'oligoastenospermia, suddivisa in "oligospermia" e "astenospermia", è uno dei tipi più comuni di infertilità maschile, con un tasso di incidenza che rappresenta circa il 75% dei casi di infertilità maschile1. L'oligoastenospermia è caratterizzata principalmente da una diminuzione della densità e della motilità degli spermatozoi nei testicoli e si manifesta principalmente clinicamente come disturbo della spermatogenesi, riduzione del numero di spermatozoi e bassa motilità degli spermatozoi 2,3. Negli ultimi anni, l'incidenza dell'oligoastenosparmia è aumentata di anno in anno4. Senza un trattamento efficace, avrà effetti negativi a lungo termine sulla salute fisica e mentale dei pazienti e persino sull'armonia familiare5. Gli studi hanno dimostrato che i problemi genetici6, i disturbi endocrini riproduttivi7, le infezioni del tratto urogenitale8 e i farmaci chimici9 possono influenzare la produzione e la maturazione degli spermatozoi, portando a un declino della qualità dello sperma. Attualmente, migliorare la qualità degli spermatozoi danneggiati è diventato un problema impegnativo in campo medico.
L'asse ipotalamo-ipofisi-testicolo (HPT) è la principale via di regolazione riproduttiva nel corpo, che può regolare la differenziazione e la maturazione delle gonadi stimolando la sintesi e il rilascio di ormoni riproduttivi correlati all'ipotalamo, alla ghiandola pituitaria e ai testicoli e svolge un ruolo importante nel mantenimento della normale funzione riproduttiva maschile10. Se la stabilità della funzione dell'asse HPT viene interrotta, la secrezione testicolare sarà insufficiente a raggiungere la concentrazione fisiologica di testosterone, con conseguente diminuzione del numero e della qualità degli spermatozoi nel testicolo11. Pertanto, il trattamento dell'oligoastenospermia mira principalmente a regolare la funzione dell'asse HPT e raggiungere lo scopo di mantenere l'equilibrio degli ormoni endocrini correlati, aumentando così il numero di spermatozoi nello sperma, migliorando l'attività degli spermatozoi e migliorando la qualità dello sperma.
Nel trattamento clinico dell'oligoastenospermia, la medicina moderna adotta principalmente metodi come la chirurgia e i farmaci anti-ossidazione e migliorano la motilità degli spermatozoi12,13, mentre la terapia di elettroagopuntura combina l'agopuntura tradizionale cinese e la moderna bioelettricità medica. Ha i vantaggi di essere veloce e preciso, di avere un evidente effetto curativo, di avere poche reazioni avverse, un'ampia gamma di malattie adatte e un basso costo di trattamento e di avere un buon effetto di trattamento sull'oligoastenospermia14,15. "La schiena è yang e l'addome è yin". La combinazione di agopunti Shu-Mu combina i punti Shu con i punti Mu, uno nella parte anteriore e uno nella parte posteriore, uno yin e uno yang, lavorando insieme, noto anche come metodo di combinazione di punti di agopuntura anteriore-posteriore. La medicina tradizionale cinese (MTC) crede che il rene sia la radice dell'essenza prenatale e che la malattia si trovi nel rene. Il punto Front-mu del rene, Jingmen (GB25), e il punto Back-shu, Shenshu (BL23), sono selezionati, il che ha l'effetto di riscaldare il rene, assistere yang e cercare yang all'interno di yin16,17; il rene immagazzina l'essenza e governa la produzione di midollo, il cervello è il mare di midollo e il luogo di incontro di tutto lo yang, e Taixi (KI3) è il punto di origine del meridiano del rene Shaoyin del piede, che può regolare e tonificare il fegato e il rene, nutrire lo yin e generare il midollo18. Combinato con Epangsanxian (MS4), collega il rene e il cervello, riflettendo l'idea della "combinazione di agopunture Shu-Mu cervello-rene" in MTC19, e l'effetto terapeutico è più evidente di quello dell'agopuntura ordinaria.
Gli attuali studi di trattamento sulla qualità dello sperma si concentrano principalmente sul miglioramento della struttura e della funzione testicolare, mentre sono state condotte ricerche limitate sulla regolazione dei livelli sierici di ormoni in diversi tessuti dell'asse ipotalamo-ipofisi-testicolo (HPT)20. Nella ricerca preliminare, il sequenziamento dell'RNA (RNA-Seq) è stato utilizzato per identificare i geni candidati e le vie regolatorie coinvolte nella regolazione della qualità dello sperma all'interno dei tessuti ipotalamo, ipofisari e testicolari di ratti sani e ratti modello di oligozoospermia indotta da adenina21. Inoltre, in entrambi i gruppi sono stati eseguiti test di qualità dello sperma e analisi istologica dei tessuti testicolari. Questi risultati hanno fornito informazioni sui meccanismi molecolari alla base della qualità dello sperma nei ratti oligoastenosparmia indotta da adenina. La terapia di elettroagopuntura con agopuntura approssimale a distanza potrebbe migliorare la qualità dello sperma nei ratti oligoastenosparmia regolando l'asse HPT e l'effetto è correlato al processo di stress ossidativo22. Tuttavia, non è noto se l'agopunto Shu-Mu cervello-rene possa migliorare la qualità dello sperma dei ratti regolando l'asse HPT. Per esplorare ulteriormente il meccanismo regolatorio del miglioramento della qualità dello sperma nei ratti oligoastenosparmia e i metodi di trattamento efficaci, questo studio ha utilizzato un modello di ratti indotti da adenina di oligoastenospermia e ha selezionato quattro agopunti, Epangsanxian, Shenshu, Jingmen e Taixi, per esplorare il meccanismo correlato dell'effetto terapeutico dell'agopunto cervello-rene Shu-Mu sull'oligoastenospermia nei ratti dal punto di vista dell'asse HPT, fornendo una base più scientifica per il trattamento clinico.
Protocollo
Tutti gli esperimenti sugli animali sono stati esaminati e approvati dal Comitato etico animale della Ningxia Medical University (numero di approvazione: IACUC-NYLAC-2021-130). Lo studio è stato condotto in stretta conformità con le linee guida ARRIVE 2.0 per gli esperimenti sugli animali e ha aderito ai principi di benessere animale descritti nella Guida NIH per la cura e l'uso degli animali da laboratorio. Questo studio randomizzato controllato su animali ha utilizzato un'analisi unidirezionale della varianza ed è stato condotto presso l'Animal Experiment Center della Ningxia Medical University da marzo a maggio 2023. Per questo studio sono stati utilizzati ratti SD maschi di grado SPF di otto settimane del peso di 180-220 g. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Definizione del modello animale e procedure di trattamento
- Animali da esperimento e gruppi
- Procurati cinquanta ratti SD maschi di grado SPF di 8 settimane del peso di 180-220 g.
- Ospita tutti i ratti in condizioni standard, mantenendo una temperatura ambiente di 22-25 °C, un'umidità del 50%-60% e fornendo libero accesso al mangime e all'acqua standard per roditori.
- Dopo una settimana di adattamento, dividere casualmente i ratti in un gruppo bianco (B) (n = 10) e un gruppo di modellazione (n = 40) utilizzando un metodo della tabella dei numeri casuali. Somministrare soluzione fisiologica normale al gruppo bianco e adenina al gruppo modellante mediante gavagage orale.
- Dopo 28 giorni, dividere casualmente il gruppo di modellazione in un gruppo modello (M), un gruppo Shu-Mu cervello-rene (S), un gruppo non agopunto (N) e un gruppo L-carnitina (L) (n = 10 per gruppo). Lasciare il gruppo di modelli non trattato.
- Applicare l'intervento di elettroagopuntura utilizzando il metodo di corrispondenza dei punti di agopuntura Shu-Mu cervello-rene al gruppo Shu-Mu cervello-rene. Somministrare un trattamento senza agopunti al gruppo senza agopunti e L-carnitina liquida orale mediante sonda gastrica al gruppo L-carnitina. Trattare tutti i gruppi ininterrottamente per 28 giorni.
- Costruzione del modello
NOTA: Gli studi hanno dimostrato che alte dosi di adenina possono influenzare la funzione testicolare nei ratti, portando a una secrezione anomala di ormoni sessuali, all'interruzione della stabilità funzionale dell'asse HPT e a un declino della qualità dello sperma23. Pertanto, l'adenina è comunemente usata per stabilire modelli di infertilità animale maschile.- Somministrare soluzione fisiologica normale (1 ml/100 g di peso corporeo) al gruppo bianco e adenina (20 mg/100 g di peso corporeo) al gruppo modello mediante sonda gastrica orale (Figura 1A).
- Garantire un'agitazione continua durante la sonda gastrica per prevenire la precipitazione dell'adenina e il blocco dell'ago della sonda gastrica. Somministrare il trattamento una volta al giorno per 28 giorni.
- 1.3 Procedura di trattamento
- Gruppo Shu-Mu cervello-rene
- Iniziare l'intervento il primo giorno dopo la modellazione. Eseguire l'agopuntura con aghi per agopuntura sterili monouso su punti bilaterali. Dopo aver fissato il ratto, esporre e disinfettare il sito di agopuntura.
- Fissare la pelle del sito di agopuntura con la mano sinistra e perforare rapidamente il punto di agopuntura con l'ago per agopuntura sterile monouso nella mano destra. Collegare uno stimolatore elettrico. Applicare onde dilatative con una frequenza di elettroagopuntura di 2 Hz, un'intensità di stimolazione di 1,5 mA e un leggero tremore del muscolo locale.
- Eseguire il trattamento di elettroagopuntura per 30 minuti ogni volta, una volta al giorno, per 28 giorni consecutivi (Figura 1B).
NOTA: Selezionare i punti di agopuntura nei ratti con riferimento a Yong Tang's Experimental Acupuncture and Moxibustion Science, Appendice II, "Punti di agopuntura comunemente usati negli animali da esperimento", combinato con un metodo di selezione anatomica comparativadei punti 19. Sono stati selezionati i seguenti punti: (1) Epangsanxian (MS4): situato 3 mm sotto e 4 mm fuori dal punto Touwei. Operazione: Puntura 1-2 mm diritta; (2) Shenshu (BL23): Situato nell'area della colonna vertebrale, su entrambi i lati del processo spinoso inferiore della seconda vertebra lombare, 6 mm accanto alla linea dorsale mediana. Operazione: Puntura 6 mm diritta; (3) Jingmen (GB25): Situato sulla vita laterale, all'estremità libera della 13a costola sul lato inferiore. Operazione: Puntura 1-2 mm diritta; (4) Taixi (KI3): Situato sul lato interno del piede, nella depressione tra il punto più alto della caviglia mediale e il bordo posteriore del tendine d'Achille. Operazione: Bucherellare 3 mm dritto.
- Gruppo non agopuntico
- Seleziona e utilizza i non-agopunti 1, 2 e 3 allo stesso modo del gruppo Cervello-Rene Shu-Mu (Figura 1B).
NOTA: Poiché i non-agopunti non seguono il principio della selezione dei punti lungo i meridiani, e secondo la teoria della Medicina Tradizionale Cinese (MTC) e l'osservazione clinica a lungo termine, questi tre agopunti hanno scarso effetto terapeutico sui pazienti con oligoastenozoospermia24. (1) Non agopunto 1: situato nel punto medio della linea tra la punta del gomito e l'ascella sul lato interno del gomito. Operazione: Puntura 1-2 mm diritta; (2) Non agopunto 2: Situato nel punto medio tra l'epicondilo mediale dell'omero e il polso dell'ulna, sul margine ulnare. Operazione: Puntura 1-2 mm diritta; (3) Non agopunto 3: situato all'intersezione tra il muscolo deltoide anteriore e il muscolo bicipite sul braccio interno. Operazione: Bucherellare 1-2 mm dritto.
- Seleziona e utilizza i non-agopunti 1, 2 e 3 allo stesso modo del gruppo Cervello-Rene Shu-Mu (Figura 1B).
- Gruppo L-carnitina
- Somministrare levocarnitina liquida orale mediante sonda gastrica orale alla dose di 10 ml/kg di peso corporeo, una volta al giorno, per 28 giorni consecutivi (Figura 1A).
- Gruppo Shu-Mu cervello-rene
- Eutanasia
- Dopo il trattamento, lasciare che tutti i ratti digiunino per 24 ore, anestetizzarli mediante iniezione intraperitoneale di pentobarbital sodico al 2% (40 mg/kg di peso corporeo, seguendo protocolli istituzionalmente approvati) e raccogliere il sangue dall'apice del cuore utilizzando un ago monouso per la raccolta del sangue endovenoso21,24.
- Dopo la morte per decapitazione, rimuovere un lato dell'epididimo per misurare la qualità dello sperma. Raccogliere i tessuti renali e testicolari, pesarli e registrarli e fissarli nel fissativo paraformaldeide a temperatura ambiente per 48 ore prima di incorporarli nella paraffina24.
2. Indici di osservazione
- Osservazione generale: osservare lo stato mentale, la dieta e i movimenti intestinali dei ratti e monitorare quotidianamente il loro peso corporeo.
- Coefficienti d'organo: Dopo la morte, rimuovere con cura il grasso superficiale e il tessuto connettivo sia dai reni che dai tessuti testicolari, sciacquare con soluzione fisiologica, asciugare con carta da filtro, pesare su una bilancia e registrare le misurazioni per il calcolo dei coefficienti d'organo. Coefficiente d'organo (%) = (peso d'organo [g] / peso corporeo [g]) x 100%.
- Qualità dello sperma
- Dopo aver rimosso il grasso in eccesso, rimuovere e porre un lato dell'epididimo da ciascun ratto in un bagnomaria a temperatura costante a 37 °C per 5 minuti. Quindi, tagliare, filtrare, soffiare delicatamente e mescolare bene il campione.
- Prelevare un'aliquota di 10 μl della sospensione di spermatozoi diluita e farla cadere sul bordo del vetro di copertura di una piastra di conteggio preriscaldata, consentendo alla sospensione di spermatozoi di permeare automaticamente nella camera di conteggio.
- Misurare il numero di spermatozoi, la densità, il tasso di sopravvivenza e il tasso di motilità utilizzando un sistema CASA (computer-assisted semenanalysis)21.
- Colorazione con ematossilina ed eosina (H&E)
NOTA: Per i dettagli sulla procedura, fare riferimento a Yang, N. et al.21.- Sciacquare i fazzoletti fissati con acqua corrente, disidratarli e incorporarli.
- Tagliare le sezioni di paraffina (5 μm di spessore) con un microtomo e cuocere a 65 °C per 4 ore.
- Decerare le sezioni e reidratarle con acqua.
- Macchiare le sezioni con una soluzione colorante di ematossilina per 3 minuti, quindi risciacquare con acqua corrente.
- Disidratare le sezioni con etanolo al 95% per 1 minuto, quindi colorare con soluzione di eosina per 2 minuti.
- Dopo aver sigillato i vetrini, eseguire la scansione utilizzando uno scanner per vetrini e raccogliere e analizzare le immagini.
- Saggio di immunoassorbimento enzimatico (ELISA)
NOTA: Per i dettagli sulla procedura, fare riferimento a Yang, N. et al.21.- Per preparare il siero, aggiungere le sostanze standard e il siero delle concentrazioni corrispondenti ai pozzetti della sostanza standard e ai pozzetti del campione da misurare, quindi aggiungere il reagente marcato con l'enzima.
- Eseguire le fasi di incubazione, lavaggio, sviluppo del colore e terminazione.
- Determinare l'assorbanza a una lunghezza d'onda di 450 nm utilizzando uno strumento marcato con un enzima e calcolare i livelli di espressione del testosterone (T), dell'ormone di rilascio delle gonadotropine (GnRH), dell'inibina B (INHB), dell'ormone luteinizzante (LH), dell'ormone follicolo-stimolante (FSH), dell'estradiolo (E2) e della prolattina (PRL).
3. Analisi statistica
- Analizzare i dati sperimentali utilizzando software statistici e presentare i risultati di ciascun gruppo come media ± deviazione standard (media ± SD).
- Utilizzare l'ANOVA unidirezionale per confrontare le medie campionarie tra più gruppi che soddisfano le ipotesi di normalità e omogeneità della varianza.
- Utilizzare il test t per i confronti tra due gruppi e i test non parametrici per i dati che non soddisfano le ipotesi di cui sopra.
- Considera le differenze statisticamente significative quando p < 0,05.
Risultati
Valutazione del modello
Dopo la modellazione, osservare i ratti per letargia, postura accovacciata, arti freddi, riluttanza a mangiare, perdita di peso, aumento del volume delle urine, feci molli e altri sintomi, che generalmente si allineano con la sindrome della carenza di rene-yang.
Dopo la dissezione, osserva che i reni sono duri, bianchi e più pesanti. La colorazione H&E rivela che i tessuti renali e testicolari dei ratti modello sono gravemente danneggiati, con forme glomerulari irregolari, infiammazione interstiziale del tubulo renale e un gran numero di cellule epiteliali in degenerazione e persino fibrosi. I tubuli più seminiferi nei testicoli sono atrofizzati e deformati, con cellule spermatogeniche disordinate o addirittura assenti (Figura 2), indicando il successo dell'instaurazione del modello.
Condizioni generali dei ratti
Nel gruppo bianco, i ratti mostravano buon umore, reazioni sensibili, capelli lucidi e alimentazione e defecazione normali. Dopo la dissezione, i loro reni apparivano bruno-rossastri e morbidi. Nel gruppo modello, i ratti mostravano letargia, schiene accovacciate, corpi freddi, perdita di appetito, perdita di peso (p < 0,001), aumento della minzione e feci molli. Dopo la dissezione, i loro reni erano duri ed è stato osservato un aspetto di "grande rene bianco" (Figura 2A). Rispetto al gruppo modello, i sintomi di cui sopra sono migliorati significativamente nel gruppo Shu-Mu cervello-rene, non sono migliorati significativamente nel gruppo senza agopunti e sono anche migliorati significativamente nel gruppo L-carnitina. Il confronto della massa corporea tra i gruppi è mostrato nella Figura 3.
Coefficienti degli organi renali e testicolari
Come mostrato nella Figura 4, rispetto al gruppo bianco, i coefficienti degli organi renali dei ratti nel gruppo modello sono aumentati significativamente (p < 0,01), mentre non è stata riscontrata alcuna differenza significativa nei coefficienti degli organi testicolari bilaterali (p > 0,05), indicando che la qualità di entrambi i testicoli è diminuita dopo la modellazione. Rispetto al gruppo modello, i coefficienti degli organi renali nei gruppi Shu-Mu Cervello-Rene e L-carnitina sono diminuiti significativamente (p < 0,05), ma non è stata riscontrata alcuna differenza significativa nel gruppo non agopunto (p > 0,05). Non è stata riscontrata alcuna differenza significativa nei coefficienti degli organi testicolari bilaterali tra i gruppi Shu-Mu cervello-rene, L-carnitina e non agopunti rispetto al gruppo modello (p > 0,05), indicando che la massa testicolare bilaterale è aumentata nei gruppi Shu-Mu cervello-rene e L-carnitina, mentre non è stato osservato alcun cambiamento significativo nel gruppo non agopunto.
Analisi della qualità dello sperma
Come mostrato nella Figura 5, rispetto al gruppo bianco, il numero di spermatozoi, la densità, il tasso di sopravvivenza e il tasso di motilità sono diminuiti significativamente nel gruppo modello (p < 0,001). Rispetto al gruppo modello, la conta degli spermatozoi, la densità degli spermatozoi, il tasso di sopravvivenza e il tasso di motilità sono aumentati significativamente nei gruppi Shu-Mu Cervello-Rene e L-carnitina (p < 0,001), ma non è stata riscontrata alcuna differenza significativa nel gruppo senza agopunti.
Cambiamenti morfologici nel rene
Come mostrato nella Figura 6, il tessuto renale dei ratti nel gruppo bianco aveva una struttura completa e una forma normale. I glomeruli erano rotondi e pieni, strettamente legati alle capsule renali, e i tubuli renali erano regolari e ben disposti. Rispetto al gruppo bianco, il gruppo modello presentava grave danno del tessuto renale, morfologia glomerulare irregolare, atrofia, riduzione, grave infiammazione interstiziale del tubulo renale, degenerazione di numerose cellule epiteliali e grave fibrosi. Rispetto al gruppo modello, il grado di danno tissutale renale è migliorato significativamente nei gruppi Shu-Mu Brain-Rene e L-carnitina, con forme glomerulari più regolari, leggera separazione dalle capsule renali, denaturazione di alcune cellule epiteliali tubulari e lieve infiltrazione e fibrosi delle cellule interstiziali dei tubuli renali. Rispetto al gruppo modello, il grado di danno tissutale renale era meno evidente nel gruppo senza agopunti, con forme glomerulari più regolari, separazione dalle capsule renali, maggiore denaturazione e disordine delle cellule epiteliali tubulari renali, moderata infiltrazione di cellule infiammatorie attorno ai glomeruli e nell'interstizio del tubulo renale e più fibrosi.
Modificazioni morfologiche dei testicoli
Come mostrato nella Figura 7, i testicoli dei ratti nel gruppo bianco avevano una struttura tissutale completa, una morfologia normale, tubuli seminiferi ordinati e cellule spermatogeniche regolari. Rispetto al gruppo bianco, il danno al tessuto testicolare era grave nel gruppo modello, con maggiore atrofia e deformazione dei tubuli seminiferi e cellule spermatogeniche disordinate o addirittura assenti. Rispetto al gruppo modello, il grado di danno tissutale testicolare è migliorato significativamente nei gruppi Shu-Mu Cervello-Rene e L-carnitina, con la maggior parte dei tubuli seminiferi disposti ordinatamente e le cellule spermatogeniche disposte regolarmente. Rispetto al gruppo modello, il grado di danno tissutale testicolare non si è ridotto significativamente nel gruppo senza agopunti, con alcuni tubuli seminiferi che mostravano atrofia e deformazione, necrosi cellulare, vacuoli e cellule spermatogeniche disordinate e assenti.
Confronto dei livelli sierici di ormoni
Come mostrato nella Figura 8, rispetto al gruppo bianco, i livelli di testosterone (T), ormone di rilascio delle gonadotropine (GnRH) e inibina B (INHB) nel siero sono diminuiti nel gruppo modello (p < 0,001), mentre l'ormone luteinizzante (LH), l'ormone follicolo-stimolante (FSH), l'estradiolo (E2) e la prolattina (PRL) sono aumentati (p < 0,001). Rispetto al gruppo modello, T, GnRH e INHB sono aumentati nei gruppi Shu-Mu Brain-Kidney e L-carnitina (p < 0,001), mentre i livelli di LH, FSH, E2 e PRL sono diminuiti (p < 0,001), ma non è stata trovata alcuna differenza significativa nel gruppo senza agopunti.
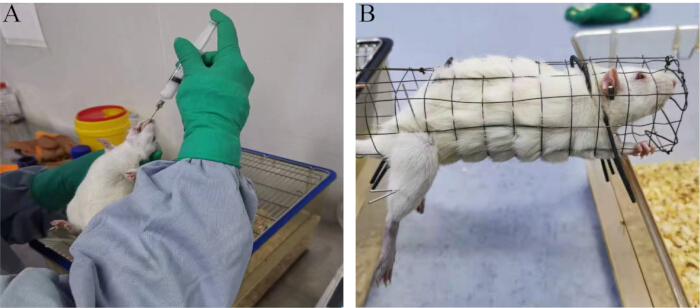
Figura 1: Metodi sperimentali. (A) Procedura di gavage orale. (B) Metodo di trattamento che prevede l'elettroagopuntura. Clicca qui per visualizzare una versione più grande di questa figura.
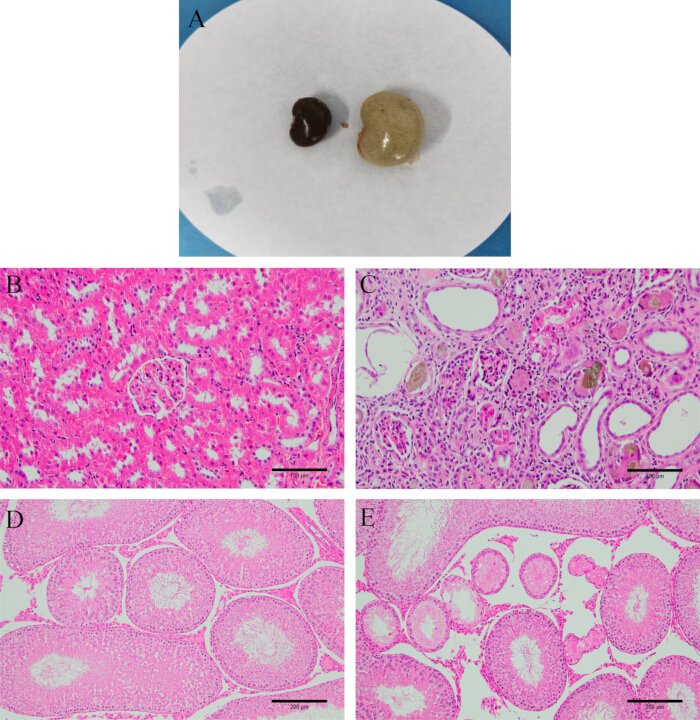
Figura 2: Verifica del modello. (A) Aspetto del rene prima e dopo la modellazione. (B) Tessuto renale normale. (C) Tessuto renale dopo la modellazione (colorazione HE, 200x, barra della scala: 100 μm). (D) Tessuto testicolare normale. (E) Tessuto testicolare dopo la modellazione (colorazione HE, 100x, barra della scala: 200 μm). Clicca qui per visualizzare una versione più grande di questa figura.
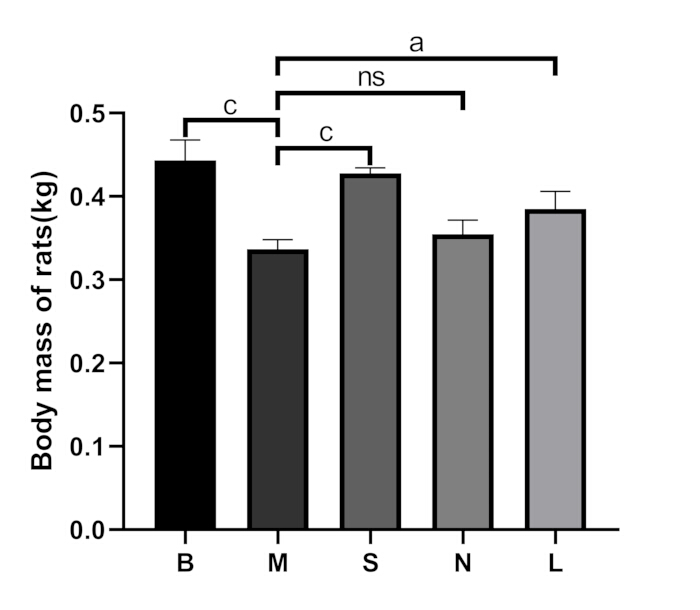
Figura 3: Confronto della massa corporea tra i gruppi. B: gruppo vuoto, M: gruppo modello, S: gruppo cervello-rene Shu-Mu, N: gruppo non agopunto, L: gruppo L-carnitina. I dati sono presentati come media ± deviazione standard (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NSP > 0,05. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Confronto dei coefficienti degli organi renali e testicolari tra i gruppi. (A) Coefficienti degli organi renali sinistri. (B) Coefficienti dell'organo renale destro. (C) Coefficienti degli organi testicolari sinistri. (D) Coefficienti degli organi testicolari destri. B: gruppo vuoto, M: gruppo modello, S: gruppo cervello-rene Shu-Mu, N: gruppo non agopunto, L: gruppo L-carnitina. Coefficiente d'organo (%) = peso d'organo (g) / peso corporeo (g) × 100%. I dati sono presentati come media ± deviazione standard (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NSP > 0,05. Clicca qui per visualizzare una versione più grande di questa figura.
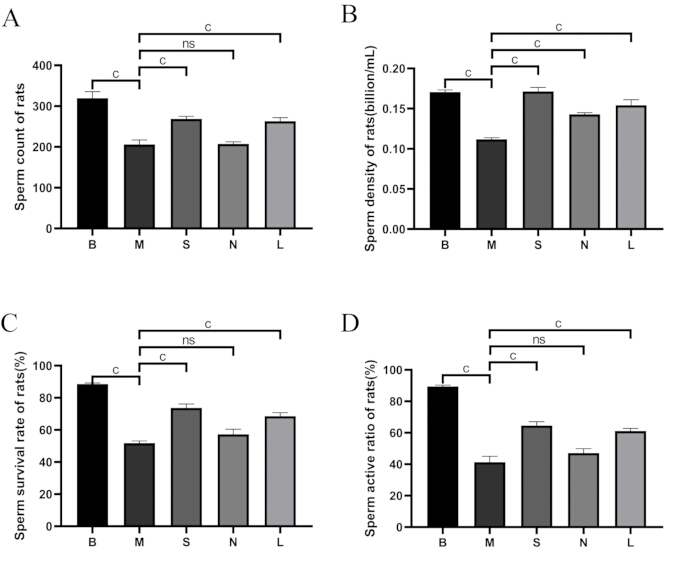
Figura 5: Confronto della qualità degli spermatozoi tra i gruppi. (A) Conta degli spermatozoi. (B) Densità degli spermatozoi. (C) Tasso di sopravvivenza degli spermatozoi. (D) Rapporto di attività degli spermatozoi. B: gruppo vuoto, M: gruppo modello, S: gruppo cervello-rene Shu-Mu, N: gruppo non agopunto, L: gruppo L-carnitina. Tasso di sopravvivenza degli spermatozoi (%) = numero di spermatozoi mobili / numero totale di spermatozoi × 100%. I dati sono presentati come media ± deviazione standard (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NSP > 0,05. Clicca qui per visualizzare una versione più grande di questa figura.
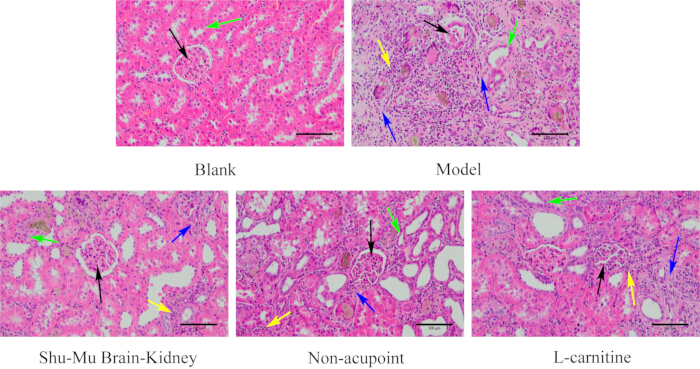
Figura 6: Cambiamenti morfologici nel rene in ciascun gruppo. (colorazione HE, 200×, barra della scala: 100 μm). Le frecce nere indicano i glomeruli, le frecce verdi indicano i tubuli renali, le frecce gialle indicano le cellule infiammatorie e le frecce blu indicano la fibrosi. Clicca qui per visualizzare una versione più grande di questa figura.
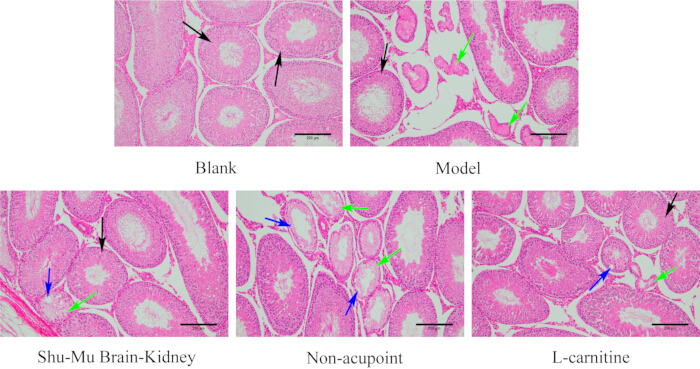
Figura 7: Cambiamenti morfologici nei testicoli in ciascun gruppo. (Colorazione HE, 100×, barra graduata: 200 μm). Le frecce nere indicano i normali tubuli seminiferi, le frecce verdi indicano la necrosi e le frecce blu indicano i vacuoli. Clicca qui per visualizzare una versione più grande di questa figura.
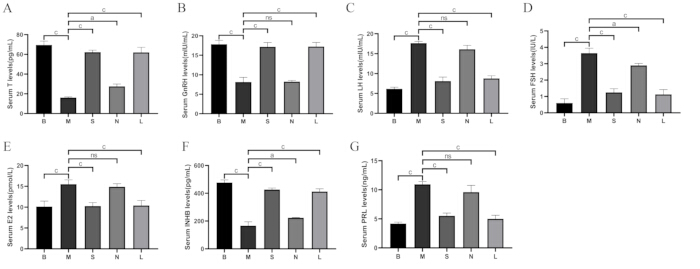
Figura 8: Confronto dei livelli sierici di ormone tra i gruppi. (A) Livelli sierici di testosterone (T). (B) Livelli sierici di GnRH. (C) Livelli sierici di LH. (D) Livelli sierici di FSH. (E) Livelli sierici di E2. (F) Livelli sierici di INHB. (G) Livelli sierici di PRL. B: gruppo vuoto, M: gruppo modello, S: gruppo cervello-rene Shu-Mu, N: gruppo non agopunto, L: gruppo L-carnitina. I dati sono presentati come media ± deviazione standard (n = 3). AP < 0,05, BP < 0,01, CP < 0,001, NSP > 0,05. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Nella MTC, il "rene" è costituito dal "rene interno", che si riferisce alle funzioni del sistema urinario nella medicina moderna, e dal "rene esterno", che si riferisce all'asse ipotalamo-ipofisi-gonadi e agli organi riproduttivi esterni anatomici25. Le vescicole seminali maschili appartengono al "rene esterno" e i loro componenti includono i testicoli, gli epididimi, le vescicole seminali, ecc.26. La MTC considera l'essenza come la base materiale del corpo umano, e l'"essenza dei reni" include l'"essenza prenatale" ereditata dai genitori e l'"essenza postnatale" prodotta dalla trasformazione della milza e dello stomaco dell'acqua e dell'essenza di grano, che viene utilizzata per nutrire i cinque visceri e le sei viscere. Tra queste, l'essenza prenatale è la sostanza originaria che costituisce l'embrione ed è il fondamento della vita; L'essenza postnatale arricchisce l'essenza dei cinque visceri e dei sei intestini e la parte rimanente viene immagazzinata nel rene. I due sono interdipendenti e strettamente combinati nel rene per formare "l'essenza del rene". Se l'essenza renale è insufficiente, cioè se le vescicole seminali non possono essere piene, porterà a "oligospermia"; Se l'essenza riproduttiva può essere normalmente scaricata, cioè se le vescicole seminali possono esercitare le loro funzioni di produzione, conservazione e scarico dello sperma, è il risultato della coordinazione reciproca della natura astringente del rene Yin e della natura eccitatoria del rene Yang. Se lo yang del rene è carente e debole, la funzione astringente è eccessiva, mentre la funzione eccitatoria è insufficiente, con conseguente essenza fredda e "astenospermia". Pertanto, le manifestazioni dell'oligoastenospermia corrispondono ai tipi di sindrome MTC di "carenza di essenza renale e carenza di yang renale". In questo esperimento, tutti i ratti modellati hanno sostanzialmente soddisfatto le manifestazioni dell'oligoastenospermia di tipo da deficit di rene-yang e il trattamento dovrebbe concentrarsi su "tonificare il rene, assistere lo yang, riempire l'essenza e nutrire il midollo". La combinazione di Epangsanxian, Shenshu, Jingmen e Taixi per l'agopunto cervello-rene Shu-Mu può coordinare yin e yang e collegare il rene e il cervello, raggiungendo in definitiva lo scopo di "equilibrio yin-yang".
La spermatogenesi è regolata dall'attività endocrina dell'asse HPT e la regolazione dell'asse HPT dipende principalmente dagli ormoni correlati e dai geni recettoriali espressi nell'ipotalamo, nella ghiandola pituitaria e nei testicoli27, che è principalmente dominato dal rilascio pulsatile di GnRH dall'ipotalamo. Questo stimola l'ipofisi anteriore a secernere LH, FSH e PRL11. Tra questi, il GnRH è il regolatore più critico dell'asse HPT e il suo livello può riflettere indirettamente lo stato dell'asse HPT e la capacità dei testicoli di produrre spermatozoi28. L'LH media il rilascio di T dalle cellule stromali testicolari e la presenza di spermatozoi dipende dalla stimolazione del T. Se la secrezione di T è insufficiente, il numero e la qualità degli spermatozoi diminuirannodi 29. L'FSH si lega ai recettori sulla superficie delle cellule del Sertoli e agisce insieme al T per promuovere la proliferazione degli spermatogoni e produrre INHB per mantenere la spermatogenesi30. L'INHB, una glicoproteina sintetizzata nelle cellule di Sertoli testicolari e nelle cellule germinali, è un importante regolatore della gonade maschile, che può, a sua volta, attivare la ghiandola pituitaria per produrre FSH e interagire con l'FSH per regolare congiuntamente l'asse HPT 31,32,33. Tuttavia, la PRL è un fattore importante che influenza la motilità degli spermatozoi34. Un PRL eccessivo può inibire la secrezione dell'asse gonadico, inibendo così la spermatogenesi35. L'E2 è secreto dalle gonadi e dal cervello e ha un effetto di feedback negativo su LH e FSH36. Alti livelli di E2 danneggiano le cellule di Sertoli e le cellule interstiziali testicolari, causano la steatosi del tessuto connettivo circostante e riducono il diametro dei tubuli seminiferi maschili, con conseguente compromissione della fertilità dei pazienti37. È stato riscontrato che i livelli sierici di FSH e LH nei ratti oligastenospermia indotti da Tripterygium wilfordii erano significativamente aumentati dopo il modellamento. Dopo 60 giorni di trattamento con la pillola Qilin, i livelli di questi due ormoni sono diminuiti significativamente rispetto al gruppo modello38, il che era coerente con i risultati di questo studio. Altri studi hanno dimostrato che la disfunzione dell'asse HPT si verifica nei ratti con sindrome da deficit di rene-yang causata dall'adenina e che anche i livelli di secrezione di ormoni sessuali correlati cambiano39.
In questo studio, rispetto al gruppo bianco, i ratti del gruppo modello erano generalmente in cattive condizioni e la qualità dello sperma era significativamente diminuita (p < 0,001). La colorazione H&E ha mostrato gravi danni al tessuto renale e testicolare, indicando che i ratti modulati con adenina soddisfacevano i criteri per l'oligonasthenospermia. Rispetto al gruppo modello, le condizioni di cui sopra sono migliorate significativamente nei gruppi Shu-Mu Brain-Rene e L-carnitina (p < 0,05), mentre il miglioramento non è stato significativo nel gruppo senza agopunti, indicando che la qualità dello sperma e la morfologia e la struttura degli organi sono migliorate nei gruppi Shu-Mu Brain-Rene e L-carnitina. Rispetto al gruppo bianco, T, GnRH e INHB sono diminuiti (p < 0,001) nel gruppo modello, indicando che la capacità di secernere T, GnRH e INHB è diminuita nei ratti oligoastenospermici dopo il successo della modellazione. LH, FSH, E2 e PRL sono aumentati (p < 0,001), indicando che la secrezione di LH, FSH, E2 e PRL è aumentata dopo il successo della modellazione, portando all'indebolimento della funzione spermatogenica testicolare. Rispetto al gruppo modello, T, GnRH e INHB sono aumentati (p < 0,001), mentre i livelli di secrezione di LH, FSH, E2 e PRL sono diminuiti (p < 0,001) nei gruppi Shu-Mu Brain-Kidney e L-carnitina, ma non è stata riscontrata alcuna differenza significativa nel gruppo senza agopunti. Ciò dimostra che sia l'elettroagopuntura che la L-carnitina possono regolare i livelli ormonali dell'asse HPT nei ratti e avere un buon effetto sul miglioramento dell'oligonasthenospermia nei ratti.
La L-carnitina è un antiossidante naturale nei mammiferi che può partecipare al metabolismo energetico cellulare e ridurre il danno antiossidante degli spermatozoi40. Numerosi studi hanno dimostrato che la L-carnitina può migliorare significativamente la motilità, la morfologia e la concentrazione degli spermatozoi, aumentando al contempo il livello di ormoni correlati all'asse HPT41. In questo esperimento, la L-carnitina è stata utilizzata come gruppo di controllo positivo al farmaco per il confronto con il gruppo Shu-Mu cervello-rene. I dati sperimentali non hanno mostrato differenze significative nel confronto dei vari indici tra i due gruppi, verificando che l'elettroagopuntura a "Epangsanxian, Shenshu, Jingmen e Taixi" ha avuto un buon effetto sui ratti oligoastenospermia. Inoltre, l'agopuntura può coordinare lo yin e lo yang dei visceri e migliorare il qi sano del corpo per resistere al qi patogeno, rendendolo sicuro, efficace e meno tossico con meno effetti collaterali. L'elettroagopuntura può migliorare l'effetto curativo più dell'agopuntura ordinaria e fornire un trattamento sicuro ed efficace per la gestione clinica dell'oligoastenospermia. Poiché i ratti del gruppo non agopunto non seguivano il principio della selezione dei punti lungo i meridiani, vari dati sperimentali erano significativamente diversi da quelli del gruppo Shu-Mu Cervello-Rene, verificando l'importanza della compatibilità dei quattro punti, "Epangsanxian, Shenshu, Jingmen e Taixi".
In sintesi, l'elettroagopuntura nei quattro punti, "Epangsanxian, Shenshu, Jingmen e Taixi", può migliorare la funzione dell'asse HPT nei ratti regolando il livello di ormoni correlati, migliorando così la qualità dello sperma nei ratti e, in ultima analisi, raggiungendo lo scopo del trattamento dell'oligoastenospermia. Fornisce un altro trattamento sicuro ed efficace per la gestione clinica dell'oligonasthenospermia.
Tuttavia, a causa della mancanza di tecnologia e fondi, questo studio è stato limitato allo studio dei livelli sierici di ormone sull'asse HPT e i metodi di rilevamento erano limitati. Negli esperimenti futuri, prenderemo in considerazione l'utilizzo di vari mezzi, come la cromatografia, per verificare ulteriormente i cambiamenti nei livelli ormonali e utilizzeremo la trascrittomica o la metabolomica per condurre ulteriori studi sulla regolazione dell'asse HPT mediante elettroagopuntura a livello genico e oltre.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata supportata dal Progetto chiave di ricerca e sviluppo della regione autonoma di Ningxia Hui (2021BEG02041), valutazione basata sull'evidenza e studio clinico sulla compatibilità dei punti di agopuntura della terapia di agopuntura che regola l'"asse ipotalamo-ipofisi-testicolare" nel trattamento della disfunzione riproduttiva maschile, Responsabile del progetto: Huisheng Ma; 2024 Progetto di costruzione disciplinare di prima classe (ZY0019110305), capo progetto: Huisheng Ma; Accademia cinese delle scienze mediche cinesi (YZ-202128), Responsabile del progetto: Huisheng Ma.
Materiali
| Name | Company | Catalog Number | Comments |
| Adenine | Beijing Solarbio Science & Technology Co. Ltd. | A8330 | |
| CASA computer-assisted semen analysis system | Nanning Songjing Tianlun Biotechnology Co., Ltd. | VICOS-SPERM | |
| Centrifuge | Sartorius | A-14C | |
| Differentiation fluid | Shanghai Biyuntian Biotechnology Co., Ltd | C0163M | |
| Disposable sterile acupuncture needles | Hanyi brand | 0.25mm*13mm | |
| Drying machine | Leica | HI1220 | |
| Electrical stimulator | Hua Tuo Brand | SDZ-II | |
| Electronic balance | Hangzhou Youheng Weighing Equipment Co., Ltd | HLD-6002 | |
| ELISA kit | Shanghai Jianglai Biotechnology Co. LTD | JL13251?JL11473?JL11525?JL12505?JL13256?JL12201 | |
| Enzyme-labeled instrument | Rayto | RT-6100 | |
| Eosin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4024 | |
| Hematoxylin staining solution | Zhuhai Beso Biotechnology Co. LTD | BA-4041 | |
| Levocarnitine oral liquid | Northeast Pharmaceutical Group Shenyang First Pharmaceutical Co. LTD. | H19990372 | |
| Microtome | Leica | RM2255 | |
| Neutral balsam | Beijing Zhongshan Jinqiao Biotechnology Co., Ltd | Zli-9555 | |
| Paraffin embedding machine | Leica | HistoCore Arcadia H | |
| SD rat, 8-week-old, Male, 180-220 g | 144 Animal Center of Ningxia Medical University | ||
| Slide scanner | Leica | Aperio LV1 | |
| Vortex oscillator | Haimen Qilin Bell Instrument Manufacturing Co., Ltd | QL-902 |
Riferimenti
- Punab, M., et al. Causes of male infertility: A 9-year prospective monocentre study on 1737 patients with reduced total sperm counts. Hum Reprod. 32 (1), 18-31 (2017).
- Nordkap, L., Joensen, U. N., Blomberg Jensen, M., Jørgensen, N. Regional differences and temporal trends in male reproductive health disorders: Semen quality may be a sensitive marker of environmental exposures. Mol Cell Endocrinol. 355 (2), 221-230 (2012).
- Daneshmandpour, Y., et al. MicroRNAs association with azoospermia, oligospermia, asthenozoospermia, and teratozoospermia: A systematic review. J Assist Reprod Genet. 37 (4), 763-775 (2020).
- Cipriani, S., et al. Trend of change of sperm count and concentration over the last two decades: A systematic review and meta-regression analysis. Andrology. 11 (6), 997-1008 (2023).
- Agarwal, A., et al. Male infertility. Lancet. 397 (10271), 319-333 (2021).
- Jensen, C. F. S., Fode, M., Østergren, P. B., Sønksen, J. A refined view on the association between y-chromosome microdeletions and sperm concentration. Eur Urol. 76 (5), 637-638 (2019).
- Pivonello, R., et al. Metabolic disorders and male hypogonadotropic hypogonadism. Front Endocrinol (Lausanne). 10, 345(2019).
- Guiton, R., Drevet, J. R. Viruses, bacteria and parasites: Infection of the male genital tract and fertility. Basic Clin Androl. 33 (1), 19(2023).
- Beeder, L. A., Samplaski, M. K. Effect of antidepressant medications on semen parameters and male fertility. Int J Urol. 27 (1), 39-46 (2020).
- Babalola, A. A., et al. Attenuation of doxorubicin-induced hypothalamic-pituitary-testicular axis dysfunction by diphenyl diselenide involves suppression of hormonal deficits, oxido-inflammatory stress and caspase 3 activity in rats. J Trace Elem Med Biol. 79, 127254(2023).
- Yang, Y., et al. Nickel chloride induces spermatogenesis disorder by testicular damage and hypothalamic-pituitary-testis axis disruption in mice. Ecotoxicol Environ Saf. 225, 112718(2021).
- Alahmar, A. T., Naemi, R. Predictors of pregnancy and time to pregnancy in infertile men with idiopathic oligoasthenospermia pre- and post-coenzyme q10 therapy. Andrologia. 54 (5), e14385(2022).
- Seiler, F., Kneissl, P., Hamann, C., Jünemann, K. P., Osmonov, D. Laparoscopic varicocelectomy in male infertility: Improvement of seminal parameters and effects on spermatogenesis. Wien Klin Wochenschr. 134 (1-2), 51-55 (2022).
- Cui, T. W., et al. Effect of electroacupuncture on spermatogenesis in rats with oligozoospermia of insufficiency of shen (kidney) essence syndrome. Chin J Integr Med. 25 (4), 292-297 (2019).
- Wang, Z., et al. Efficacy and safety of nonpharmacological strategies for the treatment of oligoasthenospermia: A systematic review and bayesian network meta-analysis. Eur J Med Res. 28 (1), 6(2023).
- Chuang, H. -N., et al. Effect of injecting adipose stem cells combined with platelet-rich fibrin released at Shenshu acupoint (BL23) on acute kidney injury in rabbits. Front Pharmacol. , 16(2025).
- Fu, C., et al. Acupuncture improves peri-menopausal insomnia: A randomized controlled trial. Sleep. 40 (11), (2017).
- Li, C. R., et al. Effects of acupuncture at taixi acupoint (ki3) on kidney proteome. Am J Chin Med. 39 (4), 687-692 (2011).
- Ma, L. Acupuncture treatment of kidney deficiency and essence deficiency based on the theory of kidney storing essence' clinical study of oligoasthenospermia. , (2023).
- Sheng, W., Xu, W., Hu, H., Xiao, D., He, Q. Effects of tortoise-shell glue on rat oligoasthenospermia model. Chin Med J (Engl). 135 (6), 732-734 (2022).
- Yang, N., et al. Transcriptomic analysis of the HPT axis in a model of oligoasthenozoospermia induced by adenine in rats. Exp Mol Pathol. 141, 104948(2025).
- Hongyu, L., et al. Assessment of electroacupuncture therapy with distant-approximal acupoints based on the HPT axis in rats with oligoasthenospermia through transcriptomic analysis. Reprod Sci. , (2025).
- Adachi, Y., et al. Influence of adenine-induced chronic renal failure on testicular function in the rat. Andrologia. 30 (2), 115-118 (1998).
- Zhao, Z., et al. Regulatory mechanism of electroacupuncture on hypothalamic-pituitary-testicular axis in oligospermic rats. Chin J Tissue Eng Res. 29 (26), 5563-5571 (2025).
- Chen, Y., Han, Z., Sun, Z., Huang, F. Analysis of male reproduction based on the "inner kidney and outer kidney" theory advanced by nation-famous Chinese medicine Professor XU Fu-song. Nat J Androl. 30 (02), 163-166 (2024).
- Ma, D., et al. Biological basis of premature ejaculation based on Theory of "Brain-heart-kidney-semen Chamber" Axis. Ch J Exp Tradit Med Formul. 30 (10), 203-209 (2024).
- Qi, L., et al. Toxic effects of ketamine on reproductive system via disrupting hypothalamic-pituitary-testicular axis. Eur Rev Med Pharmacol Sci. 21 (8), 1967-1973 (2017).
- Ryan, G. E., et al. Androgen receptor positively regulates gonadotropin-releasing hormone receptor in pituitary gonadotropes. Mol Cell Endocrinol. 530, 111286(2021).
- Jasuja, R., et al. Modulation of circulating free testosterone fraction by testosterone, dihydrotestosterone, and estradiol during testosterone replacement therapy. Andrology. 13 (3), 439-436 (2024).
- Dimmick, H., Kumar, T. R. Follicle-stimulating hormone. Trends Endocrinol Metab. 35 (9), 848-849 (2024).
- Negri, F., et al. The importance of discordant follicle stimulating hormone and inhibin b levels in primary infertile men: Findings from a cross-sectional study. World J Mens Health. 43 (1), 134-141 (2025).
- Li, J., et al. Development of a nomogram to predict fertilisation rate of infertile males with borderline semen by using semen parameters combined with AMH and INHB. Andrologia. 53 (9), e14182(2021).
- Liu, L., et al. Relationship between semen parameters, serum INHB, and insl-3 levels, and the degree of varicocele. Clinics (Sao Paulo). 79, 100339(2024).
- Akhigbe, R. E., Hamed, M. A., Odetayo, A. F. Haart and anti-koch's impair sexual competence, sperm quality, and offspring quality when used singly and in combination in male Wistar rats. Andrologia. 53 (2), e13951(2021).
- Liu, Y., Wang, G., Zhang, F., Dai, L. Correlation between serum levels of reproductive hormones and testicular spermatogenic function in men with azoospermia. Andrologia. 54 (10), e14182(2022).
- Russell, N., Grossmann, M. Mechanisms in endocrinology: Estradiol as a male hormone. Eur J Endocrinol. 181 (1), R23-R43 (2019).
- Leavy, M., et al. Effects of elevated β-estradiol levels on the functional morphology of the testis - new insights. Sci Rep. 7, 39931(2017).
- Jiao, W., et al. Improvement of qilin pills on male reproductive function in tripterygium glycoside-induced oligoasthenospermia in rats. Andrologia. 53 (4), e13923(2021).
- Zeng, Y., et al. Effects of Haima Duobian pill in a rat model of kidney yang deficiency syndrome. Evid Based Complement Alternat Med. 2021, 6696234(2021).
- Kooshesh, L., Nateghian, Z., Aliabadi, E. Evaluation of l-carnitine potential in improvement of male fertility. J Reprod Infertil. 24 (2), 69-84 (2023).
- Ma, L., Sun, Y. Comparison of l-carnitine vs. Coq10 and vitamin E for idiopathic male infertility: A randomized controlled trial. Eur Rev Med Pharmacol Sci. 26 (13), 4698-4704 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon