Method Article
CRISPR-Cas9を介したゼブラフィッシュハートの正確なノックイン編集
要約
このプロトコルは、CRISPR-Cas9技術を使用してゼブラフィッシュ胚の正確なノックイン編集を容易にするアプローチを説明しています。表現型パイプラインは、QT延長症候群関連遺伝子変異をモデル化するためのこれらの技術の適用可能性を実証するために提示される。
要約
動物モデルにおけるクラスター化された規則的に間隔を空けた短い回文反復(CRISPR)は、生理学的現象の研究のための正確な遺伝子操作を可能にします。ゼブラフィッシュは、遺伝性疾患、発生、および毒物学に関連する多くの質問を臓器および生物レベルで研究するための効果的な遺伝子モデルとして使用されてきました。よく注釈されマッピングされたゼブラフィッシュゲノムのために、遺伝子編集のための多数のツールが開発されてきた。ただし、CRISPRを使用して正確なノックイン編集を生成することの有効性と検出の容易さは制限要因です。ここでは、心臓の再分極に関与し、電気障害であるQT延長症候群(LQTS)に関連する遺伝子の正確な編集を簡単に検出するCRISPR-Cas9ベースのノックインアプローチについて説明します。この2つのシングルガイドRNA(sgRNA)アプローチは、標的配列を切除して置換し、遺伝的にコードされたレポーター遺伝子を結合します。このアプローチの有用性は、野生型および遺伝子編集ゼブラフィッシュ幼虫における心臓電気機能の非侵襲的表現型測定を記述することによって実証される。このアプローチにより、生物全体の疾患関連変異の効率的な研究が可能になります。さらに、この戦略は、レポーター遺伝子、オルソログ、遺伝子エディターなどの選択した外因性配列を挿入する可能性を提供します。
概要
動物モデルにおけるCRISPRベースの遺伝子編集戦略により、遺伝性疾患、発生、および毒物学を生物全体レベルで研究することができます1,2,3。ゼブラフィッシュは、マウスやヒト由来の細胞モデルよりも多くの生理学的側面でヒトに近い強力なモデルを提供します4。ゼブラフィッシュでは、フォワード5とリバースの両方の遺伝子スクリーニング6に、さまざまな遺伝的ツールと戦略が使用されてきました。ゼブラフィッシュの包括的な遺伝子マッピングとアノテーションは、標的遺伝子ノックアウト(KO)と精密ノックイン(KI)を設計するための主要な技術として、遺伝子編集アプローチを促進しました7。
それにもかかわらず、ゼブラフィッシュで正確なKI編集を生成することは、効率が低く、正確な検出が難しいために制限されています。転写因子様エフェクターヌクレアーゼ(TALEN)はKI8にうまく使用され最適化されていますが、CRISPRはより単純なsgRNAターゲティングで改善された遺伝子編集戦略を提供します。多くの研究がCRISPRを使用してゼブラフィッシュ9,10,11,12,13,14,15,16,17,18,19,20で正確なKIを生成していますが、CRISPRを介した相同性指向修復(HDR)によって生成されたこれらの編集は非効率的であり、本質的な成功率が低い傾向があります。一次スクリーニングとしてジェノタイピングを必要とする率9、10、14、21。これは、ゼブラフィッシュにおける効率的なKI CRISPRシステムと、正確な編集を検出するための信頼性の高いハイスループットシステムの必要性を示しています。
この研究の目的は、ゼブラフィッシュの心臓で正確な心臓遺伝子KIを生成するためのプラットフォームを記述し、成功した編集を簡単かつハイスループットに検出することでした。TALENアプローチ8に基づくCRISPR-Cas9ベースの2sgRNAエクソン置換アプローチが記載されている。このアプローチでは、2つのsgRNAガイドを使用して標的配列を切除し、目的のKIと遺伝的にコードされたイントロニックレポーター遺伝子を含む外因性のテンプレート配列で置き換えます(図1)。標的遺伝子のイントロニック配列内に遺伝的にコードされた蛍光レポーターを統合することで、ポジティブ編集の効率的な検出が可能になります。次に、ゼブラフィッシュ幼虫の心臓電気機能を評価するための表現型プラットフォームが説明され、遺伝性LQTS(個人を心臓突然死にかかりやすくする心臓電気障害)に関連する遺伝子変異の非侵襲的特徴付けが行われます。
これらのアプローチは、遺伝性疾患をモデル化し、遺伝子発現パターンのマッピングや発生制御などの生物学的および生理学的問題に対処するためのゼブラフィッシュKI遺伝子編集へのアクセスと使用を強化します。ゼブラフィッシュの心臓は、マウスモデルよりもヒトの心臓電気生理学的特性とよく平行しているので、心臓病モデリングのための遺伝的に扱いやすいシステムとして特に魅力的かもしれません7、22、23。
プロトコル
ゼブラフィッシュを用いた研究は、サイモンフレーザー大学動物管理委員会およびカナダ動物飼育評議会の方針および手順に同意して実施され、プロトコル#1264K-18の下で完了した。
1. 精密編集のためのCRISPRコンポーネントの設計
- KIターゲット部位を含む配列を切除するために使用される2sgRNAガイドを設計するには、まず目的の遺伝子のゼブラフィッシュオルソログを特定します。
注: 図 2は、2 sgRNA CRISPR-Cas9アプローチを使用して正確な編集を設計する手順の概要を示しています。 - 次に、CRISPOR24などの設計ソフトウェアツールを使用して、種としての ダニオレリオ と使用するCas酵素の選択を含めます。
注:この研究の関心のある遺伝子は zkcnh6a (アンサンブル転写ID:ENSDART00000090809.6;UniProtタンパク質ID:B3DJX4)、および標的変異はアミノ酸R56Qであった。- 2 sgRNAアプローチでは、ターゲットエクソンに先行する1つのsgRNA位置と、すぐ下流のイントロン内に位置する2番目のsgRNAを選択します。
- 選択したsgRNAの特異性が高く、予測されるオフターゲット結合が低いことを確認してください。CRISPOR ランキングを使用して、オフターゲットバインディングを最小限に抑えたガイドを特定します。潜在的なオフターゲットのシードシーケンスに不一致のないガイドは考慮しないでください。
- ステップ6.1.3でPCRベースのサンガーシーケンシングジェノタイピングの最も可能性の高いオフターゲット部位を特定します(CRISPORスコアに基づいて、オフターゲット部位の上位3つのエクソン候補を選択します)。
- 2つのsgRNAを選択したら、使用するオリゴヌクレオチド(変異に先行する2つの相補的オリゴと下流にある2つの相補的オリゴ)があるように、それぞれの逆相補体を取得します。
- 4つのオリゴのそれぞれに、選択したガイドプラスミドに組み込むための互換性のある制限部位を追加します。DR274プラスミドに組み込むには、5'BsaI制限部位を使用してオーバーハングを作成します。DR274プラスミドのガイドの正しい配向を確保するために、Bsa1認識部位がCRISPORから選択されたガイドの5'末端に、Bsa1認識部位が相補鎖の5'末端に設計されていることを確認してください( 図3を参照)。
- ゼブラフィッシュのHDRに使用される外因性テンプレートを設計するには(図1)、pKHR5プラスミドに収容されたmVenus YFPレポーター遺伝子に隣接する2つの配列断片を選択します。
注: 意図した変更/編集は、アップストリームまたはダウンストリームフラグメントに含めることができます。- Ensemblを使用して、テンプレートの作成に使用される約2 kbの隣接配列(相同性アーム)を含む、目的の遺伝子配列内のターゲット部位を見つけます。
注:相同性アームは、標的部位の上流および下流で、対称または非対称の25,26およびそれぞれ約1kbであり得る。 - テンプレートを、mVenus YFPレポーター遺伝子の両側に挿入される2つのセグメントに分割します( 図4を参照)。コーディングシーケンスが中断されないように、分割サイトがイントロンにあることを確認してください。
注:遺伝子の特性が十分に評価されている場合は、スプライシング部位や調節領域など、イントロンの機能的役割を確認します。5'末端または3'末端に近い領域は、mRNAスプライシングに関与することが多い。 - Cas酵素の再切断を防ぐために、i)ガイドプロトスペーサー隣接モチーフ(PAM)またはシード配列(Cas酵素が標的とする可能性のある代替PAM部位に注意してください)のサイレント変異を含む修飾をテンプレート配列に組み込みます。ii)利息の変更。iii)mVenus YFPレポーター遺伝子を含むpKHR5プラスミドへのクローニングを容易にするための制限エンドヌクレアーゼ部位の作成( 図3を参照)。
注:この研究では、最初のテンプレートセグメントにはR56Q変異部位の上流にXhoIが含まれ、下流にSalIが含まれ、2番目のテンプレートセグメントにはガイドターゲット配列の上流にEcoRIがあり、下流にBamHIが含まれていました。選択された制限部位のいずれかがテンプレート配列内に存在する場合、これらをサイレンシングするための突然変異が必要になるか、またはギブソンアセンブリなどの代替アプローチを使用できます。
- Ensemblを使用して、テンプレートの作成に使用される約2 kbの隣接配列(相同性アーム)を含む、目的の遺伝子配列内のターゲット部位を見つけます。
2. 胚マイクロインジェクションのためのCRISPR成分の調製
- マイクロインジェクションの1週間前にマイクロインジェクション用のCas9を準備します。Cas9タンパク質を使用するか、in vitro転写を介してCas9 mRNAを調製します。
注:この研究では、効率が高くなる傾向があったため、Cas9 mRNAを使用しました。- 市販のXL1 Blue細菌寒天スタブ(Cas9プラスミドを含む)の細菌培養物を、アンピシリンなどの適切な抗生物質を使用して増幅します。675 μLの液体培養液(325 μLのグリセロールを含む)を使用して、-80°Cで長期保存するためのバックアップグリセロールストックを作成します。
- 残りの液体培養液は、ミニプレップキットに付属のプロトコルに従って、ミニプレップ精製に使用します。最終精製DNAを付属の溶出バッファー50 μLに再懸濁します。分光光度計 で 生成物を定量し、収率と純度を調べます。
- 適切な制限酵素を使用し、目的の酵素にリストされている適切なバッファーとインキュベーション時間を使用して、制限酵素 を介して 2 μgの精製DNAを直線化します。
- PCR精製キットを使用して直鎖状プラスミドを精製し、付属の溶出バッファー30 μLに再懸濁します。
- 生成物を定量した後、目的のプロモーターに適した転写キットを使用して、これをin vitro転写のテンプレートとして使用します。提供されたプロトコルに従い、塩化リチウム沈殿27を介して精製します。精製したRNAを10 μLのヌクレアーゼフリーH2Oに再懸濁し、マイクロインジェクションミックスで使用するために-20°Cで保存する前に定量します。
- 2つのsgRNAガイドを準備します。
- アンピシリンの代わりにカナマイシンを使用する以外は、上記のMLM3613と同じ方法(ステップ2.1.1)で市販のXL1 Blue細菌寒天スタブ(詳細は 材料表 を参照)から細菌培養物を増幅することにより、足場でsgRNAプラスミドを調製します。
- 上記で設計したsgRNAガイド用の2対の相補的一本鎖オリゴヌクレオチド(ssODN)を、最初にssODNを1xアニーリングバッファーに100 μMの濃度まで再懸濁することにより、アニールします。
- 2つのsgRNAのそれぞれについて別々の反応において、サーマルサイクラーを用いて相補的なssODNのペアをアニールする。各相補的ssODNペア2 μgを50 μLのアニーリングバッファーと混合し、95°Cで2分間インキュベートした後、45分間かけて25°Cに冷却します。
- gRNAスキャフォールドを含む市販のプラスミドを消化する。1 μLのBsaI、2 μLの適切なバッファー、およびddH2Oを20 μLに使用して、37°Cで1時間、1時間、DR274プラスミドを消化します。ゲル電気泳動28を使用して線形化(オプション:PCR精製キットを使用して精製)を確認します。
- 2つの別々のライゲーション反応(各sgRNAに1つずつ)で、アニーリングしたssODNを直鎖状化したDR274プラスミドとライゲーションします。3:1のモルインサート:ベクター比を使用し、オンラインライゲーション計算機を介して適切な質量を計算します。必要量のインサートおよびベクターを1 μLのT4 DNAリガーゼ、2 μLのライゲーションバッファー、およびddH2Oと12 μLに混合し、室温で12時間インキュベートします。
- ライゲーションされた2 μLのライゲーション製品を標準的なアプローチを使用して適切なコンピテントセル(10β細胞など)に変換し、市販のMiniprepキットを使用して製品を増幅および精製します。オプション:この製品のグリセロールストックを作成します。
- 空間配列の終端にできるだけ近い3'下流の制限部位を使用して、各ガイドの2 μgを線形化することにより、2つのsgRNAを転写します。DR274プラスミドの場合は、HindIIIで直鎖化してから、PCR精製キットを使用してRNAテンプレートを精製し、30 μLの溶出バッファーに再懸濁します。
- RNA転写キットを使用して2つのガイドを転写します。メーカーのプロトコルに従い、塩化リチウム沈殿27を介して精製します。2つの精製sgRNAガイドを10 μLのヌクレアーゼフリーH2Oに再懸濁し、定量して-20°Cで保存し、マイクロインジェクションミックスに使用します。
注:RNA転写キットには、5フィートキャップまたはポリAテールを組み込むことはできません。
- 二本鎖の外因性 HDR レポーターテンプレートを準備します。
注:テンプレートは、mVenus YFPレポーター遺伝子の上流と下流の2つの部分で合成されます。これらの2つのセグメントは、商業プロバイダーを通じて注文され、pKHR5(mVenus YFPを含む)プラスミドに順次ライゲーションされた合成コンストラクトです。- 上記のMLM3613と同様の方法で市販のDH5α細菌株(詳細は 材料表 を参照)から細菌培養物を増幅することにより、pKHR5プラスミドを調製する(ステップ2.1.1)。
注:pKHR5プラスミドには、mVenus YFPレポーター遺伝子配列が含まれています。 - 上記で設計した 2 つのテンプレートセグメントを TE バッファー中で 100 μM まで再懸濁し、10β 細胞に変換します。
- ステップ1.3.3で選択した制限酵素を使用して、最初のテンプレートセグメント(mVenus YFPレポーター遺伝子の上流のもの)とpKHR5プラスミドを消化します。
注:MCS内の選択された制限部位が近接しているため、pKHR5の順次ダイジェストが必要です。 - 上流の鋳型セグメント用のpKHR5プラスミドを調製するには、4 μgのpKHR5をSalIで消化し(ステップ2.2.4に従って)、PCR精製キットを使用して精製します。30 μLのddH 2 Oに再懸濁し、これをXhoIとの2回目の消化反応のテンプレートとして使用します。PCR精製キットを使用して製品を精製します。
- 2 μgのテンプレートセグメント(ステップ2.3.2)、1 μLのXhoI、1 μLのSalI、2 μLの適切なバッファー、およびddH2Oを20 μLに37°Cで1時間消化し、生成物をゲル精製することにより、最初のテンプレートセグメントを調製します。
- ステップ2.2.5に記載の反応条件を使用して、ステップ2.3.5の上流のテンプレートセグメントを調製したpKHR5にリゲートします。ライゲーションされた製品を有能な10β細胞に変換し、増幅し、ミニプレップを使用して精製します(オプション:この製品のグリセロールストックを作成します)。
- ステップ2.3.6のライゲーション産物(mVenus YFPレポーター遺伝子の上流のpKHR5プラスミドにライゲーションされた最初のテンプレートセグメントを含む)を使用し、消化して2番目(mVenusレポーターの下流)のテンプレートセグメントを準備します。ライゲーション産物4 μg(ステップ2.2.4と同様にステップ2.3.6から)をBamHIで消化し、PCR精製キットを使用して精製します。30 μLのddH 2 Oに再懸濁し、これをEcoRIによる2回目の消化反応のテンプレートとして使用します。PCR精製キットを使用して製品を精製します。
- 2 μgのテンプレートセグメント(ステップ2.3.2)、1 μLのBamHI、1 μLのEcoRI、2 μLの適切なバッファー、およびddH 2 Oを20 μLに37°Cで1時間消化し、生成物をゲル精製することにより、2番目のテンプレートセグメントを調製します。
- ステップ2.2.5に記載の反応条件を使用して、下流のテンプレートセグメントを調製したpKHR5(ステップ2.3.7から)にリゲートします。ライゲーションされた製品をコンピテントセルに変換し、増幅し、ミニプレップキットを使用して精製します。pKHR5内のmVenus YFPレポーター遺伝子の両側にライゲーションされた両方のテンプレートセグメントを含む、この最終製品のグリセロールストックを作成します。
- 上記のMLM3613と同様の方法で市販のDH5α細菌株(詳細は 材料表 を参照)から細菌培養物を増幅することにより、pKHR5プラスミドを調製する(ステップ2.1.1)。
- Cas9 mRNA、2つのsgRNA、および外因性HDRレポーターテンプレートを使用してマイクロインジェクションミックスを調製します。
- 200 ng/μLのCas9 mRNA、100 ng/μLの各sgRNA、および200 ng/μLの外因性HDRレポーターテンプレートを1xインジェクションバッファーに混合し、最終容量20 μLにします。
- マイクロインジェクションミックスを-20°Cで保存し、3回の凍結融解サイクル後に未使用のミックスを廃棄します。
注:各胚の卵黄嚢へのマイクロインジェクションには、このマイクロインジェクションミックスの4 nLを使用します。
3.ゼブラフィッシュの繁殖と胚のマイクロインジェクション
注:ゼブラフィッシュの繁殖と単一細胞胚のマイクロインジェクションのプロトコルは、以前に説明されています29,30,31。
- 繁殖には、生後6〜12ヶ月のAB株のゼブラフィッシュを使用してください。受精後約40分で1細胞期の胚を注入します( 図5を参照)。
注:注入された胚の生物学的性別は不明でした。性的二形性は、生後約3か月の32歳まで明らかではありません。
4. CRISPR-Cas9編集仔魚のレポーター遺伝子スクリーニング
- CRISPR-Cas9成分のマイクロインジェクション後のゼブラフィッシュ幼虫におけるYFP統合を視覚化して、HDR編集の成功をスクリーニングします。
- 25 mmのペトリ皿で、受精後3日目(dpf)に24匹のゼブラフィッシュの幼虫を0.3%トリカインメタンスルホン酸塩(MS-222、HEPESと水酸化ナトリウムでpH 7.0〜7.4に緩衝)で麻酔をかけ、自己直立反射を失うまで麻酔をかけます(通常は1〜2分)。麻酔をかけたら、各幼虫を24ウェルプレートの個々のウェルに移します。
- GFP/YFPを検出できる顕微鏡を用いて、個々の幼虫の眼におけるレポーター遺伝子蛍光をスクリーニングする。
- 各幼虫の画像をキャプチャし、レポーター遺伝子発現の有無を文書化します。
5. CRISPR-Cas9編集仔魚の表現型決定
- レポーター遺伝子スクリーニングに続いて、各幼虫で心臓表現型(心拍数、心膜寸法、ECG)を実行します。表現型は同数のレポーター遺伝子陽性および陰性幼虫である。
- CCDカメラ(ブラックフライUSB3など)とビデオおよび画像記録ソフトウェア(ImageJのマイクロマネージャーなど)を使用して、幼虫が麻酔をかけられている間、心拍数と心膜の寸法を測定します。
- 心拍数を測定するには、マイクロマネージャーを使用して、心臓をキャプチャし、他の構造を除外するように関心領域(ROI)を作成します。
- ビデオを画像シーケンスとして ImageJ にインポートし、[画像数] に正しいフレーム数が入力されていることを確認します。
- ファイルを開いたら、長方形選択ツールを使用して、他の移動要素を除外してハート内にROIを描画し、ROIマネージャーにROIを保存します(|ツールを分析します|ROIマネージャー)。
- インストール|プラグインをクリックし、心拍数アルゴリズムを選択してデフォルトフォルダにコードをインストールし、[プラグイン]タブの下部にあるプラグインを選択します。ポップアップウィンドウから毎分ビート(bpm)を録音します。
注:画像検出アルゴリズムは、心室収縮期収縮に関連する個々のピクセル密度の変化を測定することにより、心拍数を検出するようにカスタム作成されました。コードは https://github.com/dpoburko/zFish_HR にあります。
- ImageJなどの無料ツールを使用して心膜の寸法を測定し、心膜嚢と片方の目の周りのROIを自由に描画します。ImageJで画像を開き、 ポリゴン選択 ツールを使用して、最初に心膜嚢の周りにROIを描画し、手順5.1.2と同様に ROIマネージャー に保存し、目に対して繰り返します。 ROI 管理r でこれら 2 つの ROI を選択し、[ 測定] をクリックします。それぞれの面積を記録して、後で各幼虫の眼の面積に正規化された心膜嚢の面積を計算します。
- 心拍数と心膜の測定に続いて、個々の幼虫からのECGを記録します。
注:ゼブラフィッシュECGを記録するためのプロトコルは、以前に説明されています33、34、35、36。
6. CRISPR-Cas9で編集したゼブラフィッシュ仔魚のジェノタイピング
- 表現型解析に続いて、オンターゲットおよび潜在的なオフターゲットジェノタイピングを実施して、正確で正確なHDR遺伝子編集を確認します。
- 0.3%MS-222とテールクリップで各3 dpf幼虫を麻酔し、HOTShot法37を使用してgDNAを単離します。切除した各テールクリップを15 μLの25 mM NaOH中で95°Cで20分間インキュベートします。その後、1.5 μLのTris-HClで中和し、13,800 x g で30秒間遠心分離します。抽出されたgDNAを含む上清を保持します。
- E3培地で幼虫を回収し、さらなる開発または研究が意図されている場合は、それらを住宅システムに戻します。
- 抽出したgDNAを鋳型として使用して、オンターゲットおよび潜在的なオフターゲット部位のPCRベースのサンガーシーケンシングを実行します。
注:オプション:ネストされたPCRアプローチは、一部の遺伝子領域に有益な場合があります。 - オンターゲットプライマーデザインが変異部位と最も近いsgRNA結合部位を捕捉していることを確認します。挿入された相同性アームと標的遺伝子からの移行を検出するための別のシーケンシングプライマーを設計し、目的の遺伝子への組み込みを確認する。ステップ1.2.3で特定された上位3つの潜在的なオフターゲット部位を配列決定するプライマーを設計します。
メモ: ガイド設計ソフトウェアプログラムでは、使用するプライマーが提案されることがよくありますが、最適な結果を得るにはカスタマイズが必要になる場合があります。 - オンターゲットおよびオフターゲットのジェノタイピング、心拍数、心膜寸法、ECG表現型、および各ゼブラフィッシュで識別可能なレポーター遺伝子データをコンパイルします。
結果
この2sgRNAエクソン置換CRISPRアプローチの使用の成功は、ゼブラフィッシュの zkcnh6a 遺伝子におけるLQTS関連変異体R56Qを改変するための正確な編集の導入と簡単な検出によって強調されています。 図6 は、上記のようなCRISPR成分を1細胞胚期に注入した代表的な3dpf幼虫を示す。 図6A は、鋳型統合に成功した陽性レポーターとしての眼レンズにおけるYFP mVenusレポーター遺伝子発現の存在を示す。 図6B、C は、野生型およびレポーター遺伝子陽性魚のテールクリップサンプルから単離されたゲノムDNAから得られたサンガーシーケンシングクロマトグラムをそれぞれ示す。レポーター遺伝子陽性の魚は、R56Q変異体を zkcnh6aに導入する正確な編集GからAを持っていることがわかりました。ジェノタイピングは、YFPレポーター遺伝子発現と正確なR56Q遺伝子編集の存在との間に100%の相関関係を示し、この蛍光スクリーニングツールを検証しました。
遺伝子編集ゼブラフィッシュ幼生の表現型は3dpfで行った。図7は、野生型およびR56Q遺伝子編集幼虫からの代表的な結果を示す。心拍数は、上記のようにビデオキャプチャによって検出した。眼面積の比としての心膜寸法の測定の一例が示されている(図7A)。図7Bは、正規化された心膜寸法に対する心拍数をプロットし、ゼブラフィッシュ8,38,39,40における心臓再分極の障害に関連する心膜浮腫の増加を伴う徐脈の傾向を強調している。図7Cは、3dpf幼虫からのECG記録の代表例を示す。標準間隔(QT、QRS)は、平均化されたECG信号から測定した。

図1:ゼブラフィッシュゲノムへのHDRテンプレートの統合。 ダークグレー、相同性アーム;緑色のsgRNAガイドターゲットは、Cas9の再切断を防ぐためのサイレント突然変異を備えています。ライトグレー、目的のターゲットエクソン;赤い線、点突然変異。黄色、αクリスタリンプロモーター下のmVenus YFPレポーター遺伝子;破線は相同性を示す。ここで、標的精密編集は、 zkcnh6a 遺伝子のエクソン2におけるR56Qであった。略語:HDR =相同性指向修復;sgRNA = シングルガイドRNA;YFP = 黄色蛍光タンパク質;DSB =二本鎖ブレーク;WT =野生型。 この図の拡大版を表示するには、ここをクリックしてください。

図2:two-sgRNA CRISPR-Cas9アプローチを使用してゼブラフィッシュ遺伝子の正確な編集を設計するステップの要約(関連するプロトコルステップ番号は括弧内に示されています)。 略語:sgRNA =シングルガイドRNA;YFP = 黄色蛍光タンパク質;gDNA = ゲノムDNA;心電図=心電図;dpf =受精後の日数。MS-222 =トリカインメタンスルホン酸塩。 この図の拡大版を表示するには、ここをクリックしてください。
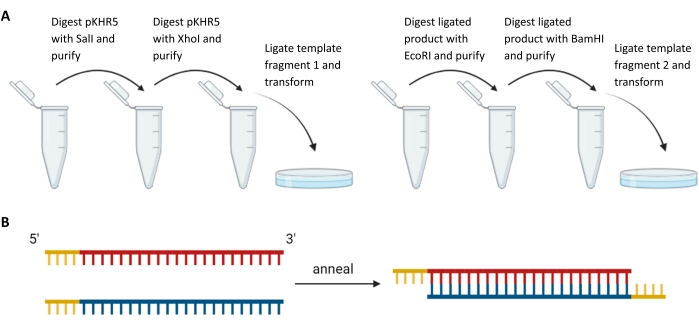
図3:外因性テンプレートフラグメントおよびsgRNAガイドの調製 。 (A)pKHR5におけるmVenus YFPレポーター遺伝子配列の上流および下流における鋳型断片の逐次消化およびライゲーション。(B)DR274へのライゲーションのための制限オーバーハングによる相補的sgRNA対のアニーリング。略語:sgRNA =シングルガイドRNA;YFP = 黄色蛍光タンパク質。 この図の拡大版を表示するには、ここをクリックしてください。
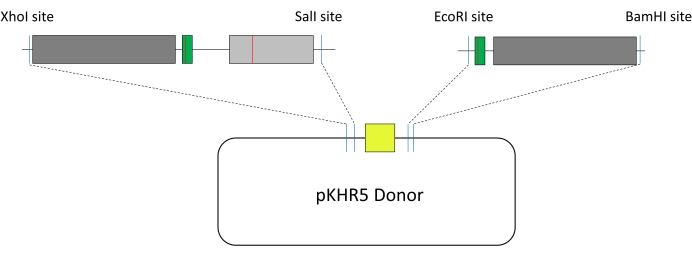
図4:HDRテンプレートの構築。 ダークグレー、相同性アーム;緑色のsgRNAガイドターゲットは、Cas9の再切断を防ぐためのサイレント突然変異を備えています。ライトグレー、目的のターゲットエクソン;赤い線、点突然変異。黄色、αクリスタリンプロモーター下のmVenus YFPレポーター遺伝子;紺色の線、制限サイトを追加。2つのテンプレート断片は、pKHR5プラスミドドナーに組み込まれています。略語:HDR =相同性指向修復;sgRNA = シングルガイドRNA。 この図の拡大版を表示するには、ここをクリックしてください。

図5:CRISPR-Cas9成分を用いた単一細胞ゼブラフィッシュ胚のマイクロインジェクション。 スケールバー= 0.5 mm。略語:HDR =相同性指向修復;sgRNA = シングルガイドRNA。 この図の拡大版を表示するには、ここをクリックしてください。

図6:mVenus YFPレポーター遺伝子の容易な検出蛍光は、標的遺伝子へのHDR外因性テンプレートの組み込みが陽性であることを示している。 (A)編集ゼブラフィッシュ仔魚のゼブラフィッシュ眼(矢印)におけるmVenus YFP発現の例。(B)編集の成功は、クロマトグラムのシーケンスによって確認されます(左、WT、右、R56Q編集)。 この図の拡大版を表示するには、ここをクリックしてください。

図7: zkcnh6a 標的遺伝子の正確なR56Q編集後の3 dpfゼブラフィッシュにおける心臓の結果の表現型分析。 (A) ImageJのポリゴンツールを用いた眼の大きさに対する心膜寸法の画像検出心膜嚢の境界は、半透明および色素沈着の変化に基づいて、単一の記録フレームからユーザーによってマークされた。正常な心膜寸法および心嚢液貯留の例が示されている。スケールバー= 0.5 mm。 (B)心膜寸法(眼の寸法に対する)と心拍数の相関、R2 = 0.33。(C)3 dpfゼブラフィッシュ幼虫の心臓(左)と平均複合体(右)からのECG記録の例。心拍数、131 bpm;心拍数補正QTc間隔、460ミリ秒。略語:dpf =受精後の日数。心電図=心電図。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
CRISPR-Cas9を使用した正確な遺伝子編集のエンジニアリングは、HDRメカニズムの効率の低さと効率的な検出によって課題となっています。ここでは、CRISPR-Cas9ベースの2sgRNAエクソン置換アプローチについて説明し、ポジティブ編集の簡単な視覚的検出によりゼブラフィッシュで正確な編集を生成します。このアプローチの有効性は、 zkcnh6a 遺伝子の正確な編集を生成することによって実証されます。この論文は、遺伝子編集ゼブラフィッシュ幼虫の心機能を、心拍数、心膜寸法、およびECG形態の非侵襲的表現型測定を使用してどのように評価できるかを示しています。遺伝子編集の導入から表現型評価まで、このアプローチは、開始から終了まで約1週間で完了することができます。
上記の編集および表現型アプローチの利点は、CRISPR修飾設計の容易さ、複数の生理学的システムへの幅広い適用性、大きな遺伝子または遺伝子断片を挿入する能力、および発生および世代を通じてバリアント効果を縦断的に追跡できることです。このアプローチでの正確な編集の成功は、ゼブラフィッシュ14の編集効率を高めることが示されている大きなテンプレートサイズ(レポーター遺伝子挿入と長い相同性アームによる)と、ゼブラフィッシュTALEN誘発編集8で効果的に使用されている2sgRNAガイド戦略の組み合わせに関連している可能性があります。
記載されたアプローチの1つの特定の強みは、大きな遺伝子または遺伝子断片を挿入する能力である。これは、例えば、ヒトオルソログ41を挿入し、より臨床的に翻訳可能なキャラクタリゼーションおよびオルソログ間の比較を可能にするのに有用であり得る。あるいは、Cas酵素をコードする遺伝子も挿入することができ、 in vivo CRISPR編集機構を備えたゼブラフィッシュの系統を可能にし、誘導可能なシステムを提供する。同様に、プライム編集などの代替のCRISPRメカニズムを統合して、正確かつ効率的に編集しやすいゼブラフィッシュのラインを生み出すことができます。
このアプローチの利点にもかかわらず、いくつかの制限があります。第一に、単一の遺伝子座と遺伝子座のみが改変されており、このアプローチがどれほど広く適用可能であるかを評価するには、他の部位または他の遺伝子でのさらなる試験が必要である。長い相同性アームが必要なため、テンプレートの設計コストが高くなります。ただし、これは効率的なスクリーニングによって相殺される可能性があります。別の制限は、スクリーニングアプローチが蛍光検出能力を必要とすることである。ただし、光学要件は比較的低く、カスタムビルドまたは合理的に低コストで商業的に購入できます。2sgRNAアプローチを使用すると、潜在的なオフターゲットイベントの数が増加します。しかし、これは、2つのsgRNAガイドが両方とも、レポーター遺伝子発現をもたらすためのテンプレートの組み込みを容易にする方法でアニールする確率が低いことによって軽減される可能性があります。最後に、Cas9 mRNAを使用すると、Cas9は後の発生段階まで活性がないため、モザイクが発生する可能性があります。これは、特定の組織タイプの配列決定によって説明できます。しかし、ゼブラフィッシュの幼虫の大きさを考えると、これは技術的に困難です。
要約すると、ゼブラフィッシュにおけるこのCRISPR-Cas9 two-sgRNA精密編集アプローチは、ポジティブ編集の簡単な視覚的検出を可能にし、任意の遺伝子座で関心のある大きな遺伝子を組み込むように適合させることができます。表現型測定と組み合わせることで、臨床的に関連する心臓変異を研究するための信頼性の高いハイスループットプラットフォームが可能になります。
開示事項
著者は開示する利益相反を持っていません。
謝辞
この研究は、カナダ衛生研究所研究プロジェクト助成金(TWC)およびカナダ自然科学工学研究評議会ディスカバリー助成金(TWC)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Program | |||
| CRISPOR | TEFOR Infrastructure | ||
| ENSEMBL | European Bioinformatics Institute | ||
| ImageJ | National Institutes of Health (NIH) | ||
| Micro-Manager | Open Source (Github) | ||
| NEBiocalculator | New England Biolabs (NEB) | ||
| EQUIPMENT | |||
| 24-well Plate | VWR | ||
| 25 mm Petri Dish | VWR | ||
| Blackfly USB3 Camera | Teledyne FLIR | ||
| C1000 Thermal Cycler | Bio-Rad | ||
| Centrifuge 5415C | Eppendorf | ||
| EZNA Gel Extraction Kit | Omega Biotek | ||
| MAXIscript T7 Transcription Kit | Invitrogen | ||
| MaxQ 5000 Incubator | Barnstead Lab Line | ||
| Miniprep Kit | Qiagen | ||
| mMessage mMachine T7 Ultra Transcription Kit | Invitrogen | ||
| ND1000 Spectrophotometer | Nanodrop | ||
| PCR Purification Kit | Qiagen | ||
| PLI 100A Picoinjector | Harvard Apparatus | ||
| PowerPac Basic Power Supply | Bio-Rad | ||
| Stemi 305 Steroscope | Zeiss | ||
| Wide Mini Sub Cell GT Electrophoresis System | Bio-Rad | ||
| ZebTec Zebrafish Housing System | Tecniplast | ||
| SERVICES | |||
| Gene Synthesis | Genewiz | ||
| Sanger Sequencing | Genewiz | ||
| REAGENTS | |||
| 10β Competent Cells | NEB | ||
| 10X PCR Buffer | Qiagen | ||
| 100 mM Nucleotide Mixture | ABM | ||
| Ampicillin | Sigma | ||
| BamHI Endonuclease w/ buffer | NEB | ||
| BsaI Endonuclease w/ buffer | NEB | ||
| DR274 Plasmid (XL1 Blue bacterial agar stab) | Addgene | ||
| EcoRI Endonuclease w/ buffer | NEB | ||
| Glycerol | |||
| HEPES | Sigma | ||
| HindIII Endonuclease w/ buffer | NEB | ||
| Kanamycin | Sigma | ||
| Methylene Blue | Sigma | ||
| MLM3613 Plasmid (XL1 Blue bacterial agar stab) | Addgene | ||
| MS-222 (Tricaine) | Sigma | ||
| pKHR5 Plasmid (DH5α bacterial agar stab) | Addgene | ||
| PmeI Endonuclease w/ buffer | NEB | ||
| SalI Endonuclease w/ buffer | NEB | ||
| Sodium Hydroxide | Sigma | ||
| T4 Ligase w/ buffer | Sigma | ||
| Taq Polymerase | Qiagen | ||
| TE Buffer | Sigma | ||
| Tris Hydrochloride | Sigma | ||
| XhoI Endonuclease w/ buffer | NEB | ||
| RECIPES | |||
| Solution | Component | Supplier | |
| Annealing Buffer (pH 7.5-8.0) | 10 mM Tris | Sigma | |
| 50 mM NaCl | Sigma | ||
| 1 mM EDTA | Sigma | ||
| E3 Media (pH 7.2) | 5 mM NaCl | Sigma | |
| 0.17 mM KCl | Sigma | ||
| 0.33 mM CaCl2 | Sigma | ||
| 0.33 mM MgSO4 | Sigma | ||
| Injection Buffer (pH 7.5) | 20 mM HEPES | Sigma | |
| 150 mM KCl | Sigma |
参考文献
- Zarei, A., Razban, V., Hosseini, S. E., Tabei, S. M. B. Creating cell and animal models of human disease by genome editing using CRISPR/Cas9. The Journal of Gene Medicine. 21 (4), 3082(2019).
- Lee, H., Yoon, D. E., Kim, K. Genome editing methods in animal models. Animal Cells and Systems. 24 (1), 8-16 (2020).
- Li, Q., et al. Applications of genome editing technology in animal disease modeling and gene therapy. Computational and Structural Biotechnology Journal. 17, 689-698 (2019).
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little fish, big data: Zebrafish as a model for cardiovascular and metabolic disease. Physiological Reviews. 97 (3), 889-938 (2017).
- Kegel, L., et al. Forward genetic screen using zebrafish to identify new genes involved in myelination. Oligodendrocytes: Methods and Protocols. 1936, 185-209 (2019).
- Shah, A. N., Davey, C. F., Whitebirch, A. C., Miller, A. C., Moens, C. B. Rapid reverse genetic screening using CRISPR in zebrafish. Nature Methods. 12 (6), 535-540 (2015).
- González-Rosa, J. M. Zebrafish models of cardiac disease: From fortuitous mutants to precision medicine. Circulation Research. 130 (12), 1803-1826 (2022).
- Hoshijima, K., Jurynec, M. J., Grunwald, D. J. Precise editing of the Zebrafish genome made simple and efficient. Developmental Cell. 36 (6), 654-667 (2016).
- Albadri, S., Del Bene, F., Revenu, C. Genome editing using CRISPR/Cas9-based knock-in approaches in zebrafish. Methods. 121-122, 77-85 (2017).
- Armstrong, G. A. B., et al. Homology directed knockin of point mutations in the zebrafish tardbp and fus genes in ALS using the CRISPR/Cas9 system. PLoS One. 11 (3), 0150188(2016).
- Bai, H., et al. CRISPR/Cas9-mediated precise genome modification by a long ssDNA template in zebrafish. BMC Genomics. 21 (1), 67(2020).
- de Vrieze, E., et al. Efficient generation of knock-in zebrafish models for inherited disorders using CRISPR-Cas9 ribonucleoprotein complexes. International Journal of Molecular Sciences. 22 (17), 9429(2021).
- Eschstruth, A., Schneider-Maunoury, S., Giudicelli, F. Creation of zebrafish knock-in reporter lines in the nefma gene by Cas9-mediated homologous recombination. Genesis. 58 (1), 23340(2020).
- Irion, U., Krauss, J., Nüsslein-Volhard, C. Precise and efficient genome editing in zebrafish using the CRISPR/Cas9 system. Development. 141 (24), 4827-4830 (2014).
- Kimura, Y., Hisano, Y., Kawahara, A., Higashijima, S. Efficient generation of knock-in transgenic zebrafish carrying reporter/driver genes by CRISPR/Cas9-mediated genome engineering. Scientific Reports. 4 (1), 6545(2014).
- Levic, D. S., Yamaguchi, N., Wang, S., Knaut, H., Bagnat, M. Knock-in tagging in zebrafish facilitated by insertion into non-coding regions. Development. 148 (19), (2021).
- Prykhozhij, S. V., et al. Optimized knock-in of point mutations in zebrafish using CRISPR/Cas9. Nucleic Acids Research. 46 (17), 102(2018).
- Wierson, W. A., et al. Efficient targeted integration directed by short homology in zebrafish and mammalian cells. eLife. 9, 53968(2020).
- Boel, A., et al. CRISPR/Cas9-mediated homology-directed repair by ssODNs in zebrafish induces complex mutational patterns resulting from genomic integration of repair-template fragments. Disease Models & Mechanisms. 11 (10), (2018).
- Tessadori, F., et al. Effective CRISPR/Cas9-based nucleotide editing in zebrafish to model human genetic cardiovascular disorders. Disease Models & Mechanisms. 11 (10), (2018).
- Zhang, Y., Zhang, Z., Ge, W. An efficient platform for generating somatic point mutations with germline transmission in the zebrafish by CRISPR/Cas9-mediated gene editing. The Journal of Biological Chemistry. 293 (17), 6611-6622 (2018).
- Vornanen, M., Hassinen, M. Zebrafish heart as a model for human cardiac electrophysiology. Channels. 10 (2), 101-110 (2016).
- Nemtsas, P., Wettwer, E., Christ, T., Weidinger, G., Ravens, U. Adult zebrafish heart as a model for human heart? An electrophysiological study. Journal of Molecular and Cellular Cardiology. 48 (1), 161-171 (2010).
- Haeussler, M., et al. Evaluation of off-target and on-target scoring algorithms and integration into the guide RNA selection tool CRISPOR. Genome Biology. 17 (1), 148(2016).
- Liang, X., Potter, J., Kumar, S., Ravinder, N., Chesnut, J. D. Enhanced CRISPR/Cas9-mediated precise genome editing by improved design and delivery of gRNA, Cas9 nuclease, and donor DNA. Journal of Biotechnology. 241, 136-146 (2017).
- Richardson, C. D., Ray, G. J., DeWitt, M. A., Curie, G. L., Corn, J. E. Enhancing homology-directed genome editing by catalytically active and inactive CRISPR-Cas9 using asymmetric donor DNA. Nature Biotechnology. 34 (3), 339-344 (2016).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Precipitation of Large RNAs with Lithium Chloride. Molecular Cloning: A Laboratory Manual, Book 3. E.15. , Cold Spring Harbor Laboratory. Long Island, NY. (1989).
- Sambrook, J., Fritsch, E. F., Maniatis, T. Agarose Gel Electrophoresis. Molecular Cloning: A Laboratory Manual, Book 1. , Cold Spring Harbor Laboratory. Long Island, NY. 3-20 (1989).
- Sorlien, E. L., Witucki, M. A., Ogas, J. Efficient production and identification of CRISPR/Cas9-generated gene knockouts in the model system Danio rerio. Journal of Visualized Experiments. (138), e56969(2018).
- Avdesh, A., et al. Regular care and maintenance of a zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196(2012).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115(2009).
- Kossack, M. E., Draper, B. W. Genetic regulation of sex determination and maintenance in zebrafish (Danio rerio). Current Topics in Developmental Biology. 134, 119-149 (2019).
- Tanaka, Y., et al. Functional analysis of KCNH2 gene mutations of type 2 long QT syndrome in larval zebrafish using microscopy and electrocardiography. Heart and Vessels. 34 (1), 159-166 (2019).
- Dhillon, S. S., et al. Optimisation of embryonic and larval ECG measurement in zebrafish for quantifying the effect of QT prolonging drugs. PLoS One. 8 (4), 60552(2013).
- Yu, F., et al. Evolving cardiac conduction phenotypes in developing zebrafish larvae: Implications to drug sensitivity. Zebrafish. 7 (4), 325-331 (2010).
- Hurst, R. M. Development and optimization of tools for embryonic electrocardiograph recording for heart dysfunction in zebrafish. , University of Birmingham. PhD thesis (2018).
- Meeker, N. D., Hutchinson, S. A., Ho, L., Trede, N. S. Method for isolation of PCR-ready genomic DNA from zebrafish tissues. BioTechniques. 43 (5), 610-614 (2007).
- Arnaout, R., et al. Zebrafish model for human long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America. 104 (27), 11316-11321 (2007).
- Milan, D. J., Peterson, T. A., Ruskin, J. N., Peterson, R. T., MacRae, C. A. Drugs that induce repolarization abnormalities cause bradycardia in zebrafish. Circulation. 107 (10), 1355-1358 (2003).
- Langheinrich, U., Vacun, G., Wagner, T. Zebrafish embryos express an orthologue of HERG and are sensitive toward a range of QT-prolonging drugs inducing severe arrhythmia. Toxicology and Applied Pharmacology. 193 (3), 370-382 (2003).
- MacRae, C. A. Cardiac arrhythmia: In vivo screening in the zebrafish to overcome complexity in drug discovery. Expert Opinion on Drug Discovery. 5 (7), 619-632 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved