Method Article
クリック可能なケージ化合物の設計、合成、光化学的特性
要約
クリック可能な部分を持つモジュラーケージ化合物の光化学的特性の合成および測定のためのプロトコルが提示される。
要約
ケージ化合物は、高い時空間分解能で細胞生理学の光媒介操作を可能にします。しかし、現在利用可能なケージ群の限られた構造的多様性と光凝集効率を犠牲にせずに合成改変の困難は、生細胞用ケージ化合物のレパートリーを拡大する障害であるアプリケーション。クマリン型光ケージ基の化学修飾は、多様な物理的および化学的特性を有するケージ化合物の調製に有望なアプローチであるとして、我々は、修飾することができるクリック可能なケージ化合物の合成のための方法を報告します銅(I)触媒ハウスゲンサイク化を介して様々な機能ユニットで簡単に。モジュラープラットフォーム分子は、フォトケイジング群として(6-ブロモ-7-ヒドロキシクーマリン-4-yl)メチル(Bhc)基を含み、従来の2-ニトロベンジルに比べて高い光分解効率を示す。アミン、アルコール、およびカルボキシレートを含むクリック可能なケージ化合物の調製のための一般的な手順が提示されます。水溶性および細胞標的化能力などの追加の特性は、クリック可能なケージ化合物に容易に組み込むことができる。さらに、光光化量子収率を含む物理的および光化学的特性を測定し、対応するBhcケージ化合物のものよりも優れていることが判明した。したがって、記載されたプロトコルは、利用可能なケージ化合物における構造的多様性の欠如に対する潜在的な解決策と考えることができる。
概要
ケージ化合物は、元の機能が一時的にコバレントに取り付けられたフォトリムーバブル保護基によってマスクされる合成分子を設計されています。興味深いことに、生物学的に関連する分子のケージ化合物は、細胞生理学1、2、3、4、5の時空間制御に不可欠な方法を提供する 、6.1977年、エンゲルスとシュレーガーはcAMPの2-ニトロベンジルエステルをcAMP7の透過性およびフォトラビタール誘導体として報告した。翌年、カプランはATP(NPE-ATP)の1-(2-ニトロフェニル)エチルエステルを報告し、この化合物を「ケージ」ATP8と名付けた。それ以来、2-ニトロベンジル、p-ヒドロキシフェナシル9、2-(2-ニトロフェニル)エチル10、11、7-ニトロインドリン-1-イルス12などの光化学的に取り外し可能な保護基の範囲、 13、および(クマリン-4-yl)メチル14、15、16は、ケージ化合物の調製に使用されている。
膜透過性、水溶性、細胞標的化能力などの望ましい追加特性を有するケージ化合物の合成は、細胞生物学的応用を容易にすることが期待されるであろう。これらの分子の物理的および光化学的特性は、主にそれらを調製するために使用される光化学的に取り外し可能な保護基の化学構造に依存するため、光凝集基の多様なレパートリーが必要とされる。しかしながら、光光効率が高い現在利用可能なケジング群の構造的多様性は限られている。これは、ケージ化合物の使用を増やすための障害である可能性があります。.
この問題に対処するために、フォトケージング群のレパートリーは、既存のフォトリムーバブル保護群の化学的修飾または優れた光物理的および光化学的特性を有する新しいフォトラビル染色体の設計によって拡大された。例としては、ニトロジベンゾフロン(NDBF)17、[3-(4,5-ジメトキシ-2-ニトロフェニル)-2-ブチル](DMNPB)18、19、カルシウム感受性2-ニトロベンジルフォト20、置換クマリニルメチル(DEAC450),DEAdcCM22,7-アゼチジニル-4-メチルカマリン23,及びスチルル・クマリン24,シアニン誘導体(CyEt-pan)25、およびBODIPY誘導体26,27。
また、以前に(6-ブロモ-7-ヒドロキシクーマリン-4-yl)メチル(Bhc)群を開発し、神経伝達物質28、第2メッセンジャー29、30、および様々なケージ化合物の合成に成功しました。オリゴヌクレオチド31、32、33は、大きな1つ及び2光子励起断面を示す。追加の特性は、その光過敏性を損なうことなくケージグループに簡単にインストールすることができれば、ケージ化合物のレパートリーを拡張することができます34,35,36,37、38、39.したがって、我々は3つの部分、すなわち写真応答性コアとしてBhcグループ、追加機能のインストールのための化学ハンドル、およびマスクされるべき分子40を含むモジュラーケージ化合物を設計しました。41.
したがって、この記事は、生物学的に関連する分子のケージ化合物の調製のための実用的な方法を提供する。本プロトコルは、フォトケージ群のためのクリック可能なプラットフォームの準備のための方法、ケージ化合物のレパートリーを拡大するための追加機能の導入、その物理的および光化学的測定について説明します。さらなる細胞応用のためのクリック可能なケージ化合物の細胞型選択的ターゲティング。
プロトコル
1. クリック可能なケージ化合物に対するモジュラーケージpaBhc群の合成28,41
-
塩化メチル(6-ブロモ-7-ヒドロキシクマリン-4-yl)の調製(Bhc-CH2Cl)
- 4ブロモレソルシノール(9.742g、51.5mmol)をスターラーバーを装備した100mLの丸底フラスコに入れます。
- フラスコにH2SO 4(98%、30mL)を加え、混合物を攪拌して溶解させます。
- エチル4クロロアセトアセテート(10 mL、74 mmol)を滴下して添加する。
- 5日間周囲温度で混合物を撹拌し続ける。
- 別に、500 mLのエルレンマイヤーフラスコに砕いた氷の立方体(〜200 mL)を置きます。
- 反応混合物を氷に注ぎ、細かく粉末状の沈殿物が得られるまで30分間激しくかき混ぜます。
- 真空濾過を介して沈殿物を収集します。薄茶色の沈殿物を水で5回洗います。
- 一晩真空下で沈殿物を乾燥させ、BhcCH2Clを薄茶色の粉末(13.57g、46.9ミリモル)として得る。
-
(6-ブロモ-7-ヒドロキシクマリン-4-yl)メタノールの調製(BhcCH2OH)
- 準備されたBhcCH2Cl(1.1440 g、3.95 mmol)および1 M HCl(300 mL)を、ディムロスコンデンサーを装備した1Lの丸底フラスコに入れます。混合物を140°Cで5日間撹拌する。この後、周囲温度に混合物を冷却します。
- 真空下での回転性蒸発によって反応から水を取り出し、明るい茶色の粉末(1.0359g、3.82 mmol、97%収率)としてBhcCH2OH(1)を得る。
注:BhcCH2Clの1g当たり1M HClの250 mLの使用は満足のいく結果を与える。
-
マニッヒ反応によるpaBhchCH2OH(2)の調製
- パラホルムアルデヒド(446.4mg、14.9 mmol)を50mLの丸底フラスコに入れます。フラスコに無水エタノール(5mL)とN-メチルプロパルギラミン(1.25mL、14.8 mmol)を加えます。
- Ar雰囲気下で1時間周囲温度で混合物をかき混ぜます。
- フラスコにBhcCH2OH(1)(1.367 g,5.04 mmol)を加えます。ブロックヒーター装置で混合物を80°Cに加熱し、Ar雰囲気下で2時間80°Cで撹拌を続ける。
- ブロックヒーターを停止し、室温に反応混合物を冷却します。
- 真空濾過により得られた明るい茶色黄色の沈殿物を収集する。少量の無水エタノール(毎回1mL)で沈殿物を2回洗浄します。
- 真空下で過剰なエタノールを取り出し、paBhcCH2OH(2)(1.393 g, 3.96 mmol) を得る。
2. クリック可能なケージ化合物の調製
注:以下の手順は、ヒドロキシル、アミノ、およびカルボキシレート官能基を含む他のクリック可能なケージ化合物の調製に適用することができる。
-
一般的な手順1:クリック可能なケージアミンの準備
- paBhcCH2OH (2) (709.6 mg, 2.02 mmol) N,N'-カルボニルジミダゾール (CDI, 397.6 mg, 2.45 mmol) を 30 mL の丸底フラスコに入れます。乾燥CH2Cl2(6 mL)を追加し、周囲温度で1時間をかき混ぜます。
- 4-ジメチルアミノピリジン(4-DMAP,324.8 mg,2.66 mmol)とテルトブチル(6-アミノヘキシル)カルバメート(533.1 mg,2.46 mmol)を添加する。溶液を周囲温度で3時間かき混ぜます。
- 真空下のロータリーエバポレータを使用して溶媒やその他の揮発性物質を除去します。シリカゲルフラッシュカラムクロマトグラフィーを使用して、残留物を直接浄化します。
-
一般的な手順2:クリック可能なケージアルコールの準備
- 30 mLの丸底フラスコに30mLの丸底フラスコにパクリタキセル(PTX、48.7 mg、0.057 mmol)を置き、3ウェイストップコックとArバルーンを装備します。ドライCH2Cl2(1 mL)、4-DMAP(17.1mg、0.14 mmol)、および4-ニトロフェニルクロロモルメート(26.0mg、0.13 mmol)を追加します。
- 溶液をAr雰囲気下で2.5時間周囲温度でかき混ぜます。
- 溶液に4-DMAP(15.7 mg、0.13ミリモル)およびpaBhcCH2OH(2)(39.1 mg, 0.111 mmol) を溶液に追加します。周囲温度で17時間撹拌を続けます。
- CHCl3(10 mL)と15%水性NaHCO 3(5mL)を混合物に加えます。約3分間激しく混ぜる. ピペットで水層を取り除きます。
- 有機層を含むフラスコに0.5Mクエン酸(5mL)を加えます。混合物をかき混ぜ、上記のように水層を除去します。
- 位相分離カラムを使用して有機層を分離します。真空下のロータリーエバポレータで溶剤を取り除きます。標準的なシリカゲルフラッシュカラムクロマトグラフィーを使用して製品を浄化します。
-
一般的な手順3:クリック可能なケージカルボキシ酸の調製
- アラキドン酸(33.0 μL、0.100 mmol)、paBhcCH2OH(2)(39.6mg、0.112 mmol)、および4-DMAP(14.1mg、0.115 mmol)をドライCH2Cl2(2mL)で溶解する。N,N,ジソプロピルカルボディミド(DIPC,17.0 μL,0.110 mmol)を加え、周囲温度で140分間撹拌します。
- 真空下で溶剤を取り除きます。シリカゲルフラッシュカラムクロマトグラフィーを使用して、残留物を直接浄化します。
3. クリック可能なケージ化合物への機能ユニットの設置
- 銅(II)硫酸ペンタハイドレート(249mg)をイオン交換水中(IEW、10mL)で溶解し、0.1 M CuSO4溶液を与える。
- 溶解 2 °-paBhcmoc-PTX (8.0 mg, 6.5 μmol), トリス (3-ヒドロキシプロピルトリアゾリルメチル) アミン (THPTA, 17.5 mg, 40.3 μmol), ナトリウム l-アスコルビン酸ナトリウム (162.4 mg, 0.825 mmol), および 15-クロロ-3,6,9-トリオキサペンタデシルアジド (3.1 mg, 11 μmol) 0.1 M リン酸の混合溶媒中バッファー(2.5 mL、pH 7.2)およびジメチルスルホキシド(DMSO、0.5 mL)。
- 0.1 M CuSO4溶液(81.2 μL、8.1 μmol)を反応混合物に加えます。周囲温度で80分間撹拌し、高性能液体クロマトグラフィー(HPLC)を用いて反応の進行状況を監視する。
- 75%のアセトニトリル/水溶液(3.5 mL)を加えて沈殿物を溶解します。得られた溶液を半準備HPLCシステムに直接適用し、目的の製品を精製します。
注:テルト-ブタノールの添加による反応混合物の可溶化は、反応の進行を促進することができる。
4. ケージ化合物の光溶解非ケージ反応
- ストックソリューションの準備
- 所望のケージ化合物(5μmol)をDMSO(500μL)に溶解し、10mMのストック溶液を調作します。各溶液(10μL)のアリコートを1.5mLのマイクロ遠心管に分配し、使用直前まで冷凍庫(−20°C)に保管してください。
- 6 mM K3[Fe(C2O4)3] (100 mL): 再結晶化したカリウムフェロキサレート (0.295 g, 0.675 mmol) を 80 mL の水に溶かします。0.5 M H2SO4 (10 mL) と適切な量の IEW を追加して、体積を 100 mL にします。
注:鉄酸化カリウムは、お湯からの再結晶化によって精製し、暗闇の中で保存する必要があります。再結晶化カリウムフェリオキシ酸塩は、三水和物として得られます。したがって、その式はK3[Fe(C2O4)3]·3H2 Oであり、491.24の式重量は、ストック溶液の調製時に考慮されるべきである。510 nmで吸収を測定して、6 mM溶液の純度を確認してください。吸光度が<0.02の場合は、実験での使用に適しています。 - 0.1% バッファーフェン (30 mL): 溶解 NaOAc·3H2O (7.35 g), 1,10-フェナンスロリン (フェン)·H2O (30 mg), およびコンク H2SO4 (0.9 mL) IEW (20 mL) .IEW を追加して、ボリュームを 30 mL にします。
注:溶液は1.8 M NaOAc、0.54 M H2SO4、および0.1%1,10-フェナンスロリンを含んでいます。
- フェリオキシサル酸活性物質測定を用した光子数の測定
- 6 mM K3[Fe(C2O4)3](V1 L) をクォーツキュベットに入れ。溶液を350nmの光で5sに照射します。
- 照射された溶液をl[cm]パス長のPyrexキュベットに移します。
- 照射されたサンプル溶液に0.1%のバッファフェン(V2 L)を加え、ピペッティングでよく混ぜます。510 nmでサンプルの吸光度を測定します。単位時間当たりの平均吸収変化を計算します(ΔA510 [s-1])。
- 次の式に従って、単位時間あたりに生成された Fe2+イオンのモルの数を計算します。
nFe2+ [mol s-1]=((V1 + V2) [L] × ΔA510 [s-1])/(l [cm] × ε510 [L モル 1 cm-1 ])、
ここで(V1 +V2)は吸収測定のためのサンプルの体積であり、lはキュベットの光学経路長であり、ε510はFe2+のモル吸収性である−510 nmのフェン複合体。
注:典型的な実験条件では、V 1 = 2.0 × 10-3 L、V 2 = 0.33 × 10-3 L、l = 1.0 cm、および ε510 = 1.1 × 104 L mol-1の値cm-1を使用しました。 - 次の式を使用して、サンプル(I0)に到達するフォトンのモルの数を計算します。
I0 [アインシュタイン cm-2 s-1]= nFe2+/Φ350
ここでΦ350は350nmでのフェリオキシサレートの光還元の量子効率である。
注:350nmでのカリウムフェリオキシ酸活性化剤計の量子効率は報告されていないが、358nmで1.2542の報告値が採用された。
- 350 nmでの量子効率測定
- サンプルストック溶液(DMSO、10 μL)をK-MOPSバッファー(pH 7.2、10 mL)で希釈し、0.1%DMSOを含むK-MOPSに10μM溶液を与えます。
注:K-MOPSバッファーは、100mM KClおよび10mM3-(N-モルフォリーノ)プロパンスルホン酸(モップ)をKOHでpH7.2に引き上げた。 - 溶液(V1 L)のアリコートを、化学作動計の光反応に使用したのと同じキュベットに移す。手順 4.2.1 で説明したのと同じ設定を使用してサンプル ソリューションを照射します。
- 照射された溶液からアリコート(50 μL)を定期的に取り出し、HPLCを使用して分析します。
- 開始材料の90%が開始材料の時間依存性消失のプロットを適合することによって反応した射照時間を秒単位で決定する。
注:照射されたサンプルの吸光度は、放射線の内部フィルタリングを無視できるように<0.1で維持する必要があります。開始材料の光溶解消費量は、光溶解プロセスを妨げる望ましくない二次効果がないように、単一指数減衰によって近似できることが望ましい。 - 次の式28を用いて消失の量子収率(Φdis)を計算する:
Φディス= 1/(t90% × I0 × σ350)
ここでt90%[s]は出発物質の90%が消費された照射時間であり、I 0[アインシュタインcm-2 s−1]はフォトンのモル数であり、σ 350[cm]である2モル−1]は、350nmでの試料のデカディック絶滅係数である。
注: σ350 [cm2モル−1] = 103ε350 [M-1 cm-1]
- サンプルストック溶液(DMSO、10 μL)をK-MOPSバッファー(pH 7.2、10 mL)で希釈し、0.1%DMSOを含むK-MOPSに10μM溶液を与えます。
5. ハロタグリガンドを使用したクリック可能なケージ化合物の標的化
注:使用前に、ダルベッコの改変イーグル培地(DMEM、低グルコース、ピルビン酸ナトリウム、l-グルタミン)に1%の抗生物質(ストレプトマイシン硫酸ペニシリンG、アンペリン)を含む10%の胎児ウシ血清(FBS)を補充して、HeLa細胞を維持する。37 °C と 5% CO2.
- 培地を取り出し、トリプシン・エチレンディアミンテトラセチン酸(EDTA,1 mL)を37°Cで1分間処理して細胞を取り出し、細胞にDMEM(4mL)を加え、穏やかにピペッティングして細胞を再中断します。シードは、トランスフェクションの前にDMEM(2 mL)24時間で35mmガラス底皿に皿あたり約5×105セルを播種する。
- 4つの料理の場合、1.5mLのマイクロ遠心分離管で、プラスミドDNA(pcDNA3-Halo-EGFR、14 μg)を還元血清培地(700μL)で希釈する。別に、還元血清培地(150μL)のリポフェクション試薬(5μL)を4本のチューブのそれぞれに希釈し、5分間周囲温度に立たせるようにします。
- 希釈されたプラスミドDNA(150μL)の一部を希釈したリポフェクション試薬試料試料試料のそれぞれに添加する。周囲温度で5分間インキュベートします。
- 細胞を37°Cおよび5%CO2で24時間維持した後、DMEMを吸引し、リン酸緩衝生理食生(PBS、2 mL)で細胞をすすいで下す。減らされた血清培地(1.5mL)を加える。
- プラスミド・リポフェクション試薬(150μL)を各皿に加えます。37 °C および 5% CO2で 48 時間のセルを維持します。
- 培地を吸引し、2 μM paBhc-hex-FITC/Haloを含む新たに調製したDMEM(1mL)の一部を加え、37°Cおよび5%CO2で30分間細胞をインキュベートする。
- ケージ化合物を含む培地を吸引し、PBS+(リンス当たり1mL)で細胞を2回すすいで、結合されていない化合物を除去します。減らされた血清培地(500μL)を加え、37°Cと5%CO2で30分間細胞をインキュベートし、細胞に入った化合物を除去する。
注:PBS+は、2 mM CaCl2および1 mM MgCl2で補充されたリン酸緩衝生理食べ物である。 - 培地を取り出し、PBS+(1 mL)で細胞を2回すすいで下す。フェノールを含まない媒体(1 mL)の一部を追加します。レーザースキャン共焦点蛍光顕微鏡による蛍光画像を記録する。
6. クリック可能なケージ化合物を用いたキナーゼ局在化のフォトメディア変調
注:使用前に、37°Cと5%CO2で10%FBSを補充したハムのF-12培地でCHO-K1細胞を維持する。
- DMSOでpaBhc-AA(5)の100×作動液(1mM)を準備します。
注:化合物の10mMストック溶液が調製され、冷凍庫(-20°C)に保存されます。 - シードは、トランスフェクションの前にDMEM(2 mL)24時間で35mmガラス底皿に皿あたり約5×105セルを播種する。
- 未老化実験の前にGFP-DGKγ 48h用プラスミドコードを有するトランスフェクトCHO-K1細胞。
注: トランスフェクションは、手順 5.2 ~ 5.5 に従って実行されます。 - 還元血清培地(2mL)で培地を交換します。100×paBhc-AA作動液(20μL)を加え、5分から1時間の間に37°Cと5%CO2で細胞をインキュベートします。
注:読み込み時間は、使用される化合物によって異なります。 - 二重光源蛍光照明器を備えた反転蛍光顕微鏡の客観的な段階に細胞を置きます。
- 10sごとに蛍光画像を取り、適切な時間に顕微鏡目的を通して330~385nmの光で細胞を照射します。あるいは、柔軟な石英繊維を通してXeランプを使用して405nm光で細胞を照射する。
- 蛍光画像を10分間記録し続けます。
結果
アラキドン酸およびパクリタキセルを含むいくつかの生物学的に興味深い分子のクリック可能なケージ化合物は、正常に合成された(図1)28、41。水溶性および細胞標的化能などの追加特性を銅(I)触媒ホイスゲン循環(「クリック」反応)を介してpaBhcmoc-PTXに導入した(図2)。これらのクリック可能なケージPTXを光化し、350nm(図3)の照射時に親PTXを生成し、クリック可能なケージ化合物の物理的および光化学的特性を表1に要約した。クリック可能なケージ化合物2の量子収率2°glc-paBhcmoc-PTX(Φ0.14)およびpaBhc-AA(Φディス0.083)は、従来のBhcケージ化合物2-Bhcmoc-PTX(Φディス)の2倍以上であった。0.040) および Bhc-AA (Φdis 0.038)43.また、ブドウ糖を含む2°glc-paBhcmoc-PTXに対して水溶性の向上が認められた。
生細胞実験では、ハロタグタンパク質と表皮成長因子受容体(EGFR)の融合タンパク質を一時的に発現する培養哺乳動物細胞へのpaBhc-hex-FITC/Haloの標的化に成功した。paBhc-hex-FITC/Haloのフルオレセイン部分の緑色蛍光が細胞膜上で観察された(図4)。キナーゼの細胞内局在化の光媒介変調は、paBhcケージ化合物を用いて達成された。ジアシルグリセロールキナーゼγ(DGγ)の転位は、アラキドン酸(AA)44の存在下で活性化することが報告されている。一過性にGFP-DGKγを発現するCHO-K1細胞を、AAまたはpaBhc-AA(5)のいずれかで処理した。AAの添加は、DGKγの細胞内局在化の変調を引き起こした(図5A,B)。DGKγの局在化における同様の変化は、紫外線に曝露した後のpaBhc-AA処理細胞についても観察された(図5C,D)。
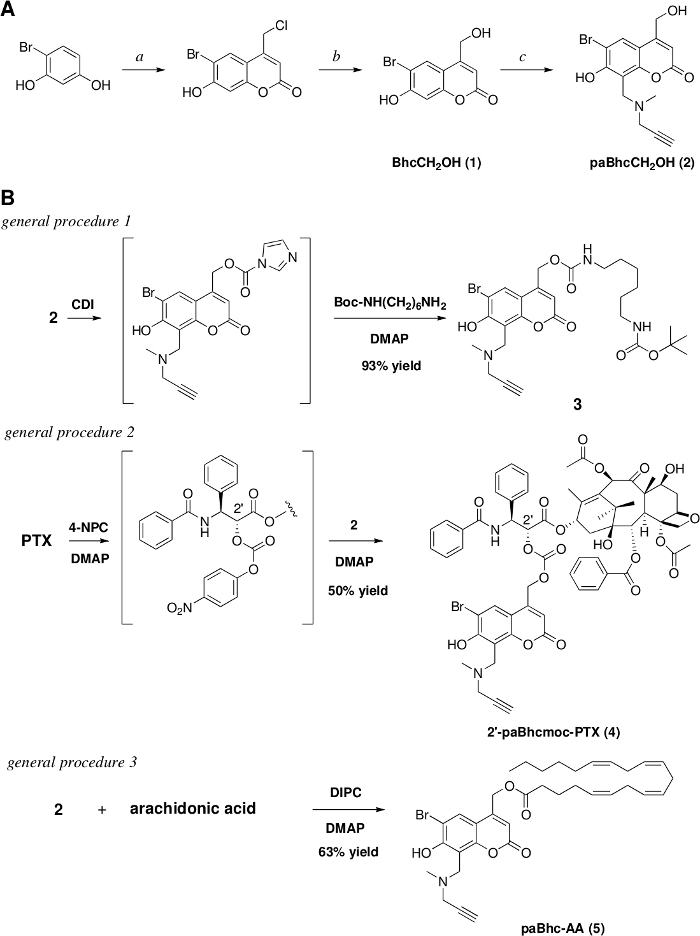
図1:クリック可能なケージ化合物の調製。
(A)試薬および条件:a.エチル4-クロロ酢酸アセテート/コンクH2SO4/rt/7日/91%収率、b. 1 M HCl/還流/3日/97%収率。c. N-メチルプロパルギラミン/HCHO/EtOH,その後、17 h/79%収率の還流で(1)と熱を加えます。(B)クリック可能なケージアミン、PTX、およびアラキドン酸の合成。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:クリック可能なケージ化合物への機能ユニットの設置
(A)銅(I)触媒ホイスゲン循環を介した水溶性ケージPTXの合成。(B)細胞標的に対するハロタグリガンドを含有するクリック可能なケージ化合物の構造。この図のより大きなバージョンを表示するには、ここをクリックしてください。
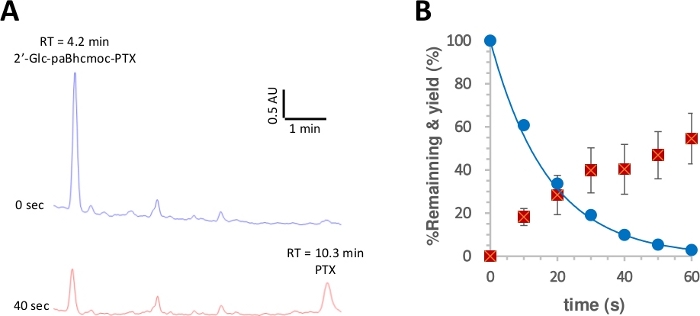
図3:2°glc-paBhcmoc-PTXの光凝図(6)。
K-MOPS溶液中の試料(10μM)(pH7.2)を350nmで照射した。(A)6の光回光回分に対する典型的なHPLCトレース(254nmで測定)。 試料を指定照射時間に分析した。(B) 6の光分光化のためのタイムコース。青い円は6の消費を示す。実線は、6の単純な減衰指数に合う最小二乗曲線を示します。赤い四角形は PTX の収率を示します。誤差記号は標準偏差(±SD)を表します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:paBhc-hex-FITC/Halo(8)でインキュベートした培養哺乳動物細胞の蛍光画像。
pcDNA3-Halo-EGFRでトランスフェクトした細胞を30分間37°Cで化合物8の2μM溶液でインキュベートした。画像はPBS+で繰り返し洗浄した後に得られた。模擬処理HEK293T細胞(A:差動干渉コントラスト(DIC)画像およびD:蛍光画像)HEK293T細胞(BおよびE)およびHeLa細胞(CおよびF)は、Halo-EGFR(BおよびC:DIC画像およびEおよびF:蛍光画像)を一時的に発現する。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:BHcケージアラキドン酸でインキュベートしたCHO-K1細胞の紫外線照射後の蛍光画像。CHO-K1細胞を融合タンパク質DGKγ-EGFPでトランスフェクトした。
(A)トランスフェクト細胞の蛍光画像。(B)アラキドン酸の10μM溶液を添加した後100s。(C)細胞をpaBhc-AA(5)の10μM溶液で37°C(D)20sUV照射後100s(330〜385nm)でインキュベートした。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 化合 物 | λ最大(nm)a | ε最大(M-1 cm-1)b | φディスc | εφディスd | 溶解度 (μM)e |
| PTX | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2'-paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2'-glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
表1:クリック可能なケージ化合物の物理的および光化学的特性。
a. 吸収最大(nm)、b.モル吸収度はλ最大(M−1cm−1)、c.350nm、dで出発物質の消失の量子収率。モル吸収性および350nmでの消失の量子収率の産物、e.K-MOPS(pH7.2)(μgmL−1)における飽和溶液の濃度。
ディスカッション
我々は以前に、高い光溶解効率28、45、46、47を示す様々な生物学的活性分子のBhcケージ化合物を開発した。Bhcケージ群のレパートリーを拡大することを目的として、様々な機能ユニット32、40、41の導入により容易に改変できるモジュラーケージ化合物のプラットフォームも報告した。したがって、本プロトコルは、銅(I)-触媒Huisgen環化を介して修飾することができるBhcケージング基のクリック可能な前駆体の合成のための方法を表す。クリック可能な前駆体paBhcCH2OH(2)の合成は、市販の4ブロモレソルシノール(図1A)から始まる4段階の反応配列を介して達成された。本プロトコルの利点は、手間のかかる精製工程(例えば、カラムクロマトグラフィー分離)が必要とされていないことである。
クリック可能な前駆体paBhcCH2OH(2)は、種々の官能基をマスクするために使用することができるので、アミン、アルコール、およびカルボキシリ酸のクリック可能なケージ化合物を前駆体として2を用いて合成した(図1B)。アルコールは炭酸塩として改変され、アミンはカルバメートとして改変された。一般的な手順1および2では、CDIをクリック可能なカルバメートの調製に使用し、4-ニトロフェニルクロロフォルマーメートは炭酸塩の調製に用いた。反応機構によって示されているように、両方の試薬は、カルバメートおよび炭酸塩の調製に使用することができる。また、所望のケージ化合物の収率は、ケージされる分子の化学構造に依存することにも留意すべきである。その他の例は、以前のレポート28、30、33、48で見ることができます。
次に、報告された手順49のわずかな変更を用いてクリック修正を行った。トリス(トリアゾリルメチル)アミン系リガンドの添加は、良好な高収率で所望の製品を得るために必要である。様々なアジドが商業的な供給源と文献のプロシージャの両方から容易に入手可能であるため、水溶性や細胞標的化能力などの追加特性を有する様々なモジュラーケージ化合物を調べることができます(図2)。
光光の量子収率は、次に報告された手順28、50に従って測定した。図3は、2°glc-paBhcmoc-PTXの光溶解消費量とPTXの放出が、それぞれ単一指数減衰と上昇によって近似されたことを示し、放射線または望ましくない二次効果の内部フィルタリングを示唆していない。改善された光光量量子収率(Φ)および光凝集効率(εΦ)は、以前に報告されたBhcケージ化合物と比較してクリック可能なpaBhcケージ化合物について観察された(表1)41、 43.Bhcケージ化合物の光凝膜効率(εΦ)は、2-ニトロベンジル型ケージ化合物48の100倍以上であるので、paBhcケージ群の存在による顕著な改善は明らかにこのシステムの利点。
概念実証実験として、親水性部分を2~paBhcmoc-PTX(4)に導入し、化合物3に細胞標的化リガンドを導入した(図2)。2°glc-paBhcmoc-PTXの水溶性は、親PTXの650倍高かった(表1)。タグプローブシステムを用いて選択的細胞標的化を達成し、ハロタグリガンドを有するpaBhcmoc-hex-FITC/Halo(8)は、ハロタグ/EGFR融合タンパク質を発現する培養哺乳動物細胞の細胞膜に標的化することに成功した(図 4)。キナーゼの細胞内局在化の光媒介変調も、クリック可能なケージ化合物5を用いて達成された(図5)。
結論として、水溶性や細胞などの追加特性で容易に改変できる生物学的に興味深い分子のフォトケージ化合物のクリック可能なプラットフォームの調製方法の実証に成功しました。ターゲティング能力。paBhc caging群は、変更可能な官能基を有する任意の分子を調製するために使用することができるので、本プロトコルの適用は、本明細書に記載される分子に限定されない。モジュラープラットフォーム、すなわちpaBhcケージグループを使用して、所望のケージ化合物を簡単に調製することができ、その物理的および化学的特性は、クリック修飾を介して変調することができます。
開示事項
何も開示することはない
謝辞
本研究は、JSPS KAKENHI助成金番号JP16H01282(TF)、革新的分野の科学研究助成金「メモリーダイナミズム」、JP19H05778(TF)、「MolMovies」の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
参考文献
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved