Method Article
Conception, synthèse et propriétés photochimiques des composés en cage cliquables
Dans cet article
Résumé
Un protocole pour la synthèse et la mesure des propriétés photochimiques des composés modulaires en cage avec des moieties cliquables est présenté.
Résumé
Les composés en cage permettent la manipulation photo-négociée de la physiologie cellulaire avec la résolution spatiotemporal élevée. Cependant, la diversité structurelle limitée des groupes de mise en cage actuellement disponibles et les difficultés de modification synthétique sans sacrifier leur efficacité de la photolyse sont des obstacles à l'élargissement du répertoire des composés en cage pour les cellules vivantes Applications. Comme la modification chimique des groupes de photo-cage de type coumarin est une approche prometteuse pour la préparation de composés en cage avec diverses propriétés physiques et chimiques, nous rapportons une méthode pour la synthèse des composés en cage cliquables qui peuvent être modifiés facilement avec diverses unités fonctionnelles par l'intermédiaire de la cyclisation de Huisgen de cuivre (I)-catalysé. La molécule de plate-forme modulaire contient un groupe (6-bromo-7-hydroxycoumarin-4-yl)methyl (Bhc) en tant que groupe photo-caging, qui présente une efficacité élevée de photolyse par rapport à ceux des 2-nitrobenzyls conventionnels. Des procédures générales pour la préparation des composés en cage cliquables contenant des amines, des alcools et des carboxylates sont présentées. D'autres propriétés telles que la solubilité de l'eau et la capacité de ciblage cellulaire peuvent être facilement incorporées dans des composés en cage cliquables. En outre, les propriétés physiques et photochimiques, y compris le rendement quantique de la photolyse, ont été mesurées et se sont avérées supérieures à celles des composés en cage Bhc correspondants. Le protocole décrit pourrait donc être considéré comme une solution potentielle au manque de diversité structurelle dans les composés en cage disponibles.
Introduction
Les composés en cage sont des molécules synthétiques conçues dont les fonctions d'origine sont masquées temporellement par des groupes de protection photo-amovibles covalents. Fait intéressant, les composés en cage de molécules biologiquement pertinentes fournissent une méthode indispensable pour le contrôle spatiotemporal de la physiologie cellulaire1,2,3,4,5 ,6. En 1977, Engels et Schlaeger ont signalé l'ester 2-nitrobenzyl de cAMP comme dérivé perméable et photolabile de la membrane 7. L'année suivante, Kaplan a signalé le 1-(2-nitrophenyl)ester éthylique de l'ATP (NPE-ATP) et a nommé ce composé "caged" ATP8. Depuis lors, une gamme de groupes de protection photochimiquement amovibles tels que 2-nitrobenzyls, p-hydroxyphényacyls9, 2-(2-nitrophenyl)ethyls10,11, 7-nitroindolin-1-yls12, 13, et (coumarin-4-yl)méthyls14,15,16 ont été utilisés pour la préparation de composés en cage.
On s'attendrait à ce que la synthèse des composés en cage avec des propriétés additionnelles souhaitables telles que la perméabilité de membrane, la solubilité d'eau, et la capacité de ciblage cellulaire facilite des applications biologiques de cellules. Étant donné que les propriétés physiques et photochimiques de ces molécules dépendent principalement de la structure chimique des groupes de protection photochimiquement amovibles utilisés pour les préparer, un répertoire diversifié de groupes de photo-cage est nécessaire. Cependant, la diversité structurelle des groupes de mise en cage actuellement disponibles qui présentent une grande efficacité en matière de photolyse est limitée. Cela pourrait être un obstacle à l'augmentation de l'utilisation de composés en cage.
Pour résoudre ce problème, le répertoire des groupes de photo-cage a été élargi par la modification chimique des groupes de protection photoamovibles existants ou la conception de nouveaux chromophores photolabile avec des propriétés photophysiques et photochimiques supérieures. Par exemple, nitrodibenzofuran (NDBF)17, [3-(4,5-dimethoxy-2-nitrophenyl)-2-butyl] (DMNPB)18,19, un calcium sensible 2-nitrobenzyl photocage20, remplacé coumarinylmethyls (DEAC45021 , DEAdcCM22, 7-azetidinyl-4-methylcoumarin23, et styryl coumarins24), dérivés de la cyanine (CyEt-pan)25, et les dérivés BODIPY26,27.
En outre, nous avons précédemment développé le (6-bromo-7-hydroxycoumarin-4-yl)méthyl (Bhc) groupe et avec succès synthétisé divers composés en cage des neurotransmetteurs28, deuxième messagers29,30, et oligonucléotides31,32,33 présentant de grandes sections d'excitation d'un et deux photons. Si des propriétés supplémentaires peuvent être installées facilement dans les groupes de mise en cage sans compromettre leur photosensibilité, alors le répertoire des composés en cage peut être élargi34,35,36, 37,38,39. Nous avons donc conçu des composés modulaires en cage qui comprennent trois parties, à savoir le groupe Bhc comme un noyau photo-réactif, poignées chimiques pour l'installation de fonctionnalités supplémentaires, et les molécules qui doivent être masqués40, 41.
Ainsi, cet article fournit une méthode pratique pour la préparation des composés en cage de molécules biologiquement pertinentes. Le présent protocole décrit les méthodes de préparation d'une plate-forme cliquable pour les groupes de photo-cage, l'introduction de fonctionnalités supplémentaires pour élargir le répertoire des composés en cage, la mesure de leur physique et photochimique et le ciblage sélectif de type cellulaire d'un composé en cage cliquable pour une application cellulaire ultérieure.
Protocole
1. Synthèse du groupe modulaire de paBhc de mise en cage pour les composés en cage cliquables28,41
-
Préparation du chlorure de méthyle (6-bromo-7-hydroxycoumarin-4-yl) (Bhc-CH2Cl)
- Placer 4-bromoresorcinol (9.742 g, 51.5 mmol) dans un flacon rond de 100 ml équipé d'une barre d'agitateur.
- Ajouter le conc. H2SO4 (98%, 30 ml) au flacon et remuer le mélange pour dissoudre.
- Ajouter l'éthyle 4-chloroacetoacetate (10 ml, 74 mmol) goutte à goutte.
- Continuer à remuer le mélange à température ambiante pendant 5 jours.
- Séparément, déposer les glaçons concassés (200 ml) dans un flacon Erlenmeyer de 500 ml.
- Verser le mélange de réaction dans la glace et remuer vigoureusement pendant 30 min jusqu'à ce qu'un précipité finement en poudre soit obtenu.
- Recueillir le précipité par filtration sous vide. Laver le précipité brun clair avec de l'eau cinq fois.
- Séchez le précipité sous vide pendant la nuit pour produire BhcCH2Cl sous forme de poudre brun clair (13,57 g, 46,9 mmol).
-
Préparation du méthanol (6-bromo-7-hydroxycoumarin-4-yl) (BhcCH2OH)
- Placer le BhcCH2Cl (1,1440 g, 3,95 mmol) et 1 M HCl (300 ml) dans un flacon à fond rond de 1 L équipé d'un condenseur Dimroth. Remuer le mélange à 140 oC pendant 5 jours. Après ce temps, refroidir le mélange à température ambiante.
- Retirer l'eau de la réaction par évaporation rotative sous vide pour donner BhcCH2OH (1) sous forme de poudre brun clair (1,0359 g, 3,82 mmol, rendement de 97 %).
REMARQUE: L'utilisation de 250 ml de 1 M HCl par 1 g de BhcCH2Cl donne un résultat satisfaisant.
-
Préparation de paBhcCH2OH (2) via la réaction de Mannich
- Placer le paraformaldéhyde (446,4 mg, 14,9 mmol) dans un flacon à fond rond de 50 ml. Ajouter l'éthanol anhydre (5 ml) et le n-méthylpropargylamine (1,25 ml, 14,8 mmol) dans le flacon.
- Remuer le mélange à température ambiante pendant 1 h sous une atmosphère Ar.
- Ajouter BhcCH2OH (1) (1,367 g, 5,04 mmol) au flacon. Chauffer le mélange à 80 oC à l'infinicisation d'un appareil chauffant et continuer à remuer le mélange à 80 oC pendant 2 h sous une atmosphère Ar.
- Arrêter le chauffe-bloc et refroidir le mélange de réaction à température ambiante.
- Recueillir le précipité brun-jaune qui en résulte par filtration sous vide. Laver le précipité deux fois avec une petite quantité d'éthanol anhydre (1 mL à chaque fois).
- Retirer l'excès d'éthanol sous vide pour produire paBhcCH2OH (2) (1,393 g, 3,96 mmol).
2. Préparation de composés en cage cliquables
REMARQUE : Les procédures suivantes peuvent être appliquées à la préparation d'autres composés en cage cliquables contenant des groupes fonctionnels d'hydroxyle, d'amino et de carboxylate.
-
Procédure générale 1 : Préparation d'une mine en cage cliquable
- Placer paBhcCH2OH (2) (709,6 mg, 2,02 mmol) et N,N'-carbonyl diimidazole (CDI, 397,6 mg, 2,45 mmol) dans un flacon à fond rond de 30 ml. Ajouter le CH2Cl 2 sec sec(6 ml) et remuer la solution à température ambiante pendant 1 h.
- Ajouter 4-dimethylaminopyridine (4-DMAP, 324.8 mg, 2.66 mmol) et tert-butyl (6-aminohexyl)carbamate (533.1 mg, 2.46 mmol). Remuer la solution à température ambiante pendant 3 h.
- Retirez le solvant et d'autres matériaux volatils à l'aide d'un évaporateur rotatif sous vide. Purifiez le résidu directement à l'aide de la chromatographie de colonne flash de gel de silice.
-
Procédure générale 2 : Préparation d'un alcool en cage cliquable
- Placer le paclitaxel (PTX, 48,7 mg, 0,057 mmol) dans un flacon à fond rond de 30 ml équipé d'un stopcock à trois voies et d'un ballon Ar. Ajouter le CH2Cl2 sec (1 ml), le 4-DMAP (17,1 mg, 0,14 mmol) et le chloroformate à 4 nitrophenyl (26,0 mg, 0,13 mmol).
- Remuer la solution à température ambiante pendant 2,5 h sous une atmosphère Ar.
- Ajouter 4-DMAP (15,7 mg, 0,13 mmol) et paBhcCH2OH (2) (39,1 mg, 0,111 mmol) à la solution. Continuer à remuer le mélange à température ambiante pendant 17 h.
- Ajouter chCl3 (10 ml) et 15 % de NaHCO3 (5 ml) aqueux au mélange. Remuer le mélange vigoureusement pendant environ 3 min. Retirer la couche aqueuse à l''adresse d'une pipette.
- Ajouter 0,5 M d'acide citrique (5 ml) au flacon contenant la couche organique. Remuer le mélange et retirer la couche aqueuse comme ci-dessus.
- Séparer la couche organique à l'aide d'une colonne de séparation de phase. Retirer les solvants à l'effet d'un évaporateur rotatif sous vide. Purifez le produit à l'aide de la chromatographie standard de colonne flash de gel de silice.
-
Procédure générale 3 : Préparation d'un acide carboxylique en cage cliquable
- Dissoudre l'acide arachidonique (33,0 l, 0,100 mmol), le paBhcCH2OH (2) (39,6 mg, 0,112 mmol) et le 4-DMAP (14,1 mg, 0,115 mmol) dans le CHsec 2Cl2 (2 ml). Ajouter N, N -diisopropylcarbodiimide (DIPC, 17,0 l, 0,110 mmol) et remuer la solution à température ambiante pendant 140 min.
- Retirer le solvant sous vide. Purifiez le résidu directement à l'aide de la chromatographie de colonne flash de gel de silice.
3. Installation d'une unité fonctionnelle dans les composés en cage cliquables
- Dissoudre le cuivre(II) pentahydrate de sulfate (249 mg) dans l'eau échangée aux ions (IEW, 10 ml) pour donner une solution De 0,1 M CuSO4.
- Dissoudre 2'-paBhcmoc-PTX (8.0 mg, 6.5 'mol), tris(3-hydroxypropyltriazolylmethyl)amine (THPTA, 17,5 mg, 40,3 'mol), sodium l-ascorbate (162,4 mg, 0,825 mmol), et 15-chloro-3,6,9-trioxapentadecyl azide (3,1 mg, 11 'mol) dans un solvant mixte de 0,1 M phosphate tampon (2,5 mL, pH 7,2) et sulfoxide de diméthyle (DMSO, 0,5 mL).
- Ajouter la solution De 0,1 M CuSO4 (81,2 l, 8,1 'mol) au mélange de réaction. Remuer le mélange à température ambiante pendant 80 min. Surveillez la progression de la réaction à l'aide d'une chromatographie liquide à haute performance (HPLC).
- Dissoudre les précipités en ajoutant une solution acétonitrile/eau de 75 % (3,5 ml). Appliquer la solution résultante directement sur le système semi-préparatif HPLC pour purifier le produit désiré.
REMARQUE: Solubilisation du mélange de réaction par l'ajout de tert-butanol peut accélérer la progression de la réaction.
4. Réaction de désencombrement photolytique des composés en cage
- Préparation des solutions de stock
- Dissoudre le composé en cage désiré (5 'mol) dans DMSO (500 'L) pour préparer une solution de stock de 10 mM. Distribuer un aliquot de chaque solution (10 l) dans un tube microcentrifuge de 1,5 ml et conserver dans un congélateur (environ 20 oC) jusqu'à l'utilisation juste avant.
- 6 mM K3[Fe(C2O4)3] (100 ml) : Dissoudre le ferrioxalate de potassium recristallisé (0,295 g, 0,675 mmol) dans 80 ml d'eau. Ajouter 0,5 M H2SO4 (10 ml) et une quantité appropriée d'IEW pour compenser le volume à 100 ml.
REMARQUE : Le ferrioxalate de potassium doit être purifié par recrystallisation de l'eau chaude et stocké dans l'obscurité. Le ferrioxalate de potassium recrystallisé est obtenu comme trihydrate ; par conséquent, sa formule est K3[Fe(C2O4)3] 3H2O et un poids de formule de 491,24 devrait être pris en considération lors de la préparation de la solution de stock. Vérifiez la pureté de la solution de 6 mM en mesurant son absorption à 510 nm. Si l'absorption est de 0,02, elle convient à une utilisation dans l'expérience. - 0,1 % De tampon-phen (30 ml) : Dissoudre NaOAc-3H2O (7,35 g), 1,10-phénanthroline (phen) H2O (30 mg), et conc. H2SO4 (0,9 ml) en IEW (20 ml). Ajouter IEW pour faire le volume à 30 ml.
REMARQUE: La solution contient 1,8 M NaOAc, 0,54 M H2SO4, et 0,1% 1,10-phénanthroline.
- Mesure du nombre de photons à l'aide de l'actinométrie ferrioxalate
- Placer 6 mM K3[Fe(C2O4)3] (V1 L) dans une cuvette de quartz. Irradier la solution avec 350 nm de lumière pour 5 s.
- Transférer la solution irradiée dans une cuvette Pyrex avec une longueur de chemin l [cm].
- Ajouter 0,1 % de tampon-phen(V2 L) à la solution d'échantillon irradiée et bien mélanger par pipetting. Mesurer l'absorption de l'échantillon à 510 nm. Calculer le changement d'absorption moyen par unité de temps (A510 [s'1]).
- Calculez le nombre de grains de beauté générés par 2 ionspar unité selon l'équation suivante :
nFe2 '[mol s'1] ' ((V1 ' V2) [L] ' 'A510 [s '1]]/(l [cm] '' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' '
où (V1 - V2) est le volume de l'échantillon pour la mesure d'absorption, l est la longueur de la trajectoire optique de la cuvette, et510 est l'absorptivité molaire de la Fe 2- complexe phen à 510 nm.
REMARQUE : Dans les conditions expérimentales typiques, les valeurs de V1 ' 2.0 '10'3 L, V2 '0.33 '10'3 L, l '1.0 cm, et'510 '1.1 '1'10 4 L mol'1 cm1 ont été utilisés. - Calculer le nombre de grains de beauté de photons qui atteignent l'échantillon (I0) en utilisant la formule suivante:
I0 [einstein cm'2 s'1] ' nFe2 '/350
où 350 euros est l'efficacité quantique de la photoréduction du ferrioxalate à 350 nm.
REMARQUE : Bien que l'efficacité quantique de l'actinomètre de ferrioxalate de potassium à 350 nm ne soit pas rapportée, la valeur rapportée de 1.2542 à 358 nm a été employée.
- Mesures d'efficacité quantique à 350 nm
- Diluer la solution de stock d'échantillon (dans DMSO, 10 'L) avec le tampon K-MOPS (pH 7.2, 10 mL) pour donner une solution de 10 M dans K-MOPS contenant 0,1% de DMSO.
REMARQUE : Le tampon K-MOPS se composait de 100 mMKCl et de 10 mM 3-(N-morpholino)propanesulfonic acid (Mops) titrated to pH 7.2 with KOH. - Transférer un aliquot de la solution(V1 L) dans la même cuvette utilisée dans la photoréaction de l'actinomètre chimique. Irradiez la solution d'échantillon en utilisant la même configuration que décrite à l'étape 4.2.1.
- Retirez périodiquement un aliquot (50 l) de la solution irradiée et analysez à l'aide de HPLC.
- Déterminer le temps d'irradiation, en secondes, dans lequel 90% du matériau de départ a réagi (t90%)en ajustant des parcelles de la disparition dépendante du temps du matériau de départ.
REMARQUE : L'absorption de l'échantillon irradié doit être maintenue à l'indice lt;0.1 afin que le filtrage interne du rayonnement puisse être négligé. Il est souhaitable que la consommation photolytique du matériau de départ puisse être approximative par une désintégration mono-exponentielle de sorte qu'il n'y ait pas d'effet secondaire indésirable qui interfère avec le processus de photolyse. - Calculer le rendement quantique de la disparition ('dis) en utilisant l'équation suivante28:
Dis 1/(t90% - I0 - 350)
où t90% [s] est le temps d'irradiation dans lequel 90% du matériel de départ a été consommé, I0 [einstein cm2 s1] est le nombre de grains de beauté de photons, et'350 [cm 2 mol1] est le coefficient d'extinction décodique de l'échantillon à 350 nm.
REMARQUE :350 [cm2 mol1] 103à350 [M1 cm1].
- Diluer la solution de stock d'échantillon (dans DMSO, 10 'L) avec le tampon K-MOPS (pH 7.2, 10 mL) pour donner une solution de 10 M dans K-MOPS contenant 0,1% de DMSO.
5. Ciblage d'un composé en cage cliquable avec un ligand HaloTag
REMARQUE : Avant utilisation, maintenez les cellules HeLa dans le milieu eagle modifié de Dulbecco (DMEM, faible teneur en glucose, pyruvate de sodium, l-glutamine) complété par 10 % de sérum bovin fœtal (FBS) contenant 1 % d'antibiotiques (sulfate de streptomycine, pénicilline G et amphotérine) à 37 oC et 5 % CO2.
- Enlever le milieu et trypsiniser les cellules en traitant avec de l'acide trypsin-éthylènediaminetetraacetic (EDTA, 1 ml) à 37 oC pendant 1 min. Ajouter d'autres DMEM (4 ml) aux cellules et les suspendre à nouveau en faisant du tuyautage en douceur. Ensemencez environ 5 à 105 cellules par plat dans des plats de fond en verre de 35 mm dans le DMEM (2 ml) 24 h avant la transfection.
- Pour quatre plats, dans un tube microcentrifuge de 1,5 ml, diluer l'ADN plasmide (pcDNA3-Halo-EGFR, 14 g) dans le milieu sérique réduit (700 l). Séparément, diluer le réactif lipofection (5 l) dans le milieu sérique réduit (150 l) dans chacun des quatre tubes et les laisser reposer à température ambiante pendant 5 min.
- Ajouter une partie de l'ADN plasmide dilué (150 l) à chacun des échantillons dilués de réactif de lipofection. Incuber à température ambiante pendant 5 min.
- Après avoir maintenu les cellules à 37 oC et 5 % de CO2 pendant 24 h, aspirer le DMEM et rincer les cellules à la saline tamponnée par le phosphate (PBS, 2 ml). Ajouter le milieu sérique réduit (1,5 ml).
- Ajouter le réactif plasmi-lipofection (150 l) complexe à chaque plat. Maintenir les cellules à 37 oC et 5 % de CO2 pendant 48 h.
- Aspirez le milieu, ajoutez une portion de DMEM fraîchement préparé (1 ml) contenant 2 M paBhc-hex-FITC/Halo, et incubez les cellules à 37 oC et 5 % de CO2 pendant 30 min.
- Aspirez le milieu contenant le composé en cage et rincez les cellules deux fois avec pbSMD (1 ml par rinçant) pour enlever les composés non liés. Ajouter le milieu sérique réduit (500 l) et incuber les cellules à 37 oC et 5 % de CO2 pendant 30 min pour enlever les composés qui sont entrés dans les cellules.
REMARQUE : Le PBSMD est salin tamponné par phosphate complété par 2 mM CaCl2 et 1 mM MgCl2. - Retirer le milieu et rincer les cellules deux fois avec pbSMD (1 ml). Ajouter une portion d'un milieu (1 ml) qui ne contient pas de rouge phénol. Enregistrez les images de fluorescence par microscopie de fluorescence confocale à balayage laser.
6. Modulation photomédiatée d'une localisation kinase à l'aide d'un composé en cage cliquable
REMARQUE : Avant d'utiliser, maintenez les cellules CHO-K1 dans le milieu F-12 de Ham complétée s'il y a 10 % de FBS à 37 oC et 5 % de CO2.
- Préparer une solution de travail de 100 m (1 mM) de paBhc-AA (5) en DMSO.
REMARQUE : Une solution de bouillon de 10 mM du composé est préparée et entreposée dans un congélateur (-20 oC). - Ensemencez environ 5 à 105 cellules par plat dans des plats de fond en verre de 35 mm dans le DMEM (2 ml) 24 h avant la transfection.
- Cellules CHO-K1 transfect avec un codage plasmide pour GFP-DGK 48 h avant les expériences de déminage.
REMARQUE : La transfection se fait selon les étapes 5.2-5.5. - Remplacer le milieu par un milieu sérique réduit (2 ml). Ajouter la solution de travail de 100 paBhc-AA (20 l) et incuber les cellules à 37 oC et 5 % de CO2 pendant 5 min à 1 h.
REMARQUE : Le temps de chargement dépend du composé utilisé. - Placez les cellules à l'étape objective d'un microscope fluorescent inversé équipé d'un enlumineur à double source de fluorescence.
- Prenez une image fluorescente tous les 10 s. Irradier les cellules avec 330 à 385 nm de lumière à travers un objectif de microscope pour un moment approprié. Alternativement, irradier les cellules avec la lumière de 405 nm utilisant une lampe Xe par des fibres flexibles de quartz.
- Continuez d'enregistrer des images fluorescentes pendant 10 min.
Résultats
Des composés en cage cliquables de certaines molécules biologiquement intéressantes, y compris l'acide arachidonique et le paclitaxel, ont été synthétisés avec succès (Figure 1)28,41. D'autres propriétés telles que la solubilité de l'eau et la capacité de ciblage cellulaire ont été introduites dans le paBhcmoc-PTX par l'intermédiaire de la cyclisation huisgen catalysée par le cuivre (I) (« Cliquez » réaction) (Figure 2). Ces PTX en cage cliquables ont ensuite été photolyzed pour produire leurs PTX parents sur irradiation à 350 nm (figure 3), et les propriétés physiques et photochimiques des composés en cage cliquables sont résumées dans le tableau 1. Les rendements quantiques des composés en cage cliquables 2 'glc-paBhcmoc-PTX('dis 0.14) et paBhc-AA ('dis 0.083) étaient plus de deux fois ceux des composés en cage bhc conventionnels 2'-Bhcmoc-PTX ('dis 0,040) et Bhc-AA (-0,038)43. En outre, une solubilité améliorée de l'eau a été observée pour 2 'glc-paBhcmoc-PTX, qui contient une moiety de glucose.
Dans les expériences de cellules vivantes, le ciblage de paBhc-hex-FITC/Halo aux cellules cultivées de mammifères exprimant transitoirement une protéine de fusion d'une protéine de HaloTag et d'un récepteur épidermique de facteur de croissance (EGFR) a été réalisé avec succès. La fluorescence verte de la moiety de fluorescein de paBhc-hex-FITC/Halo a été observée sur la membrane cellulaire (figure 4). La modulation photo-négociée de la localisation subcellulaire d'un kinase a été réalisée utilisant un composé en cage de paBhc. La translocation de la kinase diacylglycérol (DGKMD) a été signalée comme activée en présence d'acide arachidonique (AA)44. Les cellules CHO-K1 exprimant transitoirement GFP-DGKMD ont été traitées avec AA ou paBhc-AA (5). L'addition des AA a causé la modulation de la localisation subcellulaire de la DGKMD (Figure 5A,B). Des changements similaires dans la localisation de la DGKMD ont été observés pour les cellules traitées paBhc-AA après l'exposition à la lumière UV (Figure 5C,D).
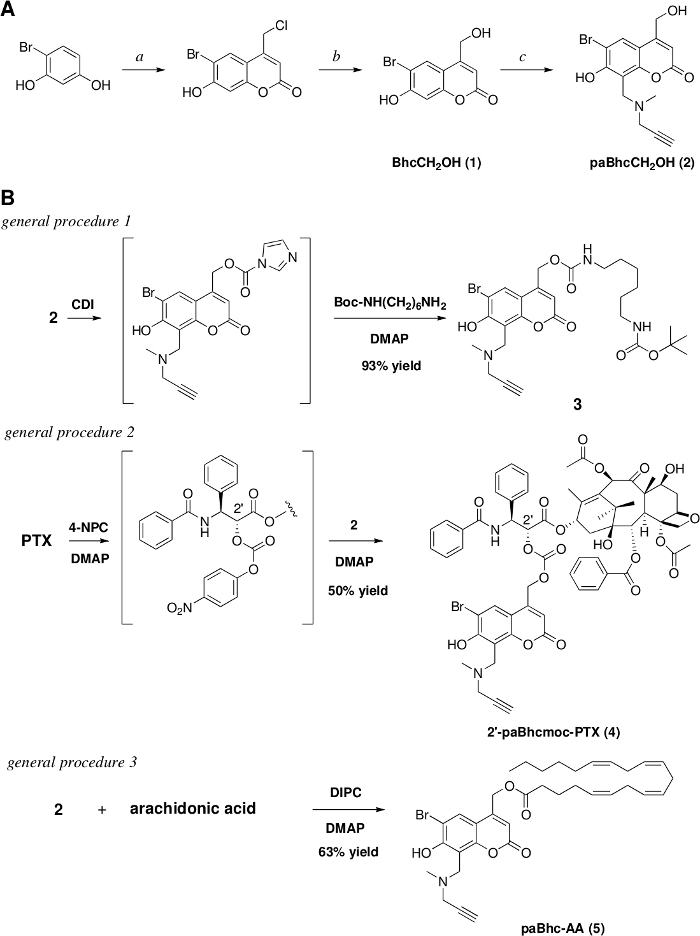
Figure 1 : Préparation des composés en cage cliquables.
(A) Réactifs et conditions : a. éthyle 4-chloroacetoacetate/conc. H2SO4/rt/7 days/91% yield, b. 1 M HCl/reflux/3 days/97% yield. c. N-méthylpropargylamine /HCHO/EtOH, puis ajouter (1) et chauffer au reflux pour 17 h/79% de rendement. (B) Synthèses de l'amine en cage cliquable, PTX, et l'acide arachidonique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Installation d'unités fonctionnelles dans des composés en cage cliquables.
(A) Synthèse d'un PTX en cage soluble dans l'eau via la cyclisation de Huisgen catalysée par le cuivre (I)-catalysé. (B) Structures de composés en cage cliquables contenant le ligand HaloTag pour le ciblage cellulaire. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
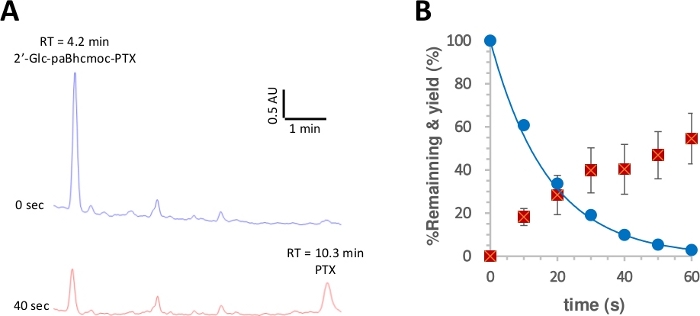
Figure 3 : Photolyse de 2 'glc-paBhcmoc-PTX (6).
Les échantillons (10 M) de la solution K-MOPS (pH 7,2) ont été irradiés à 350 nm. (A) Traces typiques de HPLC pour la photolyse de 6 (mesurée à 254 nm). Des échantillons ont été analysés au moment d'irradiation spécifié. (B) Temps de cours pour la photolyse de 6. Les cercles bleus montrent la consommation de 6. La ligne solide montre la courbe la moins carrée pour un exponentiel en décomposition simple pour 6. Les carrés rouges montrent le rendement de PTX. Les barres d'erreur représentent l'écart type (SD). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Images de fluorescence de cellules de mammifères cultivées incubées avec paBhc-hex-FITC/Halo (8).
Les cellules transfectées avec pcDNA3-Halo-EGFR ont été incubées avec une solution de 2 M M du composé 8 à 37 oC pendant 30 min. Les images ont été obtenues après lavage répété avec PBS. Cellules HEK293T traitées par mock(A: contraste différentiel d'interférence (DIC) image et D: image de fluorescence). HEK293T cellules (B et E) et heLa cellules (C et F) exprimant transitoirement Halo-EGFR (B et C: images DIC et E et F: images fluorescence). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Images de fluorescence après irradiation UV des cellules CHO-K1 incubées avec de l'acide arachidonique en cage de Bhc. Les cellules CHO-K1 ont été transfectées avec une protéine de fusion DGKMD-EGFP.
(A) Une image de fluorescence des cellules transfectées. (B) 100 s après l'ajout d'une solution de 10 M d'acide arachidonique. (C) Les cellules ont été incubées avec une solution de 10 M de paBhc-AA (5) à 37 oC pendant 5 min. (D) 100 s après irradiation UV de 20 s (330 à 385 nm). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Composés | max (nm)a | max (M-1 cm-1)b | disc | Disd | Solubilité (M)e |
| Ptx | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2'-paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2'-glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA (bhc-AA) | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
Tableau 1 : Propriétés physiques et photochimiques des composés en cage cliquables.
a. Absorption maximum (nm), b. Molar absorptivité à'max (M'1 cm'1), c. Rendement quantique de la disparition des matériaux de départ à 350 nm, d. Le produit de l'absorptivité molaire et le rendement quantique de la disparition à 350 nm, e. La concentration de la solution saturée en K-MOPS (pH 7,2) (g mL1).
Discussion
Nous avons précédemment développé des composés en cage Bhc de diverses molécules biologiquement actives qui présentent des efficacités photolytiques élevées28,45,46,47. Dans le but d'élargir le répertoire des groupes de mise en cage Bhc, nous avons également signalé des plates-formes de composés modulaires en cage qui peuvent être modifiés facilement par l'introduction de diverses unités fonctionnelles32,40,41. Le protocole actuel représente donc une méthode de synthèse d'un précurseur cliquable de groupes de cages Bhc qui peuvent être modifiés par l'intermédiaire de la cyclisation huisgen catalysée par le cuivre (I) catalysée. La synthèse du précurseur cliquable, paBhcCH2OH (2), a été réalisée par une séquence de réaction en quatre étapes à partir du 4-bromoresorcinol disponible dans le commerce (Figure 1A). L'avantage du protocole actuel est qu'aucune étape laborieuse de purification (par exemple, séparations chromatographiques de colonne) n'est exigée.
Comme précurseur cliquable paBhcCH2OH (2) peut être utilisé pour masquer divers groupes fonctionnels, les composés en cage cliquables d'amines, d'alcools et d'acides carboxyliques ont été synthétisés à l'aide de 2 comme précurseur (Figure 1B). Les amines ont été modifiées comme leurs carabines tandis que les alcools ont été modifiés comme leurs carbonates. Dans les procédures générales 1 et 2, CDI a été utilisé pour la préparation de carbamates cliquables, tandis que le chloroformate 4-nitrophenyl a été utilisé pour la préparation de carbonates. Comme l'indique le mécanisme de réaction, les deux réactifs peuvent être utilisés pour la préparation des carbamates et des carbonates. Il convient également de noter que le rendement du composé en cage désiré dépend de la structure chimique de la molécule à mettre en cage. D'autres exemples peuvent être vus dans nos rapports précédents28,30,33,48.
La modification de clic a ensuite été effectuée en utilisant une légère modification de la procédure déclarée49. L'ajout de ligands à base de tris (triazolylmethyl) est nécessaire pour obtenir les produits désirés dans des rendements bons à élevés. Étant donné qu'une variété d'azides sont facilement accessibles à la fois de sources commerciales et de procédures de littérature, nous pouvons préparer divers composés modulaires en cage avec des propriétés supplémentaires telles que la solubilité de l'eau et la capacité de ciblage cellulaire (Figure 2).
Le rendement quantique de la photolyse a ensuite été mesuré selon une procédure rapportée28,50. La figure 3 montre que la consommation photolytique de 2 'glc-paBhcmoc-PTX et la libération de PTX ont été approximatives par la désintégration et l'élévation mono-exponentielle, respectivement, suggérant aucun filtrage intérieur du rayonnement ou des effets secondaires indésirables. Des rendements quantiques améliorés de photolyse() et des efficacités de photolyse ()ont été observés pour les composés en cage de paBhc cliquables comparés à ceux des composés en cage de Bhc précédemment rapportés (tableau 1)41, 43. Étant donné que l'efficacité de la photolyse() des composés en cage de Bhc sont plus de cent fois plus élevées que celles des composés en cage de type 2-nitrobenzyl48, l'amélioration marquée due à la présence de groupes de cinage paBhc est clairement un avantage pour ce système.
Comme une expérience de preuve de concept, une moiety hydrophile a été introduite dans 2 '-paBhcmoc-PTX (4) et un ligand de ciblage cellulaire a été introduit dans le composé 3 (Figure 2). La solubilité de l'eau de 2 'glc-paBhcmoc-PTX était 650 fois plus élevée que celle de la mère PTX (tableau 1). Le ciblage cellulaire sélectif a été réalisé à l'aide d'un système de sonde d'étiquettes, et paBhcmoc-hex-FITC/Halo (8) portant le ligand HaloTag a été ciblé avec succès sur la membrane cellulaire des cellules mammifères cultivées exprimant la protéine de fusion HaloTag/EGFR ( Figure 4). La modulation photo-négociée de la localisation subcellulaire d'une kinase a également été réalisée à l'aide d'un composé en cage cliquable 5 (figure 5).
En conclusion, nous avons démontré avec succès une méthode pour la préparation de plates-formes cliquables pour les composés photo-caged des molécules biologiquement intéressantes qui peuvent être modifiés facilement avec des propriétés additionnelles, telles que la solubilité d'eau et un cellulaire capacité de ciblage. Puisque le groupe de mise en cage de paBhc peut être employé pour préparer n'importe quelle molécule avec des groupes fonctionnels modifiables, l'application du protocole actuel n'est pas limitée aux molécules décrites ci-contre. À l'aide d'une plate-forme modulaire, à savoir le groupe de mise en cage paBhc, les composés en cage désirés peuvent être facilement préparés, et leurs propriétés physiques et chimiques peuvent être modulées par modification de clic.
Déclarations de divulgation
Nous n'avons rien à divulguer.
Remerciements
Ce travail a été soutenu par jSPS KAKENHI numéro de subvention JP16H01282 (TF), une subvention pour la recherche scientifique sur les domaines innovants "Memory Dynamic," et JP19H05778 (TF), "MolMovies".
matériels
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
Références
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon