Method Article
Diseño, síntesis y propiedades fotoquímicas de compuestos enjaulados enjaulados clicables
En este artículo
Resumen
Se presenta un protocolo para la síntesis y medición de las propiedades fotoquímicas de compuestos modulares enjaulados con mitades clicables.
Resumen
Los compuestos enjaulados permiten la manipulación fotomediada de la fisiología celular con alta resolución espaciotemporal. Sin embargo, la limitada diversidad estructural de los grupos de entramado actualmente disponibles y las dificultades en la modificación sintética sin sacrificar sus eficiencias de fotólisis son obstáculos para ampliar el repertorio de compuestos enjaulados para células vivas Aplicaciones. Como la modificación química de los grupos foto-caging tipo cumarina es un enfoque prometedor para la preparación de compuestos enjaulados con diversas propiedades físicas y químicas, informamos de un método para la síntesis de compuestos enjaulados clicables que se pueden modificar fácilmente con varias unidades funcionales a través de la ciclaización Huisgen catalizada por cobre(I). La molécula de plataforma modular contiene un grupo (6-bromo-7-hidroxicoumarin-4-yl)metil (Bhc) como un grupo de foto-caging, que exhibe una alta eficiencia de fotólisis en comparación con las de los 2-nitrobenzyls convencionales. Se presentan procedimientos generales para la preparación de compuestos enjaulados enjaulados en los que se puede hacer clic que contienen aminas, alcoholes y carboxilatos. Propiedades adicionales como la solubilidad del agua y la capacidad de segmentación celular se pueden incorporar fácilmente en compuestos enjaulados enjaulados clicables. Además, se midieron las propiedades físicas y fotoquímicas, incluido el rendimiento cuántico de fotólisis, que fueron superiores a las de los compuestos enjaulados Bhc correspondientes. Por lo tanto, el protocolo descrito podría considerarse una solución potencial para la falta de diversidad estructural en los compuestos enjaulados disponibles.
Introducción
Los compuestos enjaulados están diseñados moléculas sintéticas cuyas funciones originales están enmascaradas temporalmente por grupos de protección fotoextraíbles conectados covalentemente. Curiosamente, los compuestos enjaulados de moléculas biológicamente relevantes proporcionan un método indispensable para el control espaciotemporal de la fisiología celular1,2,3,4,5 ,6. En 1977, Engels y Schlaeger informaron el éster 2-nitrobenzyl de cAMP como una membrana permeable y derivado fotolabile del cAMP7. Al año siguiente, Kaplan informó el éster de 1-(2-nitrofenilo)etil de ATP (NPE-ATP) y nombró a este compuesto "enjaulado" ATP8. Desde entonces, una gama de grupos de protección fotoquímicamente extraíbles tales como 2-nitrobenzyls, p-hidroxifenazcils9, 2-(2-nitrofenil)etils10,11, 7-nitroindolin-1-yls12, 13,y (coumarin-4-yl)metils14,15,16 se han utilizado para la preparación de compuestos enjaulados.
Se espera que la síntesis de compuestos enjaulados con propiedades adicionales deseables, como la permeabilidad de la membrana, la solubilidad del agua y la capacidad de segmentación celular faciliten las aplicaciones biológicas celulares. Dado que las propiedades físicas y fotoquímicas de estas moléculas dependen principalmente de la estructura química de los grupos de protección fotoquímicamente extraíbles utilizados para prepararlas, se requiere un repertorio diverso de grupos foto-caging. Sin embargo, la diversidad estructural de los grupos de entramado disponibles actualmente que exhiben altas eficiencias de fotólisis es limitada. Esto podría ser un obstáculo para aumentar el uso de compuestos enjaulados.
Para abordar este problema, el repertorio de grupos foto-caging se ha ampliado mediante la modificación química de los grupos de protección fotoextraíbles existentes o el diseño de nuevos cromóforos fotolábilicos con propiedades fotofísicas y fotoquímicas superiores. Algunos ejemplos son nitrodibenzofurano (NDBF)17, [3-(4,5-dimetoxi-2-nitrofenilo)-2-butil] (DMNPB)18,19, una fojaula 2-nitrobenzyl sensible al calcio20, coumarinilmetils sustituidos (DEAC45021 , DEAdcCM22, 7-azetidinyl-4-methylcoumarin23, y cumarinas de estilpílica24), derivados de cianina (CyEt-pan)25, y derivados de BODIPY26,27.
Además, previamente desarrollamos el (6-bromo-7-hidroxicoumarin-4-yl)metil (Bhc) grupo y sintetizamos con éxito varios compuestos enjaulados de neurotransmisores28, segundomensajeros29,30,y oligonucleótidos31,32,33 que exhiben grandes secciones transversales de excitación de uno y dos fotones. Si las propiedades adicionales se pueden instalar fácilmente en los grupos de encedadiso sin comprometer su fotosensibilidad, entonces el repertorio de compuestos enjaulados se puede ampliar34,35,36, 37,38,39. Por lo tanto, diseñamos compuestos modulares enjaulados que comprenden tres partes, a saber, el grupo Bhc como un núcleo foto-responsivo, mangos químicos para la instalación de funcionalidades adicionales, y las moléculas que se van a enmascarar40, 41.
Por lo tanto, este artículo proporciona un método práctico para la preparación de compuestos enjaulados de moléculas biológicamente relevantes. El presente protocolo describe los métodos para la preparación de una plataforma en la que se puede hacer clic para grupos foto-caging, la introducción de funcionalidades adicionales para ampliar el repertorio de compuestos enjaulados, la medición de sus físicos y fotoquímicos propiedades, y la segmentación selectiva de tipo celular de un compuesto enjaulado enjaulado clicable para su posterior aplicación celular.
Protocolo
1. Síntesis del grupo paBhc de caging modular para compuestos enjaulados clicables28,41
-
Preparación de (6-bromo-7-hidroxicoumarina-4-yl)cloruro de metilo (Bhc-CH2Cl)
- Coloque 4-bromoresorcinol (9.742 g, 51,5 mmol) en un matraz de fondo redondo de 100 ml equipado con una barra de agitación.
- Agregue conc. H2SO4 (98%, 30 mL) al matraz y revuelva la mezcla para disolverla.
- Añadir etil 4-cloroacetoacetato (10 mL, 74 mmol) en sentido de gota.
- Continúe revolviendo la mezcla a temperatura ambiente durante 5 días.
- Por separado, coloque los cubitos de hielo triturados (200 ml) en un matraz Erlenmeyer de 500 ml.
- Vierta la mezcla de reacción en el hielo y revuelva vigorosamente durante 30 minutos hasta obtener un precipitado finamente en polvo.
- Recoger el precipitado a través de la filtración al vacío. Lave el precipitado marrón claro con agua cinco veces.
- Seque el precipitado al vacío durante la noche para producir BhcCH2Cl como polvo marrón claro (13,57 g, 46,9 mmol).
-
Preparación de (6-bromo-7-hidroxicoumarina-4-yl)metanol (BhcCH2OH)
- Coloque el BhcCH2Cl preparado (1.1440 g, 3.95 mmol) y 1 M HCl (300 mL) en un matraz de fondo redondo de 1 L equipado con un condensador Dimroth. Revuelva la mezcla a 140oC durante 5 días. Después de este tiempo, enfríe la mezcla a temperatura ambiente.
- Retire el agua de la reacción por evaporación rotativa al vacío para producir BhcCH2OH(1) como polvo marrón claro (1.0359 g, 3.82 mmol, 97% de rendimiento).
NOTA: El uso de 250 ml de 1 M HCl por 1 g de BhcCH2Cl da un resultado satisfactorio.
-
Preparación de paBhcCH2OH (2) a través de la reacción Mannich
- Coloque paraformaldehyde (446,4 mg, 14,9 mmol) en un matraz de fondo redondo de 50 ml. Añadir etanol anhidro (5 ml) y N-metilpropilemina (1,25 ml, 14,8 mmol) al matraz.
- Revuelva la mezcla a temperatura ambiente durante 1 h bajo una atmósfera ar.
- Añadir BhcCH2OH (1) (1.367 g, 5.04 mmol) al matraz. Calentar la mezcla a 80oC con un aparato calentador de bloques y continuar revolviendo la mezcla a 80oC durante 2 h bajo una atmósfera de Ar.
- Detenga el calentador de bloques y enfríe la mezcla de reacción a la temperatura ambiente.
- Recoger el precipitado marrón-amarillo claro resultante por filtración al vacío. Lavar el precipitado dos veces con una pequeña cantidad de etanol anhidro (1 ml cada vez).
- Retire el exceso de etanol al vacío para producir paBhcCH2OH (2) (1.393 g, 3.96 mmol).
2. Preparación de compuestos enjaulados enjaulados en los que se puede hacer clic
NOTA: Los siguientes procedimientos se pueden aplicar a la preparación de otros compuestos enjaulados enlosados en los que se puede hacer clic que contienen grupos funcionales hidroxilo, amino y carboxilato.
-
Procedimiento general 1: Preparación de una amina enjaulada enjaulada en la que se puede hacer clic
- Colocar paBhcCH2OH (2) (709,6 mg, 2,02 mmol) y N,N'-carbonimidazol (CDI, 397,6 mg, 2,45 mmol) en un matraz de fondo redondo de 30 ml. Añadir CH2Cl2 (6 mL) secos y agitar la solución a temperatura ambiente durante 1 h.
- Añadir 4-dimetilaminopiridina (4-DMAP, 324.8 mg, 2.66 mmol) y tert-butilo (6-aminohexyl)carbamato (533.1 mg, 2.46 mmol). Revuelva la solución a temperatura ambiente durante 3 h.
- Retire el disolvente y otros materiales volátiles utilizando un evaporador rotativo al vacío. Purifique el residuo directamente mediante la cromatografía de columna flash de gel de sílice.
-
Procedimiento general 2: Preparación de un alcohol enjaulado enjaulado en el que se puede hacer clic
- Coloque el paclitaxel (PTX, 48,7 mg, 0,057 mmol) en un matraz de fondo redondo de 30 ml equipado con un tapón de tres vías y un globo Ar. Añadir CH2Cl2 (1 mL), 4-DMAP (17,1 mg, 0,14 mmol) y 4-nitrofenil cloroformato (26,0 mg, 0,13 mmol).
- Revuelva la solución a temperatura ambiente durante 2,5 h bajo una atmósfera Ar.
- Añadir 4-DMAP (15,7 mg, 0,13 mmol) y paBhcCH2OH (2) (39,1 mg, 0,111 mmol) a la solución. Continúe revolviendo la mezcla a temperatura ambiente durante 17 h.
- Añadir CHCl3 (10 mL) y 15% acuoso NaHCO3 (5 mL) a la mezcla. Revuelva la mezcla vigorosamente durante aproximadamente 3 min. Retire la capa acuosa con una pipeta.
- Añadir 0,5 M de ácido cítrico (5 ml) al matraz que contiene la capa orgánica. Revuelva la mezcla y retire la capa acuosa como se ha dicho anteriormente.
- Separe la capa orgánica mediante una columna de separación de fases. Retire los disolventes con un evaporador rotativo al vacío. Purifique el producto utilizando la cromatografía de columna flash de gel de sílice estándar.
-
Procedimiento general 3: Preparación de un ácido carboxílico enjaulado enjaulado en lo que se puede hacer clic
- Disolver el ácido araquidónico (33,0 l, 0,100 mmol), paBhcCH2OH (2) (39,6 mg, 0,112 mmol) y 4-DMAP (14,1 mg, 0,115 mmol) en seco CH2Cl2 (2 ml). Añadir N,No-diisopropylcarbodiimide (DIPC, 17,0 l, 0,110 mmol) y agitar la solución a temperatura ambiente durante 140 min.
- Retire el disolvente al vacío. Purifique el residuo directamente mediante la cromatografía de columna flash de gel de sílice.
3. Instalación de una unidad funcional en los compuestos enjaulados enlos
- Disolver el sulfato de cobre (II) pentahidrato (249 mg) en agua intercambiada por iones (IEW, 10 mL) para dar una solución de 0,1 M CuSO4.
- Disolver 2o-paBhcmoc-PTX (8,0 mg, 6,5 émol), tris(3-hydroxypropltriazolylmethyl)amine (THPTA, 17,5 mg, 40,3 émol), l-ascorbato sódico (162,4 mg, 0,825 mmol) y 15-cloro-3,6,9-trioxapentadecilo ázide (3,1 mg, 11mol) en un disolvente mixto de 0.1 M fosfato) tampón (2,5 ml, pH 7,2) y dimetilsulfóxido (DMSO, 0,5 ml).
- Añadir la solución de CuSO4 de 0,1 M (81,2 l, 8,1 ml) a la mezcla de reacción. Revuelva la mezcla a temperatura ambiente durante 80 minutos. Monitorear el progreso de la reacción usando cromatografía líquida de alto rendimiento (HPLC).
- Disolver los precipitados añadiendo una solución de acetonitrilo/agua al 75% (3,5 ml). Aplique la solución resultante directamente al sistema HPLC semipreparativo para purificar el producto deseado.
NOTA: La solubilización de la mezcla de reacción mediante la adición de tert-butanol puede acelerar la progresión de la reacción.
4. Reacción de desafiamiento foofolítico de los compuestos enjaulados
- Preparación de las soluciones de stock
- Disolver el compuesto enjaulado deseado (5 omol) en DMSO (500 l) para preparar una solución de stock de 10 mM. Dispensar una alícuota de cada solución (10 l) en un tubo de microcentrífuga de 1,5 ml y almacenar en un congelador (20 oC) hasta justo antes de su uso.
- 6 mM K3[Fe(C2O4)3] (100 mL): Disolver ferrioxalato de potasio recristalizado (0,295 g, 0,675 mmol) en 80 ml de agua. Agregue 0,5 M H2SO4 (10 mL) y una cantidad apropiada de IEW para compensar el volumen a 100 ml.
NOTA: El ferrioxalato de potasio debe purificarse mediante recristalización a partir de agua caliente y almacenarse en la oscuridad. El ferrioxalato de potasio recristalizado se obtiene como trihidrato; por lo tanto, su fórmula es K3[Fe(C2O4)3]-3H2O y un peso de fórmula de 491.24 debe considerarse durante la preparación de la solución de stock. Compruebe la pureza de la solución de 6 mM midiendo su absorción a 510 nm. Si la absorbancia es <0.02, es adecuada para su uso en el experimento. - 0,1% Buffer-phen (30 mL): Disolver NaOAc-3H2O (7,35 g), 1,10-fenantrombina (fen) H2O (30 mg), y conc. H2SO4 (0,9 mL) en IEW (20 mL). Agregue IEW para componer el volumen a 30 mL.
NOTA: La solución contiene 1,8 M NaOAc, 0,54 M H2SO4y 0,1% 1,10-fenantrolina.
- Medición del número de fotones utilizando actinometría de ferrioxalato
- Colocar 6 mM K3[Fe(C2O4)3] (V1 L) en una cubeta de cuarzo. Irradiar la solución con luz de 350 nm durante 5 s.
- Transfiera la solución irradiada a una cubeta Pyrex con una longitud de trayecto l [cm].
- Añadir 0.1% Buffer-phen (V2 L) a la solución de muestra irradiada y mezclar bien mediante pipeteo. Mida la absorbancia de la muestra a 510 nm. Calcule el cambio medio de absorción por unidad de tiempo (A510 [s.1]).
- Calcular el número de lunares de los iones Fe2+ generados por unidad de tiempo de acuerdo con la siguiente ecuación:
nFe2+ [mols-1] ) ((V1 + V2) [L] a510 [s.1 ])/(l [cm] á510 [Lmol-1 cm-1]),
donde (V1 + V2) es el volumen de la muestra para la medición de absorción, l es la longitud de trayectoria óptica de la cubeta, y510 es la absorción molar de la Fe 2+- complejo de fens a 510 nm.
NOTA: En las condiciones experimentales típicas, los valores de V1 a 2,0 a 10x 3 L, V2 a 0,33 a 10x 3 l, l a 1,0 cm y a510 a 1,1 a 10 a10 a 4 Lmol,1 se utilizaron cmn.o 1. - Calcular el número de lunares de fotones que llegan a la muestra (I0) utilizando la siguiente fórmula:
I0 [einstein cm 2 s.1] á nFe2+/ 350
donde 350 s es la eficiencia cuántica de la fotoreducción del ferrioxalato a 350 nm.
NOTA: Aunque no se notifica la eficiencia cuántica del actinómetro de ferrioxalato de potasio a 350 nm, se empleó el valor reportado de 1,2542 a 358 nm.
- Mediciones de eficiencia cuántica a 350 nm
- Diluir la solución de stock de muestra (en DMSO, 10 l) con tampón K-MOPS (pH 7.2, 10 ml) para dar una solución de 10 M en K-MOPS que contiene 0,1% DMSO.
NOTA: El tampón K-MOPS consistía en 100 mM KCl y 10 mM 3-(N-morpholino)ácido propanesulfónico (Mops) valorado a pH 7.2 con KOH. - Transfiera una alícuota de la solución (V1 L) a la misma cubeta utilizada en la fotorreacción del actinómetro químico. Irradiar la solución de muestra utilizando la misma configuración que se describe en el paso 4.2.1.
- Retire una alícuota (50 l) de la solución irradiada periódicamente y analice utilizando HPLC.
- Determinar el tiempo de irradiación, en segundos, en el que el 90% del material de partida reaccionó (t90%) mediante el ajuste de parcelas de la desaparición dependiente del tiempo del material de partida.
NOTA: La absorbancia de la muestra irradiada debe mantenerse en <0.1 para que se pueda descuidar el filtrado interno de la radiación. Es deseable que el consumo fotolítico del material de partida se pueda aproximar por desintegración de un solo exponencial para que no haya ningún efecto secundario no deseado que interfiera con el proceso de fotólisis. - Calcular el rendimiento cuántico de la desaparición() utilizando la siguiente ecuación28:
•dis á 1/(t90% ? I0 a 350)
donde t90% [s] es el tiempo de irradiación en el que se consumió el 90% del material de partida, I0 [einstein cm2 s1] es el número de lunares de fotones, y350 [cm 2 mol-1] es el coeficiente de extinción decádica de la muestra a 350 nm.
NOTA: 350 [cm2 mol-1] a 103a350 [M-1 cm x1].
- Diluir la solución de stock de muestra (en DMSO, 10 l) con tampón K-MOPS (pH 7.2, 10 ml) para dar una solución de 10 M en K-MOPS que contiene 0,1% DMSO.
5. Orientación de un compuesto enjaulado enjaulado con un ligando HaloTag
NOTA: Antes de su uso, mantenga las células de HeLa en el medio águila modificado de Dulbecco (DMEM, bajo nivel de glucosa, piruvato sódico, l-glutamina) suplementadas con un 10% de suero bovino fetal (FBS) que contiene 1% de antibióticos (sulfato de estreptomicina, penicilina G y anfotericina) 37 oC y 5% CO2.
- Retirar el medio y trippsinizar las células tratando con ácido trypsin-etilendiaminetetraacético (EDTA, 1 mL) a 37 oC durante 1 min. Añadir DMEM (4 ml) a las células y volver a suspender las células pipeteando suavemente. Semilla sinvertida según aproximadamente 5 x 105 células por plato en platos de fondo de vidrio de 35 mm en DMEM (2 ml) 24 h antes de la transfección.
- Para cuatro platos, en un tubo de microcentrífuga de 1,5 ml, diluir el ADN plásmido (pcDNA3-Halo-EGFR, 14 g) en el medio sérico reducido (700 l). Por separado, diluir el reactivo de lipofección (5 l) en el medio sérico reducido (150 l) en cada uno de los cuatro tubos y dejar que se pare a temperatura ambiente durante 5 min.
- Añadir una porción del ADN plásmido diluido (150 l) a cada una de las muestras de reactivos de lipofección diluidas. Incubar a temperatura ambiente durante 5 min.
- Después de mantener las células a 37 oC y 5% de CO2 durante 24 h, aspirar el DMEM y enjuagar las células con solución salina tamponada de fosfato (PBS, 2 ml). Añadir el medio sérico reducido (1,5 ml).
- Agregue el complejo del reactivo de plásmido-lipofección (150 l) a cada plato. Mantener las células a 37oC y 5% deCO2 durante 48 h.
- Aspirar el medio, añadir una porción de DMEM recién preparado (1 ml) que contenga 2 m de paBhc-hex-FITC/Halo, e incubar las células a 37 oC y 5% de CO2 durante 30 minutos.
- Aspirar el medio que contiene el compuesto enjaulado y enjuagar las células dos veces con PBS+ (1 mL por enjuague) para eliminar los compuestos no unidos. Añadir el medio sérico reducido (500 l) e incubar las células a 37 oC y 5% deCO2 durante 30 minutos para eliminar los compuestos que entraron en las células.
NOTA: PBS+ es solución salina con búfer de fosfato complementada con 2 mM De CaCl2 y 1 mM MgCl2. - Retire el medio y enjuague las células dos veces con PBS+ (1 mL). Agregue una porción de un medio (1 ml) que no contenga rojo fenol. Grabe imágenes de fluorescencia mediante microscopía de fluorescencia confocal de escaneo láser.
6. Modulación fotomediada de una localización de quinasa utilizando un compuesto enjaulado enjaulado enloquecible
NOTA: Antes de su uso, mantenga las células CHO-K1 en el medio F-12 de Ham complementado con 10% DE FBS a 37oC y 5% deCO2.
- Prepare una solución de trabajo de 100o (1 mM) de paBhc-AA (5) en DMSO.
NOTA: Se prepara y almacena una solución de material de 10 mM del compuesto en un congelador (-20 oC). - Semilla sinvertida según aproximadamente 5 x 105 células por plato en platos de fondo de vidrio de 35 mm en DMEM (2 ml) 24 h antes de la transfección.
- Células CHO-K1 transfect con una codificación plásmido para GFP-DGK 48 h antes de los experimentos de desahogamiento.
NOTA: La transfección se realiza de acuerdo con los pasos 5.2–5.5. - Sustituya el medio por un medio sérico reducido (2 ml). Añadir la solución de trabajo de 100o paBhc-AA (20 l) e incubar las células a 37 oC y 5% deCO2 entre 5 min y 1 h.
NOTA: El tiempo de carga depende del compuesto empleado. - Coloque las células en la etapa objetivo de un microscopio fluorescente invertido equipado con un iluminador de fluorescencia de fuente de luz doble.
- Tome una imagen fluorescente cada 10 s. Irradiar las células con 330–385 nm de luz a través de un objetivo de microscopio para un tiempo adecuado. Alternativamente, irradiar las células con luz de 405 nm utilizando una lámpara Xe a través de fibras de cuarzo flexibles.
- Continúe grabando imágenes fluorescentes durante 10 min.
Resultados
Los compuestos enjaulados enjaulados en los que se pueden hacer clic de algunas moléculas biológicamente interesantes, incluyendo el ácido araquidónico y el paclitaxel, se sintetizaron con éxito(Figura 1)28,41. Propiedades adicionales como la solubilidad del agua y la capacidad de segmentación celular se introdujeron en paBhcmoc-PTX a través de la ciclacización Huisgen catalizada por cobre(I) ("Reacción de clic") (Figura 2). Estos PTX enjaulados enjaulados se fotolizaron para producir sus PTX parentales tras la irradiación a 350 nm(Figura 3),y las propiedades físicas y fotoquímicas de los compuestos enjaulados enjaulados en los que se pueden hacer clic se resumen en la Tabla 1. Los rendimientos cuánticos de los compuestos enjaulados clicables de 2o-glc-paBhcmoc-PTX(adis 0,14) y paBhc-AA(adis 0,083) eran más del doble de los de los compuestos enjaulados Bhc convencionales 2o-Bhcmoc-PTX ( dismoc-PTX ( dismoc-PTX (disc 0,040) y Bhc-AA(a0,038)43. Además, se observó una mejor solubilidad en agua para 2o-glc-paBhcmoc-PTX, que contiene una mitad de glucosa.
En los experimentos con células vivas, se logró con éxito la orientación de paBhc-hex-FITC/Halo a las células de mamíferos cultivadas que expresaban transitoriamente una proteína de fusión de una proteína HaloTag y un receptor del factor de crecimiento epidérmico (EGFR). Se observó fluorescencia verde de la mitad de fluoresceína de paBhc-hex-FITC/Halo en la membrana celular (Figura 4). La modulación fotomediada de la localización subcelular de una quinasa se logró utilizando un compuesto enjaulado paBhc. Se ha informado de que la translocación de diacilglicerol quinasa (DGKo) se ha activado en presencia de ácido araquidónico (AA)44. Las células CHO-K1 que expresaban transitoriamente GFP-DGK fueron tratadas con AA o paBhc-AA (5). La adición de AA provocó la modulación de la localización subcelular de DGK(Figura 5A,B). Se observaron cambios similares en la localización de DGKo para las células tratadas con paBhc-AA después de la exposición a la luz UV(Figura 5C,D).
Figura 1: Preparación de los compuestos enjaulados enjaulados en los que se puede hacer clic.
(A) Reactivos y condiciones: a. etil 4-cloroacetoacetato/conc. H2SO4/rt/7 días/91% rendimiento, b. 1 M HCl/reflujo/3 días/97% de rendimiento. c. N-metilproargilamina /HCHO/EtOH, luego añadir (1) y el calor en el reflujo para un rendimiento de 17 h/79%. (B) Síntesis de la amina enjaulada clicable, PTX, y ácido araquidónico. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Instalación de unidades funcionales en compuestos enjaulados en los que se puede hacer clic.
(A) Síntesis de un PTX enjaulado soluble en agua a través de la cicclización Huisgen catalizada por cobre(I). (B) Estructuras de compuestos enjaulados enlos que se pueden hacer clic que contienen el ligando HaloTag para la segmentación celular. Haga clic aquí para ver una versión más grande de esta figura.
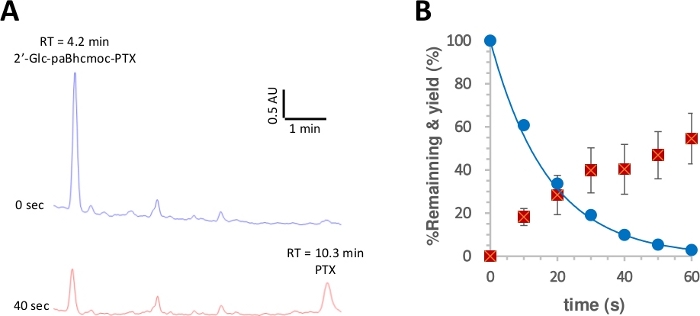
Figura 3: Fotolisis de 2o-glc-paBhcmoc-PTX (6).
Las muestras (10 m) en la solución K-MOPS (pH 7.2) se irradiaron a 350 nm. (A) Rastros típicos de HPLC para la fotólisis de 6 (medida a 254 nm). Las muestras se analizaron en el tiempo de irradiación especificado. (B) Curso de tiempo para la fotólisis de 6. Los círculos azules muestran el consumo de 6. La línea sólida muestra el ajuste de la curva de mínimos cuadrados para un exponencial en descomposición simple para 6. Los cuadrados rojos muestran el rendimiento de PTX. Las barras de error representan la desviación estándar (-SD). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Imágenes de fluorescencia de células de mamíferos cultivadas incubadas con paBhc-hex-FITC/Halo (8).
Las células transpecadas con pcDNA3-Halo-EGFR se incubaron con una solución de 2 M de compuesto 8 a 37 oC durante 30 min. Las imágenes se obtuvieron después de lavado repetido con PBS+. Células HEK293T tratadas con mock(A: imagen de contraste de interferencia diferencial (DIC) y D: imagen de fluorescencia). Células HEK293T (B y E) y células HeLa (C y F) que expresan transitoriamente Halo-EGFR (B y C: imágenes DIC y E y F: imágenes de fluorescencia). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Imágenes de fluorescencia después de la irradiación UV de las células CHO-K1 incubadas con ácido araquidónico enjaulado Bhc. Las células CHO-K1 fueron transcinfectadas con una proteína de fusión DGK-EGFP.
(A) Una imagen de fluorescencia de las células transinfectadas. (B) 100 s después de la adición de una solución de 10 m de ácido araquidónico. (C) Las células se incubaron con una solución de 10 M de paBhc-AA (5) a 37 oC durante 5 min((D) 100 s después de 20-s irradiación UV (330–385 nm). Haga clic aquí para ver una versión más grande de esta figura.
| Compuestos | -máx (nm) a | Máx.(M-1 cm-1) b | ádisc | •dis disd | Solubilidad (M)e |
| Ptx | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2'-paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2'-glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
Tabla 1: Propiedades físicas y fotoquímicas de los compuestos enjaulados enlos a los que se puede hacer clic.
a. Absorción máxima (nm), b. Absorción molar amáx .(M-1 cm x 1), c. Rendimiento cuántico de la desaparición de los materiales de partida a 350 nm, d. El producto de la absorción molar y el rendimiento cuántico de desaparición a 350 nm, e. Concentración de la solución saturada en K-MOPS (pH 7.2) (gmL.1).
Discusión
Anteriormente desarrollamos compuestos enjaulados Bhc de varias moléculas biológicamente activas que exhiben altas eficiencias fotílíticas28,45,46,47. Con el objetivo de ampliar el repertorio de los grupos de cultivo Bhc, también informamos de plataformas de compuestos modulares enjaulados que se pueden modificar fácilmente por la introducción de varias unidades funcionales32,40,41. Por lo tanto, el presente protocolo representa un método para la síntesis de un precursor clicable de los grupos de encaging Bhc que se puede modificar a través de la ciclación Huisgen catalizada por cobre(I). La síntesis del precursor clickable, paBhcCH2OH (2), se logró a través de una secuencia de reacción de cuatro pasos a partir del 4-bromoresorcinol disponible comercialmente(Figura 1A). La ventaja del presente protocolo es que no se requieren pasos laboriosos de purificación (por ejemplo, separaciones cromatográficas de columna).
Como precursor clicable paBhcCH2OH (2) se puede utilizar para enmascarar varios grupos funcionales, compuestos enjaulados clicables de aminas, alcoholes, y ácidos carboxílicos se sintetizaron utilizando 2 como el precursor(Figura 1B). Las aminas fueron modificadas como sus carbamatos, mientras que los alcoholes fueron modificados como sus carbonatos. En los procedimientos generales 1 y 2, CDI se utilizó para la preparación de carbamatos clicables, mientras que el cloroformato de 4-nitrofenilo se utilizó para la preparación de carbonatos. Como indica el mecanismo de reacción, ambos reactivos se pueden utilizar para la preparación de carbamatos y carbonatos. También debe tenerse en cuenta que el rendimiento del compuesto enjaulado deseado depende de la estructura química de la molécula a enjaular. Otros ejemplos se pueden ver en nuestros informes anteriores28,30,33,48.
A continuación, se realizó una ligera modificación del procedimientonotificado 49. La adición de tris(triazolylmethyl)ligandos a base de amina es necesario para obtener los productos deseados en el bien a altos rendimientos. Dado que una variedad de azidas están fácilmente disponibles tanto de fuentes comerciales como de procedimientos de literatura, podemos preparar varios compuestos modulares enjaulados con propiedades adicionales como la solubilidad del agua y la capacidad de segmentación celular(Figura 2).
El rendimiento cuántico de la fotólisis se midió entonces según un procedimiento reportado28,50. La Figura 3 muestra que el consumo fotolítico de 2o-glc-paBhcmoc-PTX y la liberación de PTX se aproximaron por decaimiento y aumento de un solo exponencial, respectivamente, lo que sugiere que no hay filtrado interno de la radiación o efectos secundarios no deseados. Se observaron rendimientos cuánticos de fotólisis mejorados(o) y eficiencias de fotólisis(o) para los compuestos enjaulados de paBhc en los que se puede hacer clic en comparación con los compuestos enjaulados de Bhc notificados anteriormente(Tabla 1)41, 43. Dado que las eficiencias de fotólisis(o) de los compuestos enjaulados de Bhc son más de cien veces superiores a las de los compuestos enjaulados de tipo nitrocilíico28, la notable mejora debida a la presencia de grupos de enraización de paBhc es claramente una ventaja para este sistema.
Como un experimento de prueba de concepto, se introdujo una mitad hidrófila en 2o-paBhcmoc-PTX (4) y un ligando de orientación celular se introdujo en el compuesto 3 (Figura 2). La solubilidad del agua de 2o-glc-paBhcmoc-PTX fue 650 veces mayor que la del PTX principal(Tabla 1). La focalización celular selectiva se logró utilizando un sistema de sonda de etiquetas, y el paBhcmoc-hex-FITC/Halo(8) que llevaba el ligando HaloTag fue dirigido con éxito a la membrana celular de las células de mamíferos cultivadas que expresaban la proteína de fusión HaloTag/EGFR ( Figura 4). También se logró la modulación fotomediada de la localización subcelular de una quinasa utilizando un compuesto enjaulado enjaulado 5 (Figura 5).
En conclusión, demostramos con éxito un método para la preparación de plataformas clicables para compuestos foto-enjaulados de moléculas biológicamente interesantes que se pueden modificar fácilmente con propiedades adicionales, como la solubilidad del agua y un capacidad de orientación. Dado que el grupo de apiase paBhc se puede utilizar para preparar cualquier molécula con grupos funcionales modificables, la aplicación del protocolo actual no se limita a las moléculas descritas en este documento. Utilizando una plataforma modular, a saber, el grupo de perforación paBhc, los compuestos enjaulados deseados se pueden preparar fácilmente, y sus propiedades físicas y químicas se pueden modular mediante la modificación de clics.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el número de subvención JSPS KAKENHI JP16H01282 (TF), una subvención para la investigación científica sobre áreas innovadoras "Dinamismo de la memoria", y JP19H05778 (TF), "MolMovies".
Materiales
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
Referencias
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados