Method Article
可点击笼体化合物的设计、合成和光化学特性
摘要
提出了一种可点击的网箱化合物的光化学特性的合成和测量方案。
摘要
笼状化合物能够以光介导操作细胞生理学与高时空分辨率。然而,目前可用的笼类组结构多样性有限,在不牺牲其光分解效率的情况下进行合成改性方面的困难,是扩大活细胞笼内化合物范围的障碍应用。由于coumarin型光凝组化学改性是制备具有不同物理和化学特性的笼状化合物的一种有前途的方法,我们报道了一种可修改可降解的可点击笼状化合物的合成方法。通过铜(I)催化惠氏循环,可轻松与各种功能单元配合。模块化平台分子包含(6-bromo-7-羟基纤维素-4-基)甲基(Bhc)组作为光环组,与传统2硝基苯基相比具有较高的光分析效率。介绍了制备含有胺、酒精和卡比酸盐的可点击笼状化合物的一般程序。其他特性,如水溶性和细胞靶向能力,可以很容易地融入可点击的笼体化合物中。此外,还测量了物理和光化学特性,包括光分析量子产量,发现其优于相应的Bhc笼体化合物。因此,上述议定书可被视为现有笼体中缺乏结构多样性的潜在解决办法。
引言
笼状化合物是设计合成分子,其原始功能被共价附着的光可移动保护组暂时掩盖。有趣的是,与生物相关的分子的笼状化合物为细胞生理学1、2、3、4、5的时空控制提供了不可或缺的方法。 ,6.1977年,恩格斯和施莱格报告cAMP的2-硝基酯作为cAMP7的膜渗透和光基衍生物。第二年,卡普兰报告了ATP(NPE-ATP)的1-(2-硝基)乙酯,并将这种化合物命名为"笼"ATP8。自那时以来,一系列光化学可拆卸保护组,如2-硝基苯基,p-羟基苯丙胺9,2-(2-硝基苯)乙醚10,11,7-硝基多林-1-yls12, 13,和(库马林-4-基)甲基14,15,16已用于制备笼体化合物。
具有理想的附加特性(如膜渗透性、水溶性和细胞靶向能力)的笼体化合物的合成有望促进细胞生物学应用。由于这些分子的物理和光化学性质主要取决于用于制备它们的光化学可拆卸保护组的化学结构,因此需要多种光凝组。然而,目前具有高光照效率的锥类群体的结构多样性有限。这可能是增加使用笼内化合物的障碍。
为了解决这个问题,通过对现有可拆卸保护组的化学修改或设计具有优越光物理和光化学特性的新型光实验室色光量,扩大了光凝组的阵容。例子包括硝基二苯酚(NDBF)17,[3-(4,5-二甲氧基-2-硝基)-2-丁基](DMNPB)18,19,钙敏2-硝基苯基光笼20,替代couinyl甲基(DEAC45021,DEAdcCM22,7-azetidinyl-4-甲基古马林23,和硫化古马林24,青宁衍生物(CyEt-pan)25,和BODIPY衍生物26,27。
此外,我们之前开发了(6-布罗莫-7-羟基古马林-4-基)甲基(Bhc)组,并成功地合成了神经递质28、第二信使29、30和寡核苷酸31,32,33显示大单光和双光子激发横截面。如果额外的特性可以很容易地安装到笼组,而不损害其光敏性,那么笼化化合物的剧目可以扩大34,35,36,37,38,39.因此,我们设计了模块化笼体化合物,包括三个部分,即作为光响应核心的Bhc组,用于安装附加功能的化学手柄,以及要屏蔽的分子40,41.
因此,本文为制备与生物相关的分子的笼体化合物提供了一种实用的方法。本协议描述了为光笼组准备可点击的平台的方法,引入其他功能以扩大笼内化合物的清单,测量其物理和光化学特性,以及可点击的笼状化合物的细胞类型选择性靶向,用于进一步细胞应用。
研究方案
1. 可点击笼化合物的模块化笼式paBhc组合成28,41
-
制备(6-溴-7-羟基古马林-4-基)甲基氯化物(Bhc-CH2Cl)
- 将 4-布罗莫索西诺 (9.742 g, 51.5 mmol) 放入配备搅拌棒的 100 mL 圆底烧瓶中。
- 在烧瓶中加入H2SO 4(98%,30 mL),搅拌混合物溶解。
- 滴滴加入乙基4-氯乙酸酯(10 mL,74 mmol)。
- 继续在环境温度下搅拌混合物5天。
- 另外,将碎冰块(约200 mL)放入500 mL Erlenmeyer 烧瓶中。
- 将反应混合物倒入冰中,用力搅拌30分钟,直到获得细粉沉淀物。
- 通过真空过滤收集沉淀物。用清水洗涤浅棕色沉淀物五次。
- 在真空下干燥沉淀物过夜,产生 BhcCH2Cl 作为浅棕色粉末 (13.57 g, 46.9 mmol)。
-
制备(6-溴-7-羟基古马林-4-yl)甲醇(BhcCH2OH)
- 将准备好的 BhcCH2Cl(1.1440 g、3.95 mmol)和 1 M HCl(300 mL)放入配备 Dimroth 冷凝器的 1 L 圆底烧瓶中。在140°C下搅拌混合物5天。在此时间后,将混合物冷却至环境温度。
- 在真空下通过旋转蒸发将水从反应中去除,以产生 BhcCH2OH (1) 作为浅棕色粉末(1.0359 克,3.82 mmol,97% 收率)。
注:每1克BhcCH2Cl使用250 mL 1 M HCl,结果令人满意。
-
通过曼尼奇反应制备 paBhch2OH (2)
- 将甲醛(446.4毫克,14.9毫摩尔)放入50mL圆底烧瓶中。在烧瓶中加入无水乙醇(5 mL)和N-甲基丙二醇(1.25 mL,14.8 mmol)。
- 在 Ar 气氛下,在环境温度下搅拌混合物 1 小时。
- 将 BhcCH2OH (1) (1.367 g, 5.04 mmol) 添加到烧瓶中。使用块式加热器装置将混合物加热至 80°C,并在 Ar 气氛下在 80°C 下继续搅拌混合物 2 小时。
- 停止块加热器,并将反应混合物冷却至室温。
- 通过真空过滤收集产生的浅棕色-黄色沉淀物。用少量无水乙醇(每次1 mL)清洗沉淀物两次。
- 在真空下去除多余的乙醇,以产生paBhch2OH (2) (1.393克,3.96毫摩尔)。
2. 可点击的笼体化合物的制备
注:以下程序可应用于制备含有羟基、氨基和碳化物功能组的其他可点击的笼状化合物。
-
一般程序1:制备可点击的笼式胺
- 将 paBhch2OH (2) (709.6毫克, 2.02 毫摩尔) 和N,N'-碳基二甲酰二甲苯二甲苯二甲苯二甲苯醚 ( CDI, 397.6 mg, 2.45 mmol) 放入 30 mL 圆底烧瓶中。加入干 CH2Cl2 (6 mL),并在环境温度下搅拌溶液 1 小时。
- 加入4-二甲基氨基甲酰胺(4-DMAP,324.8毫克,2.66毫摩尔)和三丁基(6-氨基)碳水化合物(533.1毫克,2.46毫摩尔)。在环境温度下搅拌溶液 3 小时。
- 在真空下使用旋转蒸发器去除溶剂和其他挥发性材料。直接使用硅胶闪光柱色谱法净化残留物。
-
一般程序2:制备可点击的笼式酒精
- 将 paclitaxel (PTX, 48.7 mg, 0.057 mmol) 放入一个 30 mL 圆底烧瓶中,配有三向止热孔和 Ar 气球。加入干CH2Cl2 (1 mL)、4-DMAP(17.1毫克,0.14毫摩尔)和4-硝基氯丁二酯(26.0毫克,0.13毫摩尔)。
- 在Ar气氛下,在环境温度下搅拌溶液2.5小时。
- 在溶液中加入4-DMAP(15.7毫克,0.13毫摩尔)和paBhch2OH (2) (39.1毫克, 0.111毫摩尔)。在环境温度下继续搅拌混合物 17 小时。
- 在混合物中加入 CHCl3 (10 mL) 和 15% 水性 NaHCO3 (5 mL)。大力搅拌混合物约3分钟,用移液器去除水层。
- 在含有有机层的烧瓶中加入0.5M柠檬酸(5 mL)。搅拌混合物并清除上述水层。
- 使用相分离柱分离有机层。在真空下用旋转蒸发器去除溶剂。使用标准硅胶闪光柱色谱法净化产品。
-
一般程序3:制备可点击的笼状卡状酸
- 在干CH2Cl2 (2 mL) 中溶解阿希辛酸 (33.0 μL, 0.100 mmol), paBhch2OH (2) (39.6 mg, 0.112 mmol) 和 4-DMAP (14.1 毫克, 0.115 mmol)。加入N,N+-二丙基卡迪米德(DIPC,17.0 μL,0.110 mmol),并在环境温度下搅拌溶液140分钟。
- 在真空下去除溶剂。直接使用硅胶闪光柱色谱法净化残留物。
3. 将功能单元安装到可点击的笼体中
- 在交流水(IEW,10 mL)中溶解硫酸铜(II)五水合物(249毫克),以给出0.1M CuSO4溶液。
- 溶解 2°-paBhcmoc-PTX (8.0 毫克, 6.5 μmol)、三s(3-羟丙基三氧化二甲酯)胺(THPTA,17.5毫克,40.3μmol),乙酸钠(162.4毫克,0.825毫摩尔)和15-氯-3,6,9-三聚氰胺(3.1毫克,11μmol),混合溶剂0.1 M缓冲液(2.5 mL,pH 7.2)和二甲基亚硫酸盐(DMSO,0.5 mL)。
- 将0.1M CuSO4溶液(81.2μL,8.1μmol)加入反应混合物。在环境温度下搅拌混合物80分钟。使用高性能液相色谱法(HPLC)监测反应的进度。
- 通过加入75%的乙酰乙酯/水溶液(3.5 mL)溶解沉淀物。将所得溶液直接应用于半准备HPLC系统,以纯化所需产品。
注:通过添加三丁醇使反应混合物的溶解可以加速反应的进展。
4. 笼内化合物的光溶性未密封反应
- 准备库存解决方案
- 将所需的笼体化合物(5μmol)溶解在DMSO(500μL)中,制备10 mM库存溶液。将每种溶液(10 μL)的等分分配到1.5 mL微离心管中,并储存在冷冻室(+20°C)中,直到使用前。
- 6 mM K3[Fe ( C2O4)3] (100 mL): 在 80 mL 水中溶解再结晶的铁氧酸钾 (0.295 g, 0.675 mmol)。加入 0.5 M H2SO4 (10 mL) 和适当数量的 IEW,以将音量补至 100 mL。
注:铁氧酸钾应通过热水再结晶进行纯化,并储存在黑暗中。再结晶的铁氧酸钾作为三水合物获得;因此,其公式为 K3+Fe (C2O4)3=3H2O,在制备库存溶液时应考虑 491.24 的公式权重。通过测量 510 nm 的吸收,检查 6 mM 溶液的纯度。如果吸光度为 <0.02,则适用于实验。 - 0.1% 缓冲-苯 (30 mL): 溶解 NaOAc+3H2O (7.35 g), 1,10-苯甲苯 (phen)*H2O (30 mg) 和康克 H2SO4 (0.9 mL) 在 IEW (20 mL)。添加 IEW 以将音量补到 30 mL。
注:该溶液含有1.8M NaOAc、0.54 M H2SO4和0.1%1,10-苯丙环。
- 使用铁氧体量测定法测量光子数
- 将 6 mM K3[Fe (C2O4)3= (V1 L) 放入石英色皿中。用 350 nm 光照射溶液,为 5 s。
- 将辐照溶液转移到具有l [cm] 路径长度的 Pyrex 比色皿中。
- 在辐照样品溶液中加入0.1%缓冲液(V2 L),通过移液进行良好混合。测量样品在 510 nm 处的吸光度。计算单位时间的平均吸收变化 (+A510 [s]1])。
- 根据以下公式计算每单位时间生成的 Fe2+离子的摩尔数:
nFe 2= [摩尔 s +1] ((( V1 + V2) [L] = = A 510 [s])/)
其中 (V1 + V2) 是用于吸收测量的样品体积,l是比色皿的光路长度,而 ±510是 Fe2+的摩尔吸收 -在510纳米的苯复合物。
注:在典型的实验条件下,V1 = 2.0 × 10±3 L,V 2 = 0.33 × 10±3 L,l = 1.0厘米,+510 = 1.1 × 10 4 L mol=1使用 cm#1。 - 使用以下公式计算到达样本的光子摩尔数 (I0):
I0 [爱因斯坦 cm] 2 s+1= nFe2]/=350
其中# 350是 350 nm 处铁氧酸盐光还原的量子效率。
注:虽然未报告350nm处铁氧酸钾作用计的量子效率,但在358nm时采用报告值1.2542。
- 350 nm 的量子效率测量
- 用K-MOPS缓冲液(pH 7.2,10 mL)稀释样品库存溶液(在DMSO,10μL中),在含有0.1%DMSO的K-MOPS中提供10μM溶液。
注:K-MOPS缓冲液由100 mM KCl和10 mM3-(N-变形)丙烷酸(Mops)组成,用KOH至pH 7.2。 - 将溶液(V1 L)的等分转移到化学活性计的光反应中使用的同一色比色皿中。使用步骤 4.2.1 中描述的相同设置照射示例解决方案。
- 定期从辐照溶液中取出等分(50 μL),并使用HPLC进行分析。
- 确定辐照时间(以秒为单位),其中 90% 的起始材料通过拟合起始材料的时间依赖性消失的地块而发生反应(t90%)。
注: 辐照样品的吸光度必须保持在 <0.1,以便忽略辐射的内部滤波。最好通过单指数衰减来近似起始材料的光解消耗,这样没有干扰光解过程的意外次效应。 - 使用以下方程28计算消失 (*dis) 的量子产量:
[dis ] 1/(t90% × I0 × =350)
其中t90% [s] 是消耗 90% 起始材料的辐照时间,I 0 [爱因斯坦 cm= 2 s+1]是光子摩尔数,而 ±350 μcm2 mol+1= 是 350 nm 处样品的分度消光系数。
注:Φ350 [厘米2摩尔+ 1] = 103×350 [M+ 1厘米+ 1]
- 用K-MOPS缓冲液(pH 7.2,10 mL)稀释样品库存溶液(在DMSO,10μL中),在含有0.1%DMSO的K-MOPS中提供10μM溶液。
5. 以可点击的笼状化合物为目标,带有光环配体
注:使用前,在Dulbecco的改性鹰培养基(DMEM,低葡萄糖,丙酸钠,l-谷氨酰胺)中保持HeLa细胞,并辅以含有1%抗生素(硫酸链霉素、青霉素和氨基林)的10%胎儿牛血清(FBS),37 °C 和 5% CO2.
- 在37°C下用胰蛋白酶-乙二胺四乙酸(EDTA,1 mL)处理1分钟,取出培养基并胰蛋白酶化细胞。在转染前24小时,将每盘种子5×105个细胞放入35毫米玻璃底盘中,24小时。
- 对于四个菜肴,在1.5 mL微离心管中,在减少的血清培养基(700μL)中稀释质粒DNA(pcDNA3-Halo-EGFR,14 μg)。另外,将减少的血清介质(150 μL)中的唇裂试剂(5 μL)稀释到四个管中,使其在环境温度下站立5分钟。
- 在每个稀释的唇裂试剂样品中加入一部分稀释的质粒DNA(150 μL)。在环境温度下孵育5分钟。
- 在37°C和5%CO2保持细胞24小时后,吸出DMEM,用磷酸盐缓冲盐水冲洗细胞(PBS,2 mL)。加入减少的血清培养基(1.5 mL)。
- 将质粒-利菲菲特试剂(150 μL)复合物添加到每道菜中。将细胞保持在37°C和5%CO248小时。
- 吸气培养基,加入含有2μM paBhc-FITC-TO-Halo的新鲜制备的DMEM(1 mL)部分,并在37°C和5%CO2下孵育细胞30分钟。
- 吸出含有笼体化合物的培养基,用PBS+冲洗细胞两次(每次冲洗1 mL),以去除任何未结合的化合物。加入减少的血清介质(500μL),在37°C和5%CO2孵育细胞30分钟,以去除进入细胞的化合物。
注: PBS+ 是磷酸盐缓冲盐水补充 2 mM CaCl2和 1 mM MgCl2。 - 取出介质,用 PBS+ (1 mL) 冲洗细胞两次。加入不含苯酚红的介质(1 mL)。通过激光扫描共聚焦荧光显微镜记录荧光图像。
6. 使用可点击的笼体化合物对激酶定位进行光介调制
注:使用前,在火腿的F-12介质中保持CHO-K1细胞,在37°C和5%CO2下辅以10%的FBS。
- 在 DMSO 中准备 100° 工作溶液 (1 mM) 的 paBhc-AA (5)。
注:该化合物的10 mM库存溶液制备并储存在冰柜中(-20°C)。 - 在转染前24小时,将每盘种子5×105个细胞放入35毫米玻璃底盘中,24小时。
- 转熟CHO-K1细胞,在解处理实验前为GFP-DGK®48h进行质粒编码。
注: 转染根据步骤 5.2_5.5 执行。 - 用减少的血清培养基(2 mL)替换培养基。加入100°paBhc-AA工作溶液(20μL),在37°C和5%CO2孵育细胞5分钟至1小时之间。
注: 装载时间取决于所使用的化合物。 - 将细胞置于装有双光源荧光照明器的倒置荧光显微镜的客观舞台上。
- 每10s拍摄一次荧光图像,用330~385nm光照射细胞,在适当的时间内通过显微镜物镜照射。或者,使用 Xe 灯通过柔性石英纤维用 405 nm 光照射电池。
- 继续录制荧光图像 10 分钟。
结果
一些生物上有趣的分子,包括甲酰酸和帕利塔塞尔的可点击笼体化合物,被成功合成(图1)28,41。水溶性和细胞靶向能力等附加特性通过铜(I)催化汇氏循环("点击"反应)引入paBhcmoc-PTX(图2)。这些可点击的笼式PTX然后光解,在350nm照射时产生其父PTX(图3),可点击的笼体化合物的物理和光化学特性在表1中总结。可点击的笼状化合物2+-glc-pabhmoc-PTX(+dis 0.14)和paBhc-AA(+dis 0.083)的量子产量是传统Bhc笼化合物2+-Bhcmoc-PTX(+dis)的两倍多。 0.040) 和 Bhc-AA (+dis 0.038)43.此外,对含有葡萄糖的2°c-paBhmoc-PTX水溶性也有所改进。
在活细胞实验中,成功地实现了将paBhc-Hex-FITC/Halo靶向培养的哺乳动物细胞,暂时表达出HaloTag蛋白和表皮生长因子受体(EGFR)的融合蛋白。在细胞膜上观察到paBhc-HEx-FITC/Halo荧光的荧光(图4)。使用paBhc笼状化合物实现了激酶亚细胞定位的光介导调制。据报道,在存在甲氧乙酸(AA)44的情况下,二乙二醇激酶(DGK+)的易位被激活。CHO-K1细胞暂时表达GFP-DG+用AA或paBhc-AA(5 )进行治疗。AA的添加导致DGK+的亚细胞定位的调制(图5A,B)。在暴露于紫外线后的paBhc-AA处理细胞的定位中,DGK+的定位也发生了类似的变化(图5C,D)。
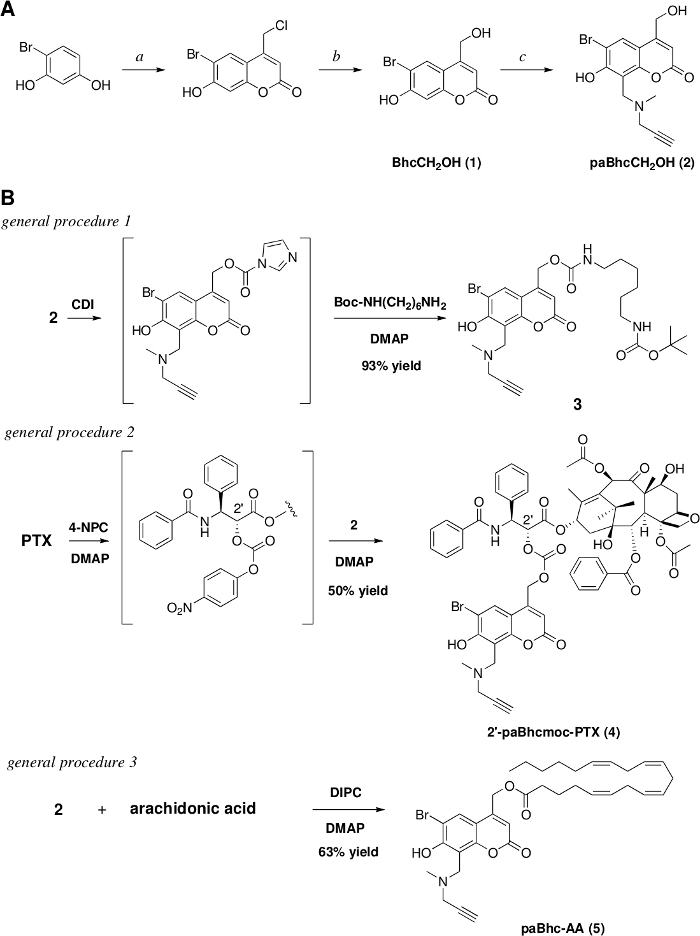
图1:可点击笼化合物的制备。
a) 试剂和条件:a. 乙基 4 氯乙酸酯/康克 H2SO4/rt/7 天/91% 产量,b. 1 M HCl/回流/3 天/97% 产量。c. N-甲基丙二甲胺/HCHO/EtOH,然后加入(1)和热在回流17小时/79%的产量。(B) 可点击的笼状胺、PTX和甲抗酸的合成。请点击此处查看此图的较大版本。

图2:将功能单元安装到可点击的笼体中。
(A) 通过铜(I)催化汇氏循环合成水溶性笼式PTX。(B) 含有HaloTag配体的可点击笼状化合物的结构,用于细胞靶向。请点击此处查看此图的较大版本。
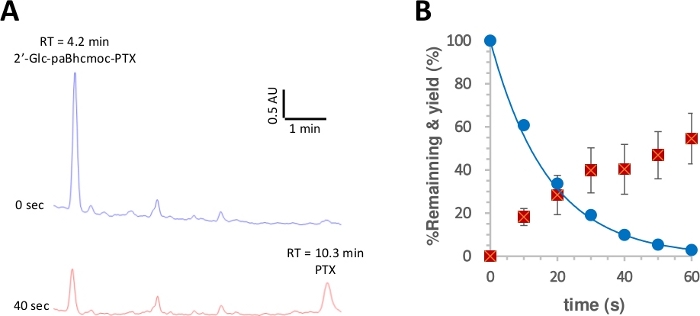
图3:2°C-paBhcmoc-PTX(6)的光裂。
K-MOPS溶液(pH 7.2)中的样品(10μM)在350nm下进行辐照。(A) 典型的 HPLC 跟踪为6的光力(测量值为 254 nm)。在指定的照射时间对样品进行了分析。(B) 6光的发光时间课程。蓝色圆圈显示消耗6。实线显示最小二乘曲线适合6的简单衰减指数。红色方块显示 PTX 的收率。误差条表示标准差 (+SD)。请点击此处查看此图的较大版本。

图4:用paBhc-六十六-FITC/Halo(8)孵育的培养哺乳动物细胞的荧光图像。
用pcDNA3-Halo-EGFR转染的细胞在37°C下用2μM溶液孵育,在37°C下孵育30分钟。图像是在用PBS+反复洗涤后获得的。模拟处理的HEK293T细胞(A:差分干扰对比度(DIC)图像和D:荧光图像)。HEK293T细胞(B和E)和HeLa细胞(C和F)瞬时地表达光晕-EGFR(B和C:DIC图像和E和F:荧光图像)。请点击此处查看此图的较大版本。

图5:用Bhc笼状阿激酸孵育的CHO-K1细胞紫外线照射后的荧光图像。CHO-K1细胞用融合蛋白DGK®-EGFP转染。
(A) 转染细胞的荧光图像.(B) 加入10μM的阿罗西酮酸溶液后100s。(C) 在20秒紫外线照射(330-385nm)后,在37°C(D)100秒下用10μM的paBhc-AA(5)溶液孵育细胞。请点击此处查看此图的较大版本。
| 化合物 | •最大(nm)a | Φ最大(M-1厘米-1)b | [disc] | [] dd | 溶解度 (μM)e |
| PTX | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2' -paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2' -glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
表1:可点击笼体化合物的物理和光化学性质。
a. 吸收最大(纳米),b.摩尔吸收在±最大(M +1 cm+1),c.在350nm时起始材料消失的量子产量,d.摩尔吸收的产物和350nm的消失量子产量,e.饱和溶液在K-MOPS(pH 7.2)中的浓度(μg mL+1)。
讨论
我们之前开发了各种生物活性分子的Bhc笼体化合物,具有高光溶效率28,45,46,47。为了扩大BhcCc的系列,我们还报告了模块化笼体化合物的平台,通过引入各种功能单元32、40、41可以很容易地修改。因此,本议定书是一种合成可点击的Bhccccc组前体的方法,该前体可通过铜(I)催化汇氏循环进行修改。可点击前体paBhch2OH(2) 的合成是通过从市售的4-布罗莫索西诺(图1A)开始的四步反应序列实现的。本协议的优点是不需要费力的纯化步骤(例如,柱色谱分离)。
由于可点击前体paBhCH2OH (2) 可用于掩盖各种功能组,使用2作为前体合成可点击的笼状胺、醇和碳水化合物化合物(图1B)。胺被改性为碳水化合物,而酒精被改为碳酸盐。在一般程序1和2中,CDI用于制备可点击的碳水化合物,而4-硝基氯丁二酯用于制备碳酸盐。如反应机制所示,两种试剂都可用于制备碳水化合物和碳酸盐。还应注意的是,所需笼体化合物的产量取决于要关在的分子的化学结构。其他例子可在我们以前的报告28、30、33、48中见。
然后,使用对报告的过程49稍加修改执行单击修改。添加三苯基(三苯基甲基)胺基配体是获得所需产品良好到高产量所必需的。由于各种阿齐德从商业来源和文献程序都很容易获得,我们可以制备各种模块化笼体化合物,具有额外的特性,如水溶性和细胞靶向能力(图2)。
然后根据报告的程序28,50测量光干的量子收率。图3显示,2°c-paBhmoc-PTX的光解消耗和PTX的释放分别以单指数衰减和上升为近似值,表明辐射没有内部滤波或不希望的次生效应。与先前报告的Bhc笼状化合物相比,可点击的paBhc笼状化合物的光裂量子产量(*)和光分解效率(*)得到观察。43.由于Bhc笼状化合物的光分解效率(*)比2-硝基苯基型笼状化合物48高出一百倍以上,因此由于paBhc笼组的存在,其明显改善是明显的该系统的优势。
作为概念验证实验,将亲水性莫伊蒂引入2°-paBhcmoc-PTX(4),并将细胞靶向利带引入化合物3(图2)。2°C-paBhcmoc-PTX的水溶性比母体PTX高650倍(表1)。选择性细胞靶向是使用标记探针系统实现的,而带有HaloTag配体的paBhcmoc-HEx-FITC/Halo(8)成功地瞄准了表达HaloTag/EGFR融合蛋白的培养哺乳动物细胞膜(图 4.使用可点击的笼体化合物5(图5)也实现了激酶亚细胞定位的光介导调制。
最后,我们成功地演示了一种制备可点击平台的方法,用于制备具有生物趣味的分子的光笼化合物,这种化合物可通过额外的特性(如水溶性和细胞)轻松修改。定位能力。由于paBhccc基块可用于制备具有可修改功能组的任何分子,因此本协议的应用并不限于本文所述的分子。使用模块化平台,即paBhc凝固组,可以轻松制备所需的笼状化合物,并通过点击修改调节其物理和化学特性。
披露声明
我们没有什么可透露的。
致谢
这项工作得到了JSPS KAKENHI赠款编号JP16H01282(TF)的支持,这是用于创新领域"记忆动力"科学研究的助学金,以及JP19H05778(TF),"摩尔电影"。
材料
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
参考文献
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。