Method Article
Design, Synthese und photochemische Eigenschaften von anklickbaren Käfigverbindungen
In diesem Artikel
Zusammenfassung
Ein Protokoll zur Synthese und Messung der photochemischen Eigenschaften modularer Käfigverbindungen mit anklickbaren Moieties wird vorgestellt.
Zusammenfassung
Käfigverbindungen ermöglichen die fotovermittelte Manipulation der Zellphysiologie mit hoher raumzeitlicher Auflösung. Die begrenzte strukturelle Vielfalt der derzeit verfügbaren Käfiggruppen und die Schwierigkeiten bei der synthetischen Modifikation ohne Einbußen bei der Photolyseeffizienz behindern jedoch die Erweiterung des Repertoires an Käfigverbindungen für lebende Zellen. Anwendungen. Da die chemische Modifikation von Cumarin-Typ-Foto-Caging-Gruppen ein vielversprechender Ansatz für die Herstellung von Käfigverbindungen mit verschiedenen physikalischen und chemischen Eigenschaften ist, berichten wir über eine Methode zur Synthese von anklickbaren Käfigverbindungen, die modifiziert werden können. mit verschiedenen Funktionseinheiten über die kupfer(I)-katalysierte Huisgen-Cyclisierung. Das modulare Plattformmolekül enthält eine (6-bromo-7-hydroxycoumarin-4-yl)methyl (Bhc)-Gruppe als Photo-Caging-Gruppe, die im Vergleich zu den herkömmlichen 2-Nitrobenzylen eine hohe Photolyseeffizienz aufweist. Es werden allgemeine Verfahren zur Herstellung von anklickbaren Käfigverbindungen vorgestellt, die Aumine, Alkohole und Carboxylate enthalten. Zusätzliche Eigenschaften wie die Wasserlöslichkeit und Zell-Targeting-Fähigkeit können leicht in klickbare Käfigverbindungen integriert werden. Darüber hinaus wurden die physikalischen und photochemischen Eigenschaften, einschließlich der Photolysequantenausbeute, gemessen und waren denen der entsprechenden Bhc-Käfigverbindungen überlegen. Das beschriebene Protokoll könnte daher als mögliche Lösung für die fehlende strukturelle Vielfalt der verfügbaren Käfigverbindungen angesehen werden.
Einleitung
Käfigverbindungen sind synthetische Moleküle, deren ursprüngliche Funktionen zeitlich durch kovalent befestigte fotoabnehmbare Schutzgruppen maskiert werden. Interessanterweise stellen Käfigverbindungen biologisch relevanter Moleküle eine unverzichtbare Methode zur räumlichzeitlichen Kontrolle der zellulären Physiologie1,2,3,4,5 ,6. 1977 meldeten Engels und Schlaeger den 2-Nitrobenzylester von cAMP als membrandurchlässiges und photolabiles Derivat von cAMP7. Im folgenden Jahr meldete Kaplan den 1-(2-Nitrophenyl)ethylester von ATP (NPE-ATP) und nannte diese Verbindung ATP8" . Seitdem eine Reihe photochemisch abnehmbarer Schutzgruppen wie 2-Nitrobenzyle, p-Hydroxyphenacyls9, 2-(2-nitrophenyl)ethyls10,11, 7-nitroindolin-1-yls12 , 13und (Cumarin-4-yl)methyls14,15,16 wurden zur Herstellung von Käfigverbindungen verwendet.
Die Synthese von Käfigverbindungen mit wünschenswerten zusätzlichen Eigenschaften wie Membrandurchlässigkeit, Wasserlöslichkeit und zelluläre Targeting-Fähigkeit würde erwartet, um zellbiologische Anwendungen zu erleichtern. Da die physikalischen und photochemischen Eigenschaften dieser Moleküle in erster Linie von der chemischen Struktur der photochemisch abnehmbaren Schutzgruppen abhängen, die zu ihrer Herstellung verwendet werden, ist ein vielfältiges Repertoire an Foto-Caging-Gruppen erforderlich. Die strukturelle Vielfalt der derzeit verfügbaren Caging-Gruppen mit hoher Photolyseeffizienz ist jedoch begrenzt. Dies könnte ein Hindernis für die zunehmende Verwendung von Käfigverbindungen sein.
Um dieses Problem anzugehen, wurde das Repertoire der Foto-Caging-Gruppen durch die chemische Modifikation bestehender fotoabnehmbarer Schutzgruppen oder die Gestaltung neuer photolabiler Chromophore mit überlegenen photophysikalischen und photochemischen Eigenschaften erweitert. Beispiele sind Nitrodibenzofuran (NDBF)17, [3-(4,5-dimethoxy-2-nitrophenyl)-2-butyl] (DMNPB)18,19, ein calciumempfindlicher 2-Nitrobenzyl-Photocage20, substituierte Cumarinylmethyle (DEAC45021 , DEAdcCM22, 7-azetidinyl-4-methylcoumarin23, und Styrylcumarine24), Cyanin-Derivate (CyEt-pan)25und BODIPY Derivate26,27.
Darüber hinaus haben wir zuvor die Gruppe (6-bromo-7-hydroxycoumarin-4-yl)methyl (Bhc) entwickelt und erfolgreich verschiedene Käfigverbindungen der Neurotransmitter28, zweite Botenstoffe29,30und Oligonukleotide31,32,33 mit großen Ein- und Zweiphotonen-Erregungsquerschnitten. Wenn zusätzliche Eigenschaften einfach in die Käfiggruppen eingebaut werden können, ohne ihre Lichtempfindlichkeit zu beeinträchtigen, dann kann das Repertoire an Käfigverbindungen erweitert werden34,35,36, 37,38,39. Wir haben daher modulare Käfigverbindungen entwickelt, die aus drei Teilen bestehen, nämlich der Bhc-Gruppe als fotoresponsivem Kern, chemischen Griffen für die Installation zusätzlicher Funktionalitäten und den Molekülen, die maskiert werden sollen40, 41.
Somit bietet dieser Artikel eine praktische Methode zur Herstellung von Käfigverbindungen biologisch relevanter Moleküle. Das vorliegende Protokoll beschreibt Methoden zur Herstellung einer anklickbaren Plattform für Foto-Caging-Gruppen, die Einführung zusätzlicher Funktionalitäten zur Erweiterung des Repertoires von Käfigverbindungen, die Messung ihrer physikalischen und photochemischen und das zelltypige selektive Targeting einer anklickbaren Käfigverbindung für die weitere zelluläre Anwendung.
Protokoll
1. Synthese der modularen Caging paBhc Gruppe für klickbare Käfigverbindungen28,41
-
Herstellung von (6-bromo-7-hydroxycoumarin-4-yl)methylchlorid (Bhc-CH2Cl)
- 4-Bromoresorcinol (9,742 g, 51,5 mmol) in einen 100 ml Rundkolben mit Rührstange legen.
- C. H2SO4 (98%, 30 ml) in den Kolben geben und die Mischung rühren, um sich aufzulösen.
- Ethyl 4-Chloracetoacetat (10 ml, 74 mmol) tropfenweise hinzufügen.
- Die Mischung 5 Tage lang bei Umgebungstemperatur weiter rühren.
- Separat zerkleinerte Eiswürfel (ca. 200 ml) in einen 500 mL ErlenmeyerKolben legen.
- Gießen Sie das Reaktionsgemisch in das Eis und rühren Sie 30 min kräftig, bis ein fein pulverförmiger Niederschlag erhalten ist.
- Sammeln Sie den Niederschlag über Vakuumfiltration. Waschen Sie den hellbraunen Niederschlag fünfmal mit Wasser.
- Trocknen Sie den Niederschlag unter Vakuum über Nacht, um BhcCH2Cl als hellbraunes Pulver (13,57 g, 46,9 mmol) zu ergeben.
-
Zubereitung von (6-bromo-7-hydroxycoumarin-4-yl)methanol (BhcCH2OH)
- Legen Sie den vorbereiteten BhcCH2Cl (1,1440 g, 3,95 mmol) und 1 M HCl (300 mL) in einen 1 L Rundkolben, der mit einem Dimroth-Kondensator ausgestattet ist. Die Mischung 5 Tage bei 140 °C rühren. Nach dieser Zeit die Mischung auf Umgebungstemperatur abkühlen.
- Entfernen Sie das Wasser aus der Reaktion durch Rotationsverdampfung unter Vakuum, um BhcCH2OH (1) als hellbraunes Pulver (1,0359 g, 3,82 mmol, 97% Ausbeute) zu erhalten.
HINWEIS: Die Verwendung von 250 ml von 1 M HCl pro 1 g BhcCH2Cl ergibt ein zufriedenstellendes Ergebnis.
-
Vorbereitung von paBhcCH2OH (2) über die Mannich-Reaktion
- Paraformaldehyd (446,4 mg, 14,9 mmol) in einen 50 ml Rundkolben geben. Wasserfreies Ethanol (5 ml) und N-Methylpropargylamin (1,25 ml, 14,8 mmol) in den Kolben geben.
- Rühren Sie das Gemisch bei Umgebungstemperatur für 1 h unter einer Ar-Atmosphäre.
- BhcCH2OH (1) (1.367 g, 5.04 mmol) in den Kolben geben. Erhitzen Sie das Gemisch mit einem Blockheizgerät auf 80 °C und rühren Sie die Mischung bei 80 °C für 2 h unter einer Ar-Atmosphäre weiter.
- Stoppen Sie die Blockheizung und kühlen Sie das Reaktionsgemisch auf Raumtemperatur.
- Sammeln Sie den resultierenden hellbraun-gelben Niederschlag durch Vakuumfiltration. Waschen Sie den Niederschlag zweimal mit einer kleinen Menge an wasserfreiem Ethanol (1 ml jedes Mal).
- Entfernen Sie das überschüssige Ethanol unter Vakuum, um paBhcCH2OH (2) (1.393 g, 3.96 mmol) zu erhalten.
2. Herstellung von anklickbaren Käfigverbindungen
HINWEIS: Die folgenden Verfahren können auf die Herstellung anderer anklickbarer Käfigverbindungen angewendet werden, die Hydroxyl-, Amino- und Carboxylat-Funktionsgruppen enthalten.
-
Allgemeines Verfahren 1: Vorbereitung eines anklickbaren Käfigamins
- PaBhcCH2OH (2) (709,6 mg, 2,02 mmol) und N,N'-Carbonyldiimidazol (CDI, 397,6 mg, 2,45 mmol) in einen 30 ml Rundkolben legen. Trocken CH2Cl2 (6 ml) hinzufügen und die Lösung bei Umgebungstemperatur 1 h rühren.
- 4-Dimethylaminopyridin (4-DMAP, 324,8 mg, 2,66 mmol) und Tert-Butyl(6-Aminohexyl)Carbamat (533,1 mg, 2,46 mmol) hinzufügen. Rühren Sie die Lösung bei Umgebungstemperatur für 3 h.
- Entfernen Sie das Lösungsmittel und andere flüchtige Materialien mit einem Rotationsverdampfer unter Vakuum. Reinigen Sie den Rückstand direkt mit Kieselgel-Flash-Säulenchromatographie.
-
Allgemeines Verfahren 2: Herstellung eines anklickbaren Käfigalkohols
- Paclitaxel (PTX, 48,7 mg, 0,057 mmol) in einen 30 ml Rundkolben mit drei Seitenhahn und einem Ar-Ballon legen. Trocken CH2Cl2 (1 ml), 4-DMAP (17,1 mg, 0,14 mmol) und 4-Nitrophenylchlorofmat (26,0 mg, 0,13 mmol) hinzufügen.
- Rühren Sie die Lösung bei Umgebungstemperatur für 2,5 h unter einer Ar-Atmosphäre.
- 4-DMAP (15,7 mg, 0,13 mmol) und paBhcCH2OH (2) (39,1 mg, 0,111 mmol) zur Lösung geben. Die Mischung bei Umgebungstemperatur 17 h weiter rühren.
- CHCl3 (10 ml) und 15% wässriges NaHCO3 (5 ml) in die Mischung geben. Rühren Sie die Mischung etwa 3 min kräftig umrühren. Entfernen Sie die wässrige Schicht mit einer Pipette.
- 0,5 M Zitronensäure (5 ml) in den Kolben geben, der die organische Schicht enthält. Rühren Sie die Mischung und entfernen Sie die wässrige Schicht wie oben.
- Trennen Sie die organische Schicht mit einer Phasentrennsäule. Entfernen Sie die Lösungsmittel mit einem Rotationsverdampfer unter Vakuum. Reinigen Sie das Produkt mit Standard-Kieselgel-Flash-Säulenchromatographie.
-
Allgemeines Verfahren 3: Herstellung einer anklickbaren Käfig-Carbonsäure
- Arachidonsäure (33,0 l, 0,100 mmol), paBhcCH2OH (2) (39,6 mg, 0,112 mmol) und 4-DMAP (14,1 mg, 0,115 mmol) im trockenen CH2Cl2 (2 ml) auflösen. Fügen Sie N,N --Diisopropylcarbodimid (DIPC, 17,0 l, 0,110 mmol) hinzu und rühren Sie die Lösung bei Umgebungstemperatur für 140 min.
- Entfernen Sie das Lösungsmittel unter Vakuum. Reinigen Sie den Rückstand direkt mit Kieselgel-Flash-Säulenchromatographie.
3. Einbau einer Funktionseinheit in die anklickbaren Käfigverbindungen
- Kupfer(II)-Sulfat-Pentahydrat (249 mg) in ionengetauschtem Wasser (IEW, 10 ml) auflösen, um eine 0,1 M CuSO4-Lösung zu erhalten.
- Lösen Sie 2-paBhcmoc-PTX (8,0 mg, 6,5 ,mol), Tris(3-Hydroxypropyltriazolylmethyl)amin (THPTA, 17,5 mg, 40,3 mol), Natrium-l-Ascorbat (162,4 mg, 0,825 mmol) und 15-Chlor-3,6,9-Trioxapentadecyl-Azid (3,1 mg, 11 Mol) in einem gemischten Lösungsmittel von 0,1 M Phosphat Puffer (2,5 ml, pH 7,2) und Dimethylsulfoxid (DMSO, 0,5 ml).
- Fügen Sie dem Reaktionsgemisch die 0,1 M CuSO4-Lösung (81,2 l, 8,1 ,mol) hinzu. Rühren Sie das Gemisch bei Umgebungstemperatur für 80 min. Überwachen Sie den Fortschritt der Reaktion mit Hochleistungs-Flüssigkeitschromatographie (HPLC).
- Lösen Sie die Ausscheidungen durch Zugabe einer 75% Acetonitril/Wasserlösung (3,5 ml). Tragen Sie die resultierende Lösung direkt auf das semipräparative HPLC-System auf, um das gewünschte Produkt zu reinigen.
HINWEIS: Die Löslichkeit der Reaktionsmischung durch Zugabe von tert-Butanol kann das Fortschreiten der Reaktion beschleunigen.
4. Photolytische Unkaging-Reaktion der Käfigverbindungen
- Vorbereitung der Bestandslösungen
- Lösen Sie die gewünschte Käfigverbindung (5 mol) in DMSO (500 l), um eine 10 mM Stofflösung vorzubereiten. Geben Sie ein Aliquot jeder Lösung (10 l) in ein 1,5 ml Mikrozentrifugenrohr und lagern Sie es in einem Gefrierschrank (ca. 20 °C) bis kurz vor Gebrauch.
- 6 mM K3[Fe(C2O4)3] (100 ml): Rekristallisiertes Kaliumferrioxalate (0,295 g, 0,675 mmol) in 80 ml Wasser auflösen. Fügen Sie 0,5 M H2SO4 (10 ml) und eine entsprechende Menge an IEW hinzu, um das Volumen auf 100 ml zu erhöhen.
HINWEIS: Kaliumferrioxaat sollte durch Rekristallisation aus heißem Wasser gereinigt und im Dunkeln gelagert werden. Rekristallisiertes Kaliumferroxalat wird als Trihydrat erhalten; Daher ist seine Formel K3[Fe(C2O4)3]-3H2O und ein Formelgewicht von 491,24 sollte bei der Herstellung der Stammlösung berücksichtigt werden. Überprüfen Sie die Reinheit der 6 mM Lösung, indem Sie ihre Absorption bei 510 nm messen. Wenn die Absorption <0.02 ist, ist sie für den Einsatz im Experiment geeignet. - 0,1% Pufferphen (30 ml): NaOAc-3H2O (7,35 g), 1,10-Phenanthroline (Phen) auflösen. H2O (30 mg) und z. B. H2SO4 (0,9 ml) in IEW (20 ml). Fügen Sie IEW hinzu, um das Volumen auf 30 ml zu erhöhen.
HINWEIS: Die Lösung enthält 1,8 M NaOAc, 0,54 M H2SO4und 0,1% 1,10-Phenanthrrinin.
- Messung der Anzahl der Photonen mit Ferrioxalate-Aktinometrie
- 6 mM K3[Fe(C2O4)3] (V1 L) in eine Quarzküvette geben. Bestrahlen Sie die Lösung mit 350 nm Licht für 5 s.
- Übertragen Sie die bestrahlte Lösung auf eine Pyrex-Küvette mit einer l [cm] Pfadlänge.
- 0,1% Pufferphen (V2 L) in die bestrahlte Probenlösung geben und durch Pipettieren gut vermischen. Messen Sie die Absorption der Probe bei 510 nm. Berechnen Sie die durchschnittliche Absorptionsänderung pro Zeiteinheit (A510 [s1]).
- Berechnen Sie die Anzahl der Maulwürfe der erzeugten Fe2+ Ionen pro Zeiteinheit gemäß der folgenden Gleichung:
nFe2+ [mol sn n ]= ((V1 + V2) [L] - A510 [s'1])/(l [cm] -'510 [L mol'1 cm'1]),
wobei ( V1 + V2) das Volumen der Probe für die Absorptionsmessung ist, l die optische Pfadlänge der Küvette ist und diemolare Absorptivität der Fe2+- Phen-Komplex bei 510 nm.
ANMERKUNG: Unter den typischen Versuchsbedingungen sind die Werte von V1 = 2,0 x 10x 3 L, V2 = 0,33 x 10 x3 L, l = 1,0 cm und510 = 1,1 x 104 L mol1 cm1 verwendet wurden. - Berechnen Sie die Anzahl der Maulwürfe von Photonen, die die Probe erreichen (I0) mit der folgenden Formel:
I0 [einstein cm'2 s' 1] = nFe2+/€350
wobei die Quanteneffizienz der Photoreduktion des Ferrioxalates bei 350 nm liegt.
HINWEIS: Obwohl die Quanteneffizienz des Kaliumferrioxalate-Aktinometers bei 350 nm nicht gemeldet wird, wurde der gemeldete Wert von 1,2542 bei 358 nm verwendet.
- Quanteneffizienzmessungen bei 350 nm
- Verdünnen Sie die Probenbestandslösung (in DMSO, 10 l) mit K-MOPS-Puffer (pH 7,2, 10 ml), um eine 10-M-Lösung in K-MOPS mit 0,1 % DMSO zu erhalten.
HINWEIS: Der K-MOPS-Puffer bestand aus 100 mM KCl und 10 mM 3-(N-Morpholino)propanesulfonsäure (Mops) titrated to pH 7.2 with KOH. - Übertragen Sie ein Aliquot der Lösung (V1 L) in dieselbe Küvette, die bei der Photoreaktion des chemischen Aktinometers verwendet wird. Bestrahlen Sie die Probenlösung mit dem gleichen Setup wie in Schritt 4.2.1 beschrieben.
- Entfernen Sie regelmäßig ein Aliquot (50 l) aus der bestrahlten Lösung und analysieren Sie es mit HPLC.
- Bestimmen Sie die Bestrahlungszeit in Sekunden, in der 90% des Ausgangsmaterials reagierten (t90%) durch Einbau von Plots des zeitabhängigen Verschwindens des Ausgangsmaterials.
ANMERKUNG: Die Absorption der bestrahlten Probe muss bei <0.1 gehalten werden, damit die innere Filterung der Strahlung vernachlässigt werden kann. Es ist wünschenswert, dass der photolytische Verbrauch des Ausgangsmaterials durch ein-exponentielle Zerdekaden angenähert werden kann, so dass es keinen unerwünschten Sekundäreffekt gibt, der den Photolyseprozess stört. - Berechnen Sie die Quantenausbeute des Verschwindens (dis)mit der folgenden Gleichung28:
•dis = 1/(t90% - I0 x 350)
wobei t90% [s] die Bestrahlungszeit ist, in der 90% des Ausgangsmaterials verbraucht wurde, i0 [einstein cm2 s '1] ist die Anzahl der Mole von Photonen, und s.350 [cm 2 mol1] ist der decadische Aussterbekoeffizient der Probe bei 350 nm.
ANMERKUNG:350 [cm2 mol n1] = 103 x350 [M1 cm ,1].
- Verdünnen Sie die Probenbestandslösung (in DMSO, 10 l) mit K-MOPS-Puffer (pH 7,2, 10 ml), um eine 10-M-Lösung in K-MOPS mit 0,1 % DMSO zu erhalten.
5. Targeting einer anklickbaren Käfigverbindung mit einem HaloTag Ligand
ANMERKUNG: Halten Sie vor der Anwendung die HeLa-Zellen im modifizierten Eagle-Medium von Dulbecco (DMEM, glukosearme Glukose, Natriumpyruvat, l-Glutamin) auf, die mit 10 % fetalem Rinderserum (FBS) ergänzt werden, das 1% Antibiotika (Streptomycinsulfat, Penicillin G und Amphotericin) 37 °C und 5% CO2.
- Entfernen Sie das Medium und versuchen Sie die Zellen, indem Sie mit Trypsin-Ethylendiamintetraessigsäure (EDTA, 1 ml) bei 37 °C für 1 min. DMEM (4 ml) zu den Zellen hinzufügen und die Zellen durch sanftepipettierende Pipetten wieder aufhängen. Samen ca. 5 x 105 Zellen pro Schale in 35 mm Glasbodenschalen in DMEM (2 ml) 24 h vor der Transfektion.
- Bei vier Schalen in einem 1,5 ml Mikrozentrifugenrohr die Plasmid-DNA (pcDNA3-Halo-EGFR, 14 g) im reduzierten Serummedium (700 l) verdünnen. Das Lipofektionsreagenz (5 l) im reduzierten Serummedium (150 l) in jeder von vier Röhren separat verdünnen und bei Umgebungstemperatur für 5 min stehen lassen.
- Fügen Sie jedem der verdünnten Lipofektionsreagenzproben einen Teil der verdünnten Plasmid-DNA (150 l) hinzu. Inkubieren bei Umgebungstemperatur für 5 min.
- Nach Der Aufrechterhaltung der Zellen bei 37 °C und 5%CO2 für 24 h, aspirieren Sie das DMEM und spülen Sie die Zellen mit phosphatgepufferter Saline (PBS, 2 ml). Fügen Sie das reduzierte Serummedium (1,5 ml) hinzu.
- Fügen Sie jeder Schale das Plasmid-Lipofektionsreagenz (150 l) hinzu. Halten Sie die Zellen bei 37 °C und 5%CO2 für 48 h.
- Das Medium aspirieren, eine Portion frisch zubereitetes DMEM (1 ml) mit 2 M paBhc-hex-FITC/Halo hinzufügen und die Zellen bei 37 °C und 5%CO2 für 30 min inkubieren.
- Saugen Sie das Medium, das die Käfigverbindung enthält, und spülen Sie die Zellen zweimal mit PBS+ (1 ml pro Spülung) aus, um ungebundene Verbindungen zu entfernen. Fügen Sie das reduzierte Serummedium (500 l) hinzu und inkubieren Sie die Zellen bei 37 °C und 5%CO2 für 30 min, um die Verbindungen zu entfernen, die in die Zellen eingedrungen sind.
HINWEIS: PBS+ ist phosphatgepufferte Saline, ergänzt durch 2 mM CaCl2 und 1 mM MgCl2. - Entfernen Sie das Medium und spülen Sie die Zellen zweimal mit PBS+ (1 ml). Fügen Sie einen Teil eines Mediums (1 ml) hinzu, das kein Phenolrot enthält. Zeichnen Sie Fluoreszenzbilder durch Laserscanning konfokale Fluoreszenzmikroskopie auf.
6. Photomediate Modulation einer Kinase-Lokalisation mit einer anklickbaren Käfigverbindung
HINWEIS: Halten Sie vor der Verwendung die CHO-K1-Zellen in Hams F-12-Medium auf, ergänzt durch 10% FBS bei 37 °C und 5%CO2.
- Bereiten Sie eine 100"-Arbeitslösung (1 mM) von paBhc-AA (5) in DMSO vor.
HINWEIS: Eine 10 mM Stofflösung der Verbindung wird zubereitet und in einem Gefrierschrank (-20 °C) gelagert. - Samen ca. 5 x 105 Zellen pro Schale in 35 mm Glasbodenschalen in DMEM (2 ml) 24 h vor der Transfektion.
- Transfekte CHO-K1-Zellen mit einem Plasmid, das für GFP-DGK 48 h vor den Unkaging-Experimenten kodiert.
HINWEIS: Die Transfektion erfolgt gemäß den Schritten 5.2–5.5. - Ersetzen Sie das Medium durch ein reduziertes Serummedium (2 ml). Fügen Sie die 100"paBhc-AA-Arbeitslösung (20 l) hinzu und inkubieren Sie die Zellen bei 37 °C und 5%CO2 für zwischen 5 min und 1 h.
HINWEIS: Die Ladezeit hängt von der verwendeten Verbindung ab. - Platzieren Sie die Zellen auf der Objektivstufe eines invertierten Fluoreszenzmikroskops, das mit einem Fluoreszenz-Illuminator mit zwei Lichtquellen ausgestattet ist.
- Nehmen Sie alle 10 s ein fluoreszierendes Bild. Bestrahlen Sie die Zellen mit 330–385 nm Licht durch ein Mikroskopobjektiv für eine angemessene Zeit. Alternativ können Sie die Zellen mit 405 nm Licht mit einer Xe-Lampe durch flexible Quarzfasern bestrahlen.
- Fahren Sie mit der Aufzeichnung von fluoreszierenden Bildern für 10 min fort.
Ergebnisse
Anklickbare Käfigverbindungen einiger biologisch interessanter Moleküle, darunter Arachidonsäure und Paclitaxel, wurden erfolgreich synthetisiert (Abbildung 1)28,41. Zusätzliche Eigenschaften wie die Wasserlöslichkeit und zelluläre Targeting-Fähigkeit wurden in paBhcmoc-PTX über die kupfer(I)-katalysierte Huisgen-Cyclisierung ("Klick"-Reaktion) eingeführt (Abbildung 2). Diese anklickbaren Käfig-PTX wurden dann photolyziert, um ihre übergeordneten PTXs bei Bestrahlung bei 350 nm zu erzeugen (Abbildung 3), und die physikalischen und photochemischen Eigenschaften der anklickbaren Käfigverbindungen sind in Tabelle 1 zusammengefasst. Die Quantenausbeuten der anklickbaren Käfigverbindungen 2 -glc-paBhcmoc-PTX(-dis 0,14) und paBhc-AA(-dis 0,083) waren mehr als doppelt so hoch wie die der herkömmlichen Bhc-Käfigverbindungen 2-Bhcmoc-PTX( 0,040) und Bhc-AA (0,038) 43. Darüber hinaus wurde eine verbesserte Wasserlöslichkeit für 2 -glc-paBhcmoc-PTX beobachtet, die eine Glukose-Moiety enthält.
In Live-Zellexperimenten wurde die Ausrichtung von paBhc-hex-FITC/Halo auf die kultivierten Säugetierzellen, die vorübergehend ein Fusionsprotein eines HaloTag-Proteins und epidermalen Wachstumsfaktorrezeptors (EGFR) exemittierten, erfolgreich erreicht. Grüne Fluoreszenz des Fluorescein-Moiety s.ä paBhc-hex-FITC/Halo wurde auf der Zellmembran beobachtet (Abbildung 4). Die photovermittelte Modulation der subzellulären Lokalisation einer Kinase wurde mit einer paBhc-Käfigverbindung erreicht. Es wurde berichtet, dass die Translokation der Diacylglycerolkinase (DGK) in Gegenwart von Arachidonsäure (AA) aktiviert wurde44. CHO-K1-Zellen, die vorübergehend GFP-DGK exzessiieren, wurden entweder mit AA oder paBhc-AA behandelt (5). Die Zugabe von AA führte zur Modulation der subzellulären Lokalisierung der DGK (Abbildung 5A,B). Ähnliche Veränderungen in der Lokalisation der DGK wurden bei den paBhc-AA-behandelten Zellen nach Uv-Licht-Exposition beobachtet (Abbildung 5C,D).
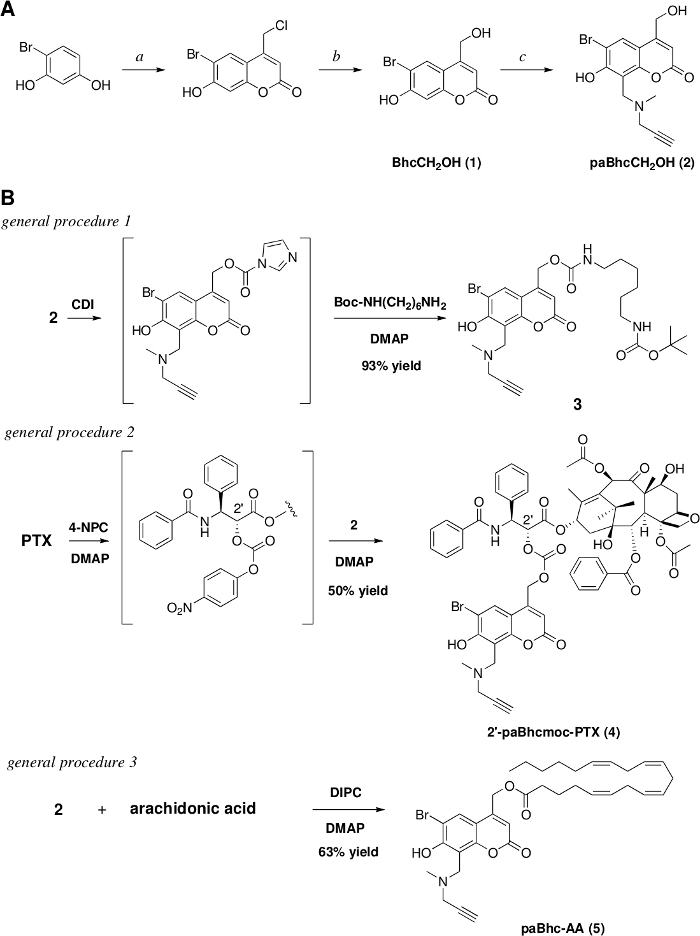
Abbildung 1: Herstellung der anklickbaren Käfigverbindungen.
(A) Reagenzien und Bedingungen: a. Ethyl 4-Chloracetoacetat/conc. H2SO4/rt/7 Tage/91% Ausbeute, b. 1 M HCl/Reflux/3 Tage/97% Ausbeute. c. N-Methylpropargylamin /HCHO/EtOH, dann hinzufügen (1) und Wärme bei Reflux für 17 h/79% Ausbeute. (B) Synthesen des anklickbaren Käfigamins, PTX und Arachidonsäure. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Einbau von Funktionseinheiten in anklickbare Käfigverbindungen.
(A) Synthese einer wasserlöslichen Klauen-PTX über die kupfer(I)-katalysierte Huisgen-Cyclisierung. (B) Strukturen von anklickbaren Käfigverbindungen, die den HaloTag Ligand für zelluläres Targeting enthalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
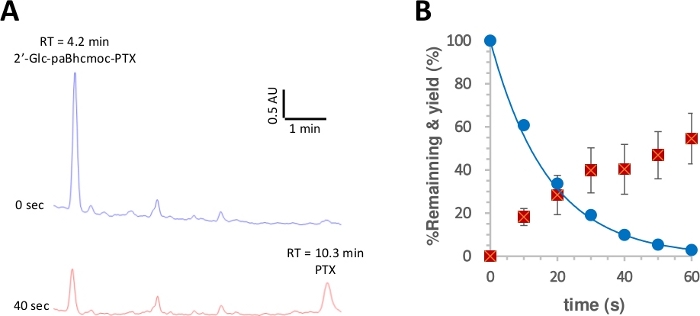
Abbildung 3: Photolyse von 2 -glc-paBhcmoc-PTX (6).
Proben (10 m) in K-MOPS-Lösung (pH 7.2) wurden mit 350 nm bestrahlt. (A) Typische HPLC-Spuren für die Photolyse von 6 (gemessen bei 254 nm). Die Proben wurden zur angegebenen Bestrahlungszeit analysiert. (B) Zeitkurs für die Photolyse von 6. Blaue Kreise zeigen den Verbrauch von 6. Die durchgezogene Linie zeigt die Kurve mit den kleinsten Quadraten, die für eine einfache verfallende Exponentialung für 6geeignet ist. Rote Quadrate zeigen die Ausbeute von PTX. Die Fehlerbalken stellen die Standardabweichung dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Fluoreszenzbilder kultivierter Säugetierzellen, die mit paBhc-hex-FITC/Halo (8) inkubiert werden.
Zellen, die mit pcDNA3-Halo-EGFR transfiziert wurden, wurden 30 min mit einer 2-M-Lösung der Verbindung 8 bei 37 °C inkubiert. Die Bilder wurden nach wiederholtem Waschen mit PBS+ erhalten. Mock-behandelte HEK293T-Zellen (A: Differential Interferenzkontrast (DIC) Bild und D: Fluoreszenzbild). HEK293T-Zellen (B und E) und HeLa-Zellen (C und F) vorübergehend ausdrückend Halo-EGFR (B und C: DIC-Bilder und E und F: Fluoreszenzbilder). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Fluoreszenzbilder nach UV-Bestrahlung der CHO-K1-Zellen, die mit Bhc-Käfig-Arachidonsäure inkubiert werden. CHO-K1-Zellen wurden mit einem Fusionsprotein DGK-EGFP transfiziert.
(A) Ein Fluoreszenzbild der transfizierten Zellen. (B) 100 s nach Zugabe einer 10-M-Lösung von Arachidonsäure. (C) Die Zellen wurden nach 20-s UV-Bestrahlung(330–385 nm) bei 37 °C bei 37 °C inkubiert. (D) 100 s nach 20-s UV-Bestrahlung (330–385 nm). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Verbindungen | •max (nm)a | max .m-1 cm-1)b | •disc | •disd | Löslichkeit (M)e |
| Ptx | 1.0 | ||||
| 2'-Bhcmoc-PTX | 340 | 10500 | 0.040 | 400 | 55 |
| 2'-paBhcmoc-PTX | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2'-glc-Bhcmoc-PTX | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA | 341 | 10800 | 0.038 | 390 | |
| paBhc-AA | 366 | 10300 | 0.083 | 750 |
Tabelle 1: Physikalische und photochemische Eigenschaften der anklickbaren Käfigverbindungen.
a) Absorptionsmaximum (nm), b. Molabsorptivität beimax .1 cm,c. Quantenausbeute des Verschwindens der Ausgangsstoffe bei 350 nm, d. Das Produkt der molaren Absorptivität und die Quantenausbeute des Verschwindens bei 350 nm, e. Die Konzentration der gesättigten Lösung in K-MOPS (pH 7,2) (g ml1).
Diskussion
Wir haben zuvor Bhc-Käfigverbindungen verschiedener biologisch aktiver Moleküle entwickelt, die hohe photolytische Wirkungsgradeaufweisen 28,45,46,47. Mit dem Ziel, das Repertoire der Bhc-Caging-Gruppen zu erweitern, berichteten wir auch über Plattformen modularer Käfigverbindungen, die durch die Einführung verschiedener Funktionseinheiten32,40,41leicht modifiziert werden können. Das vorliegende Protokoll stellt daher eine Methode zur Synthese eines anklickbaren Vorläufers von Bhc-Caging-Gruppen dar, die über die kupfer(I)-katalysierte Huisgen-Cyclisierung modifiziert werden können. Die Synthese des anklickbaren Vorläufers paBhcCH2OH (2) wurde über eine vierstufige Reaktionssequenz erreicht, die vom handelsüblichen 4-Bromoresorcinol (Abbildung 1A) ausgeht. Der Vorteil des vorliegenden Protokolls besteht darin, dass keine aufwändigen Reinigungsschritte (z.B. säulenchromatographische Trennungen) erforderlich sind.
Als anklickbare Vorläufer paBhcCH2OH (2) kann verwendet werden, um verschiedene funktionelle Gruppen zu maskieren, klickbare Käfigverbindungen von Aminen, Alkoholen und Carbonsäuren wurden mit 2 als Vorläufer synthetisiert (Abbildung 1B). Ader wurden als ihre Carbamate modifiziert, während Alkohole als ihre Karbonate modifiziert wurden. In den allgemeinen Verfahren 1 und 2 wurde CDI zur Herstellung von klickbaren Carbamate verwendet, während 4-Nitrophenylchlorofmat zur Herstellung von Karboden verwendet wurde. Wie der Reaktionsmechanismus zeigt, können beide Reagenzien zur Herstellung von Carbamate und Karbonaten verwendet werden. Es sollte auch beachtet werden, dass die Ausbeute der gewünschten Käfigverbindung von der chemischen Struktur des zu käfigen Moleküls abhängt. Weitere Beispiele sind in unseren vorherigen Berichten28,30,33,48zu sehen.
Die Klickänderung wurde dann mit einer geringfügigen Änderung des gemeldeten Verfahrens49durchgeführt. Die Zugabe von Tris(Triazolylmethyl)amin-basierten Liganden ist notwendig, um die gewünschten Produkte in guten bis hohen Erträgen zu erhalten. Da eine Vielzahl von Aziden sowohl aus kommerziellen Quellen als auch aus Literaturverfahren leicht verfügbar sind, können wir verschiedene modulare Käfigverbindungen mit zusätzlichen Eigenschaften wie Wasserlöslichkeit und zelluläre Targeting-Fähigkeit vorbereiten (Abbildung 2).
Die Quantenausbeute der Photolyse wurde dann nach einem gemeldeten Verfahren28,50gemessen. Abbildung 3 zeigt, dass der photolytische Verbrauch von 2 -glc-paBhcmoc-PTX und die Freisetzung von PTX durch ein-exponentielle Zerfall bzw. Anstieg angenähert wurden, was auf keine innere Filterung der Strahlung oder unerwünschte Sekundäreffekte hindeutet. Verbesserte Photolyse-Quantenerträge ()und Photolyse-Effizienz ()wurden für die klickbaren paBhc-Käfigverbindungen im Vergleich zu den zuvor gemeldeten Bhc-Käfigverbindungen beobachtet (Tabelle 1)41, 43. Da die Photolyseeffizienzvon Bhc-Käfigverbindungen mehr als hundertmal höher sind als die von 2-Nitrobenzyl-Käfigverbindungen48, ist die deutliche Verbesserung aufgrund des Vorhandenseins von paBhc-Käfiggruppen deutlich ein Vorteil für dieses System.
Als Proof-of-Concept-Experiment wurde ein hydrophiler Moiety in 2-paBhcmoc-PTX (4) und ein zellulärer Targeting-Ligand in Verbindung 3 eingeführt (Abbildung 2). Die Wasserlöslichkeit von 2 '-glc-paBhcmoc-PTX war 650 mal höher als die des übergeordneten PTX (Tabelle 1). Das selektive zelluläre Targeting wurde mit einem Tag-Sonden-System erreicht, und paBhcmoc-hex-FITC/Halo (8) mit dem HaloTag Ligand wurde erfolgreich auf die Zellmembran kultivierter Säugetierzellen ausgerichtet, die das HaloTag/EGFR-Fusionsprotein ( Abbildung 4). Die photovermittelte Modulation der subzellulären Lokalisation einer Kinase wurde ebenfalls mit einer anklickbaren Käfigverbindung 5 (Abbildung 5) erreicht.
Abschließend haben wir erfolgreich ein Verfahren zur Herstellung von anklickbaren Plattformen für fotohaltige Verbindungen biologisch interessanter Moleküle demonstriert, die leicht mit zusätzlichen Eigenschaften wie Wasserlöslichkeit und einer zellulären Targeting-Fähigkeit. Da die paBhc-Caging-Gruppe zur Herstellung von Molekülen mit veränderbaren funktionellen Gruppen verwendet werden kann, ist die Anwendung des vorliegenden Protokolls nicht auf die hier beschriebenen Moleküle beschränkt. Mit einer modularen Plattform, nämlich der paBhc-Caging-Gruppe, können die gewünschten Käfigverbindungen leicht vorbereitet und ihre physikalischen und chemischen Eigenschaften durch Klickmodifikation moduliert werden.
Offenlegungen
Wir haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde unterstützt von JSPS KAKENHI Grant Nummer JP16H01282 (TF), ein Grant-in-Aid für wissenschaftliche Forschung zu innovativen Bereichen "Memory Dynamm", und JP19H05778 (TF), "MolMovies".
Materialien
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
Referenzen
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten