Method Article
עיצוב, סינתזה ומאפייני פוטוכימיקלים של תרכובות בכלוב לחיצים
In This Article
Summary
פרוטוקול לסינתזה ומדידה של המאפיינים הפוטוכימיים של תרכובות בכלוב מודולרי עם moieties לחיץ מוצג.
Abstract
תרכובות בכלוב לאפשר את הטיפול בתיווך התמונה של הפיזיולוגיה התא עם רזולוציה גבוהה הזמני. עם זאת, מגוון מבניים מוגבל של קבוצות כולאת זמין כעת ואת הקשיים בשינוי סינתטי מבלי להקריב את היעילות פוטוליזה שלהם הם מכשולים כדי להרחיב את הרפרטואר של תרכובות בכלוב עבור תאים חיים יישומים. כאשר השינוי הכימי של הקבוצה מסוג coumarin רין-התמונה היא גישה מבטיחה להכנת תרכובות בכלוב עם תכונות פיזיות וכימיות מגוונות, אנו מדווחים על שיטה לסינתזה של תרכובות בכלוב לחיץ שניתן לשנות בקלות עם יחידות פונקציונליות שונות באמצעות מחזוריות הנחושת (I)-מזרז הויסיזציה. המולקולה פלטפורמה מודולרית מכיל (6-bromo-7-הידרוקסיקוארין-4-yl) מתיל (bhc) הקבוצה כקבוצה צילום-caging, אשר מציג יעילות פוטוליזה גבוהה לעומת אלה של 2-ניטרובנזים קונבנציונאלי. הליכים כלליים להכנת תרכובות בכלוב לחיצים המכילים amines, אלכוהול, ו carboxylates מוצגים. מאפיינים נוספים כגון מסיסות המים ויכולת המיקוד התאים ניתן לשלב בקלות לתוך תרכובות בכלוב לחיץ. יתר על כן, התכונות הפיזיות והפוטוכימיות, כולל התשואה הקוונטית של פוטוליזיס, נמדדות ונמצאו מעולים לאלה של תרכובות הכלוב המקבילות של Bhc. לפיכך, הפרוטוקול המתואר יכול להיחשב לפתרון פוטנציאלי לחוסר גיוון מבני בתרכובות הכלוב הזמינות.
Introduction
תרכובות בכלוב מתוכננים מולקולות סינטתיים, אשר הפונקציות המקוריות שלהם הן מסיכה באופן זמני על ידי קבוצות מחוברות הגנה באמצעות שמירה על התמונה. מעניין, תרכובות בכלוב של מולקולות רלוונטיות ביולוגית לספק שיטה הכרחית עבור השליטה זמן טמפורלית של הפיזיולוגיה התאית1,2,3,4,5 ,6. ב-1977, אנגלס ושלגר דיווחו על מחנה ה-2-ניטרולוקסיל של קמפ, כחומר לחדירות הקרום והנגזרת של מחנה7. בשנה הבאה דיווח קפלן על 1-(2-ניטרופניל) אתיל אסטר של ATP (NPE-ATP) וקרא למתחם זה "כלוב" ATP8. מאז, מגוון של קבוצות מגינים נשלפים כימית כגון 2-ניטרוגליצרין benzyls, p-הידרוקסיפנאס9, 2-(2-ניטרוגליצרין פניקסיל)10,11, 7-nitroindolin-1-yls12, 13, ו (coumarin-4-yl) מתושלח14,15,16 שימשו להכנת תרכובות בכלוב.
סינתזה של תרכובות בכלוב עם מאפיינים נוספים רצוי כגון חדירות הממברנה, מסיסות המים, ואת יכולת המיקוד הסלולר צפוי להקל על יישומים ביולוגיים התא. מאחר והתכונות הפיזיות והפוטוכימיות של מולקולות אלה תלויות בעיקר במבנה הכימי של קבוצות ההגנה הנשלפת של פוטוכימיקלים ששימשו להכנת המכונות, רפרטואר מגוון של קבוצות צילום-caging נדרש. עם זאת, מגוון מבניים של קבוצות כולאת זמין כרגע כי התצוגה יעילות פוטוליזה גבוהה היא מוגבלת. זה יכול להיות מכשול כדי להגדיל את השימוש בתרכובות בכלוב.
כדי לטפל בבעיה זו, הרפרטואר של קבוצות צילום-caging הורחב על ידי שינוי כימי של הקבוצה הקיימת הגנה מפני התמונות או עיצוב של photoremovable חדש כרומטוגרפי עם תכונות פוטופיסיים ופוטוכימיות מעולה. דוגמאות כוללות: נירורואכרופאריאן (ndbf)17, [3-(4, 5-דימוקסי-2-ניטרופניל) -2-בוטיל]18,19, מדגם 2-בנזיל-כלוב הפוטו20, התחליפי מתכות (DEAC45021 , דקסס22, 7-אזיטידיקסיל-4-מתילקוארין23, וסטיריל קומרנס24), cyanine נגזרות (cטרם-פאן)25, ונגזרים בודיפיה26,27.
בנוסף, פיתחנו בעבר (6-bromo-7-הידרוקסיקוארין-4-yl) מתיל (bhc) הקבוצה בהצלחה מסונתז תרכובות בכלובים שונים של נוירוטרנסמיטורים28, שליחים שני29,30, ו מ32,33 מציגאת החלקים הגדולים והשני של הפוטון. אם מאפיינים נוספים ניתן להתקין בקלות לתוך קבוצות כולאת מבלי להתפשר על רגישות התמונה שלהם, אז הרפרטואר של תרכובות בכלוב ניתן להרחיב34,35,36, 37,38,39. לפיכך עיצבנו תרכובות בכלוב מודולרי המרכיבות שלושה חלקים, כלומר הקבוצה Bhc כמו הליבה תגובה לתמונה, ידיות כימיות להתקנה של פונקציות נוספות, ואת המולקולות כי הם להיות רעולי פנים40, 41.
לפיכך, מאמר זה מספק שיטה מעשית להכנת תרכובות בכלוב של מולקולות רלוונטיות ביולוגית. הפרוטוקול הנוכחי מתאר שיטות להכנת פלטפורמה ללחיצה לקבוצות צילום, הכנסת פונקציות נוספות להרחבת הרפרטואר של תרכובות בכלובים, המדידה הפיזית והפוטוכימית ומיקוד התאים הסלקטיבי של מתחם כלוב לחיץ לצורך יישום סלולארי נוסף.
Protocol
1. סינתזה של הקבוצה המודולארית מודולרית של תרכובות בכלוב לחיצים28,41
-
הכנת (6-bromo-7-הידרוקסיקוארין-4-yl) מתיל כלוריד (Bhc-CH2קלרנית)
- מקום 4-ברומorcinol (9.742 g, 51.5 ממול) בבקבוקון של 100 mL עם תחתית עגול מצויד בר מערבב.
- הוסף conc. H2SO4 (98%, 30 mL) לבקבוקון ומערבבים את התערובת להתמוסס.
- להוסיף אתיל 4-כלורואצטט (10 מ ל, 74 mmol) dropwise.
- המשך לערבב את התערובת בטמפרטורת הסביבה למשך 5 ימים.
- בנפרד, המקום קוביות קרח כתוש (~ 200 mL) ב 500 mL Erlenmeyer בקבוקון.
- יוצקים את תערובת התגובה לתוך הקרח ומערבבים במרץ במשך 30 דקות עד שמתקבל אבקה דק.
- לאסוף את הזרז באמצעות סינון ואקום. רוחצים את מקלות חום האור במים חמש פעמים.
- יבש את הזרז תחת ואקום לילה כדי להניב בכצ2Cl כאבקה חום בהיר (13.57 g, 46.9 mmol).
-
הכנת (6-bromo-7-הידרוקסיקוארין-4-yl) מתנול (בכצ2הו)
- מניחים את BhcCH המוכן2קלרנית (1.1440 g, 3.95 mmol) ו-1 M HCl (300 mL) ב 1 L בקבוקון עם תחתית מצויד עם מעבה dimroth. מערבבים את התערובת ב-140 ° c לחמישה ימים. לאחר זמן זה, לצנן את התערובת לטמפרטורת הסביבה.
- להסיר את המים מן התגובה על ידי אידוי התאיידות על פני ואקום כדי להניב b2הו (1) כמו אבקה חום בהיר (1.0359 g, 3.82 mmol, 97% תשואה).
הערה: השימוש ב-250 mL של הHCl 1 מ' לכל 1 גר' בבכצ2Cl נותן תוצאה משביעת רצון.
-
הכנה לפאבכצ2או (2) באמצעות תגובת מנניק
- מניחים פאראפורמלדהיד (446.4 מ ג, 14.9 ממול) ב-50 mL עם תחתית בקבוקון. להוסיף אתנול הידרולי (5 מ ל) ו N-מתילפרולאמילין (1.25 ml, 14.8 mmol) לבקבוקון.
- מערבבים את התערובת בטמפרטורת הסביבה עבור h 1 מתחת לאווירת Ar.
- הוסף/י את הפקודה2או (1) (1.367 g, 5.04 ממול) לבקבוקון. מחממים את התערובת ל80 ° c עם מכשיר חימום בלוקים, וממשיכים לערבב את התערובת ב-80 ° c בטמפרטורה של 2 מתחת לאווירת Ar.
- לעצור את החימום לחסום ולצנן את תערובת התגובה לטמפרטורת החדר.
- לאסוף את האור המתקבל חום-צהוב מזרז על ידי סינון ואקום. שטוף את הזרז פעמיים עם כמות קטנה של אתנול אנפני (1 מ ל בכל פעם).
- הסירו את האתנול העודף תחת ואקום כדי להניב את פאבכצ2הו (2) (1.393 g, 3.96 mmol).
2. הכנת תרכובות בכלוב לחיצים
הערה: ניתן להחיל את ההליכים הבאים על הכנת תרכובות בכלוב אחרות המכילות הידרוקסיל, אמינו וקבוצות פונקציונליות מאוחרות.
-
נוהל כללי 1: הכנת מאמין בכלוב לחיץ
- מקום פאבלמ2 (2) (709.6 מ ג, 2.02 ממול) ו- n,n '-פחמן שלקרבונקסיל (cdi, 397.6 mg, 2.45 mmol) בבקבוקון בגודל 30 מ ל עם תחתית. הוסף יבש CH2Cl2 (6 מ ל) ומערבבים את הפתרון בטמפרטורת הסביבה עבור 1 h.
- להוסיף 4-dimethopyrito (4-DMAP, 324.8 mg, 2.66 ממול) ו tert-בוטיל (6-עמינח hexyl) carbamate (533.1 mg, 2.46 mmol). מערבבים את הפתרון בטמפרטורת הסביבה במשך 3 שעות.
- הסר את הממס וחומרים נדיפים אחרים באמצעות מאייד רוטרי תחת ואקום. לטהר את השאריות ישירות באמצעות כרומטוגרפיה של עמוד הבזק סיליקה ג'ל.
-
נוהל כללי 2: הכנת אלכוהול בכלוב לחיץ
- מקום פקליטקסל (ptx, 48.7 mg, 0.057 mmol) בבקבוקון 30 מ ל עגול, מצויד הזין שלושה כיוון ובלון Ar. הוסף יבש CH2Cl2 (1 מ ל), 4-dmap (17.1 mg, 0.14 mmol), ו-4-ניטרוגליצרין הכלורודיקסיל (26.0 mg, 0.13 mmol).
- מערבבים את הפתרון בטמפרטורת הסביבה עבור 2.5 h תחת אווירת Ar.
- הוסף 4-DMAP (15.7 מ"ג, 0.13 ממול) ופאבכצ2הו (2) (39.1 mg, 0.111 mmol) לפתרון. המשך לערבב את התערובת בטמפרטורת הסביבה במשך 17 שעות.
- הוסף CHCl3 (10 מ"ל) ו 15% מימית נחקו3 (5 מ ל) לתערובת. מערבבים במרץ את התערובת במשך כ -3 דקות. הסירו את השכבה הימית עם הפיפטה.
- הוסף חומצת לימון 0.5 מ' (5 מ ל) לבקבוקון המכיל את השכבה האורגנית. מערבבים את התערובת ומסירים את השכבה הימית כמעל.
- הפרד בין השכבה האורגנית באמצעות עמודת הפרדת פאזה. להסיר את הממיסים עם מאייד רוטרי תחת ואקום. לטהר את המוצר באמצעות כרומטוגרפיה רגיל לעמוד סיליקה ג'ל פלאש.
-
נוהל כללי 3: הכנת חומצה קרבוקסילית בכלוב לחיץ
- התמוססות חומצה ארכידונית (33.0 μL, 0.100 ממול),פמקב 2הו (2) (39.6 mg, 0.112 mmol), ו 4-dmap (14.1 mg, 0.115 ממול) ב-CH יבש2Cl2 (2 מ"ל). הוסף n,n ʹ-diאיזופסיפידיהאילממיד (Dipc, 17.0 μl, 0.110 ממול) ומערבבים את הפתרון בטמפרטורת הסביבה עבור 140 דקות.
- הסר את הממס תחת ואקום. לטהר את השאריות ישירות באמצעות כרומטוגרפיה של עמוד הבזק סיליקה ג'ל.
3. התקנת יחידה פונקציונלית לתוך תרכובות הכלוב הניתנים ללחיצה
- התמוססות נחושת (II) סולפט הקרב (249 mg) ב יון-החלפת מים (IEW, 10 מ"ל) כדי לתת 0.1 M CuSO4 פתרון.
- התמוססות 2 ʹ-פמוקסימוק-ptx (8.0 מ ג, 6.5 μmm), טריס (3-הידרוקסימתיל) אמין (thpta 17.5 mg, 40.3 μמול), נתרן l-ascorbate (162.4 mg, 0.825 ממול), ו 15-כלוראו-3, 6, 9-trioxapentadecyl אזיד (3.1 mg, 11 μm) בממס מעורב של 0.1 מ פוספט מאגר (2.5 mL, pH 7.2) ו diמתיל סולפוקסיד (DMSO, 0.5 mL).
- הוסף את 0.1 M CuSO4 פתרון (81.2 μl, 8.1 μm) לתערובת התגובה. מערבבים את התערובת בטמפרטורת הסביבה עבור 80 דקות. לעקוב אחר התקדמות התגובה באמצעות כרומטוגרפיה נוזלית בעלת ביצועים גבוהים (בדיקות).
- מתמוסס את הזרז על ידי הוספת 75% acetonitrile/מים פתרון (3.5 mL). החל את הפתרון המתקבל ישירות למערכת הטיפול החצי-מתבצעת כדי לטהר את המוצר הרצוי.
הערה: מסיסות של תערובת התגובה על ידי תוספת טרט-butanol יכול להאיץ את ההתקדמות של התגובה.
4. מעשה ההזדקנות של התרכובות הכלויוטיות
- הכנת פתרונות המניה
- לפזר את התרכובת בכלוב הרצוי (5 μm) ב DMSO (500 μL) כדי להכין פתרון מניות 10 מ"מ. לוותר על כל פתרון (10 μL) לתוך שפופרת מיקרוצנטריפוגה 1.5 mL ולאחסן במקפיא (למעלה 20 ° c) עד לפני השימוש.
- 6 מ"מ K3[פה (ג2O4)3] (100 mL): התמוססות האשלגן הממוסס (0.295 g, 0.675 ממול) ב80 mL של מים. הוסף 0.5 M H2SO4 (10 mL) וכמות מתאימה של iew כדי להפוך את הנפח ל 100 mL.
הערה: יש לטהר את האשלגן באמצעות מחזור המים החמים והמאוחסן בחשכה. מקבל בתור הטרילסיאן אשלגן. לכן, הנוסחה שלה היא K3[Fe (C 2O4)3] · 3h2O ו משקל הנוסחה של 491.24 צריך להיחשב במהלך הכנת פתרון המניה. בדוק את הטוהר של הפתרון 6 מ"מ על ידי מדידת ספיגת שלה ב 510 ננומטר. אם הספיגה היא < 0.02, היא מתאימה לשימוש בניסוי. - 0.1% מאגר-phen (30 מ ל): התמוססות NaOAc · 3H2O (7.35 g), 1, 10-פניאנטור (phen) · H2O (30 מ ג), ו conc. H2SO4 (0.9 mL) ב iew (20 ml). הוסף את ה-IEW כדי ליצור את אמצעי האחסון ל-30 mL.
הערה: הפתרון מכיל 1.8 M NaOAc, 0.54 M H2כל כך4, ו 0.1% 1, 10-פניאנטור.
- מדידה של מספר הפוטונים באמצעות פריאוקאלאקאומטריה
- מקום 6 מ"מK 3[פה (ג2O4)3] (V1 L) בקובט קוורץ. האפשרות להקרין את הפתרון עם אור 350 ננומטר במשך 5 ס.
- העבר את הפתרון לפני הקרינה לקובט Pyrex עם אורך נתיב l [cm].
- הוסף 0.1% מאגר-phen (V2 L) לפתרון המדגם לקרינה ומערבבים היטב על ידי ליטוף. מדוד את ספיגת המדגם ב 510 ננומטר. חישוב שינוי הספיגה הממוצע לזמן יחידה (ΔA510 [s-1)).
- חשב את מספר השומות של Fe2 + יונים לכל יחידה בהתאם למשוואה הבאה:
nfe2 + [מול s-1] = (V1 + v2) [L] × ΔA510 [s-1])/(l [cm] × ε510 [l ' 1ס מ )),
כאשר (v1 + v2) הוא הנפח של המדגם למדידת הספיגה , l הוא אורך הנתיב האופטי של קובט, ו ε510 הוא הספיגה הטוחנת של Fe2 +- פן קומפלקס ב 510 nm.
הערה: בתנאים הניסיוניים האופייניים, הערכים של V1 = 2.0 × 10 עד3 ליטר, v2 = 0.33 × 10 עד3 ל, l = 1.0 ס"מ, ו ε510 = 1.1 × 104 L מול1 ס מ-1 שימשו. - חשב את מספר השומות של הפוטונים המגיעים למדגם (I0) באמצעות הנוסחה הבאה:
אני0 [איינשטיין ס מ2 -1 לאחד) = nfe2 +/Φ350
כאשר Φ 350 הוא היעילות הקוונטית של photorמחנך של ferrioxalate ב 350 nm.
הערה: למרות היעילות הקוונטית של האשלגן ferrioxalate אקלומטר ב 350 nm אינו מדווח, הערך המדווח של 1.2542 בשנת 358 nm היה מועסק.
- יעילות מדידות קוונטית ב 350 nm
- לדלל את הפתרון מלאי לדוגמה (ב DMSO, 10 μL) עם מאגר K-ממרק (pH 7.2, 10 מ ל) כדי לתת פתרון 10 μM ב-K-מגבים המכיל 0.1% DMSO.
הערה: K-המאגר מיכל כללה 100 mM kcl ו 10 מ"מ 3-(N-שורגואולנו) חומצה propanesulfonic (מגבים) טיטרציה כדי pH 7.2 עם KOH. - העבר מקטע של הפתרון (V1 L) לאותו קובט המשמש בפעולה הפוטוריקלית של האקלומטר הכימי. הצגת פתרון המדגם באמצעות אותה התקנה כמתואר בשלב 4.2.1.
- הסר את הנורית (50 μL) מהפתרון שהיה לקרינה מעת לעת ונתח באמצעות היישום.
- קבע את זמן ההקרנה, בשניות, שבו 90% מהחומר ההתחלתי הגיב (t90%) על-ידי מגרשים מתאימים של היעלמות תלוית הזמן של החומר ההתחלתי.
הערה: יש לשמור על ספיגת הדגימה הניתנת לקרינה ב-< 0.1 כך שניתן יהיה לזנוח את הסינון הפנימי של הקרינה. רצוי כי צריכת photolytic של החומר ההתחלתי יכול להיות מקבל על ידי ריקבון יחיד מעריכי, כך שאין השפעה משנית לא רצויות המפריע לתהליך photolytic. - חישוב התשואה הקוונטית של היעלמות (Φdis) באמצעות המשוואה הבאה28:
Φdis = 1/(t90% × I0 × σ350)
כאשר t90% [s] הוא זמן הקרנה שבה 90% מחומר הזינוק נצרך, אני0 [איינשטיין ס מ2 -1 לאחד] הוא מספר שומות של פוטונים, ו σ350 [cm 2 מול1] הוא מקדם ההשמדה הדאדי של המדגם ב 350 ננומטר.
הערה: σ350 [cm 2 מול1] = 103ε350 [M-1 ס מ-1].
- לדלל את הפתרון מלאי לדוגמה (ב DMSO, 10 μL) עם מאגר K-ממרק (pH 7.2, 10 מ ל) כדי לתת פתרון 10 μM ב-K-מגבים המכיל 0.1% DMSO.
5. מיקוד של מתחם כלוב לחיץ עם ליגתג הלוגן
הערה: לפני השימוש, לשמור על תאי הלה ב בינונית שונה של הנשר מדולקו (DMEM, גלוקוז נמוך, נתרן פירובט, l-גלוטמין) שיושלם עם 10% סרום העוברי (FBS) המכיל 1% אנטיביוטיקה (סטרפטומיצין סולפט, פניצילין G, ו אמפוריטיצין) ב 37 ° c ו-5% CO2.
- הסירו את המדיום והטרינטוליזציה של התאים באמצעות טיפול בטריפיפסין-אתיליאדיטאמיטהטאציית2 (EDTA, 1 מ ל) ב-37 ° c עבור 1 דקות. הוסף DMEM (4 מ"ל) לתאים והשהה מחדש את התאים על-ידי ליטוף בעדינות. זרעי כ 5 × 105 תאים לכל מנה לתוך 35 מ"מ מנות זכוכית בתחתית dmem (2 מ ל) 24 שעות לפני הגלגול.
- עבור ארבע מנות, בצינור מיקרוצנטריפוגה 1.5 mL, לדלל את ה-DNA פלמיד (pcDNA3-Halo-EGFR, 14 μg) במדיום סרום מופחת (700 μL). בנפרד, לדלל את הזיהום מגיב (5 μL) במדיום סרום מופחת (150 μL) לתוך כל אחת מארבע הצינורות ולאפשר להם לעמוד בטמפרטורת הסביבה עבור 5 דקות.
- הוסף חלק של ה-DNA מדולל באמצע (150 μL) לכל הדגימות מדולל ליפוגל הזיהום. מודטה בטמפרטורת הסביבה עבור 5 דקות.
- לאחר שמירה על התאים בשעה 37 ° c ו-5% CO2 עבור 24 שעות, מולחים את dmem ולשטוף את התאים עם תמיסת מלח מוזרמת פוספט (PBS, 2 מ ל). הוסף את אמצעי הסרום הקטן ביותר (1.5 mL).
- מוסיפים את הקומפלקס הפלסטי (150 μL) לכל מנה. לשמור על התאים ב 37 ° צ' ו 5% CO2 עבור 48 h.
- משלחים את המדיום, להוסיף חלק של DMEM טרי (1 מ ל) המכיל 2 μM לפhc-hex-FITC/הילה, ו-דגירה את התאים ב 37 ° צ' ו 5% CO2 עבור 30 דקות.
- מרוב המדיום המכיל את המתחם הכלוב ולשטוף את התאים פעמיים עם PBS + (1 mL לכל לשטוף) כדי להסיר תרכובות לא מאוגד. להוסיף את הסרום מופחת בינונית (500 μL) ו מודדת את התאים ב 37 ° צ' ו 5% CO2 עבור 30 דקות כדי להסיר את תרכובות שנכנסו לתאים.
הערה: PBS + הוא פוספט באגירה מלוחים בתוספת עם 2 מ"מ CaCl2 ו 1 מ"מ MgCl2. - הסר את המדיום ושטוף את התאים פעמיים באמצעות PBS + (1 mL). הוסף חלק מאמצעי (1 mL) שאינו מכיל אדום פנול. הקלטת תמונות של קרינה פלואורסצנטית על ידי סריקת לייזר המיקרוסקופיה פלואורסצנטית.
6. אפנון של לוקליזציה של קינאז באמצעות תרכובת בכלוב לחיץ
הערה: לפני השימוש, לשמור על התאים CHO-K1 במדיום F-12 של Ham שיושלם עם 10% FBS ב 37 ° צ' ו 5% CO2.
- להכין פתרון עבודה 100 × (1 מ"מ) של פאבhc-AA (5) ב dmso.
הערה: פתרון מניות של 10 מ"מ במתחם מוכן ומאוחסן במקפיא (-20 ° c). - זרעי כ 5 × 105 תאים לכל מנה לתוך 35 מ"מ מנות זכוכית בתחתית dmem (2 מ ל) 24 שעות לפני הגלגול.
- Transfect צ'ו-K1 תאים עם קידוד פלבאמצע עבור GFP-DGKγ 48 h לפני ניסויים הזדקנות.
הערה: העברה מבוצעת על פי שלבים 5.2 – 5.5. - החליפו את המדיום באמצעי סרום מופחת (2 מ ל). הוסף את 100 × פhc-AA פתרון עבודה (20 μL) ו-מודתאת התאים ב 37 ° צ' ו 5% CO2 עבור בין 5 דקות ו-1 h.
הערה: זמן הטעינה תלוי בתרכובת המועסקים. - מניחים את התאים על השלב האובייקטיבי של מיקרוסקופ פלורסנט הפוכה מצויד המאיר אור כפול מקור פלואורסצנט.
- קח תמונת פלורסנט כל 10 ס. העברת התאים עם 330 – 385 אור ננומטר באמצעות מטרת מיקרוסקופ לזמן מתאים. לחילופין, מקרינים את התאים עם אור 405 ננומטר באמצעות מנורת Xe באמצעות סיבי קוורץ גמישים.
- המשך להקליט תמונות פלורסנט במשך 10 דקות.
תוצאות
תרכובות בכלוב לחיצים של כמה מולקולות מעניינות ביולוגית, כולל חומצה ארכידונית ו paclitaxel, היו מסונתז בהצלחה (איור 1)28,41. מאפיינים נוספים, כגון מסיסות המים ויכולת המיקוד התאי, הוכנסו לפאבכצ-PTX דרך מחזוריות הנחושת (I)-מזעור הואיזאז ("לחץ") (איור 2). לאחר מכן, בכלוב הלחיץ האלה, היתה פוטולייזד לאחר מכן כדי לייצר את ההורה שלהם, לאחר ההקרנה ב-350 ננומטר (איור 3), והתכונות הפיזיות והפוטוכימיות של תרכובות הכלוב הלחיצים מסוכמות בטבלה 1. התשואות הקוואנטיות של תרכובות בכלוב לחיצים 2 ʹ-glc-פהרב-PTX (Φdis 0.14) ופאבHC-AA (Φdis 0.083) היו יותר מפעמיים מאלה של תרכובות בכלוב בכלובים רגילות 2 ʹ-בכצ-ptx (Φדיס 0.040) ו-Bhc-AA (Φdis 0.038)43. בנוסף, מסיסות המים המשופרת נצפתה עבור 2 ʹ-glc-פאבכצ-PTX, אשר מכיל moiety גלוקוז.
בניסויים בתאים חיים, המיקוד של פhc-hex-FITC/הילה לתאי היונקים המתורבוניים המבטאים בסיפוק חלבון היתוך של חלבון הלותג וקולטן לגידול באפידרמיס (EGFR) הושג בהצלחה. זריחה ירוקה של fluorescein moiety של פאבhc-hex-FITC/הילה נצפתה על קרום התא (איור 4). באמצעות מתחם כלוב של פhc, הושגה אפנון מתווך של התאמה לוקליזציה תת-תאית של קינאז. הטרנסלוקציה של דיצילין קינאז γ (DGKγ) דווחה כמופעלת בנוכחות חומצה ארכידונית (AA)44. התאים צ'ו-K1 באופן מאוד מביע ביטוי GFP-DGKγ טופלו עם או AA או פאבhc-AA (5). התוספת של AA גרם לאפנון של הלוקליזציה subcellular של DGKγ (איור 5א, ב). שינויים דומים בלוקליזציה של DGKγ נצפו עבור התאים המתייחסים לפאבhc AA לאחר החשיפה לאור UV (איור 5ג, ד).
איור 1: הכנת תרכובות הכלוב הניתנים ללחיצה.
(א) ריאגנטים ומצבי הפעולה: a. אתיל 4-כלורואצטט/Conc. H2SO4/rt/7 ימים/91% תשואה, b .1 M HCl/ריפלוקס/3 ימים/97% תשואה. ג. N-מתילפרולאמילין/Hcho/oh, ואז להוסיף (1) וחום ב ריפלוקס עבור 17 h/79% תשואה. (ב) syntheses של אמין הכלוב הלחוץ, ptx, ו החומצה ארכידונית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: התקנת יחידות פונקציונליות לתוך תרכובות בכלוב לחיצים.
(א) סינתזה של כלוב מסיסים במים באמצעות מחזוריות הנחושת (I)-מזרז הויסיזציה. (ב) מבנים של תרכובות בכלובים הניתנים ללחיצה המכילות את הלוטאג ליאג ומיקוד תאי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
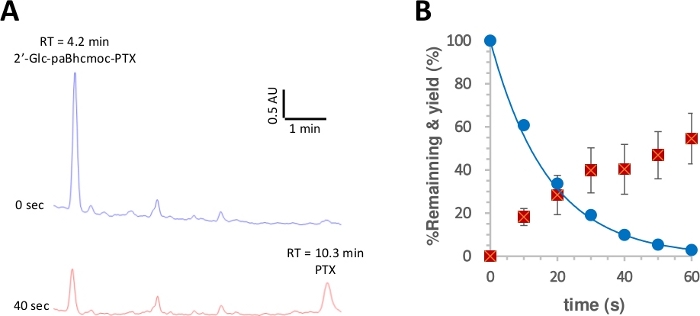
איור 3: Photolysis מתוך 2 ʹ-glc-פאבכצ-PTX (6).
דגימות (10 μM) בתמיסה K-מגבים (pH 7.2) נחשפו לקרינה בשעה 350 nm. (א) עקבות של הקשחת מרשמים ל-פוטוליזה של 6 (נמדד ב254 ננומטר). הדגימות נותחו בזמן ההקרנה שצוין. (ב) מסלול הזמן לפוטוליזיס של 6. עיגולים כחולים מציגים את הצריכה של 6. קו אחיד מראה את עקומת לפחות ריבועים להתאים מעריכי פשוט מדעיכה עבור 6. ריבועים אדומים מראים את התשואה של PTX. קווי השגיאה מייצגים את סטיית התקן (± SD). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: תמונות הקרינה הפלואורסצנטית של תאים מתוך היונקים המתורבאלים עם פאבhc-הקס-FITC/Halo (8).
תאים הpcDNA3-הילה-EGFR היו מודבטים עם פתרון μM 2 של מתחם 8 ב 37 ° c עבור 30 דקות. התמונות התקבלו לאחר כביסה חוזרת באמצעות PBS +. תאים HEK293Tמטופלים (A: ניגודיות הפרעה דיפרנציאלית (DIC) ותמונה D: תמונה פלואורסצנטית). HEK293T תאים (b ו -E) ותאי הלה (C ו- F) מביעים ביטוי הילה-egfr (B ו- c: תמונות DIC ו- E ו- F: תמונות פלואורסצנטית). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: תמונות פלואורסצנטית לאחר הקרנה UV של התאים CHO-K1 מודבטים עם חומצה ארכידונית בכלוב Bhc. התאים של צ'ו-K1 היו מזוהמים עם חלבון היתוך DGKγ-EGFP.
(א) דמות פלואורסצנטית של תאים מזוהמים. (ב) 100 s לאחר תוספת של 10 μm פתרון של חומצה ארכידונית. (ג) תאים היו מודבטים עם פתרון μm 10 של פאבhc-AA (5) ב 37 ° c עבור 5 דקות (ד) 100 s לאחר הקרנה של 20-s UV (330 – 385 nm). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| תרכובות | λmax (nm)מ | εmax (M-1 ס מ-1)b | φdisc | εφdisd | מסיסות (μM)e |
| מיכל הפאקס | 1.0 | ||||
| 2 '-בהבכצ-פאקס | 340 | 10500 | 0.040 | 400 | 55 |
| 2 '-פאבהמוק-פאקס | 359 | 9300 | 0.059 | 670 | 8.3 |
| 2 '-glc-בהבכצ-פאקס | 373 | 12300 | 0.14 | 1280 | 650 |
| Bhc-AA | 341 | 10800 | 0.038 | 390 | |
| פאבhc-AA | 366 | 10300 | 0.083 | 750 |
טבלה 1: תכונות פיזיות ופוטוכימיות של תרכובות בכלוב לחיץ.
א. הקליטה המרבית (nm), ב. הספיגה הטוחנת ב λmax (M-1 ס"מ-1), c. התשואה הקוונטית של העלמות חומרי המוצא ב 350 nm, d. התוצר של הספיגה הטוחנת והתשואה הקוונטית של העלמות ב350 ננומטר, אי. ריכוז התמיסה הרוויה ב-K-מגבים (pH 7.2) (μg mL-1).
Discussion
בעבר פיתחנו תרכובות בכלוב bhc של מולקולות פעיל ביולוגית שונים המוצגים יעילות photolytic גבוהה28,45,46,47. במטרה להרחיב את הרפרטואר של קבוצות bhc הזדקנות, אנו דיווחו גם על פלטפורמות של תרכובות בכלוב מודולרי שניתן לשנות בקלות על ידי המבוא של יחידות פונקציונליות שונות32,40,41. הפרוטוקול הנוכחי, לפיכך, מייצג שיטה לסינתזה של מבשר בלייזר של קבוצות Bhc הזדקנות שניתן לשנות באמצעות מחזוריות הנחושת (I). הסינתזה של הראשון לחיץ, פאבכצ2הו (2), הושג באמצעות רצף התגובה ארבעה צעדים החל מסחרית הזמין 4-ברומorcinol (איור 1a). היתרון של הפרוטוקול הנוכחי הוא שאין שלבי טיהור מפרך (לדוגמה, הפרדות כרומטוגרפיות של עמודות) נדרשות.
כפי שניתן ללחוץ עלהספר הראשון (2) בכדי להסוות קבוצות פונקציונליות שונות, תרכובות בכלוב לחיצים של amines, אלכוהול, ו-חומצות קרבוקסילית ו-מסונתז באמצעות 2 כקודמן (איור 1b). בעוד האלכוהול שונו. בתור הקרבונטים שלהם בהליכים כלליים 1 ו-2, CDI שימש להכנת carbamates הניתנים ללחיצה, בעוד שימוש ב-4 ניטרוגליצרין בכלורוקקסיל המשמש להכנת קרבונטים. כפי שמצוין על-ידי מנגנון התגובה, ניתן להשתמש בשני הריאגנטים להכנת כרמי וקרבונטים. יש לציין כי התשואה של תרכובת הכלוב הרצויה תלויה במבנה הכימי של המולקולה כדי להיות כלואה. דוגמאות אחרות ניתן לראות בדוחות הקודמים שלנו28,30,33,48.
השינוי בקליק התבצע לאחר מכן באמצעות שינוי קל של הפרוצדורה המדווחת49. התוספת של tris (triazolylmethyl תיל) אמין מבוססי ליגנדס הוא הכרחי כדי להשיג את המוצרים הרצויים בטוב לתשואות גבוהות. כיוון שמגוון רחב של אזימוט זמין הן ממקורות מסחריים והן מהליכי ספרות, אנו יכולים להכין תרכובות כליות מודולריות שונים עם מאפיינים נוספים כגון מסיסות מים ויכולת מיקוד הסלולר (איור 2).
התשואה הקוונטית של פוטטולזיס נמדדה על פי הליך מדווח28,50. איור 3 מראה כי הצריכה photolytic של 2 ʹ-GLC-ptx-פטק ושחרורו של ptx הוטלו על ידי ריקבון יחיד מעריכי ועלייה, בהתאמה, מציע לא סינון פנימי של הקרינה או תופעות משניות רצויות. משופר פוטוליזה התשואות הקוונטים (Φ) ו פוטוליזה יעילות (εΦ) נצפו על התרכובות בכלוב הלחיץ למדי לעומת אלה של תרכובות בכלוב שדווחו בעבר (שולחן 1)41, 43. מאחר והיעילות של הפוטטולוזיס (εΦ) של תרכובות בכלוב בכלובים גבוהה מ-100 פי שניים מאלה של48תרכובות בכלובים מסוג 2-ניטרווליקסיל, השיפור המסומן בשל נוכחותם של קבוצות פאבhc כולאת בבירור יתרון עבור מערכת זו.
כניסוי של הוכחת רעיון, הmoiety הידרופיפילית הוכנס לתוך 2 ʹ-פאבלודק-פאקס (4) והוכנס לתוך מתחם 3 (איור 2). מסיסות המים של 2 ʹ-glc-פמוקסיק-PTX היה 650 פעמים יותר גבוה מזו של ההורה PTX (שולחן 1). המיקוד הסלולר סלקטיבי הושג באמצעות מערכת תג-בדיקה, ופאבכצ-hex-הקס-FITC/Halo (8) הנושאת את הלוטאג ' ליגאג ' והייתה מכוונת בהצלחה לקרום התא של תאי היונקים המתורבתים המבטאים את חלבון ההיתוך של ההלותג/egfr ( איור 4). אפנון מתווכת התמונה של הלוקליזציה התת-תאית של קינאז הושג גם באמצעות מתחם כלוב לחיץ 5 (איור 5).
לסיכום, הדגמנו בהצלחה שיטה להכנת פלטפורמות לחיצים עבור תרכובות צילום בכלוב של מולקולות מעניינות ביולוגית, כי ניתן לשנות בקלות עם תכונות נוספות, כגון מסיסות המים הסלולר יכולת המיקוד. מאחר שקבוצת פאבhc כולאת יכולה לשמש להכנת כל מולקולות עם קבוצות פונקציונליות מסוימות, יישום הפרוטוקול הנוכחי אינו מוגבל למולקולות המתוארות להלן. באמצעות פלטפורמה מודולרית, כלומר הקבוצה פאבhc כולאת, תרכובות בכלוב הרצוי ניתן להכין בקלות, ואת התכונות הפיזיות והכימיות שלהם יכול להיות מאופנן באמצעות שינוי לחץ.
Disclosures
. אין לנו מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי JSPS KAKENHI גרנט מספר JP16H01282 (TF), מענק סיוע למחקר מדעי על אזורים חדשניים "הזיכרון דינמיות," ו JP19H05778 (TF), "מולסרטים."
Materials
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
References
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved