Method Article
主な羊水および膜 Xeno 無料条件で多能性細胞をリプログラミング
要約
このプロトコルでは、完全に化学的に定義された条件における非統合 episomal アプローチを用いた誘導多能性幹細胞にプライマリ羊水液と膜間葉系幹細胞のリプログラミングをについて説明します。抽出、文化、リプログラミング、および厳格な方法で結果の誘導多能性幹細胞の特性の手順に。
要約
自家細胞を用いた治療法は、誘導多能性幹細胞の導入により現実に近い方のステップを得た。羊水など膜幹細胞、胎児の幹細胞は、組織工学、将来小児の介入と幹細胞のバンキングの iPSC にプログラムし直す約束の未分化細胞のユニークな型を表します。ここで提示されたプロトコルを抽出するための最適化手順をについて説明し、プライマリ羊水液と膜間葉系幹細胞を培養させ、episomal 誘導これら完全に化学的に定義された培養細胞からの多能性幹細胞人間の組換えビトロネクチンおよび E8 媒体利用の条件。-フローサイトメトリー、共焦点レーザー顕微鏡、奇形腫形成と転写プロファイリング-厳格な方法を適用することによって新しい行の評価についても述べる.新しく生成された行は、SSEA 1 のマーカーが陰性でありながら胚性幹細胞-Oct3/4 a、Nanog、Sox2、トラ-1-60、トラ-1-81-SSEA 4 のマーカーを表現します。幹細胞は、6-8 週間でベージュ scid マウスにおける奇形を形成し、奇形を含むすべての 3 つの細菌層の代表的な組織。Bioinformatic 多能性評価アルゴリズムをグローバル発現マイクロ アレイ データを提出することにより、行の転写プロファイリングすべて行多能性としたがって、このアプローチは、動物実験に代わる。IPSC の新しい行は、分化とティッシュ エンジニア リングの最適化を含む下流の実験で容易に使用できます。
概要
潜在的なセル置換療法、疾患と発達モデルと薬物毒性スクリーニング1,2,3の誘導多能性幹細胞 (iPSC) の技術をもたらします。細胞の注入により、補充療法が概念的には可能、体外 (心筋パッチ) などの組織移植を区別またはティッシュ エンジニア リングによる再生を誘導します。羊水 (AFSC) と膜幹細胞 (AMSC) いずれかこれらの介入のための細胞の優れた供給源は、直接4,5,6、7リプログラミングの開始セル人口多能性8,9,10、11,12。
初期のアプローチに使用される未定義の文化システムや9,10、11,12の構成要素を伴うゲノムの統合を必要とするメソッドをプログラムし直します。最近の研究より少なく定義された基底膜添付ファイル マトリックス (BMM) は、羊膜上皮細胞から iPSC を生成に使用されたにもかかわらず xeno 自由な媒体を採用しました。しかし、奇形腫形成アッセイは in vitro 及び分子データの富と共に研究に含まれません。新生児線維芽細胞13と比較して約 8 高いリプログラミング効率を持っている羊水上皮細胞が見つかりました。別の研究で、羊水から間葉系幹細胞は多く高効率12iPSC に再プログラムするも発見されました。
多能性幹細胞はすべての 3 胚葉組織代表に区別でき、このように広範な可能性があります。小児患者が恩恵を収穫、リプログラミングとその自家羊水幹細胞の組織工学胎児と羊膜幹細胞周産期。さらに、(成体幹細胞14,15より低い) 胎児の幹細胞の分化の低レベルは、iPSC16でソース セルからエピジェネティックなバイアスの観測の保持に対処に役立つ可能性が理論的に。
羊水をプログラムし直すためのプロトコルの紹介し、膜幹細胞の多能性を化学的に組換えビトロネクチン17 (VTN) episomal プラスミド18を使用して xeno E8 培を定義します。流体と膜羊膜の細胞リプログラミングのソースとしての主な利点は、利用前とこのアプローチは主に小児組織工学に研究の利益周産期そしてこうして。
プロトコル
プロトコル人間研究倫理委員会の機関のガイドラインに従います。研究のため羊水を使用して患者の書面による同意が得られました。
このプロトコル制度動物ケアおよび使用委員会南アラバマ大学のポリシーに従います。
1. 分離とプライマリ羊膜由来間葉系幹細胞の培養
-
羊水細胞へのめっき
- 羊水羊水検査の過程で医師による収穫の 2.5 mL の最小値を取得します。
注: 無菌培養キャビネットに生きた細胞や組織のすべての処理を行う必要があります、適切な個人用保護具を使用する必要があります。基本の細胞培養と生殖不能の技術知識が必要です。 - 羊水細胞 (センテニアルレガシー時) の流体と膜の培養基の準備: EBM 2 基礎培地 15% ウシ胎児血清 (FBS)、bFGF の 20 ng/mL、EGF、IGF の 10 ng/mL の 25 ng/mL。主流体として羊水羊膜幹細胞の培養、媒体は抗生物質抗真菌薬ソリューションで補完する必要があります。
- 0 日に T25 フラスコ センテニアルレガシー時培とプレートの 3.5 ml 2.5 mL の羊水をミックスします。少なくとも 48 時間の植民地の存在をチェックする前に邪魔されずに CO2を 37 ° C、5% で孵化させなさい。
- 5 日付着細胞のコロニーが存在する必要があります。完全に下の破片に付着、真空吸引パスツール ピペットを使用して過ごした媒体/羊水流体混合細胞を取り除くためフラスコがみ合います。5 ml の新鮮なセンテニアルレガシー時媒体の交換してください。
- もう 5 日のカルチャです。1.1.4 の手順に従って、他の毎日媒体を変更します。
- 羊水羊水検査の過程で医師による収穫の 2.5 mL の最小値を取得します。
-
ひと羊膜から主の間葉系幹細胞の分離
- 胎盤の細胞の完全性を最大化するために、遅くとも 24 時間以内の誕生をできるだけ早く次を取得します。9 cm2セグメント、羊膜を切り取って血栓を削除抗生物質抗真菌薬ソリューションを添加した PBS の 30 mL と 50 mL の遠心管中を洗います。
- メスのペアを使用して滅菌 10 cm 組織培養皿の中の作品の罰金する膜をミンチします。膜の分解とセルの抽出、組織解離システムを使用して達成されます。製造元のプロトコルに従ってください。
注: ミンチ後組織の部分が細かいほどの細胞数消化後に回復。 - 1 組織解離チューブにメス刃を使用してみじん切りにした膜組織質量を転送し、4.7 ml RPMI 1640 媒体のミックスします。(材料の表を参照してください) 解離酵素を混ぜます。
- 組織発生器にチューブをマウントし、プログラム"h_tumor_01"を実行します。30 分間のロッキング プラットフォーム上の 37 ° C でチューブを孵化させなさい。
- さらに RPMI 1640 35 mL で懸濁液を希釈し、50 mL の遠心管に置かれる 70 μ m ストレーナーに適用されます。
- 遠心室温、破棄上清 200 x g で 5 分間 RPMI 1640 5 mL にペレットを再懸濁します、血球を使用してセルをカウント、新鮮な培養治療血管に 10,000 のセル/cm2の密度でプレート準備抗生物質・抗真菌薬ソリューション センテニアルレガシー時培。
メモ: 不完全な消化の場合組織の小片が、存在する単一セルが不足になります。再びスピン ・ ダウンと 1 つの T75 フラスコ全体のペレットをプレートします。
-
プライマリの AFSC とアムスクの文化
- 真空吸引 AFSC/アムスクの通路植民を過ごし中パスツール ピペットを使用して、フラスコに細胞剥離酵素の 2 mL を追加します。5-8 分の 37 ° C で孵化させなさい。
- 細胞を取り除くし、懸濁液を混ぜてセンテニアルレガシー時媒体の等量のためにフラスコをタップ (抗生物質抗真菌薬サプリメントはこの時点から必要なできませんする必要があります)。4 5 分削除いずれかガラス パスツール ピペットを使用して上清または単にチューブを反転し、ゴミ箱空に 200 g の遠心分離機します。
- 液体の残りのドロップで単一細胞懸濁液にペレットを分割し、めっき用センテニアルレガシー時媒体と混合する遠心分離機管の下にフリックします。2,500 と 5,000 セル/cm2の密度で T フラスコにプレート。
- 変更中一日おき。6 の通路を超えて細胞は文化ないです。目的のリプログラミング、低としてできるだけ通路を使用します。
- 凍結媒体を使用してのバックアップとして AFSC とアムスクの凍結する在庫を準備します。細胞剥離酵素、200 g で 4 ° C、5 分間遠心を使用して文化を収穫します。
- パスツール ピペットを使用して上清を除去し、ペレットのセルを複数化する管の底をフリックします。クリオバイアルに因数 1 × 106/mL の密度で完全凍結培地で再懸濁します。-80 ° C で一晩冷凍コンテナーに格納します。長期保存用液体窒素に移動します。
2. 多能性にプログラムし直す
- リプログラミングのプラスミドを入手します。
- 非営利のプラスミド リポジトリをリプログラミングのプラスミドを購入します。材料移転契約が必要です。
- エシェリヒア属大腸菌の有能なセルに、プラスミドを変換し、市販のプラスミド抽出キットを使用してプラスミッドを分離します。製造元の指示に従ってください。
- 分光光度計を用いた DNA のプラスミッドの濃度を測定します。高結果プラスミド濃度、トランスフェクションの中にサンプルの希釈を避けるために理想的に約 1 μ g/μ L を目指してください。
- 紫外線分光光度計と因数を使用して個々 のプラスミド濃度を測定して個別に。
- ミックス一緒に 3 μ g、3 μ g、EN2K、ET2K、M2L プラスミドの 2 μ g それぞれ。リプログラミングのプラスミド ソリューションです。プラスミド溶液の量は、1 x 10 の6セルを使って十分です。いくつかこのような因数を準備します。
- -80 ° C ですべての因数を格納します。
- ターゲット培養皿を準備します。
- ビトロネクチン 1 つの 6-ウェル プレートをコート-ビトロネクチン希釈バッファーの 1 つの mL を各ウェルに、VTN 原液 (1 μ g/cm2) の 40 μ L で混ぜます。(RT) 室温または 37 ° C で 1 時間のためのインキュベーターで残します。
- 真空吸引パスツール ピペットを使用して、ソリューション、センテニアルレガシー時各ウェル中の 2 mL で置き換えます。セルがめっきするまで 37 ° C で保存します。
注: 重要な: この手順で使用される、センテニアルレガシー時媒体に、抗生物質や抗真菌薬のソリューションを含めることはできません。
- 収穫培養一次 AFSC/アムスク
注: は、低通過数で凍結する在庫をするようにプログラムし直すための 1 つの T-75 フラスコを捧げる文化を十分に AFSC/アムスクを展開します。実験、収穫を目指す約 500,000 細胞の損失を補償するため、トランスフェクション パラメーターまたは異なる培養条件の最適化がテストされる場合、いくつかとして以来 100,000 セルで十分です。- 低い通路で都合つき次第 AFSC/アムスク 1.3.1 に 1.3.2 の手順で説明されているように細胞剥離酵素ミックスを使用しての収穫します。細胞を遠心分離されている、次の手順に進みます。
- 血清成分を洗浄する PBS とよく混ぜるの 1 mL にペレットを再懸濁します。計算盤を使用してセルをカウントします。1.5 mL 遠心チューブに 100,000/mL の PBS そして因数に細胞の密度を調整します。セルとトランスフェクションに使用するバッファーの間のみ最小限の接触時間がこうなります。
- 5 mL のポリスチレン管上に遠心チューブを配置 (アダプターとしては、遠心分離正規スイング回転体) と 200 x g で室温で 4 分間遠心します。チューブを反転し、上澄みを廃棄物容器に廃棄します。固定角ロータを使用しないでください。
- 室温で 3 分間 200 × g で遠心分離追加手順を実行します。これは残り、下部を収集する管の壁からの液体。慎重にすべての 200 μ L ピペットを使用してそれを吸い出しなさい。
- プラスミドをリプログラミングのトランスフェクション
- 実験をリプログラミングのトランスフェクション システム (材料の表を参照) される細胞リプログラミング プラスミドを提供します。組織培養のキャビネットにトランスフェクションのヒント、トランスフェクション チューブ、再懸濁バッファー、および電解バッファーを配置します。キット試薬がで保たれて RT 彼らがオープンするまで、彼らが 4 ° C で保存されます。
注: 我々 はキットの 10 μ L のバージョンを使用します。 - トランスフェクション デバイスを閉じて、その駅はキャビネットに直接配置ことができますに移動します。3 mL の電解バッファーと 1 つのトランスフェクション管を記入し、スロット内部すべての方法それを押して駅にチューブをマウントします。
- リプログラミングのプラスミド-80 ° C のストレージから 2.1.5 ステップで準備ソリューション因数とキャビネットの文化で常温解凍できるように。
- トランスフェクション デバイス次のトランスフェクション パラメーターを選択: 950 V、40 ms と 1 パルス。
- 10 μ L 再懸濁バッファーで 100,000 セルを含むペレットを再懸濁します。仕事すぐにこのポイントからの再懸濁バッファーはわずかに有毒物質、増加の暴露時間が著しくより低い細胞生存率の結果します。
- リプログラミングのプラスミド ソリューション (分注のソリューションに対応した 1 x 10 の6セルの合計) の 10 分の 1 に混ぜます。
- トランスフェクション ピペットにトランスフェクションの先端をマウントします。
- 細胞懸濁液を慎重に、トランスフェクションの先端に吸引して、気泡の形成を回避します。泡が認められた場合は、懸濁液を追放し、誤嚥を繰り返します。空気の泡は、トランスフェクションが低下します。
- トランスフェクション ピペットをトランスフェクション チューブ挿入し、トランスフェクション デバイスの画面の"START"ボタンを押します。遺伝子導入の成功を知らせる画面メッセージを待機し、すぐにチューブからピペットを削除します。
- セクション 2.2 で準備ターゲット 6 ウェル プレートの 1 に懸濁液を放出します。まあ周辺から中ミックスし、両方の井戸 (得られる細胞密度は 50,000/ウェルになります) に懸濁液を均一に分散します。
- 個別に AFSC/アムスクを含むすべてのマイクロ遠心チューブ用のため、トランスフェクションを繰り返します。37 ° C、5% CO2インキュベーターにプレートを配置します。
- 実験をリプログラミングのトランスフェクション システム (材料の表を参照) される細胞リプログラミング プラスミドを提供します。組織培養のキャビネットにトランスフェクションのヒント、トランスフェクション チューブ、再懸濁バッファー、および電解バッファーを配置します。キット試薬がで保たれて RT 彼らがオープンするまで、彼らが 4 ° C で保存されます。
- Transfected AFSC/アムスクの文化
- 2-5 日 transfected セルの文化.3 日目に酪酸の 100 μ m 補足 E8 のリプログラミング媒質に切り替えて。
注: セカンダリ通路はソース AFSC/アムスクの増殖を避けるために実行できます。ただし、このパラメーターが正しくリプログラミング効率を計算するオプションが無効になります、継します。 - リプログラミングの中毎日を 1 日おきに 10 日間に変更します。媒体の 10 日目から毎日を変更します。
- 2-5 日 transfected セルの文化.3 日目に酪酸の 100 μ m 補足 E8 のリプログラミング媒質に切り替えて。
- クローン性増殖の完全 reprogramed コロニーの手動狩り
- 完全にプログラムし直されたコロニーは 14 日目の周り表示されます。サイズ展開となりコンパクトなコロニーを許可します。手動でピックアップし、できる日 15-16 早く新鮮なプレートに転送。
- ピッキングを行う前、に 1 h で 300 μ L/ウェル (1 μ g/cm2) ビトロネクチン希釈バッファーの VTN の 8 μ L で 24 ウェル プレートをコートし、RT または 37 ° c. で孵化させなさい酪酸ナトリウムなし E8 媒体とソリューションを交換してください。
- キャビネットの無菌培養で十分なサイズ (直径理想的に以上 400 μ m) のコロニーを選択します。位相差顕微鏡や顕微鏡を使用ことができます。
- ピッキング、そのモニター接眼レンズの必要があるので、キャビネットに置かれます液晶イメージング顕微鏡が使用されます。70% エタノールを用いた顕微鏡ステージを滅菌します。
- 正規位相差細胞培養顕微鏡を使用すると、選択、マーク、および選ばれるコロニーの数に注意してください。これは、時間をこのプロセスの実際のピッキング中に浪費しないことを確認する重要です。
- PBS で 0.5 mM エチレンジアミン四酢酸 (EDTA) の 30 μ L で選ばれるコロニーの数以上にある PCR チューブの数を入力します。植民地は、メッキ前に、の部分解離のこれらの管に配置されます。
- 5 をピックアップする予定時点設定 2 μ L に 10 μ L ピペットを使用してプレートからコロニー コロニー端角度でピペット チップを保持し、慎重に、徐々 にこすり表面を離れて全体の植民地。すぐにピペット チップに全体のコロニーを吸引し、EDTA で準備された PCR チューブの 1 つに転送します。
- 残りの 4 のコロニーを繰り返します。常温 4-6 分間インキュベートします。
- 上下に優しく小さい塊に植民地を分割するより大きいピペット チップを使用して懸濁液をピペットで移しなさい。単一細胞懸濁液を作成しないでください。
- 2.6.2 準備した 24 ウェル プレートのターゲットに直接プレートの懸濁液。残りのコロニーを繰り返します。
- 以上 5 植民地が選ばれるが一度に 5 以上のコロニーを選択しない場合、手順 2.6.10 を通じて 2.6.6。37 ° C と 5% CO2で孵化させなさい。
- クローン性増殖と iPSC の成熟
- 成長し、コンパクトになるコロニーを許可します。3-6 日で十分です。培養液は毎日変わる。400 μ L と細胞密度に基づく E8 培地 1 mL を使用します。
- 十分な植民地密度 24 ウェル プレートの井戸は、6 ウェル プレートに展開されます。1 h を通過、前にコート (ステップ 2.2.1) のように VTN で 6 ウェル プレートです。井戸のソリューションをウェルあたり E8 培地 2 mL に置き換えます。
- 1 mL ピペットを使用してソース井戸から使用済み培地を吸引し、300 μ L 0.5 mM EDTA を洗浄するのに置き換えます。すぐに同じのピペット チップを使用して吸引し、0.5 mM EDTA の 300 μ L で再度交換 5 分 1 mL ピペットを使用してすべての液体を吸引するため、RT で孵化させなさい。
- 容量に 1 mL ピペットを設定、マウント、1 mL ワイドボア ヒントおよび先端にターゲットから E8 の培地を吸引します。ストリーム メディアのソース iPSC 文化を洗い落とします。
- よくターゲットとピペットを上下に数回 20 50 細胞の塊に植民地を分割するために懸濁液を転送します。彼らは穏やかなロッキング プレートを揺することによって井戸に均等に分散され、37 ° C、5% CO2で孵化させなさいことを確認します。
- 毎日媒体および通路ごと 3 〜 4 日を変更します。どんな差別化植民地は、位相差顕微鏡下でマークすることができます、キャビネット文化のピペット チップを使用して削除されます。高品質の純粋な iPSC 文化伝搬の選択が可能になります。
- 1 h を通過、前にコート、2.2.1 のステップのように VTN で 6 ウェル プレートの井戸です。その後、ソリューションをウェルあたり E8 培地 2 ml に置き換えます。
- ルーチン継、初期継行って 0.5 mM EDTA (ステップ 2.7.2 に 2.7.5) を使用してに似ています。6 ウェル プレートのウェル 1 個で過ごした中を洗浄し、破棄する EDTA の 1 mL に置き換えます。
- EDTA の 1 mL を追加し、RT の部分解離の 5-7 分間インキュベートします。インキュベーション時間を最適化するかどうかの懸濁液を確かめて、必要に応じて周り 20-50 細胞塊が生成されます。単一のセルに解離を避けてください。
- EDTA 溶液を捨て、ワイドボア ピペット チップにもターゲットから 1 mL ピペットを使用して E8 培地 1 mL を吸引します。
- 所望の部分が表面からリリースされるまで繰り返し E8 メディア ストリームのソース iPSC 文化を洗って、よくターゲットに転送。この部分は分割比率を表します (たとえば1/8 文化のために転送できる 1:8 の比率)。
- 通路ごとに 3-4 日。下流の実験で使用する前に、少なくとも 15 の通路を培養することによって成熟する iPSC 行を許可します。
3 特性および多能性の確認
注: は、フローサイトメトリーおよび共焦点顕微鏡の詳細補足ファイルを参照してください。
-
奇形腫形成アッセイ
- 奇形腫形成アッセイによってすべての 3 つの細菌層の代表的な組織に分化する iPSC の容量を確認するにはアニマル ・ ケアおよび使用、適切なプロトコルを提出するための時間を許可するように事前に計画に関する制度のポリシードキュメント。マウス奇形腫形成は、6-10 週間かかります。
- 4 日間の iPSC 1行 6 ウェル プレートの 4 井戸の文化.マウスの 1 つの側面に注入された細胞のおおよその数は 0.5 を 1 x 10 の6セルです。オプション: 余分なよく集中できるようにする単一細胞解離と細胞分離酵素による井戸の代表的な細胞数を決定して数えます。
- IPSC 塊で中断されます E8/BMM の混合物の量を計算する: 各塊の懸濁液の 150 μ L で、マウスの両方の側面を注入します。三匹の鼠は iPSC 一行の奇形腫形成をテストするのには十分です。デッド ボリュームの損失を補うために作成されたボリュームの針あたり余分な 150 μ L が含まれます。マウスあたり 1 の針が使用されます。つまり、総量 3 * (150 μ L * 2 + 150 μ L) = 1350 μ L
- 2.7.8 に 2.7.10 手順で継代するがまるで部分的に EDTA と iPSC コロニーを切り離して考えます。植民地が塊に分離され、1 つの細胞に分かれていないことが重要です。
- IPSC の植民地 (ステップ 3.3.3 から計算された容積の半分)、E8 媒体の 675 μ L で洗浄は、ワイドボア チップを使用します。5 mL ポリスチレン チューブにクランプ サスペンションを転送します。氷の上を配置します。
- BMM の 675 μ L と組み合わせます。注射まで氷の上結果の懸濁液を保ちます。
- それらを固定するマウスを麻酔イソフルランを使用します。これは実行する必要があります。 または、ビバリウムの優秀な人材によって導かれています。
- 渦 5 mL ポリスチレンは簡単にチューブし、22 G 針装備 1 つインスリン注射器に塊の懸濁液 (マウスあたり 450 μ L) を吸引します。細胞懸濁液の 150 μ L を皮下注入します。このボリュームには、約 1 × 106セル (ステップ 3.1.2 を参照) が含まれています。
- IPSC 1行 3 マウスを挿入します。すべてのプロシージャに適切な動物のケア実践に従ってください。
- マウスの健康を毎日監視します。
- 奇形がエンドポイント直径 1.5 〜 2 cm に達したら、マウスを安楽死させる、奇形、外植体し、24 h の組織固定のためのホルマリンで保存します。
- ヘマトキシリン エオシン (H & E) の汚損のための組織学の中核施設に固定の奇形をもたらします。病理医は、すべての 3 つの細菌層の組織の存在をグレードが。
Karyotyping のメモ: ライブ iPSC 文化に出荷されるべきである専門の核型の整合性をテストするための細胞遺伝学的研究所です。このテストを実行することをお勧めしますがすべての 5 の通路。
-
転写プロファイル
- 6 ウェル プレート 1 つの RNA のサンプルを取得する 3-4 日のための 2 の井戸を文化します。のみ高品質の文化を使用して、ピペットの先端を使用してそれらをこするによって対処できる細胞を区別するマイナーな汚染。
- 製造元のプロトコルに続く市販キットを用いた iPSC 文化からの RNA を隔離します。特殊なゲノムの中核施設にサンプルを出荷します。
- マイクロ アレイ (サポートされている選択肢の材料表を参照してください) または RNA シーケンスを使用して iPSC 行のグローバル転写プロファイルを取得します。
- コーリエル医学研究所でオンラインのインターフェースを介して多能性のバイオ情報評価のための"*.idat"ファイルを送信します。また、提出"* .cel「ジョンズ ・ ホプキンス大学でオンラインのインターフェースを介して、多能性幹細胞を含む細胞型のバイオ情報識別用のファイル。個々 の bioinformatic の試金を受け入れるデータの種類の詳細については材料の表を参照してください。
結果
通知の書面による同意は、遺伝テストの目的と研究のための流体の小さい因数を捧げての羊水を採取する前に患者から得られました。胎盤は医療廃棄物を表し、同意は羊膜の研究の使用のため必要ありません。羊水の流体と膜幹細胞は典型的な間葉系プロパティを表示、形態学的、細胞は紡錘形と相明るい。リプログラミング、セル間葉系上皮性 (MET) 遷移に入るし、石畳のような形態と上皮プロパティを示すコロニーの空間組織を取得します。このプロセスは、早ければ 48 72 h episomal プラスミドをリプログラミングの導入開始します。リプログラミングの 5 日目でこれらのコロニーの不在は、実験の失敗を示します。MET の植民地の細胞が増殖、その結果、植民地なるコンパクト 5 と 14 日間。コンパクトな MET のコロニーは個別に簡単に目に見える (図 1 a) は細胞から成り立っています。14 日の周り完全にプログラムし直された植民地表示されます顕著、運ぶ、単分子膜の配置のセルで簡単に識別できる核と核小体。彼らは機械的に分離し、植民地の適切なサイズに達するし、コンパクトになるときに展開する準備ができている (図 1 b)。
完全に、部分的にプログラムし直されたコロニーは、部分的にプログラムし直された植民地における多能性を必ずしも取得しないリプログラミング期間全体を通して文化に存在。図 2ショー代表フローにおける胚性幹細胞 (ESC) マーカー発現のフローサイトメトリーによる解析を完全に、部分的に多能性植民地と彼らの対応する形態。完全多能性は Nanog Oct4、Sox2、TRA 抗原と SSEA-4 の式に関連付けられた SSEA 1 式はマイナス19,20,21 (図 2 a)。部分的に多能性細胞はしかし、Nanog および TRA 抗原20 (図 2 b) を表現しません。発現および局在 ESC マーカーの免疫染色と広視野または共焦点顕微鏡 (図 3) を使用してイメージを作成して確認すべき。
多能性の機能確認は、ベージュ scid マウスに皮下細胞を次フォーム奇形 iPSC ラインの能力のデモンストレーションによって実現されます。終点のサイズに到達する奇形 6-8 週間が必要です。すべての 3 胚葉-次内胚葉、中胚葉 (図 4 a) の組織代表者の存在を確認するは、H & E 染色組織の病理学者によって検査が実行されます。動物実験に代わる、cDNA マイクロ アレイ22,23のようなゲノムのアプローチで多能性に関連する転写署名の分析です。2 つの分類子-多能性のプロットの形でオンライン bioinformatic 多能性評価ソフトウェアによって確立された iPSC と esc キー行のプールの 1 つに重なる転写プロファイルの割合を定量化しことができる、ノベルティ (図 4 b)。多能性のスコアが高いほどより多くのクエリ iPSC 行確立されたラインに似ています。目新しさは高スコアはただし、偏差または高い多能性スコア (テラトーマ行など)22にもかかわらずのも染色体異常を示すでした。ここで提示されたプロトコルに従うことによって生成されたすべての iPSC 行は、フローサイトメトリー、イメージング、奇形腫形成および転写解析メソッドによって多能性とみなされています。

図 1: プログラムし直す時に、細胞の形態学的進行。(A)羊水および膜幹細胞リプログラミングのソース セルを表し、間葉系の典型的な形態、細長いと相明るい (左) まで表示間葉系上皮性遷移 (MET) に入る彼らを上皮のプロパティの取得や石畳のような石細胞 (センター) を持つコロニーの形成に します。これらの植民地は、増殖し、MET 細胞の不規則な細胞塊 (右) を作成します。(B) (14 日目の周りから始まる) をリプログラミングの後の段階で完全にリプログラミング細胞コロニー出現-著名な核を個別に識別できる細胞と核小体明確罫線 (センター)-単分子膜における配置多く (左) をある植民地に会ったと並んで存在。完全にプログラムし直された隔離された成熟したクローンは、右側に描かれています。スケールバー = 100 μ mこの図の拡大版を表示するのにはここをクリックしてください。
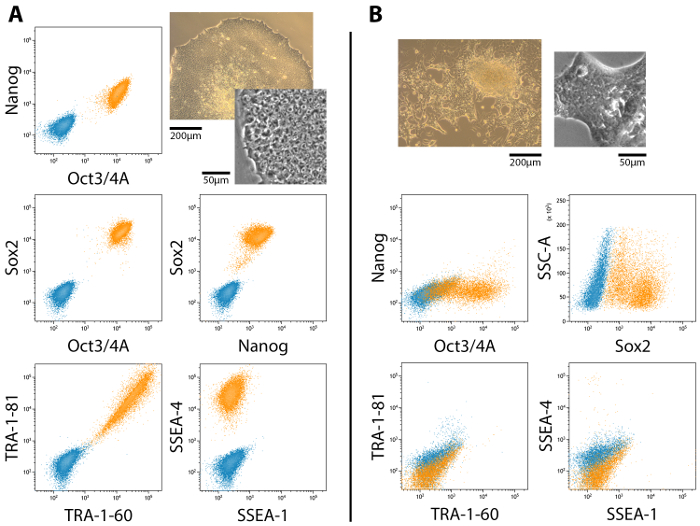
図 2: esc キー マーカーの発現のフローサイトメトリー法による解析の完全および部分的 (MET) 再プログラム細胞コロニー 。(A) SSEA 1 負中に多能性発現プロファイル Oct4、Nanog、Sox2、トラ 1 60、TRA-1-81、SSEA 4、肯定的であります。(B)部分的に-それらがメットを受けて、完全多能性に進むことができなかった-多能性細胞コロニーは Oct4、Sox2 の肯定的なしかし、Nanog、トラおよび SSEA の抗原が存在しません。関連付けられている形態がサイド ・ バイ ・ サイド比較のために含まれます。スケール バー = 200 μ m と 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。
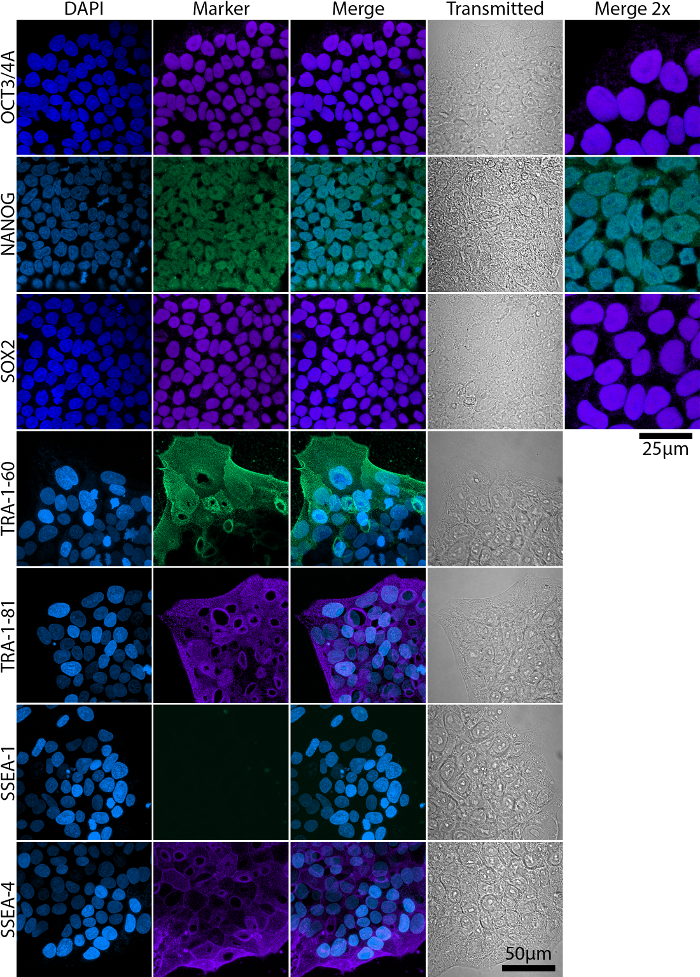
図 3: 共焦点成熟した羊水流体 iPSC で esc キー マーカーの発現の解析を画像処理します。転写因子 Nanog Oct3/4 a、Sox2 は TRA 中核でローカライズされ、SSEA 抗原は、糖蛋白質、膜上に局在しました。スケールバー = 50 μ m より大きな倍率 (マージ 2 X) の画像は核局在化のより良い視覚化の Oct3/4、Nanog Sox2 に含まれていた。スケール バー = 25 μ m. 感染-透過光の画像。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 奇形腫形成と成熟した羊水膜と流体の iPSC の転写プロファイリングします。(A)ベージュ scid マウスの皮下に成長して奇形には、すべて 3 つの胚葉 (100 倍) の代表的な組織が含まれています。(B)オンライン多能性ソフトウェアに送信されるグローバル発現マイクロ アレイには、2 つの分類子-多能性と目新しさのプロットが返されます。高い多能性スコアと目新しさは低スコア - 赤雲 - 典型的な ESC/iPSC ラインの発現プロファイルを示します。青空に雲は分化した細胞のクラスター領域を表し、かすかな青い雲が部分的に多能性細胞のクラスター領域を表します。羊水 (3 ライン) と膜 (4 行) iPSC はテストによって多能性を認め。Esc キー行 WA25 コントロールとして含まれていたし、ここで黒の矢印で識別されます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
胎児幹細胞から iPSC 生成の最初のフェーズは、胎児の組織、彼らの文化、拡張、および episomal リプログラミング プラスミドの導入からソース セルの抽出を伴います。このフェーズの後に、最初の完全にプログラムし直された植民地を拡大することができます前に約 14-18 日間の培養期間が続きます。最終段階は、iPSC クローンの成熟です。羊膜幹細胞の最初の抽出は、羊膜の組合せ機械と酵素消化によって達成されます。インキュベーション時間 30 分最高最高の生存率で抽出した細胞数の結果がわかった。消化手順は、組織・細胞の塊の小さな断片を作り出すことができます。単一のセルを基準にしてこれらの割合が高い場合は、付着細胞の増殖に貢献することができますので、1 つの容器にすべての塊と単一細胞をめっきすることをお勧めします。セルのみ培養培地と混合し、付着細胞のコロニーが十分なサイズに到達するまでインキュベートした羊水幹細胞をめっきは簡単です。通常の組織培養処理容器に最適です、にもかかわらず、彼らは改良された一次電池文化低目と、継との難しさはこれらに観察したので、専門の表面、お勧めしませんプロセス。
羊水の流体と膜幹細胞を拡大する必要があります、冷凍の株式が、都合つき次第セルがリプログラミングのソース セルとして使用できます。Episomal プラスミドの細胞、950 V に設定したトランスフェクション パラメーターでここで使用されるトランスフェクション システムへの導入を目的として 40 ms と 1 パルスは非常によく行う、すべての行が、最終的に正常にプログラムし直された (で試行以上 10 行)。同様の原理で動作している主要な競合する配信システムは、私たちの手でリプログラミング実験が成功を生成しませんでした。
Transfected セルは最初の 3-5 日センテニアルレガシー時中ビトロネクチン コーティング皿にシードされ、媒体は 100 μ M ナトリウム酪酸を添加した E8 に切り替え。これは大きく完全多能性獲得率を向上します。48-72 時間には早くも形態変換の最初の兆候が見られます。元のセルは、メットを受けるし、細胞上皮形態の植民地が表示されます。これらは徐々 に増殖し、コンパクトになります。植民地のサブセットは、完全に多能性幹細胞-著名な核と核小体、個別に識別可能な細胞の形態学的特徴を取得ファジィ境界ではなく、明確に定義されたボーダーとフラットのコロニーが部分的に観察多能性 MET の植民地。完全多能性の獲得の瞬間にコンパクトな MET 細胞コロニーを取得著名な核となり個々 の細胞識別ユニークな形態を作成中。訓練された目にこのパターンは成功の書き換えの明確な兆候です。ただし、PSC 文化訓練を欠いている調査官、完全多能性が正常に進行したコロニーの識別必要があります慎重に評価 MET と iPSC のクローンはお互い間違われることが。図 1と図 2は、両方の例を示します。MET のクローンが代わりに選んだ、徹底したフローサイトメトリー解析はミスを明らかにし、特に、トラ 1 60 とトラ-1-81 抗原はほとんど欠席する場合、図 2に示します。確かに、TRA 抗原は以前厳しい多能性マーカーのように発見されました。ただし、部分的に MET の多能性細胞は、がん研究25に関心のあるかもしれない。
この培養条件はソース AFSC/アムスクの準最適の増殖が遅くなるし、最終的には、彼らが平坦、線維芽細胞のような形態を取得します。元のセルは、この悪影響を及ぼさないプログラムし直すプロセスがリプログラミング、後の段階で表面からデタッチすることができます組織を形成します。逆に、プロセス時に不要な非プログラムし直された細胞材料を排除しながらプログラムし直されたコロニーのための領域を解放に します。独立した組織は、部分的に残して、滅菌ピペット チップと完全に手動選択下流を大幅に簡素化、多能性コロニーを使用して簡単に破棄できます。
完全にプログラムし直されたコロニーの手動狩りは、イメージング システム、安全キャビネットで置くことが、空気の流れを妨げる突き出た任意の部品に欠けている LCD を使用します。このイメージング システム以外ピッキング自体は通常のピペットを使用して実行できるは、特別な装置が必要ありません。選ばれた植民地はクローンとして成長するターゲットの井戸にメッキされている前に、部分的に EDTA/PBS 溶液中解離します。行といくつかの通路のためのクローンによって自発的に分化細胞の文化を汚染可能性があります。手動操作およびシリアル継は通常この問題を除去します。広範な分化だらけのクローンを破棄するか、繰り返しマニュアル分化細胞を処分するのではなく、多能性コロニーのピッキングによるさまざまな程度の成功の貴重なクローンを回収することができますただし。Episomal プラスミドは、iPSC26から完全に失われ約 15 通路を示されていた。したがって、ダウン ストリーム アプリケーションの解析では、TRA の抗原の表現および染色体の日常的な監視を除いてそれらを使用する前に、少なくとも通路の数の成長するクローンを許可することをお勧めします。アッセイのみ約 200,000 セルを必要があり、研究者は培養されたクローンを維持するかどうか疑問でいつでも実行できるプロトコルでは、ここで説明はフローサイトメトリーによる TRA 抗原の発現を監視することができますは簡単に多能性適切。Esc キー マーカー発現の流れフローサイトメトリー解析は候補行19多能性を確認するために十分であると考慮されません。
奇形腫形成アッセイは、標準の決定的な多能性テスト27です。化学的に定義された、xeno 無料条件で栽培 PSC 解離誘起に特に敏感死、したがって、塊として皮下注射が必要に成功した注入8,28。次の注射、通常 4-6 週間は十分な表示する異種移植片の増殖とすべてがすることができます 8 週前に収穫、H & E 染色と分析されました。動物愛護・ コスト ・長期テストに必要な期間は代替手法の開発理由です。ゲノム解析は、高度なと組み合わせて、マシン学習搭載のバイオ情報アプローチ グローバル発現プロファイルの正確な評価を提供します。このようなデータを得るためのコストは奇形腫形成アッセイのコストに匹敵する、しかし、ゲノム アプローチはかなり高速と動物を使用する必要はありません。このような 1 つの試金は bioinformatic の多能性評価ソフトウェア22です。それは、オンラインのインターフェース (材料表) として実装されます。人気の高まりと RNA シーケンスが急落のコストは、このアプローチの継続性を確保します。この多能性ソフトウェアに代わるものはジョンズ ・ ホプキンス大学23 (cellnet.hms.harvard.edu) から入手可能ですと同様のアプローチに基づいており、ひと試料のトランスクリプトームを解析するマイクロ アレイ データを受け入れることが。このソフトウェアの利点は多能性幹細胞だけでなくを識別する能力を持っているが、また分化した細胞と、その精選されたデータセットからプライマリ組織、体外で成長して細胞間類似性のレベルから派生した/組織と体内組織決定できます、微分のプロトコルや組織工学の開発のため優秀な品質管理を提供します。テストには、20 の異なる細胞や組織の種類にクエリを分類する能力があります。現時点では、マイクロ アレイ データを必要とするが、著者は、RNA にプラットフォームのオプションの拡大に向かって作業している同様のシーケンスします。
提案するプロトコルに従って、研究者は完全に化学的に定義された、xeno 無料媒体と非統合の初期化メソッドを使用して再現性の非常に高い羊水の流体と膜幹細胞から iPSC 行を生成できます。これらの行は、微分のプロトコルを最適化し、最終的に病モデルにおける薬物スクリーニング、または小児組織エンジニア リングの研究基礎研究で使用できます。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
この作品は、チューリッヒ大学、チューリッヒ大学、奨学金 10.216 と 12.176、スイス社会循環器科、スイス科学の下、サイエックス NMSChの Forschungskredit フォンこの上海虹橋によって支えられました。財団助成金 [320030 122273] の下と [310030 143992]、第 7 フレームワーク プログラム、生活バルブ、グラント [242008]、オルガ Mayenfisch 財団、EMDO 財団、大学病院チューリッヒの創業助成金 2012 の下欧州委員会と内部は、ミッチェルのがん研究所の資金調達。
資料
| Name | Company | Catalog Number | Comments |
| Tumor Dissociation Kit, human | Miltenyi Biotec | 130-095-929 | tissue dissociation system, reagent kit, includes tissue dissociation tubes and tissue dissociation enzymes |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | tissue dissociation system, dissociator |
| Thermo Scientific™ Shandon™ Disposable Scalpel No. 10, Sterile, Individually Wrapped, 5.75 (14.6cm) | Thermo-Fisher | 3120032 | |
| 70 µm cell strainers | Corning | 10054-456 | |
| RPMI 1640 medium | Thermo-Fisher | 32404014 | |
| rocking platform | VWR | 40000-300 | |
| 50 ml centrifuge tubes | Thermo-Fisher | 339652 | |
| 15 ml centrifuge tubes | Thermo-Fisher | 339650 | |
| EBM-2 basal medium | Lonza | CC-3156 | basal medium for AFMC medium |
| FGF 2 Human (expressed in E. coli, non-glycosylated) | Prospec Bio | CYT-218 | bFGF, supplement for AFMC medium |
| EGF Human, Pichia | Prospec Bio | CYT-332 | EGF, supplement for AFMC medium |
| LR3 Insulin Like Growth Factor-1 Human Recombinant | Prospec Bio | CYT-022 | IGF, supplement for AFMC medium |
| Fetal Bovine Serum, embryonic stem cell-qualified | Thermo-Fisher | 10439024 | FBS |
| Antibiotic-Antimycotic (100X) | Thermo-Fisher | 15240062 | for primary AFSC/AMSC, for routine AFSC/AMSC it should not be necessary, do not use in medium for transfected cells! |
| Accutase cell detachment solution | StemCell Technologies | 07920 | cell detachment enzyme |
| CryoStor™ CS10 | StemCell Technologies | 07930 | complete freezing medium |
| PBS, pH 7.4 | Thermo-Fisher Scientific | 10010023 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | for plasmid isolation |
| pEP4 E02S EN2K | Addgene | 20925 | EN2K, reprogramming factors Oct4+Sox2, Nanog+Klf4 |
| pEP4 E02S ET2K | Addgene | 20927 | ET2K, reprogramming factors Oct4+Sox2, SV40LT+Klf4 |
| pCEP4-M2L | Addgene | 20926 | M2L, reprogramming factors c-Myc+LIN28 |
| NanoDrop 2000c UV-Vis Spectrophotometer | Thermo-Fisher | ND-2000C | spectrophotometer |
| Neon® Transfection System | Thermo-Fisher | MPK5000 | transfection system, components: Neon pipette - transfection pipette Neon device - transfection device |
| Neon® Transfection System 10 µL Kit | Thermo-Fisher | MPK1025 | consumables kit for the Neon Transfection System, it contains: Neon tip - transfection tip Neon tube - transfection tube buffer R - resuspension buffer buffer E - electrolytic buffer |
| Stemolecule™ Sodium Butyrate | StemGent | 04-0005 | small molecule enhancer of reprogramming |
| TeSR-E8 | StemCell Technologies | 05940 | E8 medium |
| Vitronectin XF™ | StemCell Technologies | 07180 | VTN, stock concentration 250 µg/ml, used for coating at 1 µg/cm2 in vitronectin dilution (CellAdhere) buffer |
| CellAdhere™ Dilution Buffer | StemCell Technologies | 07183 | vitronectin dilution buffer |
| UltraPure™ 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | dilute with PBS to 0.5 mM before use |
| EVOS® FL Imaging System | Thermo-Fisher Scientific | AMF4300 | LCD imaging microscope system |
| CKX53 Inverted Microscope | Olympus | phase contrast cell culture microscope | |
| Pierce™ 16% Formaldehyde (w/v), Methanol-free | Thermo-Fisher | 28908 | dilute to 4% with PBS before use, diluted can be stored at 2-8 °C for 1 week |
| Perm Buffer III | BD Biosciences | 558050 | permeabilization buffer, chill to -20 °C before use |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 557782 | isotype control for Oct3/4A, Nanog |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 557783 | isotype control for Sox2 |
| Mouse anti-human Oct3/4 (Human Isoform A), Alexa Fluor® 488 | BD Biosciences | 561628 | |
| Mouse anti-human Nanog, Alexa Fluor® 488 | BD Biosciences | 560791 | |
| Mouse anti-human Sox-2, Alexa Fluor® 647 | BD Biosciences | 562139 | |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 401617 | isotype control for TRA-1-60 |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401618 | isotype control for TRA-1-81 |
| Mouse anti-human TRA-1-60, Alexa Fluor® 488 | BD Biosciences | 330613 | |
| Mouse anti-human TRA-1-81, Alexa Fluor® 647 | BD Biosciences | 330705 | |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 400129 | isotype control for SSEA-1 |
| Mouse IgG3, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401321 | isotype control for SSEA-4 |
| Mouse anti-human SSEA-1, Alexa Fluor® 488 | BD Biosciences | 323010 | |
| Mouse anti-human SSEA-4, Alexa Fluor® 647 | BD Biosciences | 330407 | |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 488 | Jackson Immunoresearch | 115-606-068 | use at a dilution of 1:600 or further optimize |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 647 | Jackson Immunoresearch | 115-546-068 | use at a dilution of 1:600 or further optimize |
| DAPI | Thermo-Fisher Scientific | D21490 | stock solution 10 mM, further dilute to 1:12.000 for a working solution |
| Corning® Matrigel® Growth Factor Reduced, Phenol Red-Free | Corning | 356231 | basement membrane matrix (BMM) |
| scid-beige mice, female | Taconic | CBSCBG-F | |
| RNeasy Plus Mini Kit (50) | Qiagen | 74134 | RNA isolation kit |
| T-25 flasks, tissue culture-treated | Thermo-Fisher | 156367 | |
| T-75 flasks, tissue culture-treated | Thermo-Fisher | 156499 | |
| Nunc™ tissue-culture dish | Thermo-Fisher | 12-567-650 | 10 cm tissue culture dish |
| 6-well plates, tissue-culture treated | Thermo-Fisher | 140675 | |
| Neubauer counting chamber (hemacytometer) | VWR | 15170-173 | |
| Mr. Frosty™ Freezing Container | Thermo-Fisher | 5100-0001 | freezing container |
| FACS tubes, Round Bottom Polystyrene Test Tube, 5ml | Corning | 352058 | 5 ml polystyrene tubes |
| Eppendorf tubes, 1.5 ml | Thermo-Fisher | 05-402-96 | 1.5 ml microcentrifuge tubes |
| PCR tubes, 200 µl | Thermo-Fisher | 14-222-262 | |
| pipette tips, 100 to 1250 µl | Thermo-Fisher | 02-707-407 | narrow-bore 1 mL tips |
| pipette tips, 5 to 300 µl | Thermo-Fisher | 02-707-410 | |
| pipette tips, 0.1 to 10 µl | Thermo-Fisher | 02-707-437 | |
| wide-bore pipette tips, 1000 µl | VWR | 89049-166 | wide-bore 1 mL tips |
| glass Pasteur pipettes | Thermo-Fisher | 13-678-20A | |
| ethanol, 200 proof | Thermo-Fisher | 04-355-451 | |
| vortex mixer | VWR | 10153-842 | |
| chambered coverglass, 8-well, 1.5mm borosilicate glass | Thermo-Fisher | 155409 | glass-bottom confocal-grade cultureware |
| 22G needles | VWR | 82002-366 | |
| insulin syringes | Thermo-Fisher | 22-253-260 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | fixation of explanted teratomas |
| Illumina HT-12 v4 Expression BeachChip | Illumina | BD-103-0204 | expression microarray, supported by PluriTest, discontinued by manufacturer |
| PrimeView Human Genome U219 Array Plate | Thermo-Fisher | 901605 | expression microarray (formerly Affymetrix brand), soon to be supported by PluriTest |
| GeneChip™ Human Genome U133 Plus 2.0 Array | Thermo-Fisher | 902482 | expression microarray (formerly Affymetrix brand), supported by CellNet, soon to be supported by PluriTest |
| PluriTest® | Coriell Institute | www.pluritest.org, free service for bioinformatic assessment of pluripotency, accepts microarray data - *.idat files from HT-12 v4 platform, soon to support U133, U219 microarray and RNA sequencing data | |
| CellNet | Johns Hopkins University | cellnet.hms.harvard.edu, free service for bioinformatic identification of cell type, including plutipotent stem cells, based on U133 microarray data - *.cel files, soon to support RNA sequencing data |
参考文献
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Yu, J., et al. Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells. Science. 318 (5858), 1917-1920 (2007).
- Trounson, A., DeWitt, N. D. Pluripotent stem cells progressing to the clinic. Nat. Rev. Mol. Cell Biol. 17 (3), 194-200 (2016).
- Schmidt, D., et al. Prenatally fabricated autologous human living heart valves based on amniotic fluid derived progenitor cells as single cell source. Circulation. 116 (11 Suppl), I64-I70 (2007).
- Weber, B., Zeisberger, S. M., Hoerstrup, S. P. Prenatally harvested cells for cardiovascular tissue engineering: Fabrication of autologous implants prior to birth. Placenta. 32, S316-S319 (2011).
- Weber, B., et al. Prenatally engineered autologous amniotic fluid stem cell-based heart valves in the fetal circulation. Biomaterials. 33 (16), 4031-4043 (2012).
- Kehl, D., Weber, B., Hoerstrup, S. P. Bioengineered living cardiac and venous valve replacements: current status and future prospects. Cardiovasc. Pathol. 25 (4), 300-305 (2016).
- Slamecka, J., et al. Non-integrating episomal plasmid-based reprogramming of human amniotic fluid stem cells into induced pluripotent stem cells in chemically defined conditions. Cell Cycle. 15 (2), 234-249 (2016).
- Jiang, G., et al. Human Transgene-Free Amniotic-Fluid-Derived Induced Pluripotent Stem Cells for Autologous Cell Therapy. Stem Cells Dev. 23 (21), 2613-2625 (2014).
- Pipino, C., et al. Trisomy 21 mid-trimester amniotic fluid induced pluripotent stem cells maintain genetic signatures during reprogramming: implications for disease modeling and cryobanking. Cell. Reprogram. 16 (5), 331-344 (2014).
- Cai, J., et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells. J Biol. Chem. 285 (15), 11227-11234 (2010).
- Ge, X., et al. Human Amniotic Mesenchymal Stem Cell-Derived Induced Pluripotent Stem Cells May Generate a Universal Source of Cardiac Cells. Stem Cells Dev. 21 (15), 2798-2808 (2012).
- Drozd, A. M., Walczak, M. P., Piaskowski, S., Stoczynska-Fidelus, E., Rieske, P., Grzela, D. P. Generation of human iPSCs from cells of fibroblastic and epithelial origin by means of the oriP/EBNA-1 episomal reprogramming system. Stem Cell Res. Ther. 6 (1), (2015).
- Kang, N. -H., et al. Potential antitumor therapeutic strategies of human amniotic membrane and amniotic fluid-derived stem cells. Cancer Gene Ther. 19 (8), 517-522 (2012).
- Moschidou, D., et al. Valproic Acid Confers Functional Pluripotency to Human Amniotic Fluid Stem Cells in a Transgene-free Approach. Mol. Ther. 20 (10), 1953-1967 (2012).
- Kim, K., et al. Epigenetic memory in induced pluripotent stem cells. Nature. 467 (7313), 285-290 (2010).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324 (5928), 797-801 (2009).
- Martí, M., et al. Characterization of pluripotent stem cells. Nat. Protoc. 8 (2), 223-253 (2013).
- Chan, E. M., et al. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27 (11), 1033-1037 (2009).
- Adewumi, O., et al. Characterization of human embryonic stem cell lines by the International Stem Cell Initiative. Nat. Biotechnol. 25 (7), 803-816 (2007).
- Müller, F. -J., et al. A bioinformatic assay for pluripotency in human cells. Nature Methods. 8 (4), 315-317 (2011).
- Cahan, P., Li, H., Morris, S. A., Lummertz da Rocha, E., Daley, G. Q., Collins, J. J. CellNet: Network Biology Applied to Stem Cell Engineering. Cell. 158 (4), 903-915 (2014).
- Schopperle, W. M., DeWolf, W. C. The TRA-1-60 and TRA-1-81 Human Pluripotent Stem Cell Markers Are Expressed on Podocalyxin in Embryonal Carcinoma. STEM CELLS. 25 (3), 723-730 (2007).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2014).
- Müller, F. -J., Goldmann, J., Löser, P., Loring, J. F. A call to standardize teratoma assays used to define human pluripotent cell lines. Cell Stem Cell. 6 (5), 412-414 (2010).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat. Protoc. 7 (11), 2029-2040 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved