Method Article
Riprogrammazione primario del liquido amniotico e le celle a membrana di pluripotenza in condizioni prive di Xeno
In questo articolo
Riepilogo
Questo protocollo descrive la riprogrammazione di primaria amniotico liquido e membrana di cellule staminali mesenchimali in cellule staminali pluripotenti indotte utilizzando un approccio episomal non-integrazione in condizioni completamente chimicamente definite. Procedure di estrazione, cultura, riprogrammazione e caratterizzazione delle cellule staminali pluripotenti indotte risultanti dai rigorosi metodi sono dettagliate.
Abstract
Terapie basate su cellule autologhe ha un passo più vicino alla realtà con l'introduzione di cellule staminali pluripotenti indotte. Cellule staminali embrionali, come il liquido amniotico e cellule staminali mesenchimali di membrana, rappresentano un tipo unico di cellule non differenziate con promessa in ingegneria tissutale e per riprogrammare in iPSC per futuri interventi pediatrici e bancaggio delle cellule staminali. Il protocollo presentato qui descrive una procedura ottimizzata per l'estrazione e la coltura primaria amniotico liquido e la membrana delle cellule staminali mesenchimali e generando episomal indotta da cellule staminali pluripotenti da queste cellule in cultura completamente chimicamente definita condizioni che utilizzano umano ricombinante vitronectina e il mezzo di E8. Caratterizzazione delle nuove linee applicando metodi rigorosi – flusso cytometry, imaging confocale, la formazione di teratoma e profiling trascrizionale – inoltre è descritto. Le linee appena generate esprimono marcatori di cellule staminali embrionali – Oct3/4A, Nanog, Sox2, TRA-1-60, TRA-1-81, SSEA-4 – pur essendo negativo per il marcatore di SSEA-1. Le linee di cellule staminali formano i teratomas in topi scid-beige in 6-8 settimane e i teratomas contengono tessuti rappresentativi di tutti i tre strati di germe. Profiling trascrizionale delle linee di invio dei dati di microarray di espressione globale a un algoritmo di valutazione pluripotenza bioinformatic ritenute tutte le linee pluripotenti e di conseguenza, questo approccio è un'attraente alternativa alla sperimentazione animale. Le nuove linee di iPSC prontamente possono essere utilizzate in esperimenti a valle che coinvolgono l'ottimizzazione di differenziazione e dell'ingegneria tissutale.
Introduzione
La tecnologia delle cellule staminali pluripotenti indotte (iPSC) comporta potenziali terapie di sostituzione cellulare, malattia e modellazione inerente allo sviluppo e droga e selezione tossicologica1,2,3. Terapie sostitutive concettualmente può essere ottenute tramite l'iniezione delle cellule, in vitro differenziato l'impianto del tessuto (ad esempio di patch cardiaci), o rigenerazione guidata mediante ingegneria tissutale. Liquido amniotico (AFSC) e cellule staminali di membrana (AMSC) sono un'ottima fonte di cellule per questi interventi sia direttamente4,5,6,7 o come una popolazione cellulare iniziale per la riprogrammazione in pluripotenza8,9,10,11,12.
Primi approcci utilizzati sistemi di coltura non definito o riprogrammazione metodi che richiedono l'integrazione genomica comporta dei costrutti9,10,11,12. Uno studio più recente ha impiegato un mezzo privo di xeno, anche se è stata utilizzata una meno definita matrice di attaccamento della membrana basale (BMM), per generare iPSC da cellule epiteliali del liquido amniotico. Tuttavia, l'analisi di formazione di teratoma non era inclusa nello studio insieme a una ricchezza di dati molecolari e in vitro. Cellule epiteliali del liquido amniotic sono state trovate per avere una più o meno 8 volte maggiore efficienza riprogramma rispetto ai fibroblasti neonatali13. In un altro studio, cellule mesenchimali staminali da liquido amniotico inoltre sono state trovate per essere riprogrammato in iPSC con molta efficienza superiore12.
Cellule staminali pluripotenti possono essere differenziate in rappresentante di tessuti di tutti e 3 strati germinali e quindi hanno il potenziale più ampio. Pazienti pediatrici potrebbero beneficiare la raccolta, riprogrammazione e ingegneria tissutale delle loro cellule staminali di liquido amniotic autologhi prenatally amniotic della membrana cellule staminali e perinatale. Inoltre, il livello relativamente basso di differenziazione delle cellule staminali embrionali (inferiore a cellule staminali adulte14,15) teoricamente potrebbe aiutare nell'affrontare la ritenzione osservata di bias epigenetici dalle celle di origine in iPSC16.
Qui presentiamo un protocollo per la riprogrammazione del liquido amniotico e cellule staminali membrana di pluripotenza in chimicamente definito medium E8 senza xeno su ricombinante vitronectina17 (VTN) utilizzando plasmidi episomal18. Il vantaggio principale delle cellule della membrana e del liquido amniotico come fonte di cellule per la riprogrammazione risiede nella loro disponibilità pre- e perinatale e quindi questo approccio principalmente avrebbe vantaggio della ricerca pediatrica tissutale.
Protocollo
Il protocollo segue le linee guida istituzionali del comitato etico per la ricerca umana. Consenso scritto del paziente è stata ottenuta per l'utilizzo del liquido amniotico per la ricerca.
Questo protocollo segue i criteri del Comitato uso della University of South Alabama e istituzionali Animal Care.
1. isolamento e coltura di cellule staminali amniotiche primario Mesenchymal
-
Placcatura di cellule del liquido amniotico
- Ottenere un minimo di 2,5 mL di liquido amniotico raccolto nel processo di amniocentesi da un medico.
Nota: Tutte le manipolazioni di tessuto e cellule vive devono essere eseguita in un cabinet di tessuto-coltura sterile e devono essere utilizzati dispositivi di protezione personale. È necessario avere familiarità con colture cellulari di base e una tecnica sterile. - Preparare il medium di coltura cellulare (AFMC) della membrana e del liquido amniotico: EBM-2 medio basale, 15% siero bovino fetale (FBS), 20 ng/mL di bFGF, 25 ng/mL di EGF, 10 ng/mL di IGF. Per la coltura di cellule staminali membrana amniotica primario di fluido, nonché amniotico, il mezzo dovrebbe essere completato con soluzione di antibiotico antimicotico.
- Il giorno 0, mescolare 2,5 mL di liquido amniotico con 3,5 mL di terreno di coltura AFMC e piastra in un matraccio da T25. Incubare a 37 ° C e 5% di CO2 per almeno 48 h indisturbati prima di verificare la presenza di colonie.
- Il giorno 5, colonie di cellule aderenti dovrebbero essere presenti. Scuotere delicatamente la boccetta per sloggiare le cellule che ha fatto non completamente aderire al fondo e detriti e vuoto-aspirare la miscela fluida medio/amniotico spesa utilizzando una pipetta Pasteur. Sostituire con 5 mL di mezzo AFMC fresco.
- Cultura per altri 5 giorni. Sostituire il terreno ogni altro giorno come descritto al punto 1.1.4.
- Ottenere un minimo di 2,5 mL di liquido amniotico raccolto nel processo di amniocentesi da un medico.
-
Isolamento di cellule staminali mesenchimali primarie da Amnios umano
- Ottenere il più presto possibile dopo la nascita, entro 24 h al più tardi, per massimizzare l'integrità cellulare le placente. Tagliare un segmento di2 cm 9 del amnion, rimuovere i coaguli di sangue e lavare in un tubo di centrifuga da 50 mL con 30 mL di PBS completati con soluzione di antibiotico antimicotico.
- Tritare le membrane usando un paio di bisturi ai raffinati pezzi in un piatto di coltura del tessuto sterile 10 cm. La digestione delle membrane e l'estrazione delle cellule sarà raggiunto utilizzando un sistema di dissociazione del tessuto. Seguire il protocollo del produttore.
Nota: più fine i pezzi del tessuto dopo macinazione, più alti i numeri di cellulare recupero dopo la digestione. - Trasferire la massa di tessuto membrana macinate utilizzando le lame di bisturi nel tubo di dissociazione di un tessuto e mescolare con 4,7 mL di terreno RPMI 1640. Mescolarvi gli enzimi di dissociazione (Vedi Tabella materiali).
- Montare i tubi sul dissociatore di tessuto ed eseguire il programma "h_tumor_01". Incubare le provette a 37 ° C su una piattaforma a dondolo per 30 min.
- Ulteriormente diluire le sospensioni con 35 mL di RPMI 1640 e applicare un colino µm 70 collocato sopra una provetta da centrifuga collezione 50 mL.
- Centrifugare per 5 min a 200 x g a temperatura ambiente, scartare il surnatante, risospendere il pellet in 5 mL di RPMI 1640, contare le celle utilizzando un emocitometro e piastra ad una densità di 10.000 cellule/cm2 nei vasi di coltura del tessuto-trattati con appena preparato Medium AFMC completate con soluzione di antibiotico antimicotico.
Nota: In caso di digestione incompleta, piccoli pezzi di tessuto sarà presente e singole cellule saranno scarse. Girare di nuovo verso il basso e piastra il pellet tutto in un matraccio da T75.
-
Cultura di primaria AFSC e AMSC
- Colonie di passaggio di AFSC/AMSC aspirando vuoto speso medio usando una pipetta di Pasteur e aggiungere 2 mL di enzima distacco della cellula nel pallone. Incubare a 37 ° C per 5-8 min.
- Toccare il pallone per sloggiare le cellule e mescolare la sospensione con un volume uguale di mezzo AFMC (supplemento antibiotico antimicotico non dovrebbe essere necessario da questo punto in poi). Centrifugare a 200 g per 4-5 minuti rimuovere il surnatante utilizzando sia un vetro pipetta Pasteur o semplicemente mediante invertendo il tubo e svuotarlo in un contenitore per rifiuti.
- Scorri verso il fondo della provetta da centrifuga per spezzare il pellet in una sospensione unicellulare in gocce di liquido residue e mescolare con terreno AFMC per placcatura. Piastra in T-palloni con una densità tra 2.500 e 5.000 cellule/cm2.
- Mezzo di cambiamento ogni altro giorno. Non della coltura di linee cellulari oltre passaggio 6. Per scopi di riprogrammazione, utilizzare come basso un passaggio possibile.
- Preparare gli stock congelati di AFSC e AMSC come back-up mediante congelamento medio. Raccogliere colture usando un enzima di distacco delle cellule, centrifugare a 200 g per 4 ° C per 5 min.
- Rimuovere il surnatante con una pipetta di Pasteur e scorri verso il fondo del tubo di singolari le cellule nel pellet. Risospendere in terreno completo congelamento ad una densità di 1 × 106/mL e aliquota in cryovials. Conservare in un contenitore di congelamento durante la notte a-80 ° C. Quindi spostare in azoto liquido per stoccaggio a lungo termine.
2. riprogrammazione in pluripotenza
- Ottenere i plasmidi riprogrammazione
- Acquistare i plasmidi riprogrammazione tramite un repository di plasmide senza scopo di lucro. È necessario un accordo di trasferimento di materiale.
- Trasformare i plasmidi in cellule competenti di Escherichia Coli e isolare i plasmidi utilizzando un kit di estrazione commerciale del plasmide. Seguire le istruzioni del produttore.
- Misurare la concentrazione di plasmide DNA utilizzando uno spettrofotometro. Scopo per un'alta concentrazione di plasmide risultante, idealmente circa 1 µ g / µ l per evitare la diluizione del campione durante la transfezione.
- Misurare le concentrazioni dei singoli plasmidi utilizzando un spettrofotometro UV e aliquota loro individualmente.
- Mescolare insieme 3 µ g e 3 µ g 2 µ g di EN2K, ET2K e M2L plasmidi, rispettivamente. Questa è la soluzione di plasmide riprogrammazione. La quantità di plasmide soluzione è sufficiente a transfect 1 x 106 cellule. Preparare diversi tali aliquote.
- Conservare tutte le aliquote a-80 ° C.
- Preparare piatti di coltura di destinazione
- Ricoprire una piastra con vitronectina 6 – aggiungere 1 mL di tampone di diluizione di vitronectin in ciascun pozzetto e mescolarvi 40 µ l di soluzione madre di VTN (1 µ g/cm2). Lasciare a temperatura ambiente (TA) o nell'incubatore a 37 ° C per 1 h.
- Vuoto-aspirare la soluzione utilizzando una pipetta Pasteur e sostituire con 2 mL di terreno AFMC in ciascun pozzetto. Conservare a 37 ° C fino a quando le cellule sono di essere placcato.
Nota: Importante: mezzo The AFMC utilizzato in questo passaggio non deve contenere alcuna soluzione antibiotiche o antimicotiche.
- Vendemmia in coltura primaria AFSC/AMSC
Nota: Espandere AFSC/AMSC nella cultura abbastanza per fare gli stock congelati a un numero di passaggio basso e dedicare una boccetta di T-75 per la riprogrammazione. Dal come pochi come 100.000 cellule sono sufficienti per un esperimento, mirano a raccolta circa 500.000 cellule per compensare le perdite e se ottimizzazione dei parametri di transfezione o differenti condizioni di coltura devono essere testati.- Il più presto a un passaggio basso, raccolto il AFSC/AMSC utilizzando cellule distacco enzima mix come descritto al punto 1.3.1-1.3.2. Dopo che le cellule sono state centrifugate, procedere al passaggio successivo.
- Risospendere il pellet in 1 mL di PBS e mescolare bene per lavare i componenti del siero. Contare le celle utilizzando un emocitometro. Regolare la densità delle cellule a 100.000/mL di PBS e aliquota in provette per microcentrifuga da 1,5 mL. In questo modo solo un minimo tempo di contatto tra le cellule e il buffer utilizzato per la transfezione.
- Posizionare il tubo del microcentrifuge sulla cima di provette di polistirene da 5 mL (come adattatori, permetterà di centrifugazione in un rotore di oscillazione regolare) e centrifugare a 200 x g per 4 min a temperatura ambiente. Invertire i tubi e scartare il surnatante in un contenitore per rifiuti. Non utilizzare un rotore ad angolo fisso.
- Eseguire un passaggio aggiuntivo di centrifugazione a 200 x g per 3 min a temperatura ambiente. In tal modo il rimanente liquido dalle pareti del tubo per raccogliere nella parte inferiore. Aspirare accuratamente tutto questo utilizzando una pipetta 200 µ l.
- Transfezione con plasmidi di riprogrammazione
- Per la riprogrammazione di esperimenti, un sistema di transfezione (Vedi Tabella materiali) sarà essere usato per fornire riprogrammazione plasmidi nelle cellule. Suggerimenti di transfezione, tubi di transfezione, tampone di risospensione e buffer elettrolitico inserire l'armadietto di coltura del tessuto. I reagenti del kit sono mantenuti a RT fino a quando sono aperti, quindi essi sono conservati a 4 ° C.
Nota: Usiamo la versione a 10 µ l del kit. - Spostare il dispositivo di transfezione chiudere in modo che la sua stazione della metropolitana può essere posizionato direttamente nel cabinet. Riempire una provetta di transfezione con 3 mL di tampone elettrolitico e montare il tubo nella stazione spingendolo completamente all'interno dello slot.
- Prendere il plasmide riprogrammazione aliquote di soluzione preparate al punto 2.1.5 fuori di-80 ° C stoccaggio e lasciarli scongelare a temperatura ambiente nella cultura armadietto.
- Sul dispositivo di transfezione, selezionare i seguenti parametri di transfezione: 950 V, 40 ms e 1 impulso.
- Risospendere il pellet contenente 100.000 cellule in 10 µ l di tampone di risospensione. Lavorare rapidamente da questo punto poiché tampone di risospensione è leggermente tossico e un tempo di esposizione maggiore si traduce in una vitalità cellulare notevolmente inferiore.
- Mescolare in 1/10 della riprogrammazione soluzione plasmide (la soluzione aliquota è stata preparata per un totale di 1 x 106 cellule).
- Montare una punta di transfezione sulla pipetta transfezione.
- Aspirare la sospensione cellulare verso la punta di transfezione con cura, evitando la formazione di bolle d'aria. Se si osservano bolle, espellere la sospensione e ripetere l'aspirazione. Bolle d'aria impediranno transfezione.
- Inserire la pipetta di transfezione tubo di transfezione e premere il pulsante "START" sulla schermata del dispositivo transfezione. Attendere il messaggio di schermo che informa circa il successo di transfezione e togliere la pipetta dalla provetta immediatamente.
- Espellere la sospensione in 1 bene del target 6-pozzetti piatto preparato nella sezione 2.2. Mescolare nel mezzo da un vicino bene e distribuire la sospensione ugualmente in entrambi i pozzetti (la densità cellulare risultante sarà 50.000/pozzetto).
- Ripetere la transfezione per tutte le provette microcentrifuga contenente AFSC/AMSC individualmente. Posizionare la piastra nell'incubatore a 37 ° C e 5% CO2.
- Per la riprogrammazione di esperimenti, un sistema di transfezione (Vedi Tabella materiali) sarà essere usato per fornire riprogrammazione plasmidi nelle cellule. Suggerimenti di transfezione, tubi di transfezione, tampone di risospensione e buffer elettrolitico inserire l'armadietto di coltura del tessuto. I reagenti del kit sono mantenuti a RT fino a quando sono aperti, quindi essi sono conservati a 4 ° C.
- Cultura di trasfettate AFSC/AMSC
- Coltura le cellule trasfettate per 2-5 giorni. Quindi passare alla riprogrammazione medio composto E8 completati con 100 µM del butirrato del sodio il giorno 3.
Nota: Passaggio secondario può essere eseguita per evitare la crescita eccessiva dell'origine AFSC/AMSC. Tuttavia, il passaggio si disabilita l'opzione per calcolare l'efficienza riprogramma correttamente se questo parametro è di interesse. - Cambiare il mezzo di riprogrammazione ogni giorno per ogni altro giorno per 10 giorni. Modificare il mezzo ogni giorno dal giorno 10 su.
- Coltura le cellule trasfettate per 2-5 giorni. Quindi passare alla riprogrammazione medio composto E8 completati con 100 µM del butirrato del sodio il giorno 3.
- Raccolta manuale delle colonie completamente riprogrammate per espansione clonale
- Le colonie completamente riprogrammate apparire intorno al giorno 14. Permettere le colonie per espandersi e diventare compatto. Possono essere raccolte manualmente e trasferiti a piatti freschi più presto il giorno 15-16.
- 1 h prima della procedura di prelievo, cappotto 24 pozzetti con 8 µ l di VTN a 300 µ l di tampone di diluizione di vitronectin per pozzetto (1 µ g/cm2) e incubare a RT o 37 ° C. Sostituire la soluzione con il mezzo di E8 senza butirrato del sodio.
- Selezionare colonie di dimensioni sufficienti (idealmente oltre 400 µm di diametro) in un'armadietto di coltura sterile. Un microscopio a contrasto di fase o uno stereomicroscopio può essere utilizzato.
- Per il prelievo, verrà utilizzato un microscopio imaging LCD posizionato nell'armadietto poiché suo monitor Elimina la necessità di oculari. Sterilizzare il tavolino del microscopio con etanolo al 70%.
- Usando un microscopio a contrasto di fase regolare cella cultura, selezionare, contrassegnare e prendere nota del numero di colonie di essere raccolti. Questo è importante per assicurarsi che non si perde tempo per questo processo durante la raccolta effettiva.
- Riempire un numero di provette PCR che è uguale o maggiore del numero di colonie di essere raccolti con 30 µ l di acido etilendiamminotetracetico 0,5 mM (ed) in PBS. Colonie verranno inseriti in questi tubi per dissociazione parziale prima di placcatura.
- Prevede di scegliere 5 colonie alla volta dalle piastre utilizzando una pipetta di 10 µ l impostata su 2 µ l. tenere la punta della pipetta ad un angolo al bordo di Colonia e con cautela e gradualmente raschiare tutta la colonia fuori dalla superficie. Immediatamente aspirare tutta la Colonia nella punta della pipetta e trasferirlo in uno dei tubi PCR preparati con EDTA.
- Ripetere l'operazione con i restanti 4 colonie. Incubare a temperatura ambiente per 4-6 min.
- Dispensare la sospensione su e giù delicatamente utilizzando un puntale più grande per abbattere la Colonia in piccoli ciuffi. Evitare di creare una sospensione unicellulare.
- Piastra di sospensione direttamente in un target ben di una piastra a 24 pozzetti preparata al punto 2.6.2. Ripetere l'operazione con le rimanenti colonie.
- Ripetere i passaggi 2.6.6 attraverso 2.6.10 se più di 5 colonie vanno raccolti ma non prendere più di 5 colonie alla volta. Incubare a 37 ° C e 5% CO2.
- L'espansione clonale e la maturazione di iPSC
- Permettere le colonie di crescere e diventare compatto. 3-6 giorni sono sufficienti. Cambiare ogni giorno il terreno di coltura. Utilizzare tra 400 µ l e 1 mL di terreno di E8 basato sulla densità delle cellule.
- Pozzetti della piastra 24 pozzetti con una sufficiente densità di Colonia saranno ampliati in piastre da 6 pozzetti. 1 h prima di passaggio, rivestire la piastre da 6 pozzetti con VTN (come al punto 2.2.1). Quindi sostituire la soluzione nel pozzo con 2 mL di terreno di E8 per pozzetto.
- Aspirare il medio speso dai pozzi sorgente usando una pipetta da 1 mL e sostituire con 300 µ l di 0,5 mM EDTA per lavare. Aspirare immediatamente utilizzando la stessa punta della pipetta e sostituire con 300 µ l di 0,5 mM EDTA nuovamente, quindi incubare a temperatura ambiente per 5 min. aspirare tutto il liquido utilizzando una pipetta da 1 mL.
- Impostare la pipetta da 1 mL capacità, montare una punta di wide-bore 1 mL su di esso e aspirare il mezzo E8 dal target ben nella punta. Lavare la cultura di iPSC di origine con un flusso del mezzo.
- Trasferire la sospensione in target ben e dispensare su e giù più volte per spezzare le colonie in ciuffi di 20-50 cellule. Assicurarsi che essi ottenere distribuiti uniformemente nel pozzo dolce dondolo e scuotendo la piastra e incubare a 37 ° C e 5% CO2.
- Cambiare il medio giornaliero e passaggio ogni 3-4 giorni. Qualsiasi differenziazione colonie possono essere contrassegnati sotto il microscopio di contrasto di fase e rimosso utilizzando un puntale nella coltura mobile. Questo consente per moltiplicazione selettiva della cultura iPSC puro di alta qualità.
- 1 h prima di passaggio, cappotto dei pozzetti di una piastra a 6 pozzetti con VTN come descritto al punto 2.2.1. Quindi sostituire la soluzione con 2 ml di terreno di E8 per pozzetto.
- Routine di passaggio è simile all'iniziale passaggio fatto la utilizzando 0,5 mM EDTA (passaggi 2.7.2 a 2.7.5). Sostituire medio speso in un pozzetto di una piastra a 6 pozzetti con 1 mL di EDTA per lavare e scartare.
- Aggiungere 1 mL di EDTA e incubare a temperatura ambiente per 5-7 min per dissociazione parziale. Ottimizzare il tempo di incubazione se necessario, assicurandosi una sospensione di intorno 20-50-cellula ciuffi è prodotto. Evitare di dissociazione in singole celle.
- Scartare la soluzione di EDTA e aspirare 1 mL di terreno E8 utilizzando una pipetta da 1 mL dal target ben in un puntale wide-bore.
- Lavare via la cultura di iPSC di origine con un flusso del mezzo E8 ripetutamente fino a quando una porzione desiderata di esso è stata rilasciata dalla superficie e trasferire anche nella destinazione. Questa parte rappresenta il rapporto di divisione (ad esempio, 1/8 della cultura possono essere trasferiti per un rapporto di 1:8.)
- Passaggio ogni 3-4 giorni. Consentire l'iPSC linee a maturare coltivando per almeno 15 passaggi prima del loro utilizzo negli esperimenti a valle
3. caratterizzazione e conferma della pluripotenza
Nota: Consultare i file supplementari per i dettagli su citofluorimetria e microscopia confocale.
-
Analisi di formazione di teratoma
- Per determinare la capacità dell'iPSC di differenziarsi in tessuti rappresentativi di tutti i tre strati di germe da analisi di formazione di teratoma, seguire le politiche istituzionali per quanto riguarda la cura degli animali e uso, pianificare in anticipo avere il tempo per la presentazione del protocollo appropriato documenti. La formazione di teratoma in topi si terrà tra 6-10 settimane.
- Cultura 4 pozzetti di una piastra a 6 pozzetti per linea iPSC per 4 giorni. Il numero approssimativo di cellule iniettate in un fianco di un mouse è 0,5 a 1 x 106 cellule. Facoltativo: un extra bene può essere dedicato a determinare un numero di cellulare rappresentativo in un pozzo per mezzo di dissociazione singola cella con un enzima di distacco delle cellule e di conteggio.
- Calcolare il volume della miscela E8/BMM i ciuffi di iPSC verranno sospeso in: entrambi i fianchi del mouse vengono iniettati, ciascuno con 150 µ l della sospensione di ciuffo. Tre topi sono sufficienti per verificare la formazione di teratoma di una linea di iPSC. Includere un extra 150 µ l di ogni ago nel volume risultante per compensare la perdita di volume morto. 1 ago per topo viene utilizzato. Il volume totale è pertanto 3 * (150 µ l * 2 + 150 µ l) = µ l 1350
- Parzialmente di dissociare le colonie di iPSC con EDTA come se essi dovevano essere attraversate, come descritto nei passaggi 2.7.8 per 2.7.10. È importante che le colonie essere dissociate in ciuffi e non separate in singole celle.
- Lavare via le colonie di iPSC con 675 µ l di terreno di E8 (metà del volume calcolato dal punto 3.3.3), utilizzando una punta di wide-bore. Trasferire la sospensione di ciuffo in una provetta di polistirene di 5 mL. Mettere sul ghiaccio.
- Combinare con 675 µ l di BMM. Conservare la sospensione risultante sul ghiaccio fino l'iniezione.
- Anestetizzare i topi per immobilizzare li utilizzando isoflurano. Questo dovrebbe essere eseguito o guidato da personale specializzato del vivario.
- Vortice il polistirolo da 5 mL tubo brevemente e aspirare la sospensione di ciuffo (450 µ l per topo) in una insulina siringa con ago 22 G. Iniettare per via sottocutanea 150 µ l di sospensione cellulare. Questo volume contiene circa 1 x 106 celle (Vedi punto 3.1.2).
- Iniettare 3 topi per linea iPSC. Seguono la prassi corretta cura degli animali per tutte le procedure.
- Monitorare l'integrità dei topi al giorno.
- Quando i teratomas raggiunge un diametro di endpoint di 1,5-2 cm, eutanasia i topi explant i teratomi e memorizzarli in soluzione di formalina per fissaggio del tessuto per 24 h.
- Portare i teratomas fisso in una struttura di nucleo di istologia per ematossilina eosina (H & E) colorazione. Un patologo sarà grado la presenza di tessuti di tutti i tre strati di germe.
Nota per Karyotyping: iPSC Live culture devono essere spedite a specializzata citogenetiche laboratori per i test dell'integrità del cariotipo. È consigliabile che questo test essere eseguita ogni 5 passaggi.
-
Profiling trascrizionale
- Cultura 2 pozzetti di una piastra a 6 pozzetti per 3-4 giorni ottenere un campione di RNA. Utilizzare solo culture di alta qualità, minore contaminazione con differenziazione delle cellule può essere affrontata da raschiare utilizzando un puntale.
- Isolare gli RNA da iPSC culture utilizzando un kit disponibile in commercio seguendo il protocollo del produttore. Nave di campioni per una struttura genomica specializzati.
- Ottenere i profili trascrizionali globali delle linee iPSC utilizzando microarrays (Vedi Tabella materiali per scelte supportate) o sequenziamento di RNA.
- Inviare i file "*.idat" per la valutazione di bioinformatic della pluripotenza attraverso un'interfaccia online presso l'Istituto di Coriell. In alternativa, inviare "* cel" file per Identificazione bioinformatica del tipo delle cellule, compreso le cellule staminali pluripotenti, attraverso un'interfaccia online presso la Johns Hopkins University. Vedi Tabella materiali per informazioni dettagliate sui tipi di dati i dosaggi individuali bioinformatic accettano.
Risultati
Consenso informato scritto è stato ottenuto dai pazienti prima della raccolta del liquido amniotico per scopi di test genetici e dedicando una piccola aliquota del fluido per la ricerca. Nessun consenso è richiesto per l'uso della membrana amniotica nella ricerca, come la placenta rappresenta rifiuti sanitari. Le cellule staminali della membrana e del liquido amniotico tipico mesenchymal proprietà di visualizzazione, morfologicamente le loro cellule sono fusiformi e fase-brillante. Al momento di riprogrammazione, le cellule subiscono mesenchymal epiteliali (MET) transizione e acquisiscono ciottoli-come la morfologia e organizzazione spaziale delle colonie, che indicano le proprietà epiteliali. Questo processo è iniziato più presto 48-72 h dopo l'introduzione della riprogrammazione episomal plasmidi. Assenza di queste colonie di giorno 5 di riprogrammazione indicherebbe il fallimento dell'esperimento. Le cellule delle colonie MET proliferano e di conseguenza, le colonie diventano compatte, tra il 5 e il 14 ° giorno. Compatto MET colonie sono costituiti da cellule che non sono facilmente individualmente distinguibile (Figura 1A). Il intorno al giorno 14, completamente riprogrammati colonie appaiono con cellule disposte in monostrato, portando prominente, facilmente distinguibili nuclei e nucleoli. Sono pronti ad essere meccanicamente isolato e ampliato quando le colonie raggiungono una dimensione adatta e diventano compatte (Figura 1B).
Completamente e parzialmente riprogrammati colonie sono presenti nelle culture durante l'intero periodo di riprogrammazione, anche se parzialmente riprogrammati colonie non necessariamente acquisire piena pluripotenza. Figura 2 viene illustrato un rappresentante flusso cytometric analisi di espressione di marcatori di cellule staminali embrionali (ESC) a completamente e parzialmente pluripotenti colonie e loro morfologie corrispondente. Pluripotenza completo è associata con l'espressione di Nanog, Oct4, Sox2, TRA antigeni e SSEA-4, mentre espressione SSEA-1 è negativo19,20,21 (Figura 2A). Parzialmente le cellule pluripotenti, tuttavia, non esprimono Nanog e TRA antigeni20 (Figura 2B). L'espressione e la localizzazione dei marcatori ESC dovrebbe essere confermate da immunocytochemical macchiatura e imaging utilizzando un microscopio confocale o di grandangolari (Figura 3).
Una conferma funzionale della pluripotenza si ottiene dimostrando la capacità delle linee iPSC di teratomi forma dopo iniezione sottocutanea delle cellule in topi scid-beige. 6-8 settimane sono necessarie per i teratomas raggiungere la dimensione di punto finale. H & E colorazione dei tessuti e l'esame da un patologo viene quindi eseguita per confermare la presenza del rappresentante di tessuti di tutti i tre strati germinali – endoderma, neuroectoderma e mesoderma (Figura 4A). Un'alternativa alla sperimentazione animale è quello di analizzare la firma trascrizionale associata pluripotenza di approcci genomici come cDNA microarrays22,23. La proporzione del profilo trascrizionale che si sovrappone con uno di una piscina di iPSC ben consolidata e linee di ESC quindi può essere quantificata dal software di valutazione di pluripotenza bioinformatic online sotto forma di un terreno di due classificatori – pluripotenza e Novità (Figura 4B). Maggiore è il Punteggio di pluripotenza, l'altro la query iPSC riga simile le linee stabilite. Un punteggio elevato novità, tuttavia, potrebbe indicare deviazioni o aberrazioni cromosomiche anche, nonostante un alto pluripotenza Punteggio (ad esempio linee teratocarcinoma)22. Tutte le linee di iPSC generate seguendo il protocollo qui presentato sono state ritenute pluripotenti di citometria a flusso, imaging, la formazione di teratoma e metodi di analisi trascrizionale.

Figura 1: progressione morfologica delle cellule durante la riprogrammazione. (A) il liquido amniotico e cellule staminali di membrana, che rappresentano le celle di origine per la riprogrammazione, visualizzare una tipica morfologia mesenchymal, allungata e fase-brillante (a sinistra) fino a quando non subiscono la transizione mesenchimale--epiteliale (MET) che conduce alla acquisizione di proprietà epiteliale e la formazione di colonie con cobble stone-come le cellule (centro). Queste colonie proliferano e creare masse irregolari cellulare delle cellule MET (a destra). (B) alle fasi successive della riprogrammazione (a partire da intorno al giorno 14), colonie di cellule riprogrammate completamente emergono – individualmente distinguibile cellule con nuclei prominenti e nucleoli disposti in strati monomolecolari, con i bordi ben definiti (centro) – e sono presente a fianco di MET colonie che sono più numerosi (a sinistra). Un clone maturo isolato completamente riprogrammato è raffigurato sulla destra. Barra della scala = 100 µm Clicca qui per visualizzare una versione più grande di questa figura.
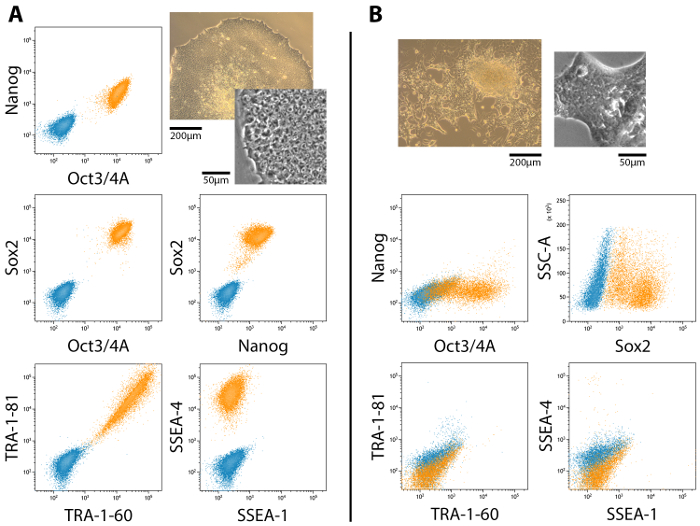
Figura 2: analisi citofluorimetrica dell'espressione di marcatori ESC in completamente e parzialmente (MET) riprogrammato le colonie delle cellule. (A) il profilo di espressione di pluripotent è positivo per Nanog, Oct4, Sox2, TRA-1-60, TRA-1-81 e SSEA-4, mentre negativo per SSEA-1. (B) parzialmente le colonie delle cellule pluripotenti, quelli che hanno subito il MET ma non è riuscito a progredire al completo pluripotenza, sono positive per Oct4 e Sox2 ma Nanog, TRA e SSEA antigeni sono assenti. Le morfologie associate sono incluse per confronto side-by-side. Scala bar = 200 µm e 50 µm. Clicca qui per visualizzare una versione più grande di questa figura.
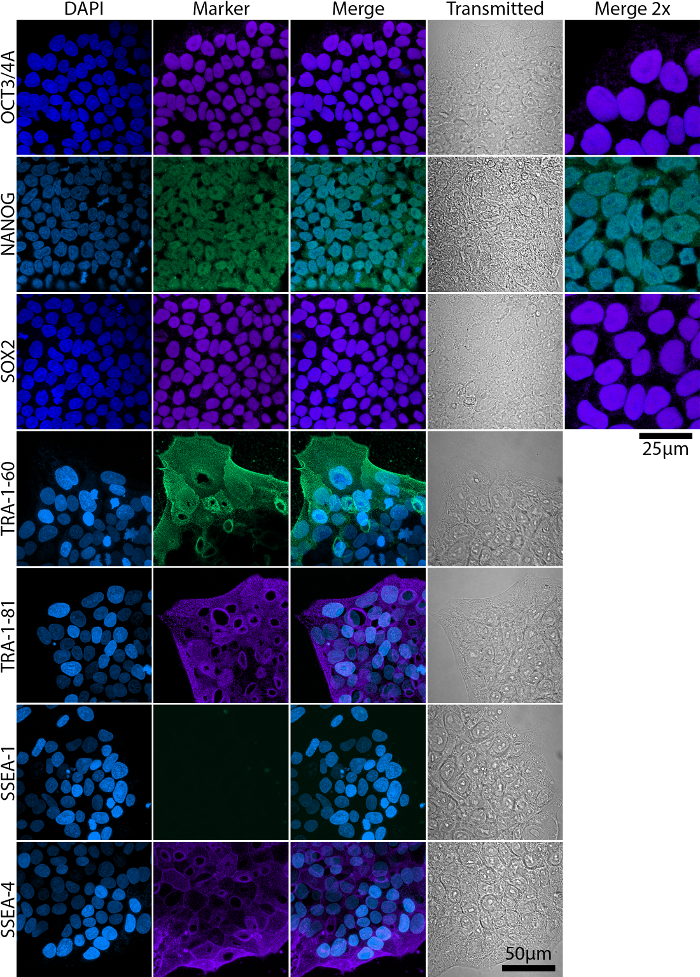
Figura 3: analisi dell'espressione di marcatori ESC in iPSC fluido amniotico maturo di imaging confocale. Fattori di trascrizione Oct3/4A, Nanog e Sox2 sono localizzati nei nuclei mentre TRA e SSEA antigeni sono glicoproteine localizzate sulla membrana. Barra della scala = 50 µm. immagini di maggiore ingrandimento (Merge 2 X) sono stati incluse per Oct3/4, Nanog e Sox2 per una migliore visualizzazione della loro localizzazione nucleare. Barra della scala = 25 µm. trasmesse – immagini acquisite in luce trasmessa. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: la formazione di Teratoma e profiling trascrizionale in maturo iPSC di membrana e del liquido amniotico. (A) Teratomas coltivate per via sottocutanea in topi scid-beige contengono tessuti rappresentativi di tutti i tre strati di germe (ingrandimento 100 X). (B) i profili di microarray di espressione globale presentati alla pluripotenza online software restituito un appezzamento di due classificatori – pluripotenza e novità. Punteggi alti pluripotenza e punteggi di novità basso - rossi cloud - indicano un profilo di espressione di una tipica linea ESC/iPSC. La nuvola blu rappresenta un'area di cluster per cellule differenziate, mentre la nube blu debole rappresenta un'area di cluster per parzialmente cellule pluripotenti. Il liquido amniotico (3 linee) e la membrana (4 linee) iPSC sono state ritenute pluripotenti dal test. Una linea ESC WA25 era inclusa come un controllo e viene identificata qui con una freccia nera. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La fase iniziale della generazione di iPSC da cellule staminali embrionali comporta l'estrazione di celle di origine da tessuti fetali, loro cultura, espansione e introduzione dei plasmidi riprogrammazione episomal. Questa fase è seguita da un periodo di cultura di circa 14-18 giorni prima che le prime colonie completamente riprogrammate possono essere espansa. La fase finale è la maturazione dei cloni iPSC. L'iniziale estrazione delle cellule staminali della membrana amniotica è realizzata per mezzo di una combinato digestione meccanica ed enzimatica del amnion. Abbiamo trovato che un tempo di incubazione di 30 minuti ha provocato il maggior numero di cellule estratte con la più alta redditività. La procedura di digestione può produrre piccoli pezzi di grumi di cellule e tessuti. Se la percentuale di questi rispetto a singole cellule è elevata, si consiglia di placcatura tutti i grumi e singole cellule in un vaso, poiché tutti possono contribuire a escrescenze delle cellule aderenti. Cellule staminali del liquido amniotico di placcatura è semplice come le cellule sono solo mescolate con il terreno di coltura e incubate fino a colonie di cellule aderenti raggiungeranno una dimensione sufficiente. Plasticware regolari di coltura del tessuto-trattati è perfettamente adatto e superfici speciali, non è consigliabile anche se sono destinati per la cultura migliore primario delle cellule, poiché con questi abbiamo osservato inferiore viabilità e le difficoltà con il passaggio processo.
Gli stock congelati e amniotico liquido e membrana staminali cellule dovrebbero essere ampliate ma, al più presto, le cellule possono essere utilizzate come celle di origine per la riprogrammazione. Allo scopo dell'introduzione dei plasmidi episomal nelle cellule, il sistema di transfezione utilizzato qui con i parametri di transfezione impostati a 950 V, 40 ms e 1 impulso ha eseguito molto bene, con tutte le linee tentato (in definitiva con successo riprogrammate oltre 10 linee). Il principale sistema di erogazione di concorrente operanti su un principio simile non ha prodotto un esperimento riuscito di riprogrammazione nelle nostre mani.
Le cellule trasfettate sono seminate su piatti vitronectin-rivestito in mezzo AFMC per i primi 3-5 giorni, poi il mezzo è passato a E8 completati con butirrato di sodio 100 µM. Ciò aumenta notevolmente il tasso di acquisizione completo pluripotenza. I primi segni di trasformazione morfologica possono essere visto più presto 48-72 h. Le cellule di origine subiscono il MET e le colonie di cellule con morfologia epiteliale apparire. Questi gradualmente proliferano e diventa compatti. Un sottoinsieme delle colonie acquisirà le caratteristiche morfologiche del completamente le cellule staminali pluripotenti – individualmente distinguibile cellule con nuclei prominenti ed i nucleoli, osservano colonie piatti con bordi ben definiti, in contrasto con i bordi fuzzy in parzialmente pluripotenti MET colonie. Il momento dell'acquisizione di pluripotenza completo, le colonie di cellule MET compatte acquisiscono nuclei prominenti e le singole celle diventano distinguibili durante la creazione di un unico modello morfologico. Ad un occhio esperto, questo modello è un chiaro segno di successo di riprogrammazione. Tuttavia, a un investigatore che manca di formazione cultura PSC, identificazione delle colonie che hanno progredito con successo alla pluripotenza completo richiede un'attenta valutazione come MET e iPSC cloni possono essere scambiati per l'altro. Figura 1 e Figura 2 forniscono esempi di entrambi. Se MET cloni vengono invece raccolti, analisi di citometria a flusso approfondita rivelerà l'errore e, in particolare, gli antigeni TRA-1-60 e TRA-1-81 sarà probabilmente assenti come mostrato nella Figura 2. Infatti, gli antigeni TRA precedentemente sono stati trovati per essere marcatori di pluripotenza rigorose. Tuttavia, parzialmente MET pluripotenti potrebbero essere di interesse in cancro ricerca25.
Questa condizione di cultura non è ottimale per l'origine AFSC/AMSC e alla fine, rallenterà la loro proliferazione e acquisiranno una morfologia pianeggiante, fibroblasto-come. Le cellule di origine formano tessuti che si possono staccare dalla superficie durante le fasi successive della riprogrammazione, anche se questo non influisce negativamente il processo di riprogrammazione. Al contrario, il processo comporta talvolta liberando spazio per le colonie riprogrammate, eliminando il materiale cellulare ONU-riprogrammato indesiderato. Tessuti indipendente possono essere eliminati facilmente utilizzando una pipetta sterile, lasciando parzialmente e completamente pluripotenti colonie dietro, semplificando notevolmente la selezione manuale a valle.
Per il prelievo manuale delle colonie completamente riprogrammate, usiamo un LCD sistema, che può essere messo nell'armadietto di sicurezza di imaging, privo di qualsiasi parti sporgenti fuori che potrebbe disturbare il flusso d'aria. Diverso da questo sistema di imaging, nessuna attrezzatura speciale è necessario in quanto la raccolta stessa può essere eseguita utilizzando pipette regolari. Le colonie raccolte sono parzialmente dissociate in soluzione di EDTA/PBS prima di essere placcato nei pozzetti destinazione a crescere fuori come cloni. A seconda della linea e il clone, per vari passaggi, le culture possono essere contaminate con spontaneamente differenziazione delle cellule. Manipolazione manuale e passaggio seriale di solito eliminare questo problema. Cloni crivellati con vasta differenziazione devono essere eliminati, tuttavia, preziosi cloni possono essere recuperati con vari gradi di successo per mezzo di ripetute manuale raccolta delle colonie pluripotent piuttosto che lo smaltimento di differenziazione delle cellule. Episomal plasmidi sono stati indicati per prendere circa 15 passaggi andranno persi completamente dal iPSC26. Pertanto, si consiglia di consentire i cloni di crescere per almeno quel numero di passaggi prima del loro utilizzo per applicazioni a valle e le analisi, tranne che per il monitoraggio di routine del karyotype e l'espressione dell'antigene TRA. L'espressione dell'antigene TRA può essere facilmente monitorato mediante citometria a flusso, come qui descritto nel protocollo, poiché il test richiede circa 200.000 cellule e può essere eseguito ogni volta che i ricercatori sono in dubbio se i cloni coltivati sono il mantenimento pluripotenza correttamente. Analisi di citometria a flusso dell'espressione marcatore ESC non è considerato sufficiente per confermare la pluripotenza in candidato linee19.
Analisi di formazione di teratoma è il test standard pluripotenza conclusivo27. PSC coltivate in condizioni chimicamente definite, privo di xeno sono particolarmente suscettibili alla dissociazione indotta morte e quindi, iniettando loro per via sottocutanea come ciuffi è necessario per loro riuscito impianto8,28. A seguito di iniezione, di solito 4-6 settimane sono sufficienti per la crescita degli xeno-innesti per essere visibili e prima della settimana 8, possono essere raccolte, H & colorati ed analizzati. Benessere degli animali, il costo e test lunghi periodi necessari sono motivi per lo sviluppo di metodi alternativi. Analisi genomica combinato con avanzate, approcci di apprendimento-powered bioinformatic macchina in grado di fornire un'accurata valutazione dei profili di espressione globale. Il costo di acquisizione di tali dati è paragonabile al costo di analisi di formazione di teratoma, tuttavia, l'approccio genomico è notevolmente più veloce e gli animali non devono essere utilizzati. Una tale analisi è un software di bioinformatic pluripotenza valutazione22. Viene implementato come un'interfaccia online (Tabella materiali). La crescente popolarità e costo crollo della volontà di sequenziamento di RNA garantire la continuità di questo approccio. Un'alternativa a questo software di pluripotenza è disponibile da Johns Hopkins University23 (cellnet.hms.harvard.edu) e si basa su un approccio simile ed è in grado di accettare dati di microarray per analizzare il trascrittoma di campioni umani. Il vantaggio di questo software è che ha la capacità di identificare non solo le cellule staminali pluripotenti, ma anche cellule differenziate e, dal relativo set di dati a cura sono stati derivato da tessuti primari, il livello di somiglianza tra le cellule in vitro coltivati / tessuti e tessuti in vivo possono essere determinati, fornendo un ottimo controllo di qualità per lo sviluppo di protocolli di differenziazione o di ingegneria tissutale. Il test ha la capacità di classificare le query in 20 differenti delle cellule o tipi di tessuto. Allo stato attuale, richiede dati di microarray, ma gli autori stanno lavorando per ampliare le opzioni di piattaforma al RNA sequenziamento pure.
Seguendo il protocollo presentato, i ricercatori possono generare iPSC linee da cellule staminali amniotiche fluido e membrana con un'altissima riproducibilità in mezzo completamente chimicamente definito e privo di xeno e utilizzando un metodo di riprogrammazione non-integrazione. Queste linee possono essere utilizzate nella ricerca di base per ottimizzare i protocolli di differenziazione e in definitiva nella modellazione di malattia, drug screening, o pediatrica studi di ingegneria tissutale.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Questo lavoro è stato supportato dal Fonds Medizinische Forschung presso l'Università di Zurigo, Forschungskredit dell'Università di Zurigo, The SCIEX NMSCh sotto 10.216 Fellowships e 12.176, The Swiss Society of Cardiology, The Swiss National Science Fondazione sotto Grant [320030-122273] e [310030-143992], il 7 ° programma quadro, la valvola di vita, la Commissione europea sotto Grant [242008], l'Olga Mayenfisch Foundation, la Fondazione EMDO, la concessione di Start-up 2012 dell'ospedale universitario di Zurigo, e finanziamento interno del Mitchell Cancer Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| Tumor Dissociation Kit, human | Miltenyi Biotec | 130-095-929 | tissue dissociation system, reagent kit, includes tissue dissociation tubes and tissue dissociation enzymes |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | tissue dissociation system, dissociator |
| Thermo Scientific™ Shandon™ Disposable Scalpel No. 10, Sterile, Individually Wrapped, 5.75 (14.6cm) | Thermo-Fisher | 3120032 | |
| 70 µm cell strainers | Corning | 10054-456 | |
| RPMI 1640 medium | Thermo-Fisher | 32404014 | |
| rocking platform | VWR | 40000-300 | |
| 50 ml centrifuge tubes | Thermo-Fisher | 339652 | |
| 15 ml centrifuge tubes | Thermo-Fisher | 339650 | |
| EBM-2 basal medium | Lonza | CC-3156 | basal medium for AFMC medium |
| FGF 2 Human (expressed in E. coli, non-glycosylated) | Prospec Bio | CYT-218 | bFGF, supplement for AFMC medium |
| EGF Human, Pichia | Prospec Bio | CYT-332 | EGF, supplement for AFMC medium |
| LR3 Insulin Like Growth Factor-1 Human Recombinant | Prospec Bio | CYT-022 | IGF, supplement for AFMC medium |
| Fetal Bovine Serum, embryonic stem cell-qualified | Thermo-Fisher | 10439024 | FBS |
| Antibiotic-Antimycotic (100X) | Thermo-Fisher | 15240062 | for primary AFSC/AMSC, for routine AFSC/AMSC it should not be necessary, do not use in medium for transfected cells! |
| Accutase cell detachment solution | StemCell Technologies | 07920 | cell detachment enzyme |
| CryoStor™ CS10 | StemCell Technologies | 07930 | complete freezing medium |
| PBS, pH 7.4 | Thermo-Fisher Scientific | 10010023 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | for plasmid isolation |
| pEP4 E02S EN2K | Addgene | 20925 | EN2K, reprogramming factors Oct4+Sox2, Nanog+Klf4 |
| pEP4 E02S ET2K | Addgene | 20927 | ET2K, reprogramming factors Oct4+Sox2, SV40LT+Klf4 |
| pCEP4-M2L | Addgene | 20926 | M2L, reprogramming factors c-Myc+LIN28 |
| NanoDrop 2000c UV-Vis Spectrophotometer | Thermo-Fisher | ND-2000C | spectrophotometer |
| Neon® Transfection System | Thermo-Fisher | MPK5000 | transfection system, components: Neon pipette - transfection pipette Neon device - transfection device |
| Neon® Transfection System 10 µL Kit | Thermo-Fisher | MPK1025 | consumables kit for the Neon Transfection System, it contains: Neon tip - transfection tip Neon tube - transfection tube buffer R - resuspension buffer buffer E - electrolytic buffer |
| Stemolecule™ Sodium Butyrate | StemGent | 04-0005 | small molecule enhancer of reprogramming |
| TeSR-E8 | StemCell Technologies | 05940 | E8 medium |
| Vitronectin XF™ | StemCell Technologies | 07180 | VTN, stock concentration 250 µg/ml, used for coating at 1 µg/cm2 in vitronectin dilution (CellAdhere) buffer |
| CellAdhere™ Dilution Buffer | StemCell Technologies | 07183 | vitronectin dilution buffer |
| UltraPure™ 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | dilute with PBS to 0.5 mM before use |
| EVOS® FL Imaging System | Thermo-Fisher Scientific | AMF4300 | LCD imaging microscope system |
| CKX53 Inverted Microscope | Olympus | phase contrast cell culture microscope | |
| Pierce™ 16% Formaldehyde (w/v), Methanol-free | Thermo-Fisher | 28908 | dilute to 4% with PBS before use, diluted can be stored at 2-8 °C for 1 week |
| Perm Buffer III | BD Biosciences | 558050 | permeabilization buffer, chill to -20 °C before use |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 557782 | isotype control for Oct3/4A, Nanog |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 557783 | isotype control for Sox2 |
| Mouse anti-human Oct3/4 (Human Isoform A), Alexa Fluor® 488 | BD Biosciences | 561628 | |
| Mouse anti-human Nanog, Alexa Fluor® 488 | BD Biosciences | 560791 | |
| Mouse anti-human Sox-2, Alexa Fluor® 647 | BD Biosciences | 562139 | |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 401617 | isotype control for TRA-1-60 |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401618 | isotype control for TRA-1-81 |
| Mouse anti-human TRA-1-60, Alexa Fluor® 488 | BD Biosciences | 330613 | |
| Mouse anti-human TRA-1-81, Alexa Fluor® 647 | BD Biosciences | 330705 | |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 400129 | isotype control for SSEA-1 |
| Mouse IgG3, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401321 | isotype control for SSEA-4 |
| Mouse anti-human SSEA-1, Alexa Fluor® 488 | BD Biosciences | 323010 | |
| Mouse anti-human SSEA-4, Alexa Fluor® 647 | BD Biosciences | 330407 | |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 488 | Jackson Immunoresearch | 115-606-068 | use at a dilution of 1:600 or further optimize |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 647 | Jackson Immunoresearch | 115-546-068 | use at a dilution of 1:600 or further optimize |
| DAPI | Thermo-Fisher Scientific | D21490 | stock solution 10 mM, further dilute to 1:12.000 for a working solution |
| Corning® Matrigel® Growth Factor Reduced, Phenol Red-Free | Corning | 356231 | basement membrane matrix (BMM) |
| scid-beige mice, female | Taconic | CBSCBG-F | |
| RNeasy Plus Mini Kit (50) | Qiagen | 74134 | RNA isolation kit |
| T-25 flasks, tissue culture-treated | Thermo-Fisher | 156367 | |
| T-75 flasks, tissue culture-treated | Thermo-Fisher | 156499 | |
| Nunc™ tissue-culture dish | Thermo-Fisher | 12-567-650 | 10 cm tissue culture dish |
| 6-well plates, tissue-culture treated | Thermo-Fisher | 140675 | |
| Neubauer counting chamber (hemacytometer) | VWR | 15170-173 | |
| Mr. Frosty™ Freezing Container | Thermo-Fisher | 5100-0001 | freezing container |
| FACS tubes, Round Bottom Polystyrene Test Tube, 5ml | Corning | 352058 | 5 ml polystyrene tubes |
| Eppendorf tubes, 1.5 ml | Thermo-Fisher | 05-402-96 | 1.5 ml microcentrifuge tubes |
| PCR tubes, 200 µl | Thermo-Fisher | 14-222-262 | |
| pipette tips, 100 to 1250 µl | Thermo-Fisher | 02-707-407 | narrow-bore 1 mL tips |
| pipette tips, 5 to 300 µl | Thermo-Fisher | 02-707-410 | |
| pipette tips, 0.1 to 10 µl | Thermo-Fisher | 02-707-437 | |
| wide-bore pipette tips, 1000 µl | VWR | 89049-166 | wide-bore 1 mL tips |
| glass Pasteur pipettes | Thermo-Fisher | 13-678-20A | |
| ethanol, 200 proof | Thermo-Fisher | 04-355-451 | |
| vortex mixer | VWR | 10153-842 | |
| chambered coverglass, 8-well, 1.5mm borosilicate glass | Thermo-Fisher | 155409 | glass-bottom confocal-grade cultureware |
| 22G needles | VWR | 82002-366 | |
| insulin syringes | Thermo-Fisher | 22-253-260 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | fixation of explanted teratomas |
| Illumina HT-12 v4 Expression BeachChip | Illumina | BD-103-0204 | expression microarray, supported by PluriTest, discontinued by manufacturer |
| PrimeView Human Genome U219 Array Plate | Thermo-Fisher | 901605 | expression microarray (formerly Affymetrix brand), soon to be supported by PluriTest |
| GeneChip™ Human Genome U133 Plus 2.0 Array | Thermo-Fisher | 902482 | expression microarray (formerly Affymetrix brand), supported by CellNet, soon to be supported by PluriTest |
| PluriTest® | Coriell Institute | www.pluritest.org, free service for bioinformatic assessment of pluripotency, accepts microarray data - *.idat files from HT-12 v4 platform, soon to support U133, U219 microarray and RNA sequencing data | |
| CellNet | Johns Hopkins University | cellnet.hms.harvard.edu, free service for bioinformatic identification of cell type, including plutipotent stem cells, based on U133 microarray data - *.cel files, soon to support RNA sequencing data |
Riferimenti
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Yu, J., et al. Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells. Science. 318 (5858), 1917-1920 (2007).
- Trounson, A., DeWitt, N. D. Pluripotent stem cells progressing to the clinic. Nat. Rev. Mol. Cell Biol. 17 (3), 194-200 (2016).
- Schmidt, D., et al. Prenatally fabricated autologous human living heart valves based on amniotic fluid derived progenitor cells as single cell source. Circulation. 116 (11 Suppl), I64-I70 (2007).
- Weber, B., Zeisberger, S. M., Hoerstrup, S. P. Prenatally harvested cells for cardiovascular tissue engineering: Fabrication of autologous implants prior to birth. Placenta. 32, S316-S319 (2011).
- Weber, B., et al. Prenatally engineered autologous amniotic fluid stem cell-based heart valves in the fetal circulation. Biomaterials. 33 (16), 4031-4043 (2012).
- Kehl, D., Weber, B., Hoerstrup, S. P. Bioengineered living cardiac and venous valve replacements: current status and future prospects. Cardiovasc. Pathol. 25 (4), 300-305 (2016).
- Slamecka, J., et al. Non-integrating episomal plasmid-based reprogramming of human amniotic fluid stem cells into induced pluripotent stem cells in chemically defined conditions. Cell Cycle. 15 (2), 234-249 (2016).
- Jiang, G., et al. Human Transgene-Free Amniotic-Fluid-Derived Induced Pluripotent Stem Cells for Autologous Cell Therapy. Stem Cells Dev. 23 (21), 2613-2625 (2014).
- Pipino, C., et al. Trisomy 21 mid-trimester amniotic fluid induced pluripotent stem cells maintain genetic signatures during reprogramming: implications for disease modeling and cryobanking. Cell. Reprogram. 16 (5), 331-344 (2014).
- Cai, J., et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells. J Biol. Chem. 285 (15), 11227-11234 (2010).
- Ge, X., et al. Human Amniotic Mesenchymal Stem Cell-Derived Induced Pluripotent Stem Cells May Generate a Universal Source of Cardiac Cells. Stem Cells Dev. 21 (15), 2798-2808 (2012).
- Drozd, A. M., Walczak, M. P., Piaskowski, S., Stoczynska-Fidelus, E., Rieske, P., Grzela, D. P. Generation of human iPSCs from cells of fibroblastic and epithelial origin by means of the oriP/EBNA-1 episomal reprogramming system. Stem Cell Res. Ther. 6 (1), (2015).
- Kang, N. -. H., et al. Potential antitumor therapeutic strategies of human amniotic membrane and amniotic fluid-derived stem cells. Cancer Gene Ther. 19 (8), 517-522 (2012).
- Moschidou, D., et al. Valproic Acid Confers Functional Pluripotency to Human Amniotic Fluid Stem Cells in a Transgene-free Approach. Mol. Ther. 20 (10), 1953-1967 (2012).
- Kim, K., et al. Epigenetic memory in induced pluripotent stem cells. Nature. 467 (7313), 285-290 (2010).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324 (5928), 797-801 (2009).
- Martí, M., et al. Characterization of pluripotent stem cells. Nat. Protoc. 8 (2), 223-253 (2013).
- Chan, E. M., et al. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27 (11), 1033-1037 (2009).
- Adewumi, O., et al. Characterization of human embryonic stem cell lines by the International Stem Cell Initiative. Nat. Biotechnol. 25 (7), 803-816 (2007).
- Müller, F. -. J., et al. A bioinformatic assay for pluripotency in human cells. Nature Methods. 8 (4), 315-317 (2011).
- Cahan, P., Li, H., Morris, S. A., Lummertz da Rocha, E., Daley, G. Q., Collins, J. J. CellNet: Network Biology Applied to Stem Cell Engineering. Cell. 158 (4), 903-915 (2014).
- Schopperle, W. M., DeWolf, W. C. The TRA-1-60 and TRA-1-81 Human Pluripotent Stem Cell Markers Are Expressed on Podocalyxin in Embryonal Carcinoma. STEM CELLS. 25 (3), 723-730 (2007).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2014).
- Müller, F. -. J., Goldmann, J., Löser, P., Loring, J. F. A call to standardize teratoma assays used to define human pluripotent cell lines. Cell Stem Cell. 6 (5), 412-414 (2010).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat. Protoc. 7 (11), 2029-2040 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon