Method Article
无异条件下多原代羊水和膜细胞重新编程
摘要
该协议描述了在完全化学定义的条件下, 使用 non-integrating episomal 方法将原代羊水和膜间充质干细胞重新编程为诱导多能干细胞。详细介绍了通过严格的方法提取、培养、重新编程和表征所产生的诱导多能干细胞的过程。
摘要
随着诱导多能干细胞的引入, 自体细胞疗法在现实中得到了更进一步的研究。胚胎干细胞, 如羊水和膜间充质干细胞, 代表了一种独特的组织工程中的未分化细胞, 并为未来的儿科干预和干细胞银行重组为 iPSC。这里介绍的协议描述了一个优化的过程, 以提取和培养初级羊水和膜间充质干细胞和产生 episomal 诱导多能干细胞从这些细胞在完全化学定义的文化利用人类重组受精和 E8 培养基的条件。本文还描述了采用严格的方法-流式细胞仪、共聚焦成像、畸胎瘤形成和转录分析-的新品系的特性。新生成的 Oct3/4A、Nanog、Sox2、TRA-1-60、TRA-1-81、SSEA-4 等胚胎干细胞的标记, 同时对 SSEA-1 标记呈阴性。干细胞系形成畸胎瘤在免疫缺陷-米色小鼠6-8 周和畸胎瘤包含组织代表的所有三种细菌层。通过将全球表达微阵列数据提交到生物多评估算法中的线转录分析认为所有的线多能性, 因此, 这种方法是一个诱人的替代动物试验。新的 iPSC 线可以很容易地用于下游实验, 涉及优化分化和组织工程。
引言
诱导多能干细胞技术 (iPSC) 带来了潜在的细胞置换疗法, 疾病和发育模型, 药物和毒理学筛选1,2,3。在概念上可以通过细胞注射、体外分化组织 (如心脏贴片) 或通过组织工程进行引导再生来实现替代疗法。羊水 (AFSC) 和膜干细胞 (AMSC) 是一种极好的细胞源, 这些干预措施要么直接4,5,6,7 ,要么作为重新编程的起始单元格填充进入多8,9,10,11,12。
早期的方法使用未定义的区域性系统或重新编程的方法, 需要构建9、10、11、12。最近的一项研究采用了无异的培养基, 即使使用了较不明确的基底膜附着基质 (钢), 从羊水上皮细胞中生成 iPSC。然而, 畸胎瘤的形成方法并没有包括在研究中, 以及大量的体外和分子数据。羊水上皮细胞与新生儿成纤维细胞的13相比, 具有大约8倍的高重编程效率。在另一项研究中, 羊水中的间充质干细胞也被发现被重新编程成 iPSC, 效率更高12。
多能干细胞可以分化为所有3种细菌层的组织代表, 因此具有最广泛的潜能。儿科患者可以受益于他们的自体羊水干细胞产前和羊膜干细胞产期的收获, 重新编程和组织工程。此外, 相对较低的胚胎干细胞分化水平 (低于成人干细胞14,15) 可以从理论上帮助解决从 iPSC16中的源细胞观察到的表观遗传偏见的保留。
在这里, 我们提出了一个协议, 以重新编程羊水和膜干细胞多在化学定义的无异 E8 培养基上的重组受精17 (VTN) 使用 episomal 质粒18。羊水和膜细胞作为细胞重新编程的主要优势在于它们的可用性和产期, 因此这种方法主要有利于儿科组织工程的研究。
研究方案
该议定书遵循人类研究道德委员会的机构准则。病人的书面同意获得了使用羊水进行研究。
该议定书遵循南阿拉巴马大学机构动物保育和使用委员会的政策。
1. 原代羊膜间充质干细胞的分离培养
-
羊膜液细胞的电镀
- 在医生的羊膜穿刺过程中获得至少2.5 毫升的羊水。
注: 所有活细胞和组织的处理必须在无菌组织培养柜中进行, 必须使用适当的个人防护设备。熟悉基本的细胞培养和无菌技术是必需的。 - 制备羊水和膜细胞 (AFMC) 培养基: EBM-2 基培养基, 15% 胎牛血清 (FBS), 20 ng/毫升的 bFGF, 25 ng/ml 的 EGF, 10 ng/毫升的 igf-i。对于原代羊水和羊膜干细胞的培养, 培养基应辅以抗生素-抗液。
- 在0天, 混合2.5 毫升的羊水与3.5 毫升的 AFMC 培养基和板块成一个 T25 烧瓶。孵育在37° c 和 5% CO2为至少 48 h 不受干扰在检查之前殖民地的存在。
- 在5天, 黏附细胞的殖民地应该存在。轻轻摇动烧瓶, 将未完全附着在底部和碎片上的细胞取出, 用巴斯德吸管抽吸所用的中/羊水混合液。替换为5毫升的新鲜 AFMC 培养基。
- 文化再过5天。每隔一天更换介质, 如步骤1.1.4 中所述。
- 在医生的羊膜穿刺过程中获得至少2.5 毫升的羊水。
-
人羊膜原发间充质干细胞的分离
- 出生后尽快获得胎盘, 最迟在24小时内, 以最大限度地提高细胞的完整性。切开羊膜的9厘米2段, 取出血块并在50毫升离心管中冲洗30毫升的 PBS, 辅以抗生素抗溶液。
- 用一双手术刀在不育的10厘米的组织培养皿中切碎。细胞膜的消化和细胞的提取将通过组织离解系统来实现。遵循制造商的协议。
注意: 切碎后的组织切片越细, 消化后细胞数越多。 - 用手术刀刀片将切碎的膜组织体转移到一个组织离解管中, 并与4.7 毫升的 RPMI 1640 培养基混合。混合离解酶 (请参见材料表)。
- 将管子安装到组织 dissociator 上, 并运行程序 "h_tumor_01"。在37° c 的摇摆平台上孵育30分钟的管子。
- 进一步稀释悬浮液与35毫升的 RPMI 1640 和适用于70µm 过滤器放置在50毫升收集离心管。
- 离心机为5分钟在室温 200 x g, 丢弃上清, 重在5毫升的 RPMI 1640, 计数的细胞使用 hemacytometer, 和板在密度1万细胞/cm2到组织培养处理过的血管与新鲜的准备AFMC 培养基辅以抗生素-抗溶液。
注意: 在不完全消化的情况下, 小块组织将会存在, 单个细胞将会稀少。再次向下旋转, 将整个颗粒放入一个 T75 烧瓶中。
-
小学 AFSC 与 AMSC 文化
- AFSC/AMSC 的通道殖民地使用巴斯德吸管吸取的真空吸气培养基, 并在烧瓶中加入2毫升的细胞剥离酶。孵育在37° c 为5-8 分钟。
- 水龙头上的烧瓶, 以帮助赶走细胞和混合的悬浮与等量的 AFMC 培养基 (抗生素-抗补充不应该是必要的, 从这一点上)。离心机在200克为4-5 分钟. 用玻璃巴斯德吸管或简单地倒置管子并将其排空到废物容器中去除上清。
- 轻拂离心管的底部, 将小球分解成单个的悬浮液, 并将其与 AFMC 介质混合以进行电镀。板到 T 烧瓶在密度在2500和5000细胞/cm2之间。
- 每隔一天更换一次培养基。不要把细胞系培养到超过6通道。为重新编程目的, 尽量使用低的段落。
- 用冷冻培养基制备 AFSC 和 AMSC 的冷冻储存备份。收获文化使用细胞剥离酶, 离心在 200 g 为4° c 为 5 min。
- 用巴斯德吸管移除上清液, 并轻拂管子底部以 singularize 颗粒中的细胞。重在 1×106/毫升和分的密度为 cryovials 的完全冻结介质中。在-80 ° c 过夜的冷冻容器中贮存。然后移动到液氮长期储存。
2. 重新编程成多
- 获得重编程质粒
- 通过一个非营利质粒存储库购买重编程粒。需要一个物质转让协议。
- 将质粒转化为大肠杆菌合格的细胞, 并使用商业化的粒化提取试剂盒分离出粒。按照制造商的说明进行操作。
- 用分光光度法测定质粒 DNA 的浓度。目的是高质粒浓度, 理想情况下约1µg/µL, 以避免稀释样品在转染。
- 使用紫外分光光度计测量单个质粒的浓度, 并分它们。
- 分别将3µg、3µg 和2µg EN2K、ET2K 和 M2L 质粒混合在一起。这是重编程质粒溶液。质粒溶液的数量足以染 1 x 106细胞。准备几个这样的等分。
- 储存所有等分在-80 ° c。
- 准备目标培养皿
- 将一个 6-井板涂上受精-在每个井中加入1毫升的受精稀释缓冲器, 并在40µL VTN 库存溶液中混合 (1 µg/cm2)。在室温下 (RT) 或在37° c 为1小时的恒温箱中离开。
- 真空吸出的解决方案使用巴斯德吸管和更换2毫升的 AFMC 介质在每个井。储存在37° c, 直到细胞被镀。
注: 重要: 此步骤中使用的 AFMC 介质不应含有任何抗生素或抗溶液。
- 收获培养的初级 AFSC/AMSC
注: 扩大 AFSC/AMSC 在文化足以使冻结股票在一个低的通道数, 并致力于一个 T-75 瓶重新编程。由于10万细胞不足以进行实验, 目的是在50万细胞周围收获, 以弥补损失, 如果转染参数或不同培养条件的优化将被测试。- 在最早期的方便, 在低通道, 收获 AFSC/AMSC 使用细胞剥离酶混合描述的步骤1.3.1 到1.3.2。在单元格被离心后, 继续下一步。
- 重1毫升的 PBS 和混合好, 以洗涤血清成分的颗粒。使用 hemacytometer 计数单元格。调整细胞密度 10万/毫升的 PBS 和分成1.5 毫升离心管。这只保证了细胞和用于转染的缓冲器之间的最小接触时间。
- 把离心管放在5毫升聚苯乙烯管 (作为适配器, 将允许离心在一个规则摆动转子) 和离心机在 200 x g 4 分钟的室温。倒置管, 把上清液丢弃在废物容器内。不要使用固定角度的转子。
- 在室温下以 200 x g 为3分钟执行额外的离心步骤。这将允许剩余的液体从管壁的底部收集。用200µL 吸管小心地吸干它
- 重组质粒转染
- 对于重新编程的实验, 一个转染系统 (见材料表) 将被用来提供重组质粒进入细胞。将转染提示、转染管、悬浮缓冲液和电解缓冲液放入组织培养柜中。试剂盒被保存在 RT, 直到他们被打开, 然后他们被存放在4° c。
注: 我们使用10µL 版本的套件。 - 将转染装置关闭, 使其管站可以直接放置到机柜中。用3毫升的电解缓冲液填充一个转染管, 并通过将其一路推入槽内将管子装入空间站。
- 在-80 ° c 的等分中, 采取步骤2.1.5 制备的重编程质粒溶液, 使其在培养基中的 RT 处解冻。
- 在转染装置上, 选择以下转染参数: 950 V、40毫秒和1脉冲。
- 重在10µL 悬浮缓冲中含有10万细胞的颗粒。从这一点上迅速工作, 因为悬浮缓冲是轻微的毒性和增加曝光时间导致明显较低的细胞活力。
- 混合在1/10 的重编程质粒溶液 (解决方案分为总共 1 x 106细胞准备)。
- 将转染针尖贴在转染吸管上。
- 仔细吸取细胞悬浮进入转染尖端, 避免气泡形成。如果观察到气泡, 则将悬浮物排出并重复这一愿望。气泡会阻碍转染。
- 将转染吸管插入转染管, 然后在转染装置的屏幕上按 "启动" 按钮。等待屏幕信息, 告知转染的成功, 并立即从管中取出吸管。
- 将2.2 条所制备的目标6井板的悬浮液排出1井。在培养基中混入邻井, 并将悬浮液均匀地分配到两个井中 (由此产生的细胞密度为 5万/井)。
- 重复转染的所有离心管包含 AFSC/AMSC 单独。将板放入37° c 和 5% CO2的孵化器中。
- 对于重新编程的实验, 一个转染系统 (见材料表) 将被用来提供重组质粒进入细胞。将转染提示、转染管、悬浮缓冲液和电解缓冲液放入组织培养柜中。试剂盒被保存在 RT, 直到他们被打开, 然后他们被存放在4° c。
- 转染 AFSC/AMSC 的文化
- 培养转染细胞2-5 天。然后切换到重新编程培养基组成的 E8 补充100µM 的丁酸钠在3天。
注意: 可进行二次通道, 以避免源 AFSC/AMSC 过度生长。但是, 如果此参数有兴趣, 传代将禁用选项来正确计算重新编程效率。 - 每天将重编程介质更改为每隔一天10天。每天从10天改变媒介。
- 培养转染细胞2-5 天。然后切换到重新编程培养基组成的 E8 补充100µM 的丁酸钠在3天。
- 人工采摘完全 reprogramed 的克隆扩张菌落
- 完全地被重新编程的殖民地出现在天14附近。允许殖民地扩大规模, 并成为紧凑。他们可以手动采摘和转移到新鲜的板块早在15-16 天。
- 1 h 在采摘做法之前, 外套 24-井板材与8µL VTN 在300µL 受精稀释缓冲每井 (1 µg/cm2) 和孵育在 RT 或37° c。用无丁酸钠的 E8 培养基代替溶液。
- 选择一个足够的大小的殖民地 (理想地超过400µm 直径) 在一个无菌文化内阁。可以使用相衬显微镜或显微镜。
- 对于采摘, 将使用 LCD 成像显微镜放置在机柜, 因为它的显示器消除了头盔的需要。用70% 乙醇消毒显微镜阶段。
- 使用常规的相衬细胞培养显微镜, 选择, 标记, 并记下要采摘的菌落数。这对于确保在实际领料过程中不浪费时间是很重要的。
- 在 PBS 中填充数等于或大于30µL 0.5 毫米乙酸酸 (EDTA) 的菌落数量的 PCR 管。在电镀之前, 菌落将被放置在这些管子中进行部分离解。
- 计划一次从板块中选取5个菌落, 使用10µL 吸管, 设置为2µL. 在菌落边缘的角度, 并小心地把吸管尖端, 并逐步刮掉整个殖民地的表面。立即将整个菌落吸进吸管尖端, 并将其转移到制备的一根 EDTA 的 PCR 管中。
- 重复其余4殖民地。在 RT 孵育4-6 分钟。
- 吸管用较大的吸管尖端轻轻地向上和向下, 将蜂群分解成更小的团簇。避免创建单个单元格挂起。
- 将悬浮板直接放入一 2.6.2 24 井板的目标井中。重复与其余的殖民地。
- 重复步骤2.6.6 通过 2.6.10, 如果超过5个殖民地是要采摘, 但不挑选超过5殖民地一次。孵育在37° c 和 5% CO2。
- iPSC 的克隆扩张与成熟
- 允许殖民地成长并变得紧凑。3-6 天就足够了。改变文化媒介日报。使用400µL 和1毫升的 E8 培养基根据细胞密度。
- 具有足够菌落密度的24孔板的井将扩展成6井板。1小时前传代, 外套6井板与 VTN (如在步骤 2.2.1)。然后用2毫升的 E8 介质在井中更换溶液。
- 用1毫升吸管从源井中吸取所用培养基, 用300µL 0.5 毫米 EDTA 进行洗涤。立即用同样的吸管尖吸吸, 再用300µL 0.5 毫米 EDTA 代替, 然后在 RT 孵育5分钟, 用1毫升吸管抽吸所有液体。
- 将1毫升吸管设置为容量, 在其上安装1毫升宽口径的尖端, 并将 E8 介质从目标井吸入到顶端。用介质的流将源 iPSC 文化洗掉。
- 将悬浮液转移到目标井中, 并多次吸管, 将菌落分成20-50 细胞团簇。确保他们得到均匀分布在井中的温柔摇摆和摇动板和孵化在37° c 和 5% CO2。
- 每天3至4天更换介质。任何分化的菌落都可以在相衬显微镜下标记, 并在培养柜中使用吸管尖端去除。这就允许有选择地传播高质量的纯 iPSC 文化。
- 在传代前1小时, 用 VTN 在台阶2.2.1 上涂上一个6孔板的井。然后用2毫升的 E8 培养基代替溶液。
- 常规传代是类似的初始传代做使用0.5 毫米 EDTA (步骤 2.7.2 2.7.5)。用1毫升 EDTA 代替6井板的一个井中的废培养基进行洗涤和丢弃。
- 在 RT 中加入1毫升 EDTA, 孵育5-7 分钟, 部分游离。如果需要, 优化孵化时间, 确保悬浮约20至50细胞团簇产生。避免分解成单个细胞。
- 丢弃 EDTA 溶液, 用1毫升吸管从靶井吸入1毫升的 E8 培养基, 注入宽口径的吸管尖端。
- 用 E8 介质的流反复冲洗源 iPSC 文化, 直到它的所需部分从表面释放并转移到目标井。此部分表示拆分比率 (例如, 可以将1/8 的区域性转移为1:8 的比率。
- 通过每3-4 天。允许 iPSC 线成熟, 培养他们至少15通道之前使用他们在下游实验
3. 多的定性和确认
注: 有关流式细胞仪和共聚焦显微镜的详细信息, 请参阅补充文件。
-
畸胎瘤形成试验
- 通过畸胎瘤形成试验, 确定 iPSC 分化为所有三种细菌层的组织的能力, 遵循动物保育和使用的体制政策, 提前计划, 以便有时间提交适当的议定书文件.小鼠畸胎瘤的形成需要6-10 周。
- 培养4口6孔板每 iPSC 线4天。向鼠标的一个侧面注入的单元格的近似数目是0.5 到 1 x 106单元格。可选: 一个额外的井可以致力于确定一个代表性的细胞数在井中通过单细胞分离酶和计数。
- 计算 E8/BMM 混合物的体积 iPSC 团块将被悬浮在: 一只老鼠的两翼被注射, 每一个都有150µL 的丛悬浮物。三只老鼠足以测试一个 iPSC 行畸胎瘤形成。在所产生的体积内, 每针额外加150µL, 以弥补死体积损失。1针每只老鼠使用。因此总容量是 3 * (150 µL * 2 + 150 µL) = 1350 µL
- 部分地离解 iPSC 殖民地与 EDTA, 好象他们将是传代, 如描述在步2.7.8 对2.7.10。重要的是, 这些菌落被分离成团簇, 而不是单独的细胞。
- 使用宽口径的尖端, 用675µL 的 E8 培养基 (从步骤3.3.3 计算出的体积的一半) 冲洗 iPSC 菌落。将该丛悬浮液转化为5毫升的聚苯乙烯管。在冰上的地方。
- 结合675µL 的钢。将产生的悬浮液保持在冰上直到注射。
- 麻醉老鼠用异氟醚固定它们。这应由 vivarium 的熟练人员执行或指导。
- 漩涡5毫升聚苯乙烯管短暂和吸气的丛悬浮 (450 µL 每只老鼠) 成一个装有22克针的胰岛素注射器。注入150µL 的细胞悬浮。此卷包含大约 1 x 106单元格 (请参见步骤 3.1.2)。
- 每 iPSC 线注射3只老鼠。遵循适当的动物护理规程。
- 每日监测小鼠的健康状况。
- 当畸胎瘤到达终点直径1.5 至2厘米, 安乐的小鼠, 外植体畸胎瘤, 并储存在福尔马林溶液的组织固定24小时。
- 将固定的畸胎瘤带到一个组织学核心设施苏木素曙红 (H & E) 染色。病理学家将对所有三种细菌层的组织的存在进行评分。
型的注意事项: 活 iPSC 文化应运到专门的细胞遗传学实验室, 以测试核型的完整性。建议每隔5通道进行一次测试。
-
转录分析
- 培养2口6井板, 3-4 天, 获得一个 RNA 样本。只有使用高品质的文化, 小污染与区分细胞可以通过刮他们使用吸管提示来解决。
- 根据制造商的协议, 使用商业可用的套件将 RNA 从 iPSC 的文化中分离出来。将样品运送到专门的基因组核心设施。
- 使用微阵列获取 iPSC 线的全球转录剖面 (参见材料表支持的选择) 或 RNA 测序。
- 通过 Coriell 研究所的在线界面提交 "idat" 生物评估多的文件。或者, 通过约翰·霍普金斯大学的在线界面, 提交 "*" 文件, 以生物识别细胞类型, 包括多能干细胞。有关单个生物分析接受的数据类型的详细信息, 请参见材料表。
结果
在为遗传学测试目的采集羊水之前, 患者获得了知情的书面同意, 并为研究提供了一小分。由于胎盘代表医疗废物, 在研究中使用羊膜是不需要同意的。羊水和膜干细胞表现出典型的间质性, 其细胞形态呈纺锤形, 相亮。在重新编程时, 细胞经历 mesenchymal-to-epithelial (MET) 过渡, 并获得鹅卵石样的形态学和空间组织的殖民地, 表明上皮的性质。这一过程是启动早在 48-72 h 后引进重新编程 episomal 质粒。这些殖民地的缺席5天的重新编程将表明失败的实验。被遇见的殖民地的细胞增殖和结果, 殖民地变得紧凑, 在天5和14之间。紧凑的 MET 菌落由不易单独识别的细胞组成 (图 1A)。在14天左右, 完全重新编程的殖民地出现与细胞排列在单层, 携带突出, 容易辨认的原子核和核仁。当菌落达到合适的尺寸并变得紧凑 (图 1B) 时, 它们可以被机械地隔离和扩展。
完全和部分重新编程的殖民地存在于文化中的整个重新编程期间, 虽然部分重新编程的殖民地不一定获得完整的多。图 2显示了具有代表性的流细胞分析了胚胎干细胞 (ESC) 标记在完全和部分多能性菌落中的表达及其相应的形态。全多与 Oct4、Nanog、Sox2、抗原和 SSEA-4 的表达有关, 而 SSEA-1 表达为负19,20,21 (图 2A)。部分多能细胞, 但是, 不表达 Nanog 和转运抗原20 (图 2B)。通过使用广域或共聚焦显微镜 (图 3), 对 ESC 标记的表达和定位应通过免疫细胞化学染色和成像来确认。
多的功能确认是通过证明 iPSC 线的能力, 形成畸胎瘤后皮下注射的细胞到无缺陷-米色小鼠。6-8 周是需要的畸胎瘤达到 end-point 大小。然后进行组织的 & E 染色并由病理学家进行检查, 以确认所有三种细菌层的组织代表的存在-内胚层、外胚层和胚层 (图 4A)。动物试验的另一种选择是用基因芯片方法分析与多相关的转录特征, 如 cDNA 微阵列22,23。iPSC 和 ESC 线重叠的转录剖面的比例可以由在线生物多评估软件以两种分类器的形式进行量化-多和新奇 (图 4B)。多分数越高, 查询 iPSC 行就越类似于已建立的行。尽管高多评分 (如畸行)22, 但较高的新颖性得分可能显示出偏差甚至染色体畸变。在这里提出的所有 iPSC 线都被认为是由流式细胞术、影像学、畸胎瘤形成和转录分析方法所产生的多功能。

图 1: 在重新编程过程中细胞的形态学进展.(A)羊水和膜干细胞, 代表重新编程的源细胞, 显示典型的间质形态学, 拉长和相位亮 (左), 直到他们经历了 mesenchymal-to-epithelial 过渡 (满足)导致获得上皮的性质和形成的殖民地与鹅卵石状细胞 (中心)。这些殖民地增殖和创造不规则细胞大量的 MET 细胞 (右)。(B)在重新编程的后期阶段 (从14天左右开始), 完全重新编程的细胞的菌落出现--单个可识别的细胞, 具有突出的核和核仁排列在单分子中, 具有明确的边界 (中心)-并目前与殖民地, 是更大量的 (左)。右图中描述了一个完全重新编程的独立成熟克隆。缩放栏 = 100 µm请单击此处查看此图的较大版本.
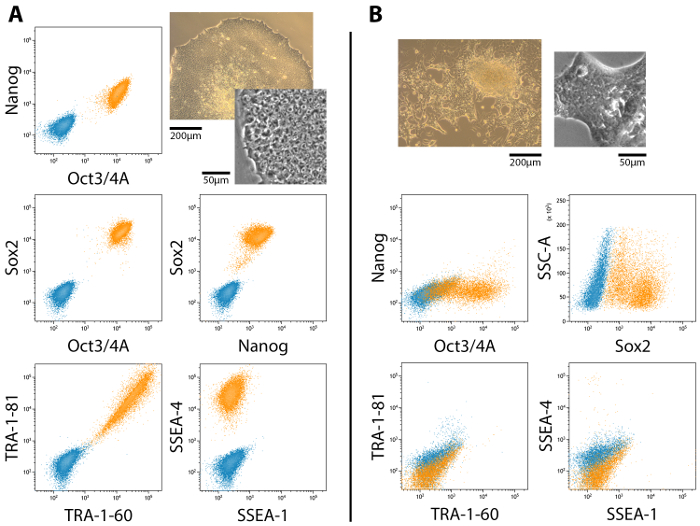
图 2: 流细胞分析了 ESC 标记在完全和部分 (满足) 重新编程的细胞菌落中的表达.(A)对于 Oct4、Nanog、Sox2、TRA-1-60、TRA-1-81 和 SSEA-4, 多能性表达式剖面为正值, 而对 SSEA-1 为负。(B)部分多能细胞菌落--那些经历过但未能完全多的人--对 Oct4 和 Sox2 都是阳性的, 但 Nanog、转运和 SSEA 抗原都缺席。相关的形态被包括在并排比较。缩放栏 = 200 µm 和50µm.请单击此处查看此图的较大版本.
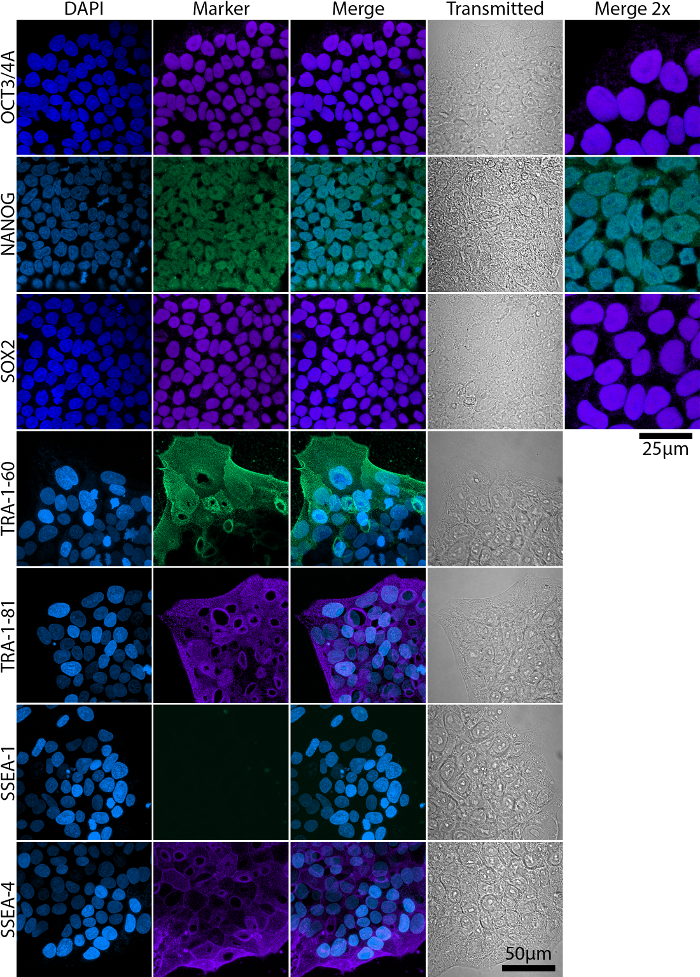
图 3: 对成熟羊水 iPSC 中 ESC 标记表达的共聚焦成像分析.转录因子 Oct3/4A、Nanog 和 Sox2 在细胞核内定位, 而 SSEA 抗原是膜上的糖蛋白。缩放栏 = 50 µm 放大倍率 (合并 2X) 的图像被包括在 Oct3/4, Nanog 和 Sox2, 以更好地显示其核定位。缩放栏 = 25 µm 传输-在透射光上获取的图像。请单击此处查看此图的较大版本.

图 4: 成熟羊水和膜 iPSC 的畸胎瘤形成和转录分析.(A)在无缺陷-米色小鼠皮下生长的畸胎瘤包含所有三种细菌层的组织代表 (100X 放大倍数)。(B)提交给在线多软件的全球表达微阵列配置文件返回了两个分类器的多和新奇的情节。高多分数和低新颖分数-红云-表示典型的 ESC/iPSC 线的表达式轮廓。蓝云代表了分化细胞的簇区, 而微弱的蓝云代表了部分多能细胞的簇区。羊膜液 (3 线) 和膜 (4 线) iPSC 被认为是多能的测试。ESC 线 WA25 包含为控件, 并在此处用黑色箭头标识。请单击此处查看此图的较大版本.
讨论
胚胎干细胞 iPSC 生成的初始阶段需要从胎儿组织中提取源细胞, 它们的培养、扩展和 episomal 重编程质粒的引入。在第一个完全重新编程的殖民地可以扩展之前, 这一阶段的文化周期大约14-18 天。最后阶段是 iPSC 无性系的成熟。羊膜干细胞的初步提取是通过羊膜的联合机械和酶消化的方法来实现的。我们发现, 潜伏期为30分钟, 产生的细胞数量最多, 提取的存活率最高。消化过程可以产生小块的组织和细胞团簇。如果这些相对于单个细胞的比例很高, 我们建议把所有的团簇和单细胞都镀到一个容器中, 因为所有这些都可以促进生长的黏附细胞。电镀羊水干细胞是直接的, 因为细胞只与培养基混合, 并孵育直到附着细胞的菌落达到足够的大小。定期组织培养治疗 plasticware 是完全合适的, 我们不建议专业的表面, 即使他们的目的是改善原细胞培养, 因为与这些我们观察到较低的上和困难与传代过程.
羊水和膜干细胞应扩大和储存, 但在方便的时候, 细胞可以作为源细胞重新编程。为了将 episomal 质粒引入细胞, 在这里使用的转染系统的转染参数设置为950伏、40 ms 和1脉, 表现非常好, 所有的线路尝试最终成功地重新编程 (超过10行)。以类似的原则运作的主要竞争的交付系统没有在我们的手上产生一个成功的重新编程实验。
前3-5 天, 转染后的细胞在 AFMC 培养基上受精, 然后将培养基转换为 E8, 辅以100µM 酸钠。这大大提高了全多收购的速度。最早的形态学改变的迹象可以看到早在48-72 小时。源细胞接受与上皮形态学的细胞菌落的相遇。这些逐渐增殖并且变得紧凑。菌落的一个子集将获得完全多能干细胞的形态学特征--具有突出核和核仁的单独可辨识的细胞, 具有明确边界的扁平菌落, 相对于部分地观察到的模糊边界多能满足殖民地。在获得充分的多的时刻, 紧凑 MET 细胞菌落获得突出的细胞核和个别细胞变得可见, 同时创造一个独特的形态模式。对于训练有素的眼睛, 这种模式是一个成功的重新编程的明确迹象。然而, 对于缺乏 PSC 文化培训的调查人员来说, 对已成功完成多的殖民地的鉴定需要仔细评估, iPSC 克隆可能会被误解。图 1和图 2提供了这两种情况的示例。如果选择满足克隆, 彻底流式细胞仪分析将揭示错误, 特别是, TRA-1-60 和 TRA-1-81 抗原将很可能缺席, 如图 2所示。事实上, 以前发现的抗原是严格的多标记。然而, 部分多能满足细胞可能是对癌症研究的兴趣25。
这种培养条件是不理想的来源 AFSC/AMSC 和最终, 它们的增殖将减慢, 他们将获得一个平坦, 成纤维细胞样形态学。在重新编程的后期阶段, 源细胞形成的组织可以从表面分离出来, 虽然这不会对重新编程过程产生负面影响。相反, 这个过程有时会为重新编程的殖民地腾出空间, 同时消除不需要的 un-reprogrammed 细胞材料。分离的组织可以很容易地丢弃使用无菌吸管尖端, 留下部分和完全多能的殖民地背后, 大大简化手工选择下游。
为了手工采摘完全重新编程的殖民地, 我们使用的 LCD 成像系统, 可以放置在安全柜, 缺乏任何部分突出, 将扰乱空气流动。除了这个成像系统, 不需要特殊的设备, 因为采摘本身可以使用常规管。被采摘的殖民地在 EDTA/PBS 溶液中部分分离, 然后被镀入靶井以作为克隆生长。根据线和克隆, 对几个段落, 文化可能被污染与自发地区分细胞。手动操作和串行传代通常会消除此问题。克隆千疮百孔, 广泛分化应丢弃, 然而, 宝贵的克隆可以挽救的各种程度的成功, 通过反复手动采摘多能性的殖民地, 而不是处理分化细胞。Episomal 质粒被证明采取大约15通道, 完全失去从 iPSC26。因此, 除了常规的抗原表达和核型的监测外, 在使用它们进行下游应用和分析之前, 最好允许克隆至少在这几个通道中生长。抗原表达式可以很容易地通过流式细胞仪进行监测, 如协议中所描述的, 因为该方法只需要大约20万细胞, 而且只要研究人员怀疑是否培养的克隆人保持多正确。流式细胞仪分析的 ESC 标记表达式不被认为足以在候选行中确认多19。
畸胎瘤形成检测是标准的结论性多测试27。PSC 生长在化学定义, 异自由的条件是特别容易离解诱导死亡, 因此, 注入他们皮下, 因为团簇是必要的, 他们成功地植入8,28。注射后, 通常4-6 周是足够的生长的异-移植可见和前一周 8, 所有可以收获, H & 染色和分析。动物福利、成本和长期需要的试验时间是开发替代方法的原因。基因组分析结合先进的机器学习动力生物方法可以提供一个准确的全球表达式的评价。获取此类数据的成本与畸胎瘤形成试验的成本相当, 然而, 基因组方法要快得多, 没有动物需要使用。其中一种检测方法是生物多评估软件22。它是作为联机接口 (材料表) 实现的。RNA 测序的日益普及和暴跌的成本将确保这种方法的连续性。这个多软件的替代品可从约翰霍普金斯大学23 (cellnet.hms.harvard.edu) 获得, 并基于类似的方法, 并能够接受微阵列数据来分析人类样本的转录。该软件的优点是, 它不仅能够识别多能干细胞, 而且还有分化的细胞, 而且, 由于其精心策划的数据集是从原始组织中衍生出来的, 所以体外生长细胞之间的相似程度组织和体内组织是可以确定的, 为分化协议或组织工程的发展提供了优良的质量控制。该测试有能力将查询分类为20不同的细胞或组织类型。目前, 它需要微阵列数据, 但作者正在努力扩大平台选项, 以 RNA 测序以及。
通过遵循所提出的协议, 研究人员可以产生 iPSC 线从羊水和膜干细胞具有很高的重现性, 在完全化学定义和异自由介质和使用 non-integrating 重编程方法。这些线可用于基础研究, 以优化差异化协议, 最终在疾病建模, 药物筛选, 或儿科组织工程研究。
披露声明
作者声明他们没有竞争的金融利益。
致谢
这项工作得到了全 Medizinische Forschung 在苏黎世大学的 Forschungskredit, 苏黎世大学, absciex NMSCh在研究金10.216 和 12.176, 瑞士国立心脏病学会, 瑞士国家科学依据授予 [320030-122273] 并且 [310030-143992], 第七框架节目, 生活阀门, 欧共体根据授予 [242008], 奥尔加 Mayenfisch 基础, EMDO 基础, 启动的津贴2012大学医院苏黎世和米切尔癌症研究所的内部资金。
材料
| Name | Company | Catalog Number | Comments |
| Tumor Dissociation Kit, human | Miltenyi Biotec | 130-095-929 | tissue dissociation system, reagent kit, includes tissue dissociation tubes and tissue dissociation enzymes |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | tissue dissociation system, dissociator |
| Thermo Scientific™ Shandon™ Disposable Scalpel No. 10, Sterile, Individually Wrapped, 5.75 (14.6cm) | Thermo-Fisher | 3120032 | |
| 70 µm cell strainers | Corning | 10054-456 | |
| RPMI 1640 medium | Thermo-Fisher | 32404014 | |
| rocking platform | VWR | 40000-300 | |
| 50 ml centrifuge tubes | Thermo-Fisher | 339652 | |
| 15 ml centrifuge tubes | Thermo-Fisher | 339650 | |
| EBM-2 basal medium | Lonza | CC-3156 | basal medium for AFMC medium |
| FGF 2 Human (expressed in E. coli, non-glycosylated) | Prospec Bio | CYT-218 | bFGF, supplement for AFMC medium |
| EGF Human, Pichia | Prospec Bio | CYT-332 | EGF, supplement for AFMC medium |
| LR3 Insulin Like Growth Factor-1 Human Recombinant | Prospec Bio | CYT-022 | IGF, supplement for AFMC medium |
| Fetal Bovine Serum, embryonic stem cell-qualified | Thermo-Fisher | 10439024 | FBS |
| Antibiotic-Antimycotic (100X) | Thermo-Fisher | 15240062 | for primary AFSC/AMSC, for routine AFSC/AMSC it should not be necessary, do not use in medium for transfected cells! |
| Accutase cell detachment solution | StemCell Technologies | 07920 | cell detachment enzyme |
| CryoStor™ CS10 | StemCell Technologies | 07930 | complete freezing medium |
| PBS, pH 7.4 | Thermo-Fisher Scientific | 10010023 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | for plasmid isolation |
| pEP4 E02S EN2K | Addgene | 20925 | EN2K, reprogramming factors Oct4+Sox2, Nanog+Klf4 |
| pEP4 E02S ET2K | Addgene | 20927 | ET2K, reprogramming factors Oct4+Sox2, SV40LT+Klf4 |
| pCEP4-M2L | Addgene | 20926 | M2L, reprogramming factors c-Myc+LIN28 |
| NanoDrop 2000c UV-Vis Spectrophotometer | Thermo-Fisher | ND-2000C | spectrophotometer |
| Neon® Transfection System | Thermo-Fisher | MPK5000 | transfection system, components: Neon pipette - transfection pipette Neon device - transfection device |
| Neon® Transfection System 10 µL Kit | Thermo-Fisher | MPK1025 | consumables kit for the Neon Transfection System, it contains: Neon tip - transfection tip Neon tube - transfection tube buffer R - resuspension buffer buffer E - electrolytic buffer |
| Stemolecule™ Sodium Butyrate | StemGent | 04-0005 | small molecule enhancer of reprogramming |
| TeSR-E8 | StemCell Technologies | 05940 | E8 medium |
| Vitronectin XF™ | StemCell Technologies | 07180 | VTN, stock concentration 250 µg/ml, used for coating at 1 µg/cm2 in vitronectin dilution (CellAdhere) buffer |
| CellAdhere™ Dilution Buffer | StemCell Technologies | 07183 | vitronectin dilution buffer |
| UltraPure™ 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | dilute with PBS to 0.5 mM before use |
| EVOS® FL Imaging System | Thermo-Fisher Scientific | AMF4300 | LCD imaging microscope system |
| CKX53 Inverted Microscope | Olympus | phase contrast cell culture microscope | |
| Pierce™ 16% Formaldehyde (w/v), Methanol-free | Thermo-Fisher | 28908 | dilute to 4% with PBS before use, diluted can be stored at 2-8 °C for 1 week |
| Perm Buffer III | BD Biosciences | 558050 | permeabilization buffer, chill to -20 °C before use |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 557782 | isotype control for Oct3/4A, Nanog |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 557783 | isotype control for Sox2 |
| Mouse anti-human Oct3/4 (Human Isoform A), Alexa Fluor® 488 | BD Biosciences | 561628 | |
| Mouse anti-human Nanog, Alexa Fluor® 488 | BD Biosciences | 560791 | |
| Mouse anti-human Sox-2, Alexa Fluor® 647 | BD Biosciences | 562139 | |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 401617 | isotype control for TRA-1-60 |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401618 | isotype control for TRA-1-81 |
| Mouse anti-human TRA-1-60, Alexa Fluor® 488 | BD Biosciences | 330613 | |
| Mouse anti-human TRA-1-81, Alexa Fluor® 647 | BD Biosciences | 330705 | |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 400129 | isotype control for SSEA-1 |
| Mouse IgG3, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401321 | isotype control for SSEA-4 |
| Mouse anti-human SSEA-1, Alexa Fluor® 488 | BD Biosciences | 323010 | |
| Mouse anti-human SSEA-4, Alexa Fluor® 647 | BD Biosciences | 330407 | |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 488 | Jackson Immunoresearch | 115-606-068 | use at a dilution of 1:600 or further optimize |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 647 | Jackson Immunoresearch | 115-546-068 | use at a dilution of 1:600 or further optimize |
| DAPI | Thermo-Fisher Scientific | D21490 | stock solution 10 mM, further dilute to 1:12.000 for a working solution |
| Corning® Matrigel® Growth Factor Reduced, Phenol Red-Free | Corning | 356231 | basement membrane matrix (BMM) |
| scid-beige mice, female | Taconic | CBSCBG-F | |
| RNeasy Plus Mini Kit (50) | Qiagen | 74134 | RNA isolation kit |
| T-25 flasks, tissue culture-treated | Thermo-Fisher | 156367 | |
| T-75 flasks, tissue culture-treated | Thermo-Fisher | 156499 | |
| Nunc™ tissue-culture dish | Thermo-Fisher | 12-567-650 | 10 cm tissue culture dish |
| 6-well plates, tissue-culture treated | Thermo-Fisher | 140675 | |
| Neubauer counting chamber (hemacytometer) | VWR | 15170-173 | |
| Mr. Frosty™ Freezing Container | Thermo-Fisher | 5100-0001 | freezing container |
| FACS tubes, Round Bottom Polystyrene Test Tube, 5ml | Corning | 352058 | 5 ml polystyrene tubes |
| Eppendorf tubes, 1.5 ml | Thermo-Fisher | 05-402-96 | 1.5 ml microcentrifuge tubes |
| PCR tubes, 200 µl | Thermo-Fisher | 14-222-262 | |
| pipette tips, 100 to 1250 µl | Thermo-Fisher | 02-707-407 | narrow-bore 1 mL tips |
| pipette tips, 5 to 300 µl | Thermo-Fisher | 02-707-410 | |
| pipette tips, 0.1 to 10 µl | Thermo-Fisher | 02-707-437 | |
| wide-bore pipette tips, 1000 µl | VWR | 89049-166 | wide-bore 1 mL tips |
| glass Pasteur pipettes | Thermo-Fisher | 13-678-20A | |
| ethanol, 200 proof | Thermo-Fisher | 04-355-451 | |
| vortex mixer | VWR | 10153-842 | |
| chambered coverglass, 8-well, 1.5mm borosilicate glass | Thermo-Fisher | 155409 | glass-bottom confocal-grade cultureware |
| 22G needles | VWR | 82002-366 | |
| insulin syringes | Thermo-Fisher | 22-253-260 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | fixation of explanted teratomas |
| Illumina HT-12 v4 Expression BeachChip | Illumina | BD-103-0204 | expression microarray, supported by PluriTest, discontinued by manufacturer |
| PrimeView Human Genome U219 Array Plate | Thermo-Fisher | 901605 | expression microarray (formerly Affymetrix brand), soon to be supported by PluriTest |
| GeneChip™ Human Genome U133 Plus 2.0 Array | Thermo-Fisher | 902482 | expression microarray (formerly Affymetrix brand), supported by CellNet, soon to be supported by PluriTest |
| PluriTest® | Coriell Institute | www.pluritest.org, free service for bioinformatic assessment of pluripotency, accepts microarray data - *.idat files from HT-12 v4 platform, soon to support U133, U219 microarray and RNA sequencing data | |
| CellNet | Johns Hopkins University | cellnet.hms.harvard.edu, free service for bioinformatic identification of cell type, including plutipotent stem cells, based on U133 microarray data - *.cel files, soon to support RNA sequencing data |
参考文献
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Yu, J., et al. Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells. Science. 318 (5858), 1917-1920 (2007).
- Trounson, A., DeWitt, N. D. Pluripotent stem cells progressing to the clinic. Nat. Rev. Mol. Cell Biol. 17 (3), 194-200 (2016).
- Schmidt, D., et al. Prenatally fabricated autologous human living heart valves based on amniotic fluid derived progenitor cells as single cell source. Circulation. 116 (11 Suppl), I64-I70 (2007).
- Weber, B., Zeisberger, S. M., Hoerstrup, S. P. Prenatally harvested cells for cardiovascular tissue engineering: Fabrication of autologous implants prior to birth. Placenta. 32, S316-S319 (2011).
- Weber, B., et al. Prenatally engineered autologous amniotic fluid stem cell-based heart valves in the fetal circulation. Biomaterials. 33 (16), 4031-4043 (2012).
- Kehl, D., Weber, B., Hoerstrup, S. P. Bioengineered living cardiac and venous valve replacements: current status and future prospects. Cardiovasc. Pathol. 25 (4), 300-305 (2016).
- Slamecka, J., et al. Non-integrating episomal plasmid-based reprogramming of human amniotic fluid stem cells into induced pluripotent stem cells in chemically defined conditions. Cell Cycle. 15 (2), 234-249 (2016).
- Jiang, G., et al. Human Transgene-Free Amniotic-Fluid-Derived Induced Pluripotent Stem Cells for Autologous Cell Therapy. Stem Cells Dev. 23 (21), 2613-2625 (2014).
- Pipino, C., et al. Trisomy 21 mid-trimester amniotic fluid induced pluripotent stem cells maintain genetic signatures during reprogramming: implications for disease modeling and cryobanking. Cell. Reprogram. 16 (5), 331-344 (2014).
- Cai, J., et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells. J Biol. Chem. 285 (15), 11227-11234 (2010).
- Ge, X., et al. Human Amniotic Mesenchymal Stem Cell-Derived Induced Pluripotent Stem Cells May Generate a Universal Source of Cardiac Cells. Stem Cells Dev. 21 (15), 2798-2808 (2012).
- Drozd, A. M., Walczak, M. P., Piaskowski, S., Stoczynska-Fidelus, E., Rieske, P., Grzela, D. P. Generation of human iPSCs from cells of fibroblastic and epithelial origin by means of the oriP/EBNA-1 episomal reprogramming system. Stem Cell Res. Ther. 6 (1), (2015).
- Kang, N. -H., et al. Potential antitumor therapeutic strategies of human amniotic membrane and amniotic fluid-derived stem cells. Cancer Gene Ther. 19 (8), 517-522 (2012).
- Moschidou, D., et al. Valproic Acid Confers Functional Pluripotency to Human Amniotic Fluid Stem Cells in a Transgene-free Approach. Mol. Ther. 20 (10), 1953-1967 (2012).
- Kim, K., et al. Epigenetic memory in induced pluripotent stem cells. Nature. 467 (7313), 285-290 (2010).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324 (5928), 797-801 (2009).
- Martí, M., et al. Characterization of pluripotent stem cells. Nat. Protoc. 8 (2), 223-253 (2013).
- Chan, E. M., et al. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27 (11), 1033-1037 (2009).
- Adewumi, O., et al. Characterization of human embryonic stem cell lines by the International Stem Cell Initiative. Nat. Biotechnol. 25 (7), 803-816 (2007).
- Müller, F. -J., et al. A bioinformatic assay for pluripotency in human cells. Nature Methods. 8 (4), 315-317 (2011).
- Cahan, P., Li, H., Morris, S. A., Lummertz da Rocha, E., Daley, G. Q., Collins, J. J. CellNet: Network Biology Applied to Stem Cell Engineering. Cell. 158 (4), 903-915 (2014).
- Schopperle, W. M., DeWolf, W. C. The TRA-1-60 and TRA-1-81 Human Pluripotent Stem Cell Markers Are Expressed on Podocalyxin in Embryonal Carcinoma. STEM CELLS. 25 (3), 723-730 (2007).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2014).
- Müller, F. -J., Goldmann, J., Löser, P., Loring, J. F. A call to standardize teratoma assays used to define human pluripotent cell lines. Cell Stem Cell. 6 (5), 412-414 (2010).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat. Protoc. 7 (11), 2029-2040 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。