Method Article
Reprogramación de primario líquido amniótico y las células de la membrana a pluripotencia en condiciones libres de Xeno
En este artículo
Resumen
Este protocolo describe la reprogramación de primaria amniótico líquido y membrana de las células madre mesenquimales en células pluripotentes inducidas mediante un enfoque episomal no integrar en condiciones totalmente químicamente definidas. Se detallan los procedimientos de extracción, cultivo, reprogramación y caracterización de las células pluripotentes inducidas resultante por métodos rigurosos.
Resumen
Terapias basadas en células autólogas consiguieron un paso más a la realidad con la introducción de células madre pluripotentes inducidas. Células madre fetales, líquido amniótico y células madre mesenquimales en membrana representan un tipo especial de células indiferenciadas con promesa en la ingeniería de tejidos y de reprogramación en iPSC para futuras intervenciones pediátricas y banca de la célula de vástago. El protocolo que presentamos describe un procedimiento optimizado para la extracción y cultivo primario amniótico líquido y membrana de las células madre mesenquimales y generando episomal inducida por células pluripotentes de estas células en cultura totalmente químicamente definida condiciones de utilización de vitronectina recombinante humana y el medio de E8. También se describe la caracterización de las nuevas líneas mediante la aplicación de métodos rigurosos – citometría de flujo, proyección de imagen confocal, formación de teratoma y perfilamiento transcripcional. Las líneas recién generadas expresan marcadores de células madre embrionarias – Oct3/4A, Nanog, Sox2, TRA-1-60, TRA-1-81, SSEA-4, mientras que siendo negativo para el marcador SSEA-1. Las líneas de células madre forman teratomas en ratones scid-beige en 6-8 semanas y los teratomas contienen tejidos representativos de las tres capas del germen. Transcripcional de perfiles de las líneas mediante la presentación de datos de microarrays de expresión global a un algoritmo de evaluación bioinformática pluripotencia consideran todas las líneas pluripotentes y por lo tanto, este enfoque es una alternativa atractiva a los ensayos con animales. Las nuevas líneas de iPSC pueden utilizarse fácilmente en experimentos posteriores con la optimización de la diferenciación y la ingeniería de tejidos.
Introducción
La tecnología de células madre pluripotentes inducidas (iPSC), trae consigo potenciales terapias de reemplazo celular, enfermedad y desarrollo modelado y drogas y detección toxicológica1,2,3. Terapias de reemplazo de expresiones se logra por la inyección de la célula, in vitro había distinguido implantación de tejido (como los parches cardíacos), o la regeneración guiada mediante ingeniería de tejidos. Líquido amniótico (AFSC) y células de membrana (AMSC) son una excelente fuente de células para estas intervenciones ya sea directamente4,5,6,7 o como una población celular a partir de reprogramación en pluripotencia8,9,10,11,12.
Primeros enfoques utilizan sistemas de cultivo indefinido o reprogramación métodos que requieren implican integración genómica de construye9,10,11,12. Un estudio más reciente empleó un medio libre de xeno, aunque se utilizó una matriz de accesorio menos definida de la membrana del sótano (BMM), para generar iPSC a partir de las células epiteliales del líquido amnióticas. Sin embargo, el ensayo de formación de teratoma no fue incluido en el estudio junto con una amplia variedad de datos moleculares y in vitro. Las células epiteliales del líquido amnióticas fueron encontradas para tener una áspero 8-fold reprogramación una eficacia más alta en comparación con los fibroblastos neonatales13. En otro estudio, las células madre mesenquimales de líquido amniótico también fueron encontradas para ser reprogramado en iPSC con una mucho mayor eficiencia12.
Células madre pluripotentes pueden ser distinguidas en representante de tejidos de todas las capas germinales 3 y por lo tanto tienen el potencial más amplio. Pacientes pediátricos podrían beneficiarse de la cosecha, reprogramación e Ingeniería del tejido fino de sus células madre líquidos amnióticos autólogas prenatally y células madre de la membrana amniótica durante el período perinatal. Por otra parte, el relativamente bajo nivel de diferenciación de células fetales de la madre (menores de14,de las células madre adultas15) teóricamente podría ayudar en el tratamiento de la retención observada de sesgo epigenético de las células de origen en iPSC16.
Aquí presentamos un protocolo para la reprogramación de líquido amniótico y membrana células madre de pluripotencia en químicamente definidos gratis xeno E8 medio vitronectina recombinante17 (VTN) usando plásmidos episomal18. La principal ventaja de amniótico líquido y membrana de las células como fuente de células para la reprogramación radica en su disponibilidad pre y perinatal y por lo tanto este enfoque beneficiaría principalmente a investigación en ingeniería de tejidos pediátricos.
Protocolo
El protocolo sigue las directrices del Comité de ética para la investigación en humanos. Se obtuvo consentimiento por escrito del paciente para usar el líquido amniótico para la investigación.
Este protocolo sigue las políticas de cuidado de Animal institucional y Comité de uso de la Universidad de Alabama del sur.
1. aislamiento y cultivo de células mesenquimales amniótico primaria
-
Placas de células del líquido amniótico
- Obtener un mínimo de 2.5 mL de líquido amniótico que se cosechan en el proceso de la amniocentesis por un médico.
Nota: Toda la gestión de células vivas y tejidos debe realizarse dentro de un armario de cultivo de tejido estéril y deben utilizarse equipos de protección personal adecuado. Familiaridad con la cultura de célula básica y técnica estéril es necesaria. - Preparar el medio de cultivo amniótico líquido y membrana celular (AFMC): medio basal EBM-2, 15% de suero bovino fetal (FBS), 20 ng/mL de bFGF, 25 ng/mL de EGF, 10 ng/mL de IGF. Para la cultura primaria amniótico líquido y amniótico de la membrana de células de vástago, el medio debería complementarse con solución antibiótico-antimicótico.
- En el día 0, mezclar 2,5 mL de líquido amniótico con 3,5 mL de medio de cultivo AFMC y placa a un matraz de T25. Incubar a 37 ° C y 5% de CO2 durante al menos 48 h antes de comprobar la presencia de colonias.
- El día 5, colonias de células adherentes deben estar presentes. Muévalo suavemente el matraz para desalojar a las células que no se adhieren a la parte inferior y escombros y vacío-aspiración de la mezcla líquida amniótico/medio gastada utilizando una pipeta Pasteur. Reemplazar con 5 mL de medio fresco de AFMC.
- Cultura por otros 5 días. Cambiar el medio día como se describe en el paso 1.1.4.
- Obtener un mínimo de 2.5 mL de líquido amniótico que se cosechan en el proceso de la amniocentesis por un médico.
-
Aislamiento de células madre mesenquimales primarias de amnios humano
- Obtener placentas tan pronto como sea posible después del nacimiento, dentro de las 24 h como máximo, para maximizar la integridad celular. Cortar un segmento de 9 cm2 de amnios, eliminar coágulos de sangre y lavado en un tubo de centrífuga de 50 mL con 30 mL de PBS suplementado con solución antibiótico-antimicótico.
- Pique las membranas con un par de escalpelos a trozos en un plato de cultivo de tejido estéril de 10 cm. La digestión de las membranas y la extracción de las células se logrará mediante un sistema de disociación del tejido. Seguir el protocolo del fabricante.
Nota: más fino las piezas del tejido después de picar, cuanto mayor sea el número de células se recuperó después de la digestión. - Transferir la masa de tejido de la membrana picada usando las cuchillas de bisturí en tubo de disociación de un tejido y mezclar con 4,7 mL de Medio RPMI 1640. Mezcle las enzimas disociación (véase Tabla de materiales).
- Montar los tubos en el Disociador de tejido y ejecutar el programa "h_tumor_01". Incubar los tubos a 37 ° C en una plataforma oscilante durante 30 minutos.
- Además diluir las suspensiones con 35 mL de RPMI 1640 y se aplican a 70 μm colador colocado sobre un tubo de centrífuga de 50 mL colección.
- Centrifugar 5 min a 200 x g a temperatura ambiente, descartar sobrenadante, Resuspender el precipitado en 5 mL de RPMI 1640, contar las células con un hemacitómetro, y recién la placa a una densidad de 10.000 células/cm2 en recipientes de cultivo de tejidos tratados con preparados AFMC suplementado con solución antibiótico-antimicótico.
Nota: En caso de digestión incompleta, pequeñas porciones de tejido estará presentes y las células será escasas. Girar hacia abajo otra vez y la pelotilla toda la placa en un matraz T75.
-
Cultura de AFSC y AMSC
- Colonias de paso del AFSC/sistema por vacío-aspiración pasaron medio utilizando una pipeta Pasteur y añadir 2 mL de enzima de la separación de células en el matraz. Incubar a 37 ° C durante 5-8 minutos.
- Golpee el frasco para ayudar a desalojar a las células y la suspensión de la mezcla con un volumen igual de medio AFMC (suplemento antibiótico-antimicótico no debería ser necesario desde aquí). Centrifugue a 200 g durante 4-5 minutos Retire el sobrenadante utilizando un vidrio pipeta Pasteur o simplemente por inversión del tubo y vaciar en un recipiente de desechos.
- La parte inferior del tubo de la centrífuga para romper los pellets en una única suspensión en la gota restante de líquido y mezclar con medio de AFMC de galjanoplastia de la película. Placa en T-frascos con una densidad entre 2.500 y 5.000 células/cm2.
- Medio de cambio cada día. La cultura no las líneas celulares más allá del paso 6. Para efectos de reprogramación, utilizar como bajo un paso posible.
- Preparar reservas congeladas de AFSC y haciendo copias de seguridad por medio de congelación. Culturas mediante una enzima de separación celular, centrifugar a 200 g para 4 ° C por 5 min de la cosecha.
- Quite el sobrenadante con una pipeta Pasteur y mueva la parte inferior del tubo para singularizar las células en el sedimento. Resuspender en medio de congelación completo a una densidad de 1 × 106/ml y alícuota en crioviales. Almacenar en un recipiente de congelación durante la noche a-80 ° C. Luego pasar a nitrógeno líquido para el almacenamiento a largo plazo.
2. reprogramación en pluripotencia
- Obtener la reprogramación plásmidos
- Comprar la reprogramación plásmidos a través de un repositorio de plásmido sin fines de lucro. Es necesario un acuerdo de transferencia de Material.
- Transformar la plásmidos de células competentes de e. Coli y aislar la plásmidos utilizando un kit de extracción de plásmidos comerciales. Siga las instrucciones del fabricante.
- Medir la concentración de plásmido ADN utilizando un espectrofotómetro. Objetivo de una alta concentración de plásmido resultante, idealmente alrededor de 1 μg/μl para evitar la dilución de la muestra durante la transfección.
- Medir las concentraciones de la plásmidos individual usando un espectrofotómetro UV y alícuota ellos individualmente.
- Mezclar 3 μg, 3 μg, 2 μg de plásmidos EN2K, ET2K y M2L, respectivamente. Esta es la solución de plásmido reprogramación. La cantidad de plásmido solución es suficiente para transfectar las células 1 x 106 . Preparar varios tales alícuotas.
- Almacenar todas las alícuotas a-80 ° C.
- Preparar platos de la cultura de destino
- Recubrir una placa de 6 pozos con vitronectina, añadir 1 mL de tampón de dilución de vitronectina en cada pozo y mezclar en 40 μl de la solución madre de VTN (1 μg/cm2). Dejar a temperatura ambiente (RT) o en la incubadora a 37 ° C durante 1 hora.
- Reemplazar con 2 mL de medio AFMC en cada pozo y vacío-Aspire la solución con una pipeta Pasteur. Almacenan a 37 ° C hasta que las células deben ser plateado.
Nota: Importante: mediana de la AFMC utilizada en esta etapa no debe contener ninguna solución de antibiótico o antimicótico.
- Cosecha cultivo primario AFSC/sistema
Nota: Ampliar AFSC/AMSC en la cultura suficiente para hacer acciones congeladas en un número de paso bajo y dedicar un matraz T-75 para reprogramación. Desde tan pocas como 100.000 células son suficientes para un experimento, tiene como objetivo cosechar alrededor de 500.000 células para compensar pérdidas y optimización de parámetros de transfección o condiciones de cultivo diferentes para ser probado.- A la brevedad en un paso bajo, cosecha el AFSC/sistema usando mezcla de enzima celular separación como se describe en el paso 1.3.1 a 1.3.2. Después de que las células han sido centrifugadas, proceda al siguiente paso.
- Resuspender el pellet en 1 mL de PBS y mezcle bien para lavar los componentes del suero. Contar las células con un hemacitómetro. Ajustar la densidad celular a 100.000/mL de PBS y Alicuotar en tubos de microcentrífuga de 1,5 mL. Esto asegura que sólo un tiempo mínimo de contacto entre las células y el búfer utilizado para transfección.
- Coloque el tubo de microcentrífuga sobre tubos de poliestireno de 5 mL (como adaptadores, permitirá centrifugación en un rotor de columpio regular) y centrifugar a 200 x g durante 4 min a temperatura ambiente. Invierta los tubos y desechar el sobrenadante en un recipiente de desechos. No utilice un rotor de ángulo fijo.
- Realizar un paso adicional de centrifugación a 200 x g durante 3 min a temperatura ambiente. Esto permitirá que el resto de líquido de las paredes del tubo para recoger en la parte inferior. Aspirar cuidadosamente todo con ayuda de una pipeta de 200 μl.
- Transfección con reprogramación de plásmidos
- Para reprogramación de experimentos, un sistema de transfección (véase Tabla de materiales) se utilizará para entregar reprogramación plásmidos a las células. Colocar consejos de transfección, tubos de transfección, buffer de resuspensión y electrolítica tampón dentro del gabinete de cultura del tejido. Los reactivos del kit se mantienen a temperatura ambiente hasta que son abiertos, entonces se almacenan a 4 ° C.
Nota: Utilizamos la versión μl 10 del kit. - Mueva el dispositivo de transfección cercana para que su estación de metro se puede colocar directamente en el gabinete. Llene un tubo de transfección con 3 mL de solución electrolítica y Monte el tubo en la estación empujando todo el camino dentro de la ranura.
- Tomar el plásmido reprogramación alícuotas de la solución preparadas en el paso 2.1.5 de-80 ° C almacenamiento y déjelos descongelar a temperatura ambiente en el gabinete de la cultura.
- En el dispositivo de transfección, seleccionar los siguientes parámetros de transfección: 950 V, 40 ms y 1 pulso.
- Resuspender el precipitado que contiene 100.000 células en 10 μl de tampón de resuspensión. Trabajar rápidamente desde este punto en buffer de resuspensión es levemente tóxico y un tiempo de exposición mayor resulta en una notablemente menor viabilidad de las células.
- Mezclar en 1/10 de la reprogramación plásmido solución (la alícuota de la solución fue preparada para un total de 1 x 106 células).
- Coloque una punta de transfección en la pipeta de transfección.
- Aspirar la suspensión de células en la punta de la transfección con cuidado, evitando formación de burbujas de aire. Si se observan burbujas, expulsar de la suspensión y repetición de la aspiración. Burbujas de aire impedirá la transfección.
- Insertar la pipeta de la transfección en el tubo de transfección y presione el botón "START" en la pantalla del dispositivo de la transfección. Espere el mensaje en pantalla informando sobre el éxito de la transfección y quitar la pipeta del tubo inmediatamente.
- Vierta la suspensión en la 1 de la placa de 6 pozos de destino preparada en la sección 2.2. Mezclar en el medio de un vecino bien y distribuir igualmente la suspensión en ambos pozos (la densidad celular resultante será 50.000/pozo).
- Repita la transfección para todos los tubos de microcentrífuga con AFSC/sistema individualmente. Coloque la placa en la incubadora a 37 ° C y 5% CO2.
- Para reprogramación de experimentos, un sistema de transfección (véase Tabla de materiales) se utilizará para entregar reprogramación plásmidos a las células. Colocar consejos de transfección, tubos de transfección, buffer de resuspensión y electrolítica tampón dentro del gabinete de cultura del tejido. Los reactivos del kit se mantienen a temperatura ambiente hasta que son abiertos, entonces se almacenan a 4 ° C.
- Cultura de transfected AFSC/sistema
- La cultura las células transfected para 2-5 días. Luego cambiar a medio reprogramación de E8 complementado con 100 μm de butirato de sodio el día 3.
Nota: Paso secundario puede realizarse para evitar el crecimiento excesivo de la fuente de AFSC/sistema. Sin embargo, los pases se desactive la opción para calcular la eficiencia de reprogramación correctamente si este parámetro es de interés. - Cambiar el medio de la reprogramación cada día a días alternos durante 10 días. Cambiar el medio cada día desde el día 10 en.
- La cultura las células transfected para 2-5 días. Luego cambiar a medio reprogramación de E8 complementado con 100 μm de butirato de sodio el día 3.
- Cosecha manual de colonias totalmente reprogramarlo para expansión clonal
- Totalmente reprogramadas colonias aparecen alrededor del día 14. Permiten colonias expandirse en tamaño y compacto. Puede ser manualmente seleccionados y transferidos a placas frescas tan pronto como el día 15-16.
- 1 h antes del procedimiento de selección, capa de placas de 24 pocillos con 8 μl de VTN en 300 μL de tampón de dilución de la vitronectina por pozo (1 μg/cm2) e incubar a RT o 37 ° C. Reemplazar la solución con medio E8 sin butirato.
- Seleccione colonias de un tamaño suficiente (idealmente más de 400 μm de diámetro) en un armario de cultivo estériles. Puede utilizar un microscopio de contraste de fase o un estereomicroscopio.
- Para cosecha, se utilizará un microscopio de proyección de imagen LCD en el gabinete desde su monitor elimina la necesidad de oculares. Esterilizar la platina del microscopio con etanol al 70%.
- Usando un microscopio de contraste de la fase regular de la célula cultura, seleccionar, marcar y tenga en cuenta el número de colonias a sus padres. Esto es importante para asegurarse de que no se desperdicia tiempo de este proceso durante la cosecha actual.
- Llenar una serie de tubos PCR que es igual o mayor que el número de colonias a sus padres con 30 μl de ácido etilendiaminotetracético de 0,5 mM (EDTA) en PBS. Las colonias se colocará en estos tubos para disociación parcial antes de la galjanoplastia.
- Plan para recoger 5 colonias a la vez de las placas con una pipeta de 10 μl a 2 μl. Mantenga la punta de la pipeta a un ángulo en el borde de la Colonia y poco a poco y cuidadosamente raspe la Colonia toda la superficie. Inmediatamente aspirar la colonia entera en la punta de la pipeta y transferir a uno de los tubos PCR preparados con EDTA.
- Repita con las restantes 4 colonias. Incubar a temperatura ambiente durante 4-6 minutos.
- Pipetear la suspensión hacia arriba y abajo con la ayuda de una pipeta más grande para dividir la Colonia en grupos más pequeños. Evite crear una suspensión unicelular.
- La suspensión de la placa directamente en un objetivo de una placa de 24 pocillos preparado en el paso 2.6.2. Repita con las colonias restantes.
- Repita los pasos 2.6.6 por 2.6.10 si más de 5 colonias a sus padres pero no escoger más de 5 colonias a la vez. Incubar a 37 ° C y 5% CO2.
- Expansión clonal y la maduración de iPSC
- Permitir que las colonias al crecer y volverse compacto. 3-6 días son suficientes. Cambiar diariamente el medio de cultivo. Utilizar entre 400 μl y 1 mL de medio de E8 basado en la densidad celular.
- Pocillos de la placa de 24 pocillos con una suficiente densidad de Colonia se ampliará en placas de 6 pocillos. 1 h antes de pases, cubrir las placas de 6 pozos con VTN (como en el paso 2.2.1). Cambie la solución en el pozo con 2 mL de medio de E8 por pozo.
- Aspire el medio gastado de los pozos fuente utilizando una pipeta de 1 mL y reemplazar con 300 μL de 0.5m EDTA para lavar. Aspirar inmediatamente utilizando la misma punta de pipeta y reemplace con 300 μL de EDTA 0,5 mM otra vez y luego incubar a temperatura ambiente por 5 min aspirar todo el líquido con una pipeta de 1 mL.
- Establece la pipeta de 1 mL en capacidad de montar una punta ancha de 1 mL en ella y aspirar el medio E8 de la blanco en la punta. Lavar la cultura iPSC con una corriente del medio.
- Transferir la suspensión a la pipeta hacia arriba y abajo varias veces para romper las colonias en grupos de 20-50 células blanco bien. Asegúrese de que Obten distribuidos uniformemente en el pozo por suave balanceo y agitación de la placa e incuban a 37 ° C y 5% CO2.
- Cambiar las medias diariamente y paso cada 3 a 4 días. Cualquier diferenciación de las colonias bajo el microscopio de contraste de fase se pueden marcar y eliminar con una pipeta en el gabinete de cultura. Esto permite la propagación selectiva de la cultura de iPSC puro de alta calidad.
- 1 h antes de pases, cubrir los pocillos de una placa de 6 pozos con VTN como en el paso 2.2.1. Cambie la solución con 2 ml de medio de E8 por pozo.
- Pases de rutina es similar a la inicial pases hace el usar 0.5 mM EDTA (pasos 2.7.2 a 2.7.5). Reemplazar el medio gastado en un pozo de una placa de 6 pozos con 1 mL de EDTA para lavar y desechar.
- Añadir 1 mL de EDTA e incubar a temperatura ambiente durante 5-7 min de disociación parcial. Optimizar el tiempo de incubación si es necesario, asegurándose de que una suspensión de alrededor de 20 a 50 células macizos se produce. Evitar la disociación en las células.
- Deseche la solución de EDTA y aspirar 1 mL del medio E8 usando una pipeta de 1 mL del blanco bien en una punta ancha.
- Lavar la cultura iPSC con una corriente del medio E8 repetidamente hasta que una parte de él fue liberada de la superficie y así la transferencia en el blanco. Esta parte representa el cociente de dividir (por ejemplo, 1/8 de la cultura se puede transferir para un cociente de 1:8.)
- Paso cada 3-4 días. Permite líneas de iPSC a madurar por les cultivo para por lo menos 15 pasos antes de utilizarlos en experimentos posteriores
3. Caracterización y confirmación de pluripotencia
Nota: Consulte los archivos complementarios para obtener más información sobre citometría de flujo y microscopia confocal.
-
Ensayo de formación de teratoma
- Para determinar la capacidad de diferenciarse en tejidos representativos de las tres capas del germen por análisis de la formación de teratoma de iPSC, siga las políticas institucionales en cuanto a uso, planeando dar tiempo a presentar el protocolo apropiado y cuidado animal documentos. La formación de teratoma en ratones tomará entre 6 a 10 semanas.
- 4 pocillos de una placa de 6 pozos por línea de iPSC de la cultura durante 4 días. El número aproximado de células inyectadas en un costado de un ratón es 0.5 a 1 x 106 células. Opcional: extra bien puede ser dedicada a determinar un número representativo de la célula en un pozo por medio de la disociación de unicelular con una enzima de la separación celular y contando.
- Calcular el volumen de la mezcla de E8/BMM se suspenderá en las matas de iPSC: se inyectan dos flancos de un ratón, cada uno con 150 μL de la suspensión de grupo. Tres ratones son suficientes para probar la formación de teratoma de una línea de iPSC. Incluyen una aguja extra 150 μL en el volumen resultante para compensar la pérdida de volumen muerto. se utiliza 1 aguja por ratón. El volumen total es por lo tanto 3 * (150 μL * 2 + 150 μL) = 1350 μl
- Disocian parcialmente las colonias de iPSC con EDTA como si fueran a ser pasados, como se describe en los pasos 2.7.8 a 2.7.10. Es importante que las colonias se disociaron en grupos y no se separa en células individuales.
- Lavado de las colonias de iPSC con 675 μl de medio de E8 (la mitad del volumen calculado en el paso 3.3.3), usando una punta ancha. Transferir la suspensión de la masa en un tubo de poliestireno de 5 mL. Coloque en hielo.
- Combinan con 675 μl de BMM. Mantenga la suspensión resultante en hielo hasta que la inyección.
- Anestesiar los ratones para inmovilizarlos con isoflurano. Esto debe realizada o guiada por personal especializado del vivero.
- Vórtice el poliestireno de 5 mL tubo brevemente y aspirar a la suspensión de grupo (450 μl por ratón) en una insulina jeringa equipada con una aguja de 22 G. Inyectar por vía subcutánea 150 μL de la suspensión de células. Este volumen contiene aproximadamente 1 x 106 células (ver paso 3.1.2).
- Inyectar 3 ratones por línea de iPSC. Siga las prácticas de cuidado animal para todos los procedimientos.
- Supervisar diariamente la salud de los ratones.
- Cuando los teratomas alcanzan un diámetro de extremo de 1,5 a 2 cm, eutanasia a los ratones, presentaron los teratomas y almacenarlos en solución de formalina para la fijación de tejido durante 24 h.
- Traer los teratomas fijados a una instalación de base de histología de hematoxilina eosina (H & E) tinción. Un patólogo que grado la presencia de tejidos de las tres capas del germen.
Nota para el Karyotyping: iPSC en culturas deben ser enviadas a especializados laboratorios citogenéticos para la prueba de la integridad del karyotype. Se recomienda que esta prueba se realiza cada 5 pasos.
-
Perfilamiento transcripcional
- La cultura 2 pocillos de una placa de 6 pozos para 3-4 días obtener una muestra de RNA. Utilice sólo las culturas de alta calidad, menor contaminación con diferenciación de las células puede ser abordada por raspado con una punta de la pipeta.
- Aislar el RNA de culturas de iPSC usando un kit comercial siguiendo el protocolo del fabricante. Enviar muestras a un centro especializado de base genómica.
- Obtener los perfiles transcripcionales globales de las líneas de iPSC usando microarrays (véase Tabla de materiales para las opciones compatibles) o secuencia de RNA.
- Enviar los archivos "*.idat" para la evaluación de Bioinformática de pluripotencia a través de una interfaz en línea en el Instituto Coriell. Por otra parte, presentar "* .cel" archivos de Bioinformática identificación del tipo de célula, incluyendo las células madre pluripotentes, a través de una interfaz en línea en la Universidad de Johns Hopkins. Véase Tabla de materiales para obtener información sobre los tipos de datos los análisis bioinformáticos individual acepten.
Resultados
Consentimiento informado se obtuvo de pacientes antes de la cosecha de líquido amniótico para realizar pruebas genéticas y dedicar una pequeña alícuota del líquido para la investigación. Ningún consentimiento es necesario para el uso de la membrana amniótica en la investigación como la placenta representa la eliminación de residuos. Amniótico líquido y membrana de las células madre mostrar propiedades mesenquimales típicos, morfológicamente las células son fusiformes y fase luminosa. Reprogramación, las células experimentan mesenquimal-a-epitelial (MET) transición y adquieran guijarro-como morfología y organización espacial de las colonias, indicando características epiteliales. Este proceso se inicia tan pronto como 48-72 h después de la introducción de plásmidos episomal de reprogramación. Ausencia de estas colonias por día 5 de reprogramación indica fracaso del experimento. Proliferan las células de las colonias MET y como resultado, las colonias se convierten en compactas, entre los días 5 y 14. Compacto MET de colonias se componen de células que no son discernibles fácilmente individualmente (figura 1A). En alrededor del día 14, colonias totalmente reprogramadas aparecen con las células dispuestas en una monocapa, con prominente, fácilmente discernibles núcleos y nucleolos. Están listos para ser mecánicamente aislado y ampliado cuando las colonias alcanzan un tamaño adecuado y se vuelven compactas (figura 1B).
Reprogramado completamente y parcialmente colonias están presentes en las culturas a lo largo de todo el período reprogramación, aunque parcialmente reprogramadas colonias no necesariamente adquiere completo pluripotencia. Figura 2 se muestra un representante de flujo análisis de citometría de la expresión de marcadores de células madre embrionarias (ESC) en completamente y parcialmente pluripotentes colonias y sus morfologías correspondientes. Pluripotencia completo se asocia con la expresión de Oct4, Nanog, Sox2, TRA antígenos y SSEA-4, mientras que la expresión de SSEA-1 es negativo19,20,21 (figura 2A). Parcialmente las células pluripotentes, sin embargo, no expresan Nanog y TRA antígenos20 (figura 2B). La expresión y localización de marcadores ESC deben confirmarse mediante inmunocitoquímica la coloración y fotografiada con un microscopio confocal o de campo amplio (figura 3).
Una confirmación funcional de la pluripotencia es alcanzada demostrando la capacidad de las líneas de iPSC de teratomas de forma después de la inyección subcutánea de las células en ratones scid-beige. 6-8 semanas son necesarios para que los teratomas a alcanzar el tamaño de punto final. H & E tinción de los tejidos y examinados por un patólogo se realiza para confirmar la presencia del representante de los tejidos de las tres capas del germen, endodermo, neuroectodermo y mesodermo (Figura 4A). Una alternativa a la experimentación con animales es analizar la firma transcripcional asociada a pluripotencia por acercamientos genomic como cDNA microarrays22,23. La proporción del perfil transcripcional que se superpone con una una piscina de iPSC bien establecida y ESC entonces puede ser cuantificada por el software de evaluación de pluripotencia bioinformáticas online en forma de una trama de dos clasificadores – pluripotencialidad y novedad (Figura 4B). La puntuación más alta la pluripotencia, el más la consulta iPSC línea se asemeja a las líneas establecidas. Una puntuación alta novedad, sin embargo, podría indicar desviaciones o aberraciones cromosómicas incluso, a pesar de una pluripotencia alta puntuación (tales como líneas de teratocarcinoma)22. Todas las líneas de iPSC generadas siguiendo el protocolo que presentamos han sido consideradas pluripotentes por citometría de flujo, la proyección de imagen, formación de teratoma y métodos de análisis transcripcional.

Figura 1: evolución morfológica de las células durante la reprogramación. (A) el líquido amniótico y células de la membrana, que representan las células fuente de reprogramación, mostrar una típica morfología mesenquimal, alargada y brillante fase (izquierda) hasta que la transición mesenquimal-a-epitelial (MET) que conduce a la adquisición de características epiteliales y formación de colonias con adoquín piedra-como las células (centro). Estas colonias proliferan y crean masas celulares irregulares de células MET (derecha). (B) en las etapas avanzadas de reprogramación (a partir de alrededor del día 14), colonias de células totalmente reprogramadas emergen – discernibles individualmente células con núcleos prominentes y nucleolos en monocapas, con bordes bien definidos (centro) y son presente junto a MET colonias que son más numerosos (izquierda). Un clon maduro aislado totalmente reprogramado se representa a la derecha. Barra de escala = 100 μm haga clic aquí para ver una versión más grande de esta figura.
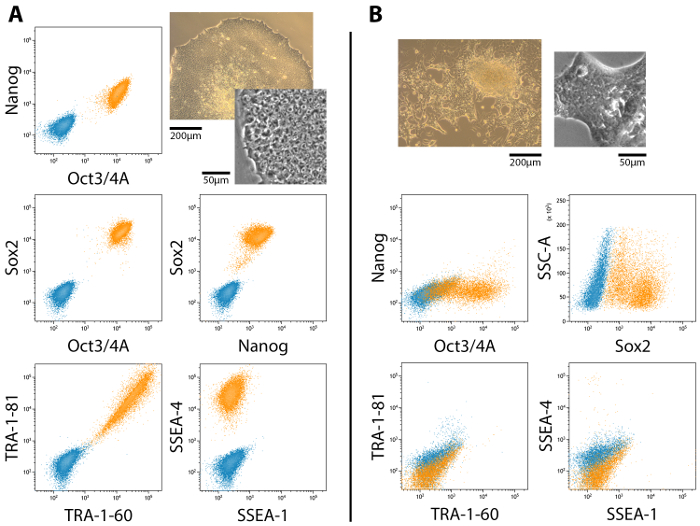
Figura 2: flujo de análisis de citometría de la expresión de marcadores ESC en completamente y parcialmente (MET) reprogramado colonias celular. (A) el perfil de expresión pluripotentes es positivo para Oct4, Nanog, Sox2, TRA-1-60, TRA-1-81 y SSEA-4, mientras que negativo para el SSEA-1. (B) parcialmente las colonias de células pluripotentes – aquellas que han sufrido el MET pero no ha podido progresar a pluripotencia completo – son positivas para el Oct4 y Sox2 pero Nanog, TRA y SSEA antígenos están ausentes. Las morfologías asociadas se incluyen para una comparación lado a lado. Barras de escala = 200 μm y 50 μm. haga clic aquí para ver una versión más grande de esta figura.
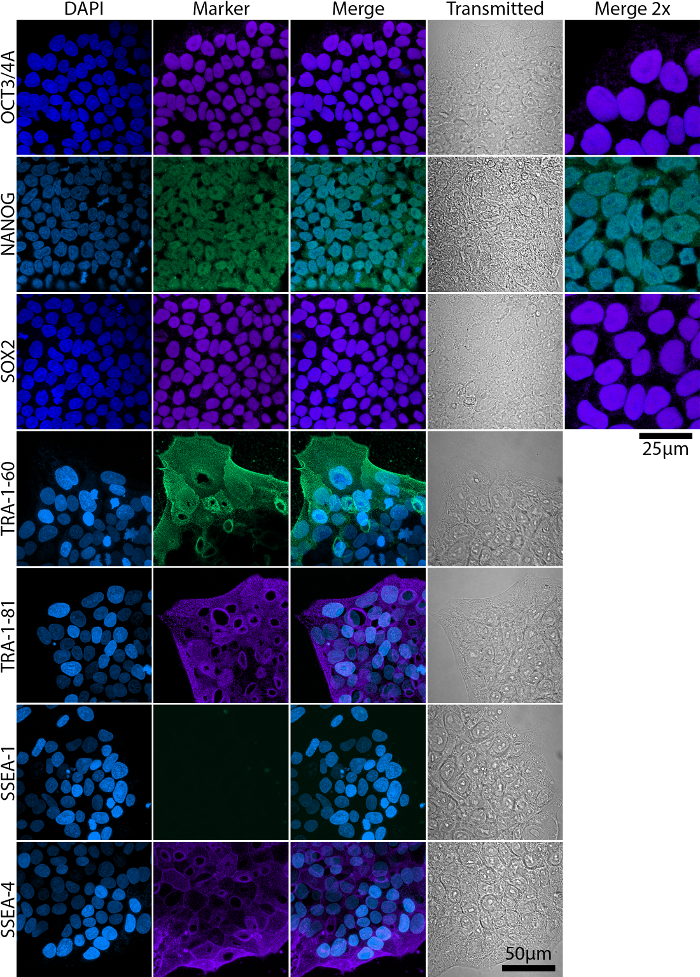
Figura 3: Análisis de la expresión de marcadores ESC en iPSC líquido amniótico maduro la proyección de imagen Confocal. Factores de transcripción Oct3/4A y Nanog, Sox2 se localizan en los núcleos mientras que TRA y SSEA antígenos son glucoproteínas localizadas en la membrana. Barra de escala = 50 μm. imágenes de mayor aumento (Merge 2 X) se incluyeron Oct3/4, Nanog y Sox2 para mejor visualización de su localización nuclear. Barra de escala = 25 μm. transmisión – imágenes adquiridas en luz transmitida. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: formación de Teratoma y perfiles transcripcionales en maduro iPSC líquido y membrana amniótica. (A) crecidos por vía subcutánea en ratones scid-beige los Teratomas contienen tejidos representativos de las tres capas germinales (100 aumentos). (B) los perfiles de microarrays de expresión global presentados a pluripotencia en línea software volvió una parcela de dos clasificadores, pluripotencia y la novedad. Pluripotencia altas puntuaciones y novedad baja puntuaciones - rojo nube - indican un perfil de expresión de una típica línea ESC/iPSC. La nube azul representa un área de racimo de células diferenciadas, mientras que la tenue nube azul representa un área de cluster para parcialmente las células pluripotentes. El líquido amniótico (3 líneas) y membrana (4 líneas) iPSC se consideran pluripotentes por la prueba. Una línea ESC WA25 se incluyó como control y se identifica aquí con una flecha negra. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La fase inicial de generación de iPSC de células madre fetales consiste en la extracción de las células de origen de los tejidos fetales, su cultura, la expansión y la introducción de la plásmidos reprogramación episomal. Esta fase es seguida por un período de cultivo de alrededor de 14-18 días antes de las primeras colonias totalmente reprogramadas pueden ampliarse. La última fase es la maduración de los clones de iPSC. La extracción inicial de las células de vástago de la membrana amniótica se consigue mediante una digestión enzimática y mecánica combinada de amnios. Encontramos que un tiempo de incubación de 30 minutos resultó en el mayor número de células extraídas con la más alta viabilidad. El procedimiento de digestión puede producir pequeños trozos de tejido y célula de nidos. Si la proporción de éstos en relación con las células es alta, se recomienda la galjanoplastia de todos los grupos y las células en un vaso puesto que todos pueden contribuir a crecimientos de células adherentes. Las células madre del líquido amnióticas de la galjanoplastia es sencilla ya que las células sólo mezcladas con el medio de cultivo se incubaron hasta colonias de células adherentes alcanzan un tamaño suficiente. Recipientes de plástico regular trata de cultivo de tejidos es perfectamente adecuado y no recomendamos superficies especiales, aunque se piensan para el cultivo celular primario mejorado, ya que con éstos se observaron menor viabilidades y dificultades con los pases proceso.
El amniótico madre líquido y membrana de las células deben ser ampliadas y las poblaciones de congelados pero, a la brevedad, las células se pueden utilizar como células fuente de reprogramación. Con el propósito de la introducción de plásmidos episomal en las células, el sistema de transfección usado aquí con los parámetros de la transfección a 950 V, ha desempeñado muy bien, con todas las líneas intentó en última instancia con éxito reprogramado (40 ms y 1 pulso más de 10 líneas). El sistema de competencia principal en un principio similar de funcionamiento no produjo un exitoso experimento de reprogramación en nuestras manos.
Se siembran las células transfected en platos recubiertos de vitronectina en medio de la AFMC durante los primeros 3-5 días, luego el medio se cambia a E8 con butirato de sodio de 100 μm. Esto aumenta la tasa de adquisición de pluripotencia completo. Los primeros signos de transformación morfológica pueden verse ya en 48-72 h. Las células de origen se someten al MET y aparecen colonias de células con morfología epitelial. Poco a poco éstos proliferan y convertido compactos. Un subconjunto de las colonias adquirirá las características morfológicas de totalmente pluripotentes células madre – células individualmente perceptibles con núcleos prominentes y nucleolos, colonias planas con bordes bien definidos, en contraposición a las difusas fronteras observan en parcialmente pluripotentes MET colonias. En el momento de la adquisición de pluripotencia completo, las colonias de células compactas MET adquieran núcleos prominentes y las células individuales a ser perceptibles durante la creación de un único patrón morfológico. Para un ojo entrenado, este patrón es un claro signo de reprogramación exitosa. Sin embargo, un investigador que carece de formación de cultura PSC, identificación de colonias que con éxito han progresado a pluripotencia completo requiere evaluación cuidadosa como clones de MET y iPSC pueden confundirse unos a otros. Figura 1 y figura 2 son ejemplos de ambos. Si MET clones son recogidas en su lugar, análisis de citometría de flujo cuidadoso revelará el error, y en particular, los antígenos TRA-1-60 y TRA-1-81 probablemente estará ausentes como se muestra en la figura 2. De hecho, antígenos TRA previamente fueron encontrados para ser marcadores de pluripotencia estrictas. Sin embargo, parcialmente MET de pluripotent células podrían ser de interés en la investigación de cáncer25.
Esta condición de cultura es subóptima para el origen de AFSC/sistema y eventualmente disminuirá su proliferación y adquieren una morfología plana, fibroblasto-como. Las células de origen forman tejidos que pueden separar de la superficie durante las etapas posteriores de la reprogramación, aunque esto no afecta negativamente el proceso de reprogramación. Por el contrario, el proceso conduce a veces a liberar espacio para las colonias reprogramadas, eliminando material celular sin reprogramadas no deseado. Separadas de los tejidos pueden desecharse fácilmente usando una pipeta estéril, dejando parcialmente y totalmente pluripotentes colonias, grandemente simplificando la selección manual aguas abajo.
Recolección manual de las colonias totalmente reprogramadas, utilizamos un LCD sistema, que puede ser colocado en el gabinete de seguridad de imagen, falta de partes sobresalga que perturban el flujo de aire. Que no sea de este sistema de proyección de imagen, ningún equipo especial es necesario que la cosecha se puede realizar utilizando pipetas regulares. Las colonias escogidas son parcialmente disociadas en la solución de EDTA/PBS antes de ser plateado en los pocillos del blanco para crecer como clones. Dependiendo de la línea y el clon, por varios pasajes, las culturas pueden estar contaminadas con espontáneamente diferenciando las células. Manipulación manual y pases serial generalmente eliminan este problema. Clones con extensa diferenciación deben descartarse, sin embargo, se pueden salvar preciosas clones con diversos grados de éxito mediante repetidas manual recolección de colonias pluripotentes en lugar de deshacerse de diferenciar las células. Episomal plásmidos fueron demostrados para tener alrededor de 15 pasajes a perderse totalmente de la iPSC26. Por lo tanto, es aconsejable permitir que los clones a crecer para por lo menos ese número de pasos antes de usar para aplicaciones posteriores análisis y, salvo la supervisión rutinaria de cariotipo y la expresión de antígeno TRA. Expresión del antígeno TRA fácilmente controlables mediante citometría de flujo como se describe aquí en el protocolo, puesto que el ensayo sólo necesita alrededor de 200.000 y puede realizarse siempre que los investigadores están en duda sobre si mantienen los clones cultivados pluripotencia correctamente. Análisis de citometría de flujo de la expresión del marcador ESC no se considera suficiente confirmar la pluripotencia en candidato líneas19.
Ensayo de formación de teratoma es el estándar de pluripotencia concluyente prueba27. PSC en condiciones químicamente definidas, xeno-libre son particularmente susceptibles a la disociación inducida por muerte y por lo tanto, les inyecta por vía subcutánea como grupos es necesaria para su éxito de la implantación8,28. Después de la inyección, 4-6 semanas suelen ser suficientes para el crecimiento de los xeno-injertos para ser visible y antes de la semana 8, todos pueden ser cosechadas, H & E-teñidas y analizadas. Bienestar de los animales, costo y tiempo pruebas períodos necesitadas son razones para el desarrollo de métodos alternativos. Análisis genómicos combinan con avanzada, máquina bioinformáticas desarrollado aprendizaje enfoques pueden proporcionar una evaluación precisa de perfiles de expresión global. El costo de obtener dichos datos es equiparable al costo de la prueba de formación de teratoma, sin embargo, el enfoque genómico es considerablemente más rápido y no los animales tienen que ser utilizados. Uno tales es un Bioinformático pluripotencia evaluación software22. Se implementa como una interfaz en línea (Tabla de materiales). La creciente popularidad y el costo de desplome de la voluntad de la secuencia de RNA garantizan la continuidad de este enfoque. Una alternativa a este software de pluripotencia en Johns Hopkins University23 (cellnet.hms.harvard.edu) y se basa en un enfoque similar y es capaz de aceptar datos de microarrays para analizar el transcriptoma de muestras humanas. La ventaja de este software es que tiene la capacidad de identificar no sólo células pluripotentes pero también células diferenciadas y, desde sus bases de datos curada se derivaron de tejidos primarios, el nivel de similitud entre las células in vitro crecido / pueden determinarse los tejidos y los tejidos in vivo , proporcionando un excelente control de calidad para el desarrollo de protocolos de diferenciación o de ingeniería de tejidos. La prueba tiene la capacidad para clasificar las consultas en 20 diferentes células o tipos de tejidos. En la actualidad, requiere datos de microarray pero los autores están trabajando para ampliar las opciones de plataforma ARN secuencia así.
Siguiendo el protocolo presentado, los investigadores pueden generar líneas de iPSC de amniótico líquido y membrana de las células madre con una muy alta reproducibilidad en medio totalmente químicamente definido y libre de xeno y utilizando un método de reprogramación no integración. Estas líneas se pueden utilizar en la investigación básica para optimizar protocolos de diferenciación y en última instancia en el modelado de la enfermedad, la droga tejido screening o pediátrico, estudios de ingeniería.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
Este trabajo fue apoyado por el Fonds Medizinische Forschung en la Universidad de Zurich, Forschungskredit de la Universidad de Zurich, la NMS SCIEXCh 10.216 becas y 12.176, la sociedad Suiza de Cardiología, la Swiss National Science Fundación bajo concesión [320030-122273] y [310030-143992], el 7 º Programa marco, válvula de vida, la Comisión Europea bajo Grant [242008], la Fundación de Mayenfisch Olga, la Fundación EMDO, la concesión inicial 2012 de la Hospital Universitario de Zurich, y financiamiento interno del Instituto de cáncer de Mitchell.
Materiales
| Name | Company | Catalog Number | Comments |
| Tumor Dissociation Kit, human | Miltenyi Biotec | 130-095-929 | tissue dissociation system, reagent kit, includes tissue dissociation tubes and tissue dissociation enzymes |
| gentleMACS Dissociator | Miltenyi Biotec | 130-093-235 | tissue dissociation system, dissociator |
| Thermo Scientific™ Shandon™ Disposable Scalpel No. 10, Sterile, Individually Wrapped, 5.75 (14.6cm) | Thermo-Fisher | 3120032 | |
| 70 µm cell strainers | Corning | 10054-456 | |
| RPMI 1640 medium | Thermo-Fisher | 32404014 | |
| rocking platform | VWR | 40000-300 | |
| 50 ml centrifuge tubes | Thermo-Fisher | 339652 | |
| 15 ml centrifuge tubes | Thermo-Fisher | 339650 | |
| EBM-2 basal medium | Lonza | CC-3156 | basal medium for AFMC medium |
| FGF 2 Human (expressed in E. coli, non-glycosylated) | Prospec Bio | CYT-218 | bFGF, supplement for AFMC medium |
| EGF Human, Pichia | Prospec Bio | CYT-332 | EGF, supplement for AFMC medium |
| LR3 Insulin Like Growth Factor-1 Human Recombinant | Prospec Bio | CYT-022 | IGF, supplement for AFMC medium |
| Fetal Bovine Serum, embryonic stem cell-qualified | Thermo-Fisher | 10439024 | FBS |
| Antibiotic-Antimycotic (100X) | Thermo-Fisher | 15240062 | for primary AFSC/AMSC, for routine AFSC/AMSC it should not be necessary, do not use in medium for transfected cells! |
| Accutase cell detachment solution | StemCell Technologies | 07920 | cell detachment enzyme |
| CryoStor™ CS10 | StemCell Technologies | 07930 | complete freezing medium |
| PBS, pH 7.4 | Thermo-Fisher Scientific | 10010023 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | for plasmid isolation |
| pEP4 E02S EN2K | Addgene | 20925 | EN2K, reprogramming factors Oct4+Sox2, Nanog+Klf4 |
| pEP4 E02S ET2K | Addgene | 20927 | ET2K, reprogramming factors Oct4+Sox2, SV40LT+Klf4 |
| pCEP4-M2L | Addgene | 20926 | M2L, reprogramming factors c-Myc+LIN28 |
| NanoDrop 2000c UV-Vis Spectrophotometer | Thermo-Fisher | ND-2000C | spectrophotometer |
| Neon® Transfection System | Thermo-Fisher | MPK5000 | transfection system, components: Neon pipette - transfection pipette Neon device - transfection device |
| Neon® Transfection System 10 µL Kit | Thermo-Fisher | MPK1025 | consumables kit for the Neon Transfection System, it contains: Neon tip - transfection tip Neon tube - transfection tube buffer R - resuspension buffer buffer E - electrolytic buffer |
| Stemolecule™ Sodium Butyrate | StemGent | 04-0005 | small molecule enhancer of reprogramming |
| TeSR-E8 | StemCell Technologies | 05940 | E8 medium |
| Vitronectin XF™ | StemCell Technologies | 07180 | VTN, stock concentration 250 µg/ml, used for coating at 1 µg/cm2 in vitronectin dilution (CellAdhere) buffer |
| CellAdhere™ Dilution Buffer | StemCell Technologies | 07183 | vitronectin dilution buffer |
| UltraPure™ 0.5M EDTA, pH 8.0 | Thermo-Fisher | 15575020 | dilute with PBS to 0.5 mM before use |
| EVOS® FL Imaging System | Thermo-Fisher Scientific | AMF4300 | LCD imaging microscope system |
| CKX53 Inverted Microscope | Olympus | phase contrast cell culture microscope | |
| Pierce™ 16% Formaldehyde (w/v), Methanol-free | Thermo-Fisher | 28908 | dilute to 4% with PBS before use, diluted can be stored at 2-8 °C for 1 week |
| Perm Buffer III | BD Biosciences | 558050 | permeabilization buffer, chill to -20 °C before use |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 557782 | isotype control for Oct3/4A, Nanog |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 557783 | isotype control for Sox2 |
| Mouse anti-human Oct3/4 (Human Isoform A), Alexa Fluor® 488 | BD Biosciences | 561628 | |
| Mouse anti-human Nanog, Alexa Fluor® 488 | BD Biosciences | 560791 | |
| Mouse anti-human Sox-2, Alexa Fluor® 647 | BD Biosciences | 562139 | |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 401617 | isotype control for TRA-1-60 |
| Mouse IgGM, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401618 | isotype control for TRA-1-81 |
| Mouse anti-human TRA-1-60, Alexa Fluor® 488 | BD Biosciences | 330613 | |
| Mouse anti-human TRA-1-81, Alexa Fluor® 647 | BD Biosciences | 330705 | |
| Mouse IgG1, κ Isotype Control, Alexa Fluor® 488 | BD Biosciences | 400129 | isotype control for SSEA-1 |
| Mouse IgG3, κ Isotype Control, Alexa Fluor® 647 | BD Biosciences | 401321 | isotype control for SSEA-4 |
| Mouse anti-human SSEA-1, Alexa Fluor® 488 | BD Biosciences | 323010 | |
| Mouse anti-human SSEA-4, Alexa Fluor® 647 | BD Biosciences | 330407 | |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 488 | Jackson Immunoresearch | 115-606-068 | use at a dilution of 1:600 or further optimize |
| Affinipure F(ab')2 Fragment Goat Anti-Mouse IgG+IgM, Alexa Fluor® 647 | Jackson Immunoresearch | 115-546-068 | use at a dilution of 1:600 or further optimize |
| DAPI | Thermo-Fisher Scientific | D21490 | stock solution 10 mM, further dilute to 1:12.000 for a working solution |
| Corning® Matrigel® Growth Factor Reduced, Phenol Red-Free | Corning | 356231 | basement membrane matrix (BMM) |
| scid-beige mice, female | Taconic | CBSCBG-F | |
| RNeasy Plus Mini Kit (50) | Qiagen | 74134 | RNA isolation kit |
| T-25 flasks, tissue culture-treated | Thermo-Fisher | 156367 | |
| T-75 flasks, tissue culture-treated | Thermo-Fisher | 156499 | |
| Nunc™ tissue-culture dish | Thermo-Fisher | 12-567-650 | 10 cm tissue culture dish |
| 6-well plates, tissue-culture treated | Thermo-Fisher | 140675 | |
| Neubauer counting chamber (hemacytometer) | VWR | 15170-173 | |
| Mr. Frosty™ Freezing Container | Thermo-Fisher | 5100-0001 | freezing container |
| FACS tubes, Round Bottom Polystyrene Test Tube, 5ml | Corning | 352058 | 5 ml polystyrene tubes |
| Eppendorf tubes, 1.5 ml | Thermo-Fisher | 05-402-96 | 1.5 ml microcentrifuge tubes |
| PCR tubes, 200 µl | Thermo-Fisher | 14-222-262 | |
| pipette tips, 100 to 1250 µl | Thermo-Fisher | 02-707-407 | narrow-bore 1 mL tips |
| pipette tips, 5 to 300 µl | Thermo-Fisher | 02-707-410 | |
| pipette tips, 0.1 to 10 µl | Thermo-Fisher | 02-707-437 | |
| wide-bore pipette tips, 1000 µl | VWR | 89049-166 | wide-bore 1 mL tips |
| glass Pasteur pipettes | Thermo-Fisher | 13-678-20A | |
| ethanol, 200 proof | Thermo-Fisher | 04-355-451 | |
| vortex mixer | VWR | 10153-842 | |
| chambered coverglass, 8-well, 1.5mm borosilicate glass | Thermo-Fisher | 155409 | glass-bottom confocal-grade cultureware |
| 22G needles | VWR | 82002-366 | |
| insulin syringes | Thermo-Fisher | 22-253-260 | |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | fixation of explanted teratomas |
| Illumina HT-12 v4 Expression BeachChip | Illumina | BD-103-0204 | expression microarray, supported by PluriTest, discontinued by manufacturer |
| PrimeView Human Genome U219 Array Plate | Thermo-Fisher | 901605 | expression microarray (formerly Affymetrix brand), soon to be supported by PluriTest |
| GeneChip™ Human Genome U133 Plus 2.0 Array | Thermo-Fisher | 902482 | expression microarray (formerly Affymetrix brand), supported by CellNet, soon to be supported by PluriTest |
| PluriTest® | Coriell Institute | www.pluritest.org, free service for bioinformatic assessment of pluripotency, accepts microarray data - *.idat files from HT-12 v4 platform, soon to support U133, U219 microarray and RNA sequencing data | |
| CellNet | Johns Hopkins University | cellnet.hms.harvard.edu, free service for bioinformatic identification of cell type, including plutipotent stem cells, based on U133 microarray data - *.cel files, soon to support RNA sequencing data |
Referencias
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Yu, J., et al. Induced Pluripotent Stem Cell Lines Derived from Human Somatic Cells. Science. 318 (5858), 1917-1920 (2007).
- Trounson, A., DeWitt, N. D. Pluripotent stem cells progressing to the clinic. Nat. Rev. Mol. Cell Biol. 17 (3), 194-200 (2016).
- Schmidt, D., et al. Prenatally fabricated autologous human living heart valves based on amniotic fluid derived progenitor cells as single cell source. Circulation. 116 (11 Suppl), I64-I70 (2007).
- Weber, B., Zeisberger, S. M., Hoerstrup, S. P. Prenatally harvested cells for cardiovascular tissue engineering: Fabrication of autologous implants prior to birth. Placenta. 32, S316-S319 (2011).
- Weber, B., et al. Prenatally engineered autologous amniotic fluid stem cell-based heart valves in the fetal circulation. Biomaterials. 33 (16), 4031-4043 (2012).
- Kehl, D., Weber, B., Hoerstrup, S. P. Bioengineered living cardiac and venous valve replacements: current status and future prospects. Cardiovasc. Pathol. 25 (4), 300-305 (2016).
- Slamecka, J., et al. Non-integrating episomal plasmid-based reprogramming of human amniotic fluid stem cells into induced pluripotent stem cells in chemically defined conditions. Cell Cycle. 15 (2), 234-249 (2016).
- Jiang, G., et al. Human Transgene-Free Amniotic-Fluid-Derived Induced Pluripotent Stem Cells for Autologous Cell Therapy. Stem Cells Dev. 23 (21), 2613-2625 (2014).
- Pipino, C., et al. Trisomy 21 mid-trimester amniotic fluid induced pluripotent stem cells maintain genetic signatures during reprogramming: implications for disease modeling and cryobanking. Cell. Reprogram. 16 (5), 331-344 (2014).
- Cai, J., et al. Generation of human induced pluripotent stem cells from umbilical cord matrix and amniotic membrane mesenchymal cells. J Biol. Chem. 285 (15), 11227-11234 (2010).
- Ge, X., et al. Human Amniotic Mesenchymal Stem Cell-Derived Induced Pluripotent Stem Cells May Generate a Universal Source of Cardiac Cells. Stem Cells Dev. 21 (15), 2798-2808 (2012).
- Drozd, A. M., Walczak, M. P., Piaskowski, S., Stoczynska-Fidelus, E., Rieske, P., Grzela, D. P. Generation of human iPSCs from cells of fibroblastic and epithelial origin by means of the oriP/EBNA-1 episomal reprogramming system. Stem Cell Res. Ther. 6 (1), (2015).
- Kang, N. -. H., et al. Potential antitumor therapeutic strategies of human amniotic membrane and amniotic fluid-derived stem cells. Cancer Gene Ther. 19 (8), 517-522 (2012).
- Moschidou, D., et al. Valproic Acid Confers Functional Pluripotency to Human Amniotic Fluid Stem Cells in a Transgene-free Approach. Mol. Ther. 20 (10), 1953-1967 (2012).
- Kim, K., et al. Epigenetic memory in induced pluripotent stem cells. Nature. 467 (7313), 285-290 (2010).
- Chen, G., et al. Chemically defined conditions for human iPSC derivation and culture. Nature Methods. 8 (5), 424-429 (2011).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324 (5928), 797-801 (2009).
- Martí, M., et al. Characterization of pluripotent stem cells. Nat. Protoc. 8 (2), 223-253 (2013).
- Chan, E. M., et al. Live cell imaging distinguishes bona fide human iPS cells from partially reprogrammed cells. Nat. Biotechnol. 27 (11), 1033-1037 (2009).
- Adewumi, O., et al. Characterization of human embryonic stem cell lines by the International Stem Cell Initiative. Nat. Biotechnol. 25 (7), 803-816 (2007).
- Müller, F. -. J., et al. A bioinformatic assay for pluripotency in human cells. Nature Methods. 8 (4), 315-317 (2011).
- Cahan, P., Li, H., Morris, S. A., Lummertz da Rocha, E., Daley, G. Q., Collins, J. J. CellNet: Network Biology Applied to Stem Cell Engineering. Cell. 158 (4), 903-915 (2014).
- Schopperle, W. M., DeWolf, W. C. The TRA-1-60 and TRA-1-81 Human Pluripotent Stem Cell Markers Are Expressed on Podocalyxin in Embryonal Carcinoma. STEM CELLS. 25 (3), 723-730 (2007).
- Ohnishi, K., et al. Premature Termination of Reprogramming In Vivo Leads to Cancer Development through Altered Epigenetic Regulation. Cell. 156 (4), 663-677 (2014).
- Schlaeger, T. M., et al. A comparison of non-integrating reprogramming methods. Nature Biotechnology. 33 (1), 58-63 (2014).
- Müller, F. -. J., Goldmann, J., Löser, P., Loring, J. F. A call to standardize teratoma assays used to define human pluripotent cell lines. Cell Stem Cell. 6 (5), 412-414 (2010).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat. Protoc. 7 (11), 2029-2040 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados