Method Article
次世代シーケンシングのための収集と唾液DNAの抽出
要約
DNA extraction from saliva can provide a readily available source of high molecular weight DNA, with little to no degradation/fragmentation. This protocol provides optimized parameters for saliva collection/storage and DNA extraction to be of sufficient quality and quantity for downstream DNA assays with high quality requirements.
要約
The preferred source of DNA in human genetics research is blood, or cell lines derived from blood, as these sources yield large quantities of high quality DNA. However, DNA extraction from saliva can yield high quality DNA with little to no degradation/fragmentation that is suitable for a variety of DNA assays without the expense of a phlebotomist and can even be acquired through the mail. However, at present, no saliva DNA collection/extraction protocols for next generation sequencing have been presented in the literature. This protocol optimizes parameters of saliva collection/storage and DNA extraction to be of sufficient quality and quantity for DNA assays with the highest standards, including microarray genotyping and next generation sequencing.
概要
ヒト遺伝子研究のための高品質のDNAを得ることは、疾患遺伝子発見プロセスに不可欠である。血液は、侵襲的処置を必要とし、また、唾液収集よりも高価であるものの、機能的研究のためのDNA、またはiPS細胞の無限の供給源として不死化細胞株を作成するために好まれ、そして細胞株が利用できない場合、時には血液DNAが使用される。しかし、血液を得ることは訓練された瀉血専門医を必要とし、血液、唾液1より短い半減期を有する。それによりよく病院や研究室2の集水域を越えて潜在的な対象プールを増加、瀉血専門医を必要とせずにメールを介して収集して送信することができますので、唾液からのDNAを、安価で入手が容易である。被験者はその代わりに、血液3,4の唾液試料を提供するオプションを有する場合、研究登録を向上させることができる。唾液からのDNAの量と質についての懸念は、その広範なたちが限られている可能性唾液2、3、4、5、かなりの量を取得しなかった古い頬スワブ法よりもDNA検査のためのミリリットル当たり4.3×10 5細胞の平均で、全唾液の適合性を示す多くの研究の最近の研究にもかかわらず、電子、ささやかな文献は、マイクロアレイに基づく方法8,9,10を含むジェノタイピングアプリケーション用の全唾液由来のDNAの適合性を示す存在するが6。、何の研究では、次世代シーケンシング(NGS)を検討していない。この全体の唾液のDNA抽出プロトコルを最適化するための目標は、簡単に一般的な試薬や消耗品研究所で実施され、コスト効果の高い方法で遺伝学·アプリケーションの量と質を最大にすることであった。
1)収集および記憶、2)細胞溶解、3)RNase処理、4)タンパク質沈殿、5)エタノール沈殿、6)DNAの再水和:唾液からのDNA抽出は、いくつかの手順が必要である。記載のDNA安定化緩衝液、以前2、変更することなく十分に機能します。 RNase処理とDNA再水和工程を最適化する試みはなされなかった。残りの各ステップについては、歩留まりに影響を与える可能性がいくつかの変数を同定した。各変数は、個別に操作され、収量と品質の改善が統計的に評価した。収率および/またはDNAの質を改善することが示された変数の場合、最適値は、最終的なプロトコールに含めた。
プロトコル
注:前に唾液サンプルを提供するために、すべての被験者は、全国の小児病院でのヒト対象の治療のためのガイドラインに準拠したインフォームドコンセントを与えた。
1唾液の収集と保管
- 唾液収集の前に、被験者の口は、被験者が水で彼らの口をすすぎ有し、食べないように、またはサンプルを収集する前に、30分間、飲むことによって食物やその他の異物がないことを保証する。
- 必ずキャップやチューブの内側に触れないようにすること、DNAの安定化緩衝液2の2.5ミリリットルと15ミリリットルの遠心管を開き、被写体が緩衝溶液中に唾液の2.5ミリリットルを吐くがある。注:唾液以上の2.5ミリリットルを収集するには、サンプルの不十分な比率からのDNAの安定化バッファにサンプルの劣化につながることができます。少なすぎる唾液を収集するプロトコルから、期待利回りが低下します。収集量を評価するために、tの側の偶数勾配を使用し彼はチューブ。
- キャップを元に戻し、混合物を均質化されるまで転倒混和。激しく振盪は必要ありません。短期保存または長期保存のために4°C(> 3ヶ月)のための室温でサンプルを記憶する。
2。初期準備と細胞溶解
- 抽出を開始する前に、37℃に水浴を加熱し、氷のバケツを用意。三つ15ミリリットルの円錐遠心管に抽出された各サンプルのために必要とされる。 3本のチューブは、細胞およびタンパク質ペレットを、最終的な抽出のgDNA、イソプロパノールおよびエタノール上清を保持するために使用される。
- 15秒間、次に中程度の速度で渦をストレージからのサンプル、及び転化サンプル数回を取得します。
- 清潔な15mlの遠心管にサンプル2.5mlの分注、および細胞溶解溶液の5ミリリットルを追加。反転によって試料を50回混合し、室温で30分間インキュベートする。
3 RNAの取り外し
- RNase Aをソルの40μl添加100 mg / mlの少なくともution、15分間37℃でインキュベートする。
- 37℃の水浴からサンプルを取り出し、3分間氷上で冷却する。
- RNアーゼAのインキュベーション後、プロトコルのDNAの再水和工程のために65℃の水浴の温度を上昇させる。
4。タンパク質および脂質の除去
- 、ミリリットル/ 20 mgのでプロテイナーゼK溶液50μLを追加逆さにして数回混合し、最低30分間RTでインキュベートする。注:これは、プロトコルのための可能なポーズポイントです。抽出が完了できるまで、プロテイナーゼK溶液を加えた後、試料を4℃で保存することができる。最大24時間、4℃での貯蔵は、抽出収率またはDNAの質に大きな影響を有することが示されなかった。この段階での長期保管は、評価されていない。
- タンパク質沈殿溶液、高速で20秒間激しくボルテックスし、氷上で10分間場所の1.7ミリリットルを追加します。
- サンプルを10分間、3000×gで10分間遠心分離し、4℃、氷上で冷却した後。沈殿したタンパク質は、継続して固いペレットを形成しなければならない。ペレットがタイトではないか、解決策はまだ濁っている場合には、サンプルはより5分間氷上で冷却することができるし、遠心分離を繰り返した。サンプルは固いペレットを確実にするために氷上に保持されなければならない。
gDNAの5。単離および精製
- 清潔な15mlの遠心管に、ピペットイソプロパノール5mlのおよび20mg / mlの純粋なグリコーゲンソリューション8μlの。
- 沈殿したタンパク質ペレットを残し、イソプロパノールおよびグリコーゲン溶液を含むチューブにステップ4.3からのgDNAを含む上清を注ぐ。上清が添加された後、穏やかに3000×gで、4℃で30分間反転遠心によって試料を50回混合する。
- 清潔な15mlチューブにゆっくりと上澄みを注ぐ。上清を除去した後、70%エタノールを1ml加えるゆっくりと揺れ、ゆっくりと沈殿したペレットを数回にわたってエタノールを移動させることにより、ペレットを洗浄。チューブ内のエタノールを保持します。
- 最初の洗浄の後、2000×gで、20℃で1分間のサンプルを集める。この遠心分離工程は、4℃または20℃のいずれかで行うことができる。温度の有意な影響は、このステップのために示されていない。
- ペレットの最初の洗浄および遠心分離した後、ゆっくりとステップ5.3および5.4を繰り返して二回目の洗浄を行い、その後、チューブからエタノール洗浄を注ぐと捨てる。
- 二回目の洗浄から上清を除去した後、15分間空気乾燥ペレットを可能にする。
- 試料が完全に乾燥していない場合、さらに15分間空気乾燥。
gDNAの6。再水和
- サンプルが乾燥した後、乾燥させたgDNAペレットを再水和するトリス-EDTAを300μlを追加。
- 中程度の速度と場所で5秒間のボルテックスのサンプル1時間65℃の湯浴。
- 水浴からサンプルを取り出し、室温でO / Nインキュベートする。
注:すべての製 品および試薬材料表にリストされて使用されるだけでなく、 表4。
結果
DNAは対になったDNA抽出のシリーズが行われた抽出のための最適なパラメータを決定すること。単一の唾液試料は、与えられた変数のための2つの可能な値の一つで分割し、各部分を試験した。各ペアの試験のうち、少なくとも8回の反復は、( 例えば 、単一の唾液サンプルを用いて、初期50℃でのインキュベーションない場合の両方の抽出をテストするために等分した)を実施した。断片化を評価するために、総DNA収量、260/280値、260/230値、および泳動DNAの目視検査:最適化は、標準的な4つの測定基準に基づいていた。変数のすべてではない可能性のある組み合わせは、個別に各変数の限界効果を評価するために代わりに選ぶ、(N = 169の組み合わせ)の統計的な相互作用を評価した。効果は、マルチウェイ反復測定ANOVAを用いて試験し、推定効果は同等の回帰式から誘導した。すべての重要な効果は、AVERとして示し、 表1に要約されている歩留まりの年齢変化やDNAの質(260/280と260/230)(唾液入力の1mlあたりngの/μl)を。
蓄積バッファによって媒介されるプロテイナーゼK分解および細胞溶解が完了するまで行ったことを確認するために細胞溶解1)50°Cのインキュベーション(1時間)の存在下/非存在は、従来、2:細胞溶解(ステップ2)を評価することによって最適化された)工程(中速、15秒)、3)溶解溶液のインキュベーション時間(5〜30対分)ボルテックスすることにより均質化の存在/不在。 30分間の細胞溶解のインキュベーションは、3.5%の平均た(p <0.01)によって収量を増加させたが、他の細胞溶解変数は、収量に有意な影響を及ぼさなかった。ボルテックスは、統計学的に有意な(p <0.001)が、0.03実用的に小さなことで260/280比率を減少させた。
タンパク質沈殿(工程4)は、アミノ酸鎖を破壊するためにプロテイナーゼK消化によって先行タンパク質沈殿の効率を向上させ、捕捉されたDNAを放出される。プロテイナーゼKの量は10倍に変化させた。遠心分離温度が4°Cまで20°Cで還元した。プロテイナーゼKの量を増加させると、収率の統計的に有意な減少(8.7%)を引き起こし、また、若干の両方260/280と260/230比を改善した。
エタノール沈殿(ステップ5)を調べ、プロトコルの最終段階でした。総遠心分離時間(5対30分11)があったとしてグリコーゲンキャリヤ(0,8μl)の量は、変化させた。専用の遠心時間が大幅に290パーセントの平均増加で、歩留まりに影響を与えた。長いスピンも260/280比わずかに(0.05)減少した。収量にグリコーゲンの有意な影響は実験の間に観測されなかった。これらの抽出中のDNAの総量のにグリコーゲンは、一般的に使用されないように十分に大きかった。これらのサンプル中の効果の欠如にもかかわらず、それはまだ唾液入力音量がここかTHER場合、指定されたよりも低いときはいつでも収量の減少のリスクを最小限に抑えるためにグリコーゲンを使用することをお勧めしますeは収率が低くなると信じる他の理由である。
代表的なDNA試料の目視検査( 図1)は、抽出されたDNAが大幅に任意の唾液DNA抽出手順のために断片化されなかったことを示し、むしろ劣化したDNAを示すにじみなく、適切な高分子量のバンドを示した。 RNアーゼA消化した後、プロトコルは、1.74の平均260/280を生成した。
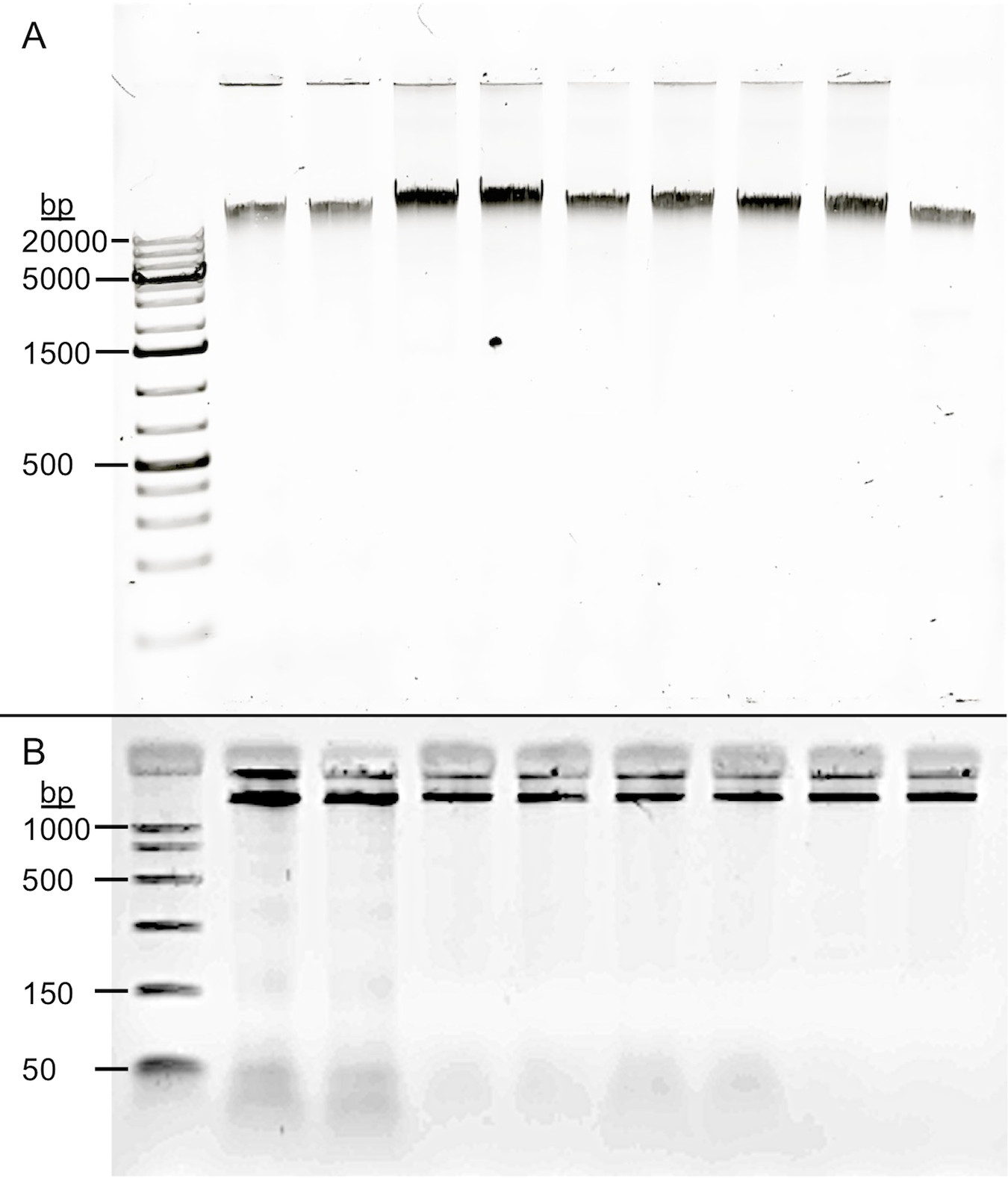
唾液由来のDNAの図1品質フォー抽出手順は、同一の唾液収集に適用した。 (A)試料を、0.8%アガロースゲル(250ngのDNA)中で電気泳動した。唾液DNA抽出プロトコルのすべてのバリエーションは、分解の証拠を有する高分子量(> 20キロバイト)DNAをもたらす。レーン:1 DNA laddeR、2&3 OrageneピットL2P議定書サンプル、4&5 Gentraでプロトコールとトラブルシューティング体液プロトコル、6&7に最適化されたRNA除去工程なしのプロトコル、8&9 RNA削除ステップで最適化されたプロトコル。レーン2-7は、同じ唾液サンプルに直接的に類似したプロトコルである。レーン8および9は、RNA除去工程は、DNAの分解をもたらさないことを示している。 (B)サンプルを、2%アガロースゲル(150ngのDNA)中で電気泳動した。わずかなRNAのピークはレーン7(上記の規則)を介して2でゲルの底部近くに観察可能である。レーン8および9は、RNA除去工程の有効性を示す。
RNA除去工程(RNase Aでステップ3)は、DNAの正確な定量化のために重要である。量子ビット2.0蛍光光度計によって測定されたRNAの二本鎖DNAの比によって決定されるようにテスト中に、一貫して高いRNA含量は、観察された。平均すると、RNase Aを処理していないサンプルからの核酸含有量は、RN(±0.4)46.6%から成っ量子ビットのRNA検出のための可能な限り低い読書です」<20 / mlの」と読み、RNA除去工程を、受けたA.サンプル。
追加のRNA分解酵素ステップが適用されたときに、この最適化されたプロトコルを介して得られたDNAは、高スループット配列決定のために十分な品質であった。標的リシークエンシングデータを得るために、カスタムアジレントSureSelectターゲット濃縮キットは、シーケンスの2.6 Mbのターゲッティング、24サンプルに適用した。ハイスループット配列決定は、12バーコード(インデックス化)レーンあたりのサンプルについて行った。シーケンスは、GATK 13塩基品質スコアの再較正、インデル再編、重複削除、SNPの発見と全24のサンプルで同時に遺伝子型決定の後、アプリケーションがベストプラクティスハードフィルタリングパラメータを用いて行ったhg19のリファレンスゲノム12にBWA整合された読み込み14値 。すべての24の試料は、高品質NGSデータ( 表2)を得た。のIlluに合格したことを読み取るミナの標準フィルタとQを持っていた> 20、各サンプルウェル内のレアSNP発見のため必要な限度内で、Q> 100で> 30倍のカバレッジの平均オンターゲットのカバレッジの深さを提供する、一連の濃縮標的領域に合わせ91.4%。平均ストランド収支は49.9%であった。イルミナマイクロアレイ遺伝子型を有する変異コールを比較すると、98.9%の一致が得られた。
| 候補変数 | NG /μL | 260/280 | 260/230 |
| ボルテックス | ナノ秒 | -0.03 *** | ナノ秒 |
| 細胞溶解インキュベーション分X30 | 3.5%** | ナノ秒 | ナノ秒 |
| プロテイナーゼK×10 | -8.7%* | -0.05 *** | -0.03 *** |
| 30分のスピン | 290.2パーセント*** | -0.05 *** | ナノ秒 |
| グリコーゲン | ナノ秒 | ナノ秒 | -0.37 *** |
数量/品質メトリクスに最適化された変数の表1効果量。全ての効果の大きさは、列のヘッダーに記載されている単位になります。 ANOVAからのp値:* pの<0.05; ** P <0.01; ***はp <0.001; nsの有意ではない
| 品質メトリック | 値 |
| ターゲットの長さ | 1708キロバイト |
| ターゲット> 30X屋根 | 85.22パーセント |
| dbSNPの中のSNP | 92.55パーセント |
| アレイ合意 | 98.99パーセント |
ターゲット濃縮から高スループットシーケンスの表2の品質。
| 新しい最適化されたプロトコル | アイテム | ディストリビューター | カタログ# | 購買単位 | コスト/ユニット | コスト/コレクション |
| 15ミリリットルの遠心管 | フィッシャー | 12-565-268 | 500チューブ | 233.50ドル | 3.2690ドル | |
| 細胞溶解ソリューション | キアゲン | 158908 | 1 L | 401.00ドル | 3.2080ドル | |
| プロテイナーゼK | シグマ | P6556 | 1グラム | 713.00ドル | 1.5686ドル | |
| タンパク質沈殿ソリューション | キアゲン | 158912 | 350ミリリットル | 350.00ドル | 2.7200ドル | |
| イソプロパノール | フィッシャー | A416-4 | 4×4リットルの事例 | 486.71ドル | 0.2434ドル | |
| グリコーゲン溶液(20 mg / ml)を | EZ-バイオリサーチ | S1003 | 1ミリリットル | 51.00ドル | 0.8160ドル | |
| 70%エタノール | フィッシャー | 04-355-305 | 4×1ガロンのケース。 | 123.03ドル | 0.0325ドル | |
| トリス-EDTA(TE) | フィッシャー | BP2473-1 | 1 L | 68.67ドル | 0.0412ドル | |
| NaClを | フィッシャー | AC194090010 | 1キロ | 34.65ドル | 0.000004ドル | |
| トリスHCl | フィッシャー | BP1757-100 | 100ミリリットル | 57.84ドル | 0.0116ドル | |
| EDTA(0.5M)ソリューション | フィッシャー | 03-500-506 | 100ミリリットル | 33.60ドル | 0.0134ドル | |
| ナトリウムドッドecyl硫酸 | フィッシャー | BP166-100 | 100グラム | 59.95ドル | 0.0060ドル | |
| 総費用 | 11.93ドル | |||||
| Oragene | アイテム | ディストリビューター | カタログ# | 購買単位 | コスト/ユニット | コスト/コレクション |
| 15ミリリットルの遠心管 | フィッシャー | 12-565-268 | 500チューブ | 233.50ドル | 0.9340ドル | |
| 100%エタノール | フィッシャー | BP2818-100 | 100ミリリットル | 34.29ドル | 1.6459ドル | |
| 70%エタノール | フィッシャー | 04-355-305 | 4×1ガロンのケース。 | 123.03ドル | 0.0081ドル | |
| トリス-EDTA(TE) | フィッシャー | BP2473-1 | 1 L | 68.67ドル | 0.0687ドル | |
| 1.5mlチューブ | ジェネシー川 | 22-281A | 500チューブ | 22.85ドル | 0.0457ドル | |
| Orageneコレクションキット | Oragene | OG-500 | 1 | 25.00ドル | 25.00ドル | |
| 総費用 | 27.70ドル | |||||
| とトラブルシューティング | アイテム | ディストリビューター | カタログ# | 購買単位 | コスト/ユニット | コスト/コレクション |
| 15ミリリットルの遠心管 | フィッシャー | 12-565-268 | 500チューブ | 233.50ドル | 0.9340ドル | |
| 細胞溶解ソリューション | キアゲン | 158908 | 1 L | 401.00ドル | 4.0100ドル | |
| プロテイナーゼK | キアゲン | 158918 | 650ミリリットル | 73.10ドル | 7.8723ドル | |
| タンパク質沈殿ソリューション | キアゲン | 158912 | 350ミリリットル | 350.00ドル | 4.0000ドル | |
| イソプロパノール | フィッシャー | A4164 | 4×4リットルの事例 | 486.71ドル | 0.3650ドル | |
| グリコーゲンソリューション | キアゲン | 158930 | 500ミリリットル | 64.30ドル | 2.5720ドル | |
| 70%エタノール | フィッシャー | 04-355-305 | 4×1ガロンのケース。 | 123.03ドル | 0.0975ドル | |
| のDNA Hydration Solution | キアゲン | 158914 | 100ミリリットル | 69.80ドル | 0.1396ドル | |
| NaClを | フィッシャー | AC19409-0010 | 1キロ | 34.65ドル | 0.000004ドル | |
| トリスHCl | フィッシャー | BP1757-100 | 100ミリリットル | 57.84ドル | 0.0116ドル | |
| EDTA(0.5M)ソリューション | フィッシャー | 03-500-506 | 100ミリリットル | 33.60ドル | 0.0134ドル | |
| ドデシル硫酸ナトリウム | フィッシャー | BP166-100 | 100グラム | 59.95ドル | 0.0060ドル | |
| 総費用 | 19.99ドル |
他の市販されているプロトコルと全唾液2mlのからDNAを抽出するために最適化されたプロトコルの表3のコストの比較。ADNA抽出に必要なLL試薬および消耗品は、9月30日のようにインターネット上で利用可能な標準リスト価格を用いて評価されているが、このプロトコルは全唾液の1.25ミリリットル(からDNAを抽出するために書かれていることを2013年注すなわち 、唾液の緩衝液2.5ミリリットルこの値は唾液収集チューブ中の全体積の半分を表すように、ステップ2.3)を参照してください。コスト比較のために、2ミリリットル、これは一般的な市販のキット(Oragene)に関連した量であるとして選ばれた。
| DNA安定化バッファー(250ミリリットル) | ||
| コンポーネント | 容量(ml) | [決勝] |
| 1 MのNaCl | 1.461グラム | 0.1Mの |
| トリスHCl | 2.5 | 0.01 M |
| 0.5M EDTA | 5 | 0.01 M |
| 10%SDS | 12.5 | 0.014 M |
| プロテイナーゼK溶液(20 mg / ml)を | 2.5 | 6.92x10 -6 M |
| のddH 2 O | 227.5 | |
| プロテイナーゼK溶液(20 mg / ml)を | ||
| コンポーネント | 容量(ml) | [決勝] |
| プロテイナーゼK粉末 | 500mgの | 6.92x10 -4 M |
| のddH 2 O | 25 | |
| 70%エタノール(500ml)に | ||
| コンポーネント | 容量(ml) | [決勝] |
| エタノール95% | 368.5 | 12.63 M |
| のddH 2 O | 131.5 | |
表試薬のため4。レシピ。
ディスカッション
本手順は、かなりDNAの品質を損なうことなく、標準的な方法に比べて高分子量DNAの収量が改善された最適化されたDNA抽出プロトコルである。収量を最大限に最も大きな影響を持つ重要なステップは、広く11を配布していなかったものを除く、ここでレビュー公開済みプロトコルよりエタノール沈殿中に長い遠心分離工程を含むステップ5.2であった。この長い遠心分離と関連するDNAの質の変更は全唾液コレクションから入手可能なDNAの大部分が分解され、高分子量ではないことを示し、検出されなかった。
全唾液収集は、収集段階で最小限に抑える必要があり、外国の汚染物質の可能性や、潜在する感染の徴候である可能性があり、サンプル中の過剰なタンパク質の存在として、サンプルの質の制限があります。タンパク質または外国の汚染物質の大量の缶それによって、定量化が不正確作り、最終的な抽出されたDNAに残る。残留タンパク質または汚染物質は、再水和の後に存在する場合(ステップ6)が疑われる試料クリーンアップサンプル入力ボリュームを反映するようにスケーリングされた試薬量を有するタンパク質沈殿工程から開始することにより行うことができる。プロトコルの別の制限は、手順を実行するために必要な時間の長さである。複数の試料を並行して実行することができ;しかし、それは24以上の並列の抽出を同時に実行しないことをお勧めします。これは、サンプルがタイトペレットと再溶解したペレット時間を可能にすることができる24以上のサンプルを実行を確実にするために冷たいままでなければならないタンパク質沈殿工程のために特に重要である。
ここに提示されたプロトコル( 表3を参照)と見なさ最も費用効果的な方法である。このプロトコルは、プロトコールとトラブルシューティング抽出キットからの試薬を使用していますが、プロトコールとトラブルシューティングプロトコルで推奨さよりも小さなボリュームが使用されている抽出収率を損なうことなく、それがプロトコルの相対的なコスト削減を駆動する試薬のこの減少である。抽出のための計算されたコストは、各項目の表示価格を使用して、任意の割引を反映していないことに注意してください。最適化されたプロトコルでの抽出あたりのコストは、会社の営業担当者を通じて大量注文または割引とさらに低減することができる。
証拠はまた、このプロトコルは、次世代配列決定での使用に適していることが提供されている。得られたデータは、血液が日常的に利用できない多くの疾患におけるヒト遺伝学研究のための唾液サンプルの有用性のさらなる証拠を提供する。血液や細胞株由来のDNAは、テストのための遺伝物質の好ましい供給源であり続けているが、このようなソースが利用できない場合、全唾液収集が実行可能な代替であり、患者の登録は、それらのコレクションまたは静脈切開によって影響を受ける場合に使用可能か非現実的ではありません。
開示事項
The authors have nothing to disclose.
謝辞
This work was funded by a National Institutes of Health R01 (DC009453 support to CWB).
資料
| Name | Company | Catalog Number | Comments |
| 15 ml Centrifuge Tubes | Fisher | 12-565-268 | |
| Cell Lysis Solution | Qiagen | 158908 | |
| Proteinase K | Sigma | P6556 | |
| Protein Precipitation Solution | Qiagen | 158912 | |
| Isopropanol | Fisher | A416-4 | |
| Glycogen | EZ-BioResearch | S1003 | |
| 70% Ethanol | Fisher | 04-355-305 | |
| Tris-EDTA (TE) | Fisher | BP2473-1 | |
| NaCl | Fisher | AC194090010 | |
| Tris HCl | Fisher | BP1757-100 | |
| EDTA (0.5 M) Solution | Fisher | 03-500-506 | |
| Sodium Dodecyl Sulfate | Fisher | BP166-100 | |
| Analog Vortex Mixer | Fisher | 02-215-365 | |
| Centrifuge 5810R | Eppendorf | 5811 000.010 |
参考文献
- Quinque, D., Kittler, R., Kayser, M., Stoneking, M., Nasidze, I. Evaluation of saliva as a source of human DNA for population and association studies. Analytical Biochemistry. 353, 272-277 (2006).
- Min, J. L., et al. High mircosatellite and SNP genotyping success rates established in a large number of genomic DNA samples extracted from mouth swabs and genotypes. Twin Research and Human Genetics. 9, 501-506 (2006).
- Dlugos, D. J., Scattergood, T. M., Ferraro, T. N., Berrettinni, W. H., Buono, R. J. Recruitment rates and fear of phlebotomy in pediatric patients in a genetic study of epilepsy. Epilepsy & Behavior. 6, 444-446 (2005).
- Etter, J. F., Neidhart, E., Bertand, S., Malafosse, A., Bertrand, D. Collecting saliva by mail for genetic and cotinine analyses in participants recruited through the internet. European Journal of Epidemiology. 20, 833-838 (2005).
- Hansen, T. V., Simonsen, M. K., Nielsen, F. C., Hundrup, Y. A. Collection of blood, saliva, and buccal cell samples in a pilot study on the danish nurse cohort: Comparison of the response rate and quality of genomic DNA. Cancer Epidemiol Biomarkers Prev. 16, 2072-2076 (2007).
- Van Schie, R. C. A. A., Wilson, M. E. Saliva: A convenient source of DNA for analysis of bi-allelic polymorphisms of fcγ receptor iia (cd32) and fcγ receptor iiib (cd16). Journal of Immunological Methods. 208, 91-101 (1997).
- Dawes, C. Estimates, from salivary analyses, of the turnover time of oral mucosal epithelium in humans and the number of bacteria in an edentulous mouth. Archives of Oral Biology. 48, 329-336 (2003).
- Bahlo, M., et al. Saliva-derived DNA performs well in large-scale, high-density single-nucleotide polymorphism microarray studies. Cancer Epidemiol Biomarkers Prev. 19, 794-798 (2010).
- Hu, Y., et al. Genotyping performance between saliva and blood-derived genomic dnas on the dmet array: A comparison. PLoS ONE. 7 (3), e33968(2012).
- Simmons, T. R., et al. Increasing genotype-phenotype model determinism: Application to bivariate reading/language traits and epistatic interactions in language-impaired families. Human Heredity. 70, 232-244 (2010).
- Zeugin, J. A., Hartley, J. L. Ethanol precipitation of DNA. Focus. 7, 1-2 (1985).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler Transform. Bioinformatics. 25, 1754-1760 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- DePristo, M., et al. A framework for variation discovery and genotyping using next-generation DNA sequencing data. Nature Genetics. 43, 491-498 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved