Method Article
جمع واستخراج الحمض النووي من اللعاب لتسلسل الجيل القادم
In This Article
Summary
DNA extraction from saliva can provide a readily available source of high molecular weight DNA, with little to no degradation/fragmentation. This protocol provides optimized parameters for saliva collection/storage and DNA extraction to be of sufficient quality and quantity for downstream DNA assays with high quality requirements.
Abstract
The preferred source of DNA in human genetics research is blood, or cell lines derived from blood, as these sources yield large quantities of high quality DNA. However, DNA extraction from saliva can yield high quality DNA with little to no degradation/fragmentation that is suitable for a variety of DNA assays without the expense of a phlebotomist and can even be acquired through the mail. However, at present, no saliva DNA collection/extraction protocols for next generation sequencing have been presented in the literature. This protocol optimizes parameters of saliva collection/storage and DNA extraction to be of sufficient quality and quantity for DNA assays with the highest standards, including microarray genotyping and next generation sequencing.
Introduction
الحصول على الحمض النووي عالية الجودة للدراسات الجينية البشرية أمر أساسي في عملية اكتشاف الجين المرض. الدم، على الرغم تتطلب إجراء الغازية وكونها أكثر تكلفة من جمع اللعاب أيضا، ويحظي لإنشاء خطوط الخلايا خلد كمصدر لانهائي من الحمض النووي، أو iPSCs للدراسات وظيفية، وأحيانا يستخدم الحمض النووي في الدم عند خطوط الخلايا غير متوفرة. ومع ذلك، يتطلب الحصول على الدم فصاد المدربين والدم لديه نصف عمر أقصر من اللعاب 1. DNA من اللعاب هو أقل كلفة وأكثر سهولة الحصول عليها، لأنها يمكن جمعها وإرسالها عبر البريد دون الحاجة إلى فصاد، وبالتالي زيادة برك الموضوع المحتملة إلى ما وراء منطقة مستجمعات المياه من المستشفيات والمختبرات 2. يمكن تحسين التحاق دراسة عندما يكون الخيار من المواضيع إعطاء عينة من اللعاب بدلا من الدم 3، 4. المخاوف بشأن كمية ونوعية الحمض النووي من اللعاب قد تقتصر على نطاق واسع لناه على الرغم من العديد من الدراسات الدراسات الحديثة تظهر مدى ملاءمة اللعاب كله، بمتوسط قدره 4.3 × 10 5 خلية في الملليمتر الواحد، لاختبار الحمض النووي على مدى القديمة مسحات الشدق الأساليب التي لم تحصل على كميات كبيرة من اللعاب 2، 3، 4، 5، 6. في حين أن الأدب متواضع موجود تبين مدى ملاءمة DNA اللعاب كله مستمد للتطبيقات بما في ذلك أساليب التنميط الجيني القائم على ميكروأري 8، 9، 10، وقد درست توجد دراسات الجيل القادم التسلسل (خ ع). كان الهدف لتحسين هذا البروتوكول استخراج الحمض النووي اللعاب كله لتحقيق أقصى قدر من كمية ونوعية لتطبيقات علم الوراثة بطريقة فعالة من حيث التكلفة التي يتم تنفيذها بسهولة في المختبرات المشتركة مع الكواشف والمواد الاستهلاكية.
استخراج الحمض النووي من اللعاب يتطلب العديد من الإجراءات: 1) جمع وتخزين، 2) تحلل الخلايا، 3) العلاج ريبونوكلياز، 4) البروتين هطول، 5) هطول الأمطار الإيثانول، 6) الإماهة الحمض النووي. الحل DNA لتحقيق الاستقرار العازلة، وصفت2 سابقا، وظائف كاف دون تغيير. ولم تبذل أية محاولة لتحسين العلاج ريبونوكلياز وDNA الخطوات الإماهة. لكل خطوة المتبقية، وقد تم تحديد العديد من المتغيرات التي يمكن أن تؤثر على الإنتاجية. تم التلاعب بها كل متغير على حدة وتقييم التحسن في المحصول وجودة إحصائيا. للمتغيرات التي عرضت لتحسين العائد و / أو نوعية الحمض النووي، وأدرجت القيم المثلى في البروتوكول النهائي.
Protocol
ملاحظة: قبل تقديم عينات من اللعاب جميع المواد أعطى موافقة مستنيرة تتفق مع المبادئ التوجيهية للعلاج من المواضيع الإنسان في مستشفى الأطفال على الصعيد الوطني.
1. اللعاب جمع وتخزين
- قبل جمع اللعاب، تأكد من فم هذا الموضوع هو حر من المواد الغذائية أو المواد الغريبة الأخرى من خلال وجود موضوع شطف الفم بالماء وتجنب الأكل أو الشرب لمدة 30 دقيقة قبل جمع العينة.
- فتح 15 مل أنبوب الطرد المركزي مع 2.5 مل من الحمض النووي استقرار عازلة 2 مع التأكد من تجنب لمس داخل الغطاء أو أنبوب، ويكون موضوع يبصقون 2.5 مل من اللعاب في حل العازلة. ملاحظة: يمكن جمع أكثر من 2.5 مل من اللعاب يؤدي إلى تدهور عينة من نسبة كافية من عينة لعازلة الاستقرار DNA. وجمع اللعاب قليلا جدا لحد عوائد المتوقعة من البروتوكول. لتقييم حجم جمع واستخدام التدرجات مرقمة على جانب ركان الأنبوب.
- استبدال الغطاء وتخلط بواسطة قلب حتى يتم الخليط المتجانس. اهتزاز قوي ليست ضرورية. تخزين العينات في RT للتخزين على المدى القصير أو 4 درجة مئوية لمدة التخزين على المدى الطويل (> 3 أشهر).
2. الاستعدادات الأولية وتحلل الخلية
- قبل بدء الاستخراج، تسخين حمام مائي إلى 37 درجة مئوية، وإعداد دلو الجليد. سوف تكون هناك حاجة إلى ثلاثة 15 مل أنابيب الطرد المركزي المخروطية لكل عينة المستخرجة. وسوف تستخدم هذه الأنابيب الثلاثة لعقد الخلية والبروتين بيليه، المباراة النهائية المستخرجة gDNA، والأيزوبروبانول والإيثانول supernatants.
- استرجاع عينات من التخزين، وعكس عينات عدة مرات ثم دوامة على سرعة متوسطة لمدة 15 ثانية.
- الاستغناء 2.5 مل من العينة إلى نظيفة 15 مل أنبوب الطرد المركزي، وإضافة 5 مل من خلية تحلل الحل. مزيج العينة 50 مرات انعكاس، واحتضان في RT لمدة 30 دقيقة.
إزالة 3. RNA
- إضافة 40 ميكرولتر من ريبونوكلياز وسولution في 100 ملغ / مل، واحتضان عند 37 درجة مئوية لمدة 15 دقيقة.
- إزالة عينة من 37 درجة مئوية الماء وحمام بارد على الجليد لمدة 3 دقائق.
- بعد ريبونوكلياز والحضانة، وزيادة درجة حرارة حمام الماء إلى 65 درجة مئوية للخطوة الإماهة الحمض النووي للبروتوكول.
4. البروتين وإزالة الدهون
- إضافة 50 ميكرولتر من بروتين K الحل عند 20 ملغ / مل، مزيج عدة مرات من قبل انعكاس، واحتضان في RT مدة لا تقل عن 30 دقيقة. ملاحظة: هذه هي نقطة التوقف المحتملة للبروتوكول. بعد إضافة من الحل K بروتين، ويمكن تخزين العينة في 4 درجات مئوية حتى يمكن الانتهاء من الاستخراج. لم تظهر تخزين في 4 درجات مئوية لمدة تصل إلى 24 ساعة أن يكون لها تأثير كبير على عائدات استخراج أو نوعية الحمض النووي. لم يتم تقييم التخزين على المدى الطويل في هذه المرحلة.
- إضافة 1.7 مل من الهطول البروتين الحل، دوامة بقوة لمدة 20 ثانية بسرعة عالية، ومكان على الجليد لمدة 10 دقيقة.
- بمجرد أن يبرد العينات على الجليد لمدة 10 دقيقة، الطرد المركزي لمدة 10 دقيقة في 3،000 x ج و 4 درجات مئوية. يجب على البروتينات عجلت تشكيل بيليه ضيق للمتابعة. إذا كان بيليه ليست ضيقة أو الحل لا تزال غائمة، العينات يمكن تبريده على الجليد لمدة 5 دقائق أكثر وتكرار الطرد المركزي. يجب أن تبقى العينات على الجليد لضمان بيليه مشددة.
5. عزل وتنقية gDNA
- في نظيفة 15 مل أنبوب الطرد المركزي، الماصة 5 مل من كحولالأيسوبروبيل و 8 ميكرولتر من الحل النقي الجليكوجين في 20 ملغ / مل.
- صب طاف تحتوي على gDNA من الخطوة 4.3 في أنبوب يحتوي على الأيزوبروبانول والجليكوجين الحل، مخلفين وراءهم البروتين عجلت بيليه. مرة واحدة تمت إضافة طاف، مزيج بلطف العينة 50 مرات من قبل انعكاس وأجهزة الطرد المركزي لمدة 30 دقيقة في 3،000 x ج و 4 درجات مئوية.
- صب طاف ببطء في نظيفة أنبوب 15 مل. بعد إزالة طاف، إضافة 1 مل من الايثانول 70٪ لغسل بيليه بواسطة هزاز ببطء وتتحرك بلطف الإيثانول على بيليه عجلت عدة مرات. الإبقاء على الإيثانول في الأنبوب.
- بعد غسل الأولي، الطرد المركزي العينة لمدة 1 دقيقة في 2،000 x ج و 20 درجة مئوية. ويمكن القيام بهذه الخطوة إما الطرد المركزي في 4 درجات مئوية أو 20 درجة مئوية. وقد تبين أي أثر ملموس للحرارة لهذه الخطوة.
- بعد غسل الأولي والطرد المركزي من بيليه، صب ببطء غسل الإيثانول من الأنبوب وتجاهل، ثم إجراء غسل الثاني بتكرار الخطوات 5.3 و 5.4.
- بعد إزالة طاف من غسل الثاني، والسماح بيليه الهواء الجاف لمدة 15 دقيقة.
- إذا لم تجفف العينة تماما، الهواء الجاف لمدة 15 دقيقة أخرى.
6. الإماهة من gDNA
- مرة واحدة قد جفت عينة، إضافة 300 ميكرولتر من تريس، EDTA لترطيب gDNA بيليه المجففة.
- دوامة العينة لمدة 5 ثانية على سرعة متوسطة ومكان في65 ° C حمام الماء الساخن لمدة 1 ساعة.
- إزالة عينات من حمام الماء واحتضان O / N في RT.
ملاحظة: جميع المنتجات والكواشف المستخدمة المذكورة في الجدول المواد، وكذلك الجدول 4.
النتائج
لتحديد المعايير المثلى لاستخراج الحمض النووي تم تنفيذ سلسلة من عمليات الاستخراج DNA المقترنة. تم تقسيم عينة اللعاب واحدة واختبار كل جزء واحد من اثنين من القيم الممكنة للمتغير معين. وأجريت ثمانية على الأقل مكررات من كل اختبار تقرن (على سبيل المثال، تم aliquoted عينة اللعاب واحدة لاختبار استخراج مع وبدون الأولية 50 ° C حضانة كليهما). واستند الأمثل على أربعة مقاييس معيارية: إجمالي العائد DNA، وقيمة 260/280، قيمة 260/230، والفحص البصري من الحمض النووي electrophoresed لتقييم تجزئة. تم تقييم ليس كل التركيبات الممكنة للمتغيرات التفاعلات الإحصائية (N = 169 مجموعات)، واختارت بدلا من ذلك لتقييم تأثير هامشي كل متغير على حدة. تم اختبار تأثيرات باستخدام متعددة طريقة تدابير المتكررة ANOVA واستخلصت آثار المقدرة من معادلة الانحدار مماثلة. وتتلخص كل آثار كبيرة في الجدول 1، كما هو موضح جزمتغيير العمر في الغلة (نانوغرام / مل لكل ميكرولتر من المدخلات اللعاب) أو نوعية الحمض النووي (260/280 و260/230).
تم تحسين تحلل الخلية (الخطوة 2) من خلال تقييم: 1) وجود / غياب 50 ° C الحضانة (1 ساعة) قبل الخلية تحلل لضمان أن تدهور بروتين K وتحلل الخلايا بوساطة المخزن المؤقت التخزين ذهب إلى الانتهاء، 2 ) حضور / غياب التجانس قبل vortexing خطوة (سرعة متوسطة، و 15 ثانية)، و3) وقت حل تحلل الحضانة (5 مقابل 30 دقيقة). زادت 30 دقيقة تحلل الخلية حضانة العائد بمعدل 3.5٪ (P <.01) ولكن لم يكن الآخر متغير تحلل الخلية لها تأثير كبير على المحصول. انخفضت نسبة vortexing ل260/280 من قبل ذات دلالة إحصائية (p <.001) ولكن صغيرة عمليا 0.03.
وسبق هطول البروتين (الخطوة 4) من بروتين K الهضم لتعطيل سلاسل الأحماض الأمينية، وتحسين كفاءة البروتين هطول القبض والإفراج DNA. وكانت كمية بروتين K متنوعة عشرة أضعاف.تم تخفيض درجة حرارة الطرد المركزي من 20 درجة مئوية إلى 4 درجات مئوية. زيادة كمية بروتين K تسبب في انخفاض ملحوظ إحصائيا في الغلة (8.7٪)، وكذلك تحسن طفيف كل من نسب 260/280 و260/230.
كان هطول الإيثانول (الخطوة 5) المرحلة الأخيرة من بروتوكول فحصها. كان المبلغ من الناقل الجليكوجين (0، 8 ميكرولتر) متنوع، كما كان مجموع وقت الطرد المركزي (5 مقابل 30 دقيقة 11). الوقت الطرد المركزي فقط أثرت بشكل كبير الغلة، بمعدل زيادة 290٪. كما انخفض تدور أطول نسبة 260/280 قليلا (0.05). لم يلاحظ أي تأثير كبير على المحصول من الجليكوجين خلال التجارب. على الرغم من أن الكمية الإجمالية من الحمض النووي في هذه الاستخراج كان كبيرا بما فيه الكفاية أن الجليكوجين لن عادة استخدامها. على الرغم من عدم وجود تأثير في هذه العينات، فإنه لا يزال من المستحسن استخدام الجليكوجين للحد من مخاطر انخفاض عائدات كلما حجم المدخلات اللعاب أقل من الواردة هنا أو إذا ذره أي سبب آخر للاعتقاد سوف تكون منخفضة العائد.
أشار الفحص البصري لعينات من الحمض النووي التمثيلية (الشكل 1) أن الحمض النووي المستخرج لم مجزأة بشكل كبير لأي إجراء استخراج الحمض النووي اللعاب، ولكن أظهر بالأحرى عالية الجزيئية الفرقة المناسبة الوزن دون تلطيخ يدل على الحمض النووي المتدهورة. بعد ريبونوكلياز الهضم، أنتج البروتوكول في المتوسط 260/280 1.74.
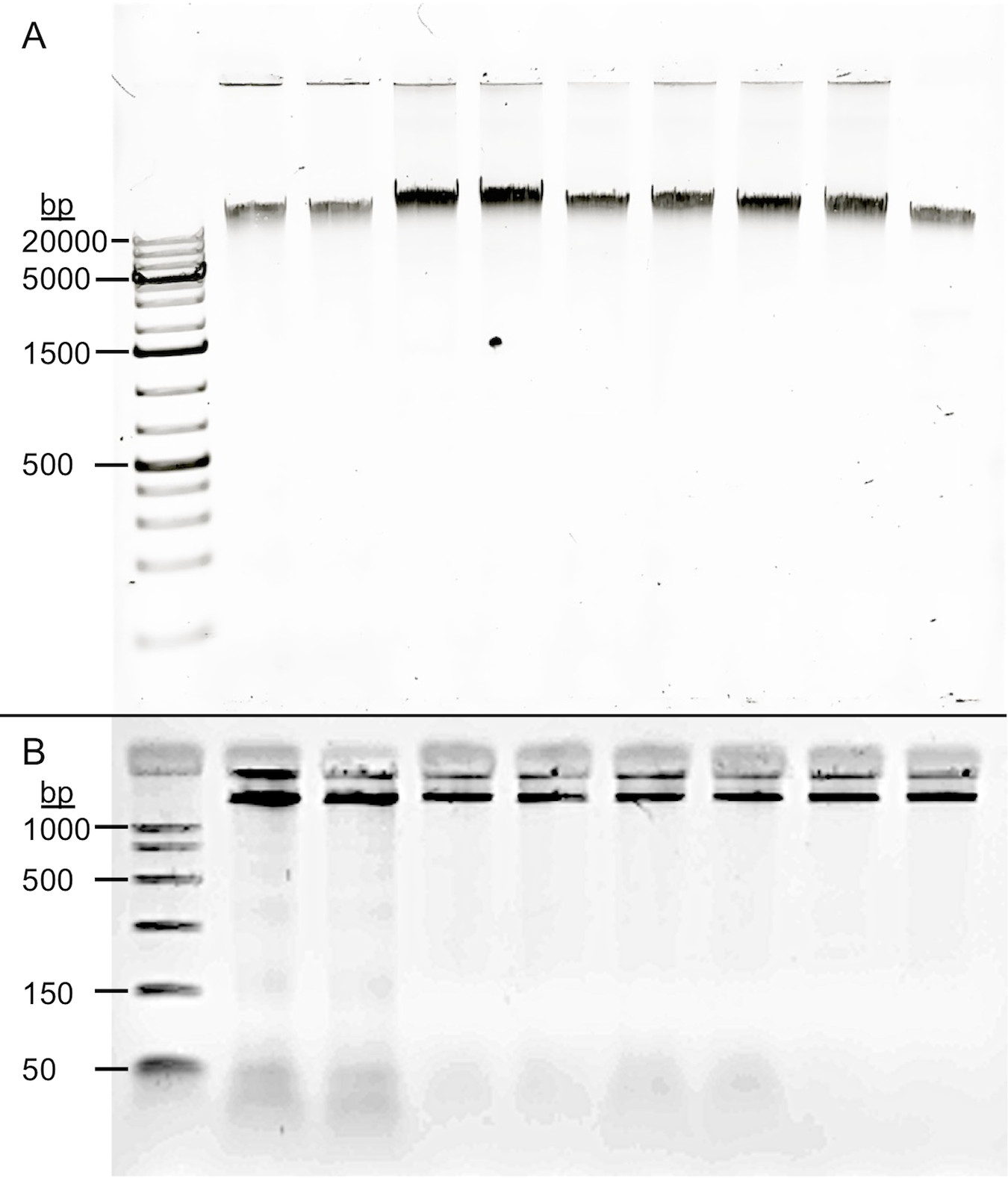
الرقم 1. جودة DNA المستمدة اللعاب. تم تطبيق إجراءات استخراج أربعة إلى نفس جمع اللعاب. تم electrophoresed (A) عينات على هلام الاغاروز 0.8٪ (250 نانوغرام DNA). كافة أنواع بروتوكولات استخراج الحمض النووي اللعاب يؤدي إلى ارتفاع الوزن الجزيئي (> 20 KB) DNA، مع عدم وجود دليل على تدهور. لين: 1 DNA laddeص و 2 و 3 عينات Oragene prepIT بروتوكول L2P و 4 و 5 Gentra Puregene الجسم بروتوكول السوائل، 6 & 7 بروتوكول الأمثل دون خطوة إزالة RNA و 8 و 9 من بروتوكول الأمثل مع إزالة خطوة RNA. الممرات 2-7 هي مباشرة بروتوكولات مماثلة على عينات من اللعاب نفسها. 8 حارات و9 تظهر أن الخطوة إزالة RNA لا يعرض تدهور الحمض النووي. تم electrophoresed (B) عينات على هلام الاغاروز 2٪ (150 نانوغرام DNA). ذروة RNA طفيفة هي ملاحظتها بالقرب من الجزء السفلي من هلام في الممرات من 2 إلى 7 (الاتفاقيات على النحو الوارد أعلاه). 8 حارات و9 تظهر فعالية خطوة إزالة الحمض النووي الريبي.
الخطوة إزالة RNA (الخطوة 3 مع ريبونوكلياز A) أمر بالغ الأهمية لتقدير دقيق من الحمض النووي. أثناء الاختبار، لوحظ ارتفاع محتوى باستمرار RNA، على النحو الذي يحدده نسبة الذين تقطعت بهم السبل الحمض النووي RNA المزدوج لتقاس و qubit 2.0 التألق. في المتوسط، والمحتوى الحمض النووي من عينات دون ريبونوكلياز والعلاج تتكون من 46.6٪ (± 0.4) RNA. العينات التي خضعت الخطوة إزالة RNA النحو "<20 نانوغرام / مل"، وهي أدنى قراءة ممكنة للكشف RNA و qubit ل.
كان الحمض النووي التي تم الحصول عليها من خلال هذا البروتوكول الأمثل من جودة كافية لإنتاجية عالية التسلسل عندما ريبونوكلياز إضافية تم تطبيق هذه الخطوة. للوصول إلى البيانات resequencing المستهدفة، تم تطبيق مخصص اجيلنت SureSelect الهدف إثراء مجموعة إلى 24 عينة، وتستهدف 2.6 ميغابايت من التسلسل. أجريت عالية التسلسل الإنتاجية في 12 barcoded (فهرسة) عينات لكل حارة. تسلسل، ثم تم إجراء تطبيق الجودة GATK 13 درجة قاعدة إعادة تقويم، indel إعادة تنظيم، وإزالة مكررة، SNP اكتشاف والتنميط الجيني في وقت واحد في جميع العينات 24 باستخدام أفضل الممارسات المعلمة تصفية الصعبة يقرأ وBWA الانحياز إلى الجينوم مرجعية hg19 12 قيم 14. أسفرت عن 24 عينة عالية الجودة NGS البيانات (الجدول 2). من يقرأ التي مرت Illuفي مينا الفلاتر القياسية، وكان س> 20، 91.4٪ الانحياز إلى المناطق المستهدفة تخصيب تسلسل، وتوفير بمتوسط عمق تغطية على الهدف من> 30X في تغطية Q> 100، وأيضا ضمن الحدود اللازمة لنادر اكتشاف SNP في كل عينة. كان متوسط الرصيد حبلا 49.9٪. مقارنة مع المكالمات البديل البورشيد المورثات ميكروأري أثمرت عن وجود تطابق 98.9٪.
| مرشح متغير | نانوغرام / ميكرولتر | 260/280 | 260/230 |
| دوامة | نانوثانية | -0.03 *** | نانوثانية |
| X30 دقيقة خلية تحلل الحضانة | 3.5٪ ** | نانوثانية | نانوثانية |
| بروتين K X10 | -8.7٪ * | -0.05 *** | -0.03 *** |
| 30 دقيقة تدور | 290.2٪ *** | -0.05 *** | نانوثانية |
| الجليكوجين | نانوثانية | نانوثانية | -0.37 *** |
الجدول الحجم 1. تأثير متغير محسن على الكمية / مقاييس الجودة. جميع الأحجام هي تأثير في الوحدات المدرجة في رأس العمود. ص القيم من ANOVA: * ع <.05. ** ع <.01. *** P <.001. NS غير الهامة
| جودة متري | قيمة |
| طول الهدف | 1،708 كيلوبايت |
| الهدف المغطاة> 30X | 85.22٪ |
| تعدد الأشكال في dbSNP | 92.55٪ |
| اتفاق مجموعة | 98.99٪ |
الجدول 2. جودة إنتاجية عالية تسلسل الهدف من تخصيب اليورانيوم.
| بروتوكول محسن الجديد | البند | موزع | كتالوج # | وحدة الشرائية | التكلفة / وحدة | التكلفة / جمع |
| 15 مل أنابيب الطرد المركزي | فيشر | 12-565-268 | 500 أنابيب | 233،50 $ | $ 3،2690 | |
| خلية تحلل الحل | QIAGEN | 158908 | 1 L | 401،00 $ | $ 3،2080 | |
| بروتين K | سيغما | P6556 | 1 ز | 713،00 $ | $ 1،5686 | |
| الهطول البروتين الحل | QIAGEN | 158912 | 350 مل | 350،00 $ | $ 2،7200 | |
| الأيزوبروبانول | فيشر | A416-4 | حالة 4 × 4 L | 486،71 $ | $ 0،2434 | |
| الجليكوجين الحل (20 ملغ / مل) | EZ-BIORESEARCH | S1003 | 1 مل | $ 51،00 | $ 0،8160 | |
| 70٪ من الإيثانول | فيشر | 04-355-305 | حالة 4 × 1 غال. | 123،03 $ | $ 0،0325 | |
| تريس، EDTA (TE) | فيشر | BP2473-1 | 1 L | $ 68،67 | $ 0،0412 | |
| كلوريد الصوديوم | فيشر | AC194090010 | 1 كجم | $ 34،65 | $ 0.000004 | |
| تريس حمض الهيدروكلوريك | فيشر | BP1757-100 | 100 مل | $ 57،84 | $ 0،0116 | |
| EDTA (0.5 M) الحل | فيشر | 03-500-506 | 100 مل | $ 33،60 | $ 0،0134 | |
| دود الصوديومecyl كبريتات | فيشر | BP166-100 | 100 غرام | $ 59،95 | $ 0،0060 | |
| التكلفة الإجمالية | $ 11،93 | |||||
| Oragene | البند | موزع | كتالوج # | وحدة الشرائية | التكلفة / وحدة | التكلفة / جمع |
| 15 مل أنابيب الطرد المركزي | فيشر | 12-565-268 | 500 أنابيب | 233،50 $ | $ 0،9340 | |
| الإيثانول بنسبة 100٪ | فيشر | BP2818-100 | 100 مل | $ 34،29 | $ 1،6459 | |
| 70٪ من الإيثانول | فيشر | 04-355-305 | حالة 4 × 1 غال. | 123،03 $ | $ 0،0081 | |
| تريس، EDTA (TE) | فيشر | BP2473-1 | 1 L | $ 68،67 | $ 0،0687 | |
| أنبوب 1.5 مل | جينيسي | 22-281A | 500 أنابيب | $ 22،85 | $ 0،0457 | |
| Oragene مجموعة KIT | Oragene | OG-500 | 1 | $ 25،00 | $ 25،00 | |
| التكلفة الإجمالية | $ 27،70 | |||||
| Puregene | البند | موزع | كتالوج # | وحدة الشرائية | التكلفة / وحدة | التكلفة / جمع |
| 15 مل أنابيب الطرد المركزي | فيشر | 12-565-268 | 500 أنابيب | 233،50 $ | $ 0،9340 | |
| خلية تحلل الحل | QIAGEN | 158908 | 1 L | 401،00 $ | $ 4،0100 | |
| بروتين K | QIAGEN | 158918 | 650 مل | $ 73،10 | $ 7،8723 | |
| الهطول البروتين الحل | QIAGEN | 158912 | 350 مل | 350،00 $ | $ 4،0000 | |
| الأيزوبروبانول | فيشر | A4164 | حالة 4 × 4 L | 486،71 $ | $ 0،3650 | |
| الجليكوجين الحل | QIAGEN | 158930 | 500 مل | $ 64،30 | $ 2،5720 | |
| 70٪ من الإيثانول | فيشر | 04-355-305 | حالة 4 × 1 غال. | 123،03 $ | $ 0،0975 | |
| DNA الترطيب الحل | QIAGEN | 158914 | 100 مل | $ 69،80 | $ 0،1396 | |
| كلوريد الصوديوم | فيشر | AC19409-0010 | 1 كجم | $ 34،65 | $ 0.000004 | |
| تريس حمض الهيدروكلوريك | فيشر | BP1757-100 | 100 مل | $ 57،84 | $ 0،0116 | |
| EDTA (0.5 M) الحل | فيشر | 03-500-506 | 100 مل | $ 33،60 | $ 0،0134 | |
| كبريتات الصوديوم دوديسيل | فيشر | BP166-100 | 100 غرام | $ 59،95 | $ 0،0060 | |
| التكلفة الإجمالية | $ 19،99 |
الجدول 3. مقارنة التكلفة للبروتوكول الأمثل لاستخراج الحمض النووي من 2 مل من اللعاب كله مع غيرها من البروتوكولات المتوفرة تجاريا. وتم تقييم الكواشف ليرة لبنانية والمستهلكات اللازمة لاستخراج الحمض النووي باستخدام معيار قائمة الأسعار المتاحة على شبكة الانترنت اعتبارا من 30 سبتمبر 2013. ملاحظة أن هذا البروتوكول هو مكتوب لاستخراج الحمض النووي من 1.25 مل من اللعاب كله (أي 2.5 مل من اللعاب وعازلة ، راجع الخطوة 2.3)، وتمثل هذه القيمة نصف إجمالي حجم في أنبوب جمع اللعاب. للمقارنة التكلفة، وقد تم اختيار 2 مل لأن هذا هو المبلغ المرتبطة مشتركة عدة المتاحة تجاريا (Oragene).
| DNA لتحقيق الاستقرار العازلة (250 مل) | ||
| عنصر | حجم (مل) | [النهائي] |
| 1 M كلوريد الصوديوم | 1.461 غرام | 0.1 M |
| تريس حمض الهيدروكلوريك | 2.5 | 0.01 M |
| 0.5M EDTA | 5 | 0.01 M |
| 10٪ SDS | 12.5 | 0.014 M |
| بروتين K الحل (20 ملغ / مل) | 2.5 | 6.92x10 -6 M |
| DDH 2 O | 227.5 | |
| بروتين K الحل (20 ملغ / مل) | ||
| عنصر | حجم (مل) | [النهائي] |
| مسحوق بروتين كاف | 500 ملغ | 6.92x10 -4 M |
| DDH 2 O | 25 | |
| 70٪ إيثانول (500 مل) | ||
| عنصر | حجم (مل) | [النهائي] |
| الإيثانول 95٪ | 368.5 | 12.63 M |
| DDH 2 O | 131.5 | |
الجدول 4. وصفات لالكواشف.
Discussion
الإجراء الحالي هو الأمثل DNA بروتوكول الاستخراج التي قد تحسن بشكل كبير العائد من الحمض النووي الوزن الجزيئي عالية مقارنة بالطرق القياسية، دون المساومة على جودة DNA. كانت الخطوة الحاسمة مع أكبر تأثير على العائد على معظم خطوة 5.2، والذي يتضمن خطوة الطرد المركزي أطول أثناء هطول الإيثانول من أي بروتوكول نشرت استعرض هنا، ما عدا واحدة أن لم يوزع على نطاق واسع 11. تم الكشف عن أية تغييرات في نوعية الحمض النووي المرتبطة بهذا الطرد المركزي أطول، مشيرا إلى أن معظم الحمض النووي المتاحة من جمع اللعاب كله ليس المتدهورة وارتفاع الوزن الجزيئي.
جمع اللعاب كله لديه قيود في نوعية العينة مثل إمكانية الملوثات الخارجية، الذي يحتاج إلى أن يكون الحد الأدنى في مرحلة جمع، ووجود البروتين الزائد في العينة التي يمكن أن تكون علامة على وجود العدوى الكامنة. كميات كبيرة من البروتين أو أجنبية الملوثات يمكنالبقاء في الحمض النووي المستخرج النهائي مما يجعل تقدير غير دقيق. إذا كان هناك بروتينات أو الملوثات المتبقية بعد الإماهة (الخطوة 6) من المشتبه فيهم أو عينة تنظيف يمكن أن يقوم بها بدءا من البروتين هطول خطوة مع أحجام كاشف تحجيم لتعكس حجم المدخلات العينة. الحد آخر من البروتوكول هو طول الفترة الزمنية اللازمة لتنفيذ الخطوات. يمكن تشغيل عينات متعددة في نفس الوقت. ومع ذلك، فمن المستحسن أن يتم تشغيل ما لا يزيد عن 24 الاستخراج موازية في نفس الوقت. هذا مهم بشكل خاص للبروتين هطول الخطوة، حيث يجب أن تظل عينة البارد لضمان بيليه ضيق وتشغيل أكثر من 24 عينة قد تسمح الكريات الوقت لإعادة حل.
بروتوكول المعروضة هنا هي أكثر طريقة فعالة من حيث التكلفة تعتبر (انظر الجدول 3). في حين أن هذا البروتوكول لا الكواشف استخدام من عدة استخراج Puregene، يتم استخدام حجم أصغر من الموصى بها في بروتوكول Puregeneدون المساس العائد استخراج وهذا التخفيض هو في الكواشف التي تحرك وفورات في التكاليف النسبية للبروتوكول. لاحظ أن تكلفة تحسب لاستخراج تستخدم قائمة الأسعار لكل بند ولا تعكس أي خصومات. التكلفة لكل استخراج مع بروتوكول الأمثل يمكن تخفيض كذلك مع معظم الاوامر أو خصومات من خلال ممثلي مبيعات الشركة.
كما قدمت أدلة على أن هذا البروتوكول هو مناسبة للاستخدام مع الجيل القادم التسلسل. البيانات التي تم الحصول عليها توفر دليلا إضافيا على فائدة عينات من اللعاب لأبحاث علم الوراثة البشرية في كثير من الأمراض حيث الدم بشكل روتيني. بينما يستمر DNA المستمدة خط الدم والخلايا لتكون المصدر المفضل للمادة الوراثية للاختبار، جمع اللعاب كله هو بديل قابل للتطبيق عند هذه المصادر ليست متاحة، عندما يتأثر التحاق المريض بواسطة جمع أو الفصد غير متوفرة أو غير عملي.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was funded by a National Institutes of Health R01 (DC009453 support to CWB).
Materials
| Name | Company | Catalog Number | Comments |
| 15 ml Centrifuge Tubes | Fisher | 12-565-268 | |
| Cell Lysis Solution | Qiagen | 158908 | |
| Proteinase K | Sigma | P6556 | |
| Protein Precipitation Solution | Qiagen | 158912 | |
| Isopropanol | Fisher | A416-4 | |
| Glycogen | EZ-BioResearch | S1003 | |
| 70% Ethanol | Fisher | 04-355-305 | |
| Tris-EDTA (TE) | Fisher | BP2473-1 | |
| NaCl | Fisher | AC194090010 | |
| Tris HCl | Fisher | BP1757-100 | |
| EDTA (0.5 M) Solution | Fisher | 03-500-506 | |
| Sodium Dodecyl Sulfate | Fisher | BP166-100 | |
| Analog Vortex Mixer | Fisher | 02-215-365 | |
| Centrifuge 5810R | Eppendorf | 5811 000.010 |
References
- Quinque, D., Kittler, R., Kayser, M., Stoneking, M., Nasidze, I. Evaluation of saliva as a source of human DNA for population and association studies. Analytical Biochemistry. 353, 272-277 (2006).
- Min, J. L., et al. High mircosatellite and SNP genotyping success rates established in a large number of genomic DNA samples extracted from mouth swabs and genotypes. Twin Research and Human Genetics. 9, 501-506 (2006).
- Dlugos, D. J., Scattergood, T. M., Ferraro, T. N., Berrettinni, W. H., Buono, R. J. Recruitment rates and fear of phlebotomy in pediatric patients in a genetic study of epilepsy. Epilepsy & Behavior. 6, 444-446 (2005).
- Etter, J. F., Neidhart, E., Bertand, S., Malafosse, A., Bertrand, D. Collecting saliva by mail for genetic and cotinine analyses in participants recruited through the internet. European Journal of Epidemiology. 20, 833-838 (2005).
- Hansen, T. V., Simonsen, M. K., Nielsen, F. C., Hundrup, Y. A. Collection of blood, saliva, and buccal cell samples in a pilot study on the danish nurse cohort: Comparison of the response rate and quality of genomic DNA. Cancer Epidemiol Biomarkers Prev. 16, 2072-2076 (2007).
- Van Schie, R. C. A. A., Wilson, M. E. Saliva: A convenient source of DNA for analysis of bi-allelic polymorphisms of fcγ receptor iia (cd32) and fcγ receptor iiib (cd16). Journal of Immunological Methods. 208, 91-101 (1997).
- Dawes, C. Estimates, from salivary analyses, of the turnover time of oral mucosal epithelium in humans and the number of bacteria in an edentulous mouth. Archives of Oral Biology. 48, 329-336 (2003).
- Bahlo, M., et al. Saliva-derived DNA performs well in large-scale, high-density single-nucleotide polymorphism microarray studies. Cancer Epidemiol Biomarkers Prev. 19, 794-798 (2010).
- Hu, Y., et al. Genotyping performance between saliva and blood-derived genomic dnas on the dmet array: A comparison. PLoS ONE. 7 (3), e33968(2012).
- Simmons, T. R., et al. Increasing genotype-phenotype model determinism: Application to bivariate reading/language traits and epistatic interactions in language-impaired families. Human Heredity. 70, 232-244 (2010).
- Zeugin, J. A., Hartley, J. L. Ethanol precipitation of DNA. Focus. 7, 1-2 (1985).
- Li, H., Durbin, R. Fast and accurate short read alignment with Burrows-Wheeler Transform. Bioinformatics. 25, 1754-1760 (2009).
- McKenna, A., et al. The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res. 20, 1297-1303 (2010).
- DePristo, M., et al. A framework for variation discovery and genotyping using next-generation DNA sequencing data. Nature Genetics. 43, 491-498 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved