Imaging di campioni biologici con microscopia ottica e confocale
Panoramica
Fonte: Peiman Shahbeigi-Roodposhti e Sina Shahbazmohamadi, Dipartimento di Ingegneria Biomedica, Università del Connecticut, Storrs, Connecticut
I microscopi ottici sono in circolazione da secoli e, mentre hanno raggiunto il loro limite teorico di risoluzione decenni fa, nuove attrezzature e tecniche, come l'elaborazione di immagini confocali e digitali, hanno creato nuove nicchie nel campo dell'imaging ottico. I migliori microscopi ottici avranno in genere una risoluzione fino a 200 nm in condizioni ideali. Tuttavia, i microscopi ottici sono limitati dalla diffrazione delle onde, una funzione della lunghezza d'onda, che è di circa 500 nm per la luce visibile. Mentre la risoluzione dei microscopi ottici non raggiunge quella dei microscopi elettronici, sono gli strumenti più preziosi nell'imaging di macrostrutture biologiche e sono un punto fermo in qualsiasi laboratorio biologico.
Nei microscopi ottici convenzionali, il segnale prodotto dall'oggetto ripreso proviene dall'intero spessore del campione, il che non consente alla maggior parte di esso di essere a fuoco per l'osservatore. Ciò fa sì che l'immagine abbia una "sfocatura sfocata". Il microscopio confocale, d'altra parte, illumina il campione attraverso un foro di spillo, ed è quindi in grado di filtrare la luce fuori fuoco dall'alto e dal basso del punto di messa a fuoco nell'oggetto.
Questa dimostrazione fornisce un'introduzione all'acquisizione di immagini utilizzando metodi di microscopia ottica e confocale. Qui, verrà studiato un pezzo sezionato del cervello del topo. Saranno trattati l'acquisizione e l'analisi delle immagini, compresi gli strumenti per generare mappe topografiche e immagini composite. Verranno inoltre discussi i vantaggi e gli svantaggi dei diversi metodi di imaging in relazione alla risoluzione, alla profondità di messa a fuoco e al tipo di campione. Lo scopo di questa dimostrazione è quello di fornire maggiori informazioni sui microscopi ottici e confocali per determinare se questi moduli di microscopia sono la soluzione migliore per un tipo di campione biologico.
Principi
I microscopi ottici funzionano utilizzando almeno due elementi di ingrandimento. L'obiettivo primario, chiamato obiettivo, determina l'ingrandimento totale e l'obiettivo secondario, chiamato oculare, mette a fuoco l'immagine virtuale per la visualizzazione. L'ingrandimento totale è determinato moltiplicando gli ingrandimenti delle due lenti. La messa a fuoco della luce attraverso queste sorgenti, unita alla messa a fuoco della luce dalla lampada sul campione, fornisce un piano di messa a fuoco specificato in cui l'ingrandimento e la luce della lampada si incontrano tutti nello stesso punto, il che dà la migliore risoluzione nell'immagine. La figura seguente mostra come viene creato il piano focale del campione attraverso le diverse lenti. Gli oggetti al di fuori del piano focale avranno fasci di luce che interferiscono da altre parti del campione a causa della più ampia area di illuminazione. Ciò causa sfocatura nell'immagine. Pertanto, per concentrarsi su diverse posizioni z di un campione con altezze molto variabili, le sezioni di direzione z devono essere spostate nel piano focale.

Figura 1. Lenti al microscopio ottico e piani focali.
I microscopi digitali funzionano secondo lo stesso principio dei micropscopi ottici, tranne per il fatto che non si basano su un oculare. È un microscopio ottico dotato di una fotocamera digitale. La fotocamera digitale funge da rilevatore e le immagini vengono visualizzate sul monitor di un computer. Questi microscopi sono ideali per l'analisi e la documentazione dei campioni durante la ricerca e lo sviluppo (R & S), la produzione e l'ispezione, il controllo e la garanzia della qualità (QC / QA), nonché l'analisi dei guasti (FA). Di solito offrono software che consentono agli utenti di analizzare l'immagine di esempio. La Figura 2 mostra una tipica configurazione del microscopio digitale.

Figura 2. Componenti principali del microscopio digitale.
I componenti principali del sistema sono:
- Motore ottico: contiene il sensore di acquisizione dell'immagine e gli obiettivi per lo zoom sull'immagine.
- Obiettivo: Acquisisce e focalizza la luce dal campione. Sono disponibili tre diversi obiettivi per varie attività di acquisizione delle immagini.
- Fase di scansione: posizione in cui deve essere posizionato il campione.
- Supporto per microscopio: fornisce il supporto per il motore ottico e lo stadio di scansione. Controlla anche la comunicazione tra i componenti collegati e il computer.
- Computer: supporta il software dell'utente e consente di visualizzare le immagini sul monitor.
- Controller: controlla il microscopio e il flusso di lavoro utilizzando gesti multi-touch e icone sensibili al tocco e specifiche del contesto. Le manopole di controllo controllano lo zoom, la messa a fuoco e la posizione dell'immagine del microscopio.
Un microscopio confocale, o microscopia a scansione laser confocale (CLSM), è un microscopio con maggiore risoluzione ottica e contrasto. Confocale significa "avere la stessa attenzione". L'oggetto e la sua immagine sono "confocali".
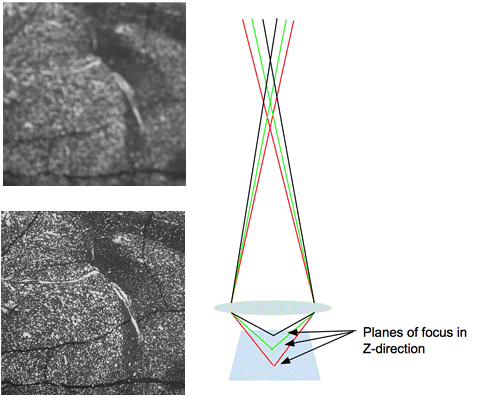
Figura 3. Sfocatura e relativo effetto su un'immagine. L'immagine a sinistra mostra un'immagine sfocata con bordi sfocati. L'immagine corretta mostra il percorso della luce attraverso l'obiettivo quando si esegue l'imaging di un campione a fuoco.
A differenza dei microscopi otrò generali che illuminano e visualizzano l'intero campione in vista, i microscopi confocali utilizzano un foro stenopeico tra lo stadio del campione e il rilevatore in modo che solo un fascio di luce più piccolo sia focalizzato a un livello di profondità stretto alla volta. Pertanto, l'unica area visibile del campione è il punto a fuoco. Il microscopio confocale quindi raster scansiona la superficie del campione con questo fascio di luce molto più focalizzato (o un laser). I dati vengono quindi assemblati in un'immagine 2D che ha una risoluzione migliore rispetto alla microscopia ottica classica. Inoltre, poiché la luce è focalizzata su una gamma molto ristretta di altezze, l'utente può mettere a fuoco diversi piani mentre la direzione Z viene spostata. Attraverso tecniche di elaborazione delle immagini e software di automazione, i microscopi confocali aiutano nella ricostruzione 3D di immagini composite focalizzate su più piani.
I microscopi confocali hanno la capacità attraverso l'elaborazione delle immagini di fornire dati di direzione Z su un campione che in precedenza non era disponibile in microscopia ottica. Ad esempio, nella dimostrazione descritta di seguito, l'utente può definire gli intervalli di messa a fuoco superiore e inferiore per un campione e quindi non solo sviluppare una mappa termica che mostri le misurazioni della direzione z, ma anche creare un'immagine composita che mostra tutte le parti dell'immagine a fuoco. Queste funzionalità sono particolarmente utili quando si ottengono dati 3D su un campione.

Figura 4. Componenti principali di un microscopio confocale.
I componenti principali del microscopio confocale includono:
- Testa di scansione con unità Z fine e fotocamera da 4 megapixel, supporto con unità Z grossolana
- Obiettivi: 2.5x/ 5x/ 10x/ 20x/ 50x/ 100x
- Fasi: fase di scansione e fase fissa
- Sistema informatico: software di imaging del sistema PC
- Controller: movimento x, y, z
Procedura
1. Imaging confocale
- Caricare il campione sullo stage. Centralo sotto l'obiettivo. Non deve superare il limite di peso del palcoscenico, che in questo caso è di 5 kg. Il campione non deve avere uno spessore superiore a 100 mm.
- Apri il software di imaging e seleziona "Crea lavoro".
- Sotto la colonna Topografie, scegli il pulsante assistente.
- Crea un'immagine panoramica con l'ingrandimento più basso, 2,5X. Prima di cambiare gli ingrandimenti, assicurarsi che il campione sia a fuoco modificando la posizione Z fino a quando non viene visualizzata un'immagine chiara. Questo può essere fatto spingendo verso il basso o tirando verso l'alto il manipolatore del microscopio 3D. Il movimento Z più fine si ottiene impegnando il pulsante sul lato, che provoca una luce blu attorno ai bordi.
- Aumentare lentamente l'ingrandimento dell'obiettivo, giocando continuamente con l'intensità della luce e la messa a fuoco fino a raggiungere l'ingrandimento desiderato. Se lo si desidera, scegliere un'area di interesse diversa spostando il palco nelle direzioni x e y utilizzando il manipolatore.
- Una volta scattata un'immagine panoramica a basso ingrandimento, premere il pulsante Successivo per procedere al passaggio punto di riferimento. Se lo si desidera, specificare un determinato punto di riferimento ai fini della misurazione (ad esempio, l'angolo del campione), anche se a tale scopo il punto di riferimento predefinito va bene.
- Premere la freccia successiva per passare alla parte successiva della procedura guidata.
- Modificare l'obiettivo come desiderato per visualizzare una risoluzione appropriata per il campione. In questo caso, l'obiettivo 50X viene utilizzato per visualizzare le celle nel campione. Il 50X è l'obiettivo più vicino al campione, quindi spostati gradualmente fino all'obiettivo 50X assicurandoti che ci sia ancora spazio per ridurre la distanza di lavoro dopo l'obiettivo 20X.
- Nella pagina "Definizione intervallo di misurazione", spostare leggermente la posizione Z (facendo clic sul pulsante laterale sul manipolatore per le regolazioni fini) in modo che solo la parte superiore del campione sia a fuoco e fare clic su "Imposta ultimo". Quindi spostare lo stage nella direzione Z (verso il basso) fino a quando solo la parte inferiore del campione è a fuoco e premere "Imposta per primo". Assicurarsi che il numero di sezioni calcolate non superi 1000 o il programma avrà esito negativo.
- Assicurati che l'intensità della luce non si sovrasatura (causi pixel rossi) nell'immagine a nessuno dei livelli e quindi premi fatto. Questo prenderà l'immagine della tomografia e aprirà il software di tomografia.
- Nel software di tomografia, aprire schede come la scheda Studi per visualizzare i dati in 3D e prendere misure nello spazio 2D o 3D.
2. Imaging digitale al microscopio ottico
- Caricare il campione sullo stage. Centrare il campione sotto l'obiettivo. Il peso del campione non deve superare il limite di peso dello stadio, che in questo caso è di 4 kg. Il campione non deve essere superiore a 12 cm.
- Aprire il software di imaging.
- Selezionare un processo dall'elenco dei modelli forniti. È anche possibile lavorare al di fuori di un lavoro premendo Free Examination, che consente di studiare un campione al di fuori di un lavoro.
- Acquisisci un'immagine panoramica che mostri l'intero palcoscenico. Questo servirà come mappa in seguito per visualizzare la parte dell'esempio che viene visualizzata. Durante l'acquisizione dell'immagine, utilizzare il controller per modificare la messa a fuoco e la posizione dell'immagine.
- Posizionare un sistema di coordinate. Il sistema di coordinate predefinito si trova nell'angolo posteriore sinistro dello stage e va bene per questa applicazione. Se l'esempio è storto, è possibile regolare le coordinate qui.
- Assegna un nome all'esempio e al processo, questo lo aggiunge all'elenco dei processi in modo che altri utenti possano tornare ad esso.
- Selezionare il pulsante della fotocamera in Acquisisci. Scatta un'immagine iniziale, quindi premi il pulsante live mentre navighi nell'esempio.
- Spostare lo stato attivo verso il basso fino a quando il campione non è chiaramente a fuoco. Potrebbe essere necessario regolare anche l'illuminazione nella scheda "Illuminazione e apertura".
- Ottimizza l'immagine con gli strumenti del pannello Ottimizzazione immagine. È possibile giocare con diversi parametri nella scheda Miglioramenti immagine, ad esempio l'inclinazione dell'obiettivo, i livelli di illuminazione sul campione e la luminosità e il contrasto, fino a quando l'immagine non ha la nitidezza desiderata.
- Eseguire le misurazioni toccando lo strumento Matita sul software. Da lì, hai accesso a diversi strumenti di misurazione, tra cui distanze, angoli e area. Utilizzare gli strumenti di distanza e area per misurare le dimensioni del campione.
- Passare alla scheda Workflow risultati e controllare il layout del workflow per configurare il layout del report
- Tocca il pulsante Salva per salvare il tuo lavoro in modo che altri possano utilizzare lo stesso flusso di lavoro.
Risultati
Le seguenti immagini forniscono una panoramica dei risultati che possono essere ottenuti da un cervello di topo utilizzando un microscopio confocale. Mostrano come è possibile ottenere diversi livelli di informazioni e come una mappa topografica dei risultati rivela l'altezza del campione.
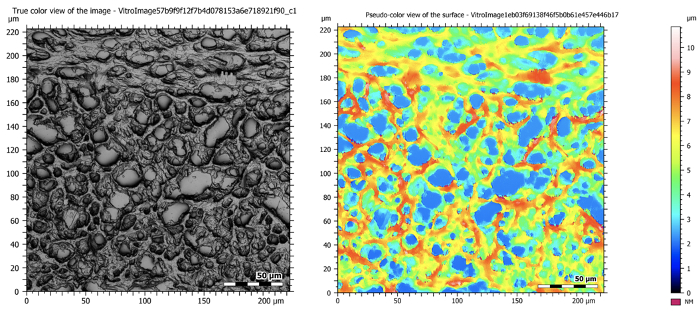
Figura 5: Immagini confocali con ingrandimento 50X che mostrano un cervello di topo sezionato. L'immagine a sinistra è un'immagine composita che prende tutti i piani a fuoco durante la tomografia e crea un'immagine ad alta risoluzione e profondamente focalizzata. L'immagine a destra mostra la mappa topografica del campione.

Figura 6: Come esempio più rappresentativo delle applicazioni 3D del microscopio confocale, è stato ripreso e analizzato un foro in plastica. La mappa topografica originale è a sinistra e la ricostruzione 3D è a destra.

Figura 7: Mostra l'estensione dell'analisi del software ConfoMap per l'osservazione di un profilo da una ricostruzione 3D. Vengono mostrati i parametri di ampiezza, il profilo di rugosità, la caratterizzazione della curva.
Le immagini seguenti forniscono una panoramica dei risultati che possono essere ottenuti utilizzando un microscopio ottico digitale sulla stessa fetta di cervello del topo. Il microscopio digitale offre un campo visivo più ampio ma immagini a risoluzione inferiore dal microscopio confocale, ideale per guardare componenti più grandi o strutture biologiche. Il software dispone di utili strumenti di analisi per misurare il campione.

Figura 8: Immagine panoramica che mostra l'intera fetta di organo.

Figura 9: Zoom nell'immagine di un cervello di topo sezionato. Ecco un campo visivo di 300 micron ottenuto con illuminazione mista coassiale e ad anello e stabilizzazione elettronica dell'immagine.

Figura 10: Dimostrazione delle capacità di misura del microscopio ottico digitale. Il diametro del campione viene misurato a sinistra e un contorno definito dall'utente che viene utilizzato per calcolare l'area interna del cervello del topo sezionato viene mostrato a destra. Questi strumenti sono utili quando si analizzano campioni biologici, che potrebbero non avere bordi uguali a forme predefinite.
Applicazione e Riepilogo
In questa dimostrazione, la profondità di messa a fuoco, il campo visivo e la massima risoluzione e ingrandimento dei microscopi ottici e confocali sono stati ottimizzati per visualizzare campioni biologici. Questa dimostrazione è stata progettata per aiutare il partecipante a decidere quale modulo di microscopia è il migliore per una determinata applicazione. Entrambe le modalità di microscopia hanno vantaggi nell'analisi di campioni biologici per la loro facilità di preparazione e immagini composite ad alta risoluzione.
Le applicazioni per la microscopia ottica e confocale sono di vasta portata. A causa della limitata preparazione del campione e della capacità di integrare piani di movimento e utilizzare tecniche di luce sopra il campione, questi strumenti sono in grado di ottenere informazioni dalla maggior parte dei set di dati. La microscopia è stata un'opzione molto popolare quando si diagnosticano cellule vive, come quelle trattate con fluorescenza, ma le applicazioni possono variare dall'imaging delle superfici dei dispositivi biomedici al rilevamento di difetti e rugosità prima di impiantarle nel corpo. La microscopia confocale e ottica sono lo standard attuale per l'imaging di campioni biologici.
Infine, la microscopia confocale offre immagini migliorate con tecniche di fluorescenza. I fluorofori in un campione hanno una durata limitata e possono foto-candeggiare se esposti a elevate quantità di luce. Nella microscopia ottica tradizionale, l'intero campione viene illuminato durante l'imaging, il che si traduce in un rapido foto-sbiancamento. Tuttavia, poiché solo una piccola parte del campione è illuminata contemporaneamente con la microscopia confocale, la durata del fluoroforo è più lunga e ci sono meno sfide associate al foto-sbiancamento.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
36.3K Visualizzazioni

Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
24.1K Visualizzazioni

Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.6K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.8K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.9K Visualizzazioni

Imaging a risonanza magnetica cardiaca
Biomedical Engineering
15.0K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
12.0K Visualizzazioni

Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.4K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
12.1K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
107.1K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.7K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.3K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.3K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.2K Visualizzazioni