光学・共焦点顕微鏡による生体試料のイメージング
概要
出典:ペイマン・シャーベイギ・ルードポシュティとシナ・シャーバズモハマディ、バイオメディカル工学部、コネチカット大学、ストールズ、コネチカット州
光学顕微鏡は何世紀にもわたって行われており、数十年前に解像度の理論的限界に達する一方で、共焦点画像処理やデジタル画像処理などの新しい機器や技術は、光学の分野で新しいニッチを生み出しました。イメージング。最高の光学顕微鏡は、通常、理想的な条件で200 nmまでの分解能を有する。しかしながら、光学顕微鏡は波の回折によって制限され、波長の関数であり、可視光に対しては約500nmである。光学顕微鏡の分解能は電子顕微鏡の分解能には達しないが、生物学的大構造のイメージングにおいて最も貴重なツールであり、あらゆる生物学的実験室の定番である。
従来の光顕微鏡では、画像化された物体から生成される信号は、検体の全厚さからであり、そのほとんどが観察者に焦点を合わせることは許されない。これにより、画像に "フォーカスがぼやけていない" 可能性が高くなります。一方、共焦点顕微鏡はピンホールを通してサンプルを照らし、物体の焦点の上下から焦点外の光を除去することができる。
このデモでは、光学顕微鏡法と共焦点顕微鏡法を用いた画像集録の概要を説明します。ここでは、マウスの脳の切り離された部分を研究します。 地形図や合成画像を生成するツールなど、画像の取得と解析について説明します。解像度、焦点深度、サンプルタイプに関連するさまざまなイメージング方法の長所と短所についても説明します。このデモンストレーションの目的は、光学顕微鏡および共焦点顕微鏡に関するより多くの情報を提供し、これらの顕微鏡検査モジュールが生物学的サンプルの一種に最も適しているかどうかを判断することです。
原則
光学顕微鏡は、倍率の少なくとも2つの要素を用いて機能する。目的と呼ばれる一次レンズは総倍率を決定し、接眼レンズと呼ばれる二次レンズは、表示用の仮想画像に焦点を当てます。総倍率は、2つのレンズの倍率を乗じて決定されます。これらの光源を通る光の焦点は、ランプからサンプルへの光の焦点と相まって、倍率とランプライトがすべて同じ点で交わされる特定の焦点面を与え、画像内で最良の解像度を与えます。次の図は、異なるレンズを介して標本の焦点面がどのように作成されるかを示しています。焦点面の外側のオブジェクトは、照明の面積が大きいため、サンプルの他の部分から干渉する光のビームを持ちます。これにより、イメージがぼやけます。したがって、高さが大きく異なるサンプルの異なる Z 位置に焦点を当てるには、Z 方向スライスを焦点平面に移動する必要があります。

図 1.光学顕微鏡レンズと焦点面。
デジタル顕微鏡は光学マイクロプスコープと同じ原理で動作しますが、接眼時計に依存しない点を除きます。デジタルカメラを搭載した光学顕微鏡です。デジタル カメラは検出器として機能し、画像はコンピュータ モニタに表示されます。これらの顕微鏡は、研究開発(R&D)、製造および検査、品質管理および保証(QC/QA)、および故障分析(FA)中のサンプルの分析および文書化に最適です。通常、ユーザーがサンプル イメージを分析できるソフトウェアを提供します。図2は、典型的なデジタル顕微鏡のセットアップを示しています。

図 2.デジタル顕微鏡の主な構成要素。
システムの主なコンポーネントは次のとおりです。
- 光学エンジン:画像を拡大するための画像集録センサーとレンズが含まれています。
- 目的: サンプルから光を取得し、焦点を当てます。さまざまな画像取得タスクでは、3 つの異なる目的を使用できます。
- スキャンステージ: サンプルを配置する場所。
- 顕微鏡の立場:光学エンジンおよび走査段階のためのサポートを提供する。また、接続されているコンポーネントとコンピュータ間の通信も制御します。
- コンピューター: ユーザー ソフトウェアをサポートし、イメージをモニターで表示できるようにします。
- コントローラー: マルチタッチ ジェスチャとタッチに敏感なコンテキスト固有のアイコンを使用して、顕微鏡とワークフローを制御します。コントロールノブは、ズーム、フォーカス、顕微鏡の画像位置を制御します。
共焦点顕微鏡、または共焦点レーザー走査顕微鏡(CLSM)は、光学分解能とコントラストを高めた顕微鏡です。共焦点とは「同じ焦点を持つ」ことを意味します。オブジェクトとそのイメージは「共焦点」です。
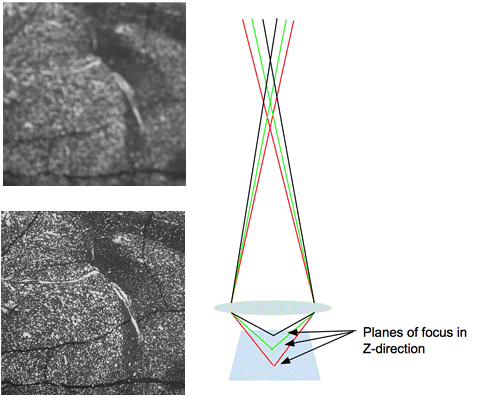
図 3.イメージに対するぼかしとその効果。左の画像は、エッジがぼやけたフォーカスの外側の画像を示しています。右の画像は、焦点を合わせられているサンプルをイメージングする際のレンズを通る光の経路を示しています。
サンプル全体を照らして画像化する一般的な光顕微鏡とは対照的に、共焦点顕微鏡はサンプルステージと検出器の間のピンホールを利用して、一度に1つの狭い深さレベルで小さな光ビームだけが集結するようにします。したがって、サンプルの可視領域はフォーカス内の点のみです。共焦点顕微鏡は、このはるかに焦点を当てた光(またはレーザー)でサンプルの表面をスキャンします。その後、データは、古典的な光学顕微鏡よりも優れた解像度を持つ1つの2D画像に組み立てられます。また、光は非常に狭い高さの範囲に焦点を当てているので、ユーザーはZ方向が移動するにつれて異なる平面を焦点に置くことができます。画像処理技術と自動化ソフトウェア共焦点顕微鏡を通じて、マルチプレーンに焦点を当てた合成画像の3D再構成に役立ちます。
共焦点顕微鏡は、画像処理を通じて、これまで光学顕微鏡では利用できなかったことのあるサンプルに関するZ方向データを提供する能力を有する。たとえば、次に説明するデモンストレーションでは、ユーザーはサンプルの焦点の上限と下限を定義し、Z 方向の測定値を示すヒート マップを作成するだけでなく、イメージのすべての部分を示す合成イメージを作成できます。フォーカス。これらの機能は、サンプルに関する 3-D データを取得する場合に特に役立ちます。

図 4.共焦点顕微鏡の主成分。
共焦点顕微鏡の主な構成要素は次のとおりです。
- 細かいZドライブと4メガピクセルのカメラでヘッドをスキャンし、粗いZドライブで立つ
- 目的: 2.5x/ 5x/ 10x/ 20x/ 50x/ 100x
- ステージ: スキャンステージと固定ステージ
- コンピュータシステム:PCシステムイメージングソフトウェア
- コントローラ: x、y、z モーション
手順
1. 共焦点イメージング
- サンプルをステージにロードします。レンズの下の中央に配置します。これは、この場合は5キロである段階の重量制限を超えてはなりません。サンプルは100mm以下の厚さでなければなりません。
- イメージングソフトウェアを開き、「ジョブの作成」を選択します。
- [地形] 列で、アシスタント ボタンを選択します。
- 最も低い倍率 2.5X で概要イメージを作成します。倍率を切り替える前に、鮮明な画像が表示されるまで Z 位置を変更して、サンプルにフォーカスがあることを確認します。これは、3D顕微鏡マニピュレータを押し下げたり引き上げたりすることで行うことができます。細かいZモーションは、エッジの周りに青色の光を引き起こす側面のボタンを係動することによって達成されます。
- ゆっくりとレンズの倍率を上げ、光の強度と焦点で連続的に再生し、所望の倍率になるまで。必要に応じて、マニピュレータを使用してステージを x 方向と y 方向に移動して、別の対象領域を選択します。
- 低倍率で概要画像を撮影したら、次のボタンを押して[参照ポイント]ステップに進みます。必要に応じて、測定のために特定の基準点(サンプルのコーナー)を指定しますが、この目的のためにデフォルトの基準点は問題ありません。
- 次の矢印を押して、ウィザードの次の部分に進みます。
- 必要に応じて目標を変更して、サンプルに適した解像度を確認します。この場合、50X対物レンズを使用してサンプル内の細胞を可視化します。50Xはサンプルに最も近いレンズなので、50X目標まで徐々に上がり、20Xレンズ後の作業距離を短くする余地があることを確認します。
- [範囲定義の測定] ページで、Z 位置を少し移動し (マニピュレータのサイド ボタンをクリックして微調整します)、サンプルの一番上だけがフォーカスを合わせ、[最後に設定] をクリックします。次に、サンプルの一番下だけがフォーカスされるまで Z 方向(下向き)にステージを移動し、「最初に設定」を押します。計算されたスライスの数が 1000 を超えていないこと、またはプログラムが失敗することを確認してください。
- 光の強度が、いずれかのレベルで画像内で過飽和(赤いピクセルを引き起こす)しないことを確認してから、ヒットを行います。これは、断層撮影画像を取り、断層撮影ソフトウェアを開きます。
- 断層撮影ソフトウェアで、[スタディ]タブなどのタブを開いてデータを 3D で表示し、2D または 3D 空間で計測します。
2. デジタル光学顕微鏡イメージング
- サンプルをステージにロードします。サンプルをレンズの下に中央揃えします。サンプル重量は、この場合は4キロである段階の重量制限を超えてはなりません。サンプルは12cm以下でなければなりません。
- イメージング ソフトウェアを開きます。
- 表示されるテンプレートの一覧からジョブを選択します。また、無料試験を押すことで仕事以外で仕事をすることも可能です。
- ステージ全体を示す概要画像を取得します。これは、後で表示されているサンプルの一部を表示するマップとして機能します。画像を取得する際は、コントローラを使用してフォーカスと画像位置を変更します。
- 座標系を配置します。既定の座標系はステージの左下隅から取得され、このアプリケーションでは問題ありません。サンプルが曲がっている場合は、ここで座標を調整できます。
- サンプルとジョブに名前を付けます。
- [取得] の下にあるカメラ ボタンを選択します。初期イメージを取得し、サンプルをナビゲートしながらライブ ボタンを押します。
- サンプルに明らかに焦点が合うまで、フォーカスを下に移動します。[照明と絞り]タブの照明も調整する必要がある場合があります。
- [画像の最適化] パネルのツールを使用して、イメージを最適化します。レンズの傾き、サンプルの照明レベル、明るさとコントラストなど、画像が目的の鮮明さを得るまで、さまざまなパラメータを使用して再生できます。
- ソフトウェアの鉛筆ツールをタップして測定を実行します。そこから、距離、角度、面積など、複数の計測ツールにアクセスできます。距離ツールと面積ツールを使用して、サンプルのサイズを測定します。
- [結果ワークフロー ] タブに移動し、ワークフロー レイアウトを確認してレポートのレイアウトを構成します。
- 保存ボタンをタップしてジョブを保存し、他のユーザーが同じワークフローを使用できるようにします。
結果
以下の画像は、共焦点顕微鏡を用いてマウス脳から得られる結果の概要を示す。さまざまなレベルの情報を取得する方法と、結果の地形図がサンプルの高さを明らかにする方法を示します。
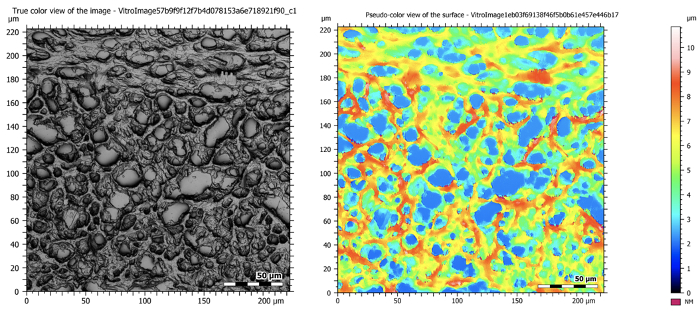
図5:切り離されたマウス脳を示す50X倍率の共焦点画像。左側の画像は、断層撮影中にすべてのインフォーカス平面を撮影し、高解像度で深く焦点を当てた画像を作成する合成画像です。右側の図は、サンプルの地形図を示しています。

図6:共焦点顕微鏡の3D用途のより良い代表例として、プラスチック中の穴を画像化し、分析した。元の地形図は左側にあり、3D 再構築は右側にあります。

図7:3D再構成からプロファイルを観察するためのConfoMapソフトウェア分析の範囲を示す。振幅パラメータ、粗さプロファイル、曲線特性評価が表示されます。
次の図は、同じマウス脳スライス上のデジタル光学顕微鏡を使用して得られる結果の概要を示しています。デジタル顕微鏡は、より大きな視野を与えるが、より大きな部品や生物学的構造を見て理想的である共焦点顕微鏡からの低解像度の画像を与える。ソフトウェアは、サンプルを測定するための有用な分析ツールを備えています。

図8:臓器スライス全体を示す概要画像

図9:切り離されたマウス脳の画像を拡大した。ここでは、同軸照明とリング照明、および電子画像安定化を混合して得られた300ミクロンの視野を示します。

図10: デジタル光学顕微鏡の測定能力を実証する。サンプルの直径は左側で測定され、断面化されたマウス脳の内部領域の計算に使用されるユーザー定義のアウトラインが右側に表示されます。これらのツールは、定義済みの形状と同じエッジを持たない可能性がある生物学的サンプルを分析する場合に便利です。
申請書と概要
このデモンストレーションでは、光学顕微鏡と共焦点顕微鏡の焦点深度、視野、最大解像度と倍率を最適化し、生体試料を見た。このデモンストレーションは、特定のアプリケーションに最適な顕微鏡モジュールを参加者が判断できるように設計されています。顕微鏡検査の両方のモードは、調製の容易さと高解像度の合成画像のための生物学的サンプルを分析する利点があります。
光学顕微鏡および共焦点顕微鏡の応用は広範囲に及ぶ。サンプルの準備が限られており、動き面を統合して上記の光技術を使用できるため、これらのツールはほとんどのデータセットから情報を取得できます。顕微鏡検査は、蛍光で治療されたものなど、生細胞をイメージングする際に非常に一般的な選択肢でしたが、バイオメディカルデバイスのイメージング表面から、体内に埋め込む前の欠陥や粗さを検出する用途まで多岐にわたります。共焦点および光学顕微鏡は生体試料をイメージするための現在の標準である。
最後に、共焦点顕微鏡は蛍光技術によって改善されたイメージ投射を提供する。サンプル中の蛍光色素は寿命が限られており、大量の光にさらされると光漂白することができます。従来の光顕微鏡では、画像化中にサンプル全体が照らされ、迅速な光漂白が行われる。しかし、共焦点顕微鏡で一度に照らされたサンプルのごく一部だけなので、蛍光性の寿命は長くなり、光漂白に伴う課題は少ない。
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
光学・共焦点顕微鏡による生体試料のイメージング
Biomedical Engineering
36.3K 閲覧数

生体試料のSEMイメージング
Biomedical Engineering
24.1K 閲覧数

ナノドラッグキャリアのバイオディストリビューション:SEMの応用
Biomedical Engineering
9.6K 閲覧数

腹部大オルタの高周波超音波イメージング
Biomedical Engineering
14.8K 閲覧数

腹部大動脈瘤の定量的ひずみマッピング
Biomedical Engineering
4.6K 閲覧数

インフラレナル大オルタにおける血液と脂質を画像化する光音響断層撮影
Biomedical Engineering
5.9K 閲覧数

心臓磁気共鳴イメージング
Biomedical Engineering
15.0K 閲覧数

脳動脈瘤における血流の計算流体力学シミュレーション
Biomedical Engineering
11.9K 閲覧数

腹部大動脈瘤の近赤外蛍光イメージング
Biomedical Engineering
8.4K 閲覧数

非侵襲的な血圧測定技術
Biomedical Engineering
12.1K 閲覧数

心電図(心電図)信号の獲得と解析
Biomedical Engineering
107.0K 閲覧数

リバーブルバイオマテリアルの引張強度
Biomedical Engineering
7.7K 閲覧数

マウス脊髄のマイクロCTイメージング
Biomedical Engineering
8.3K 閲覧数

ラットにおける非侵襲的ACL損傷後の膝関節変性の可視化
Biomedical Engineering
8.3K 閲覧数

SPECTとCTイメージングを組み合わせて心臓機能を可視化
Biomedical Engineering
11.2K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved