Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Panoramica
Fonte: Gurneet S. Sangha e Craig J. Goergen,Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
La tomografia fotoacustica (PAT) è una modalità di imaging biomedico emergente che utilizza onde acustiche generate dalla luce per ottenere informazioni compositivi dai tessuti. Pat può essere utilizzato per l'immagine di componenti del sangue e dei lipidi, che è utile per un'ampia varietà di applicazioni, tra cui l'imaging cardiovascolare e tumorale. Le tecniche di imaging attualmente utilizzate hanno limitazioni intrinseche che ne limitano l'uso con ricercatori e medici. Ad esempio, lunghi tempi di acquisizione, costi elevati, uso di contrasti dannosi e invasività da minima a elevata sono tutti fattori che limitano l'uso di varie modalità in laboratorio e in clinica. Attualmente, le uniche tecniche di imaging paragonabili alla PAT sono le tecniche ottiche emergenti. Ma questi hanno anche degli svantaggi, come la limitata profondità di penetrazione e la necessità di mezzi di contrasto esogeni. PAT fornisce informazioni significative in modo rapido, non invasivo e privo di etichette. Se accoppiato con gli ultrasuoni, il PAT può essere utilizzato per ottenere informazioni strutturali, emodinamiche e compositive dal tessuto, integrando così le tecniche di imaging attualmente utilizzate. I vantaggi del PAT illustrano le sue capacità di avere un impatto sia in ambito preclinico che clinico.
Principi
PAT è una modalità ibrida che utilizza onde acustiche indotte dalla luce per ottenere informazioni compositivi dal tessuto. La propagazione acustica è attribuita all'espansione termoelastica. Ciò si verifica quando specifici legami chimici in un tessuto assorbono la luce e l'aumento della temperatura ambiente provoca l'espansione del tessuto. Per elaborare, specifici legami chimici assorbono la luce, facendo vibrare la molecola e convertono parte di questa energia vibrazionale in calore. Questa produzione di calore provoca l'espansione locale del tessuto, che induce propagazioni acustiche che possono essere rilevate da un trasduttore ad ultrasuoni. Per indurre l'effetto fotoacustico, devono essere soddisfatte sia le condizioni termiche che di confinamento da stress per ridurre al minimo la dissipazione del calore e consentire alla pressione indotta termoelasticamente di accumularsi all'interno del tessuto. L'onda di pressione fotoacustica risultante può essere caratterizzata dall'equazione (1), che afferma che l'onda acustica indotta dalla luce (Po) è governata dal parametro di Grueneisen dipendente dalla temperatura (Γ), dal coefficiente di assorbimento (μa) e dalla fluenza ottica locale (F).
Po = ΓμaF Equazione 1
Di conseguenza, ogni aumento di temperatura mK produce tipicamente un'onda di pressione di 800 Pascal che può essere rilevata utilizzando un trasduttore ad ultrasuoni. Questo assorbimento selettivo della luce consente agli utenti di indirizzare vari componenti biologici regolando la lunghezza d'onda della luce, ad esempio utilizzando la luce a 1100 nm per indirizzare il sangue e la luce a 1210 nm per indirizzare i lipidi. Inoltre, poiché la luce viene utilizzata per indurre la propagazione delle onde acustiche, questa tecnica può essere utilizzata per immagini tipicamente più profonde rispetto ad altre tecniche ottiche senza la necessità di agenti di contrasto o procedure invasive. Questo metodo specifico che utilizza la luce a lunga lunghezza d'onda nella seconda luce della finestra nel vicino infrarosso per indurre onde acustiche offre numerosi vantaggi all'utente, consentendo al PAT vibrazionale (o VPAT) di essere potenzialmente utilizzato per una vasta gamma di applicazioni biomediche.
Procedura
La seguente procedura descrive i metodi necessari per impostare VPAT per l'imaging ematico e lipidico dell'aorta infrarenale in topi con deficit di apolipoproteina-E (apoE-/-).
1. Accoppiamento laser-ultrasuoni
- Ottenere un laser a oscillatore ottico parametrico pulsato Nd:YAG e un sistema ad ultrasuoni. Acquisire un generatore di impulsi, 1 cavo BNC e un connettore D collegato a due cavi BNC.
- Utilizzando la configurazione del connettore D, collegare il cavo BNC "Fire" alla porta A del generatore di impulsi e "Q-switch" alla porta B del generatore di impulsi. Infine, collegare un cavo BNC dalla porta C per "innescare" sul retro del sistema a ultrasuoni.
- Allineare il cavo in fibra ottica con il laser e collegare le estremità della fibra ai lati del trasduttore a ultrasuoni a 40 MHz.
- Regolare il ritardo delle porte A, B e C in funzione dei valori elencati qui (Porta A: 0,00000000, porta B: 0,00021440, porta C: 0,00000910). Impostare le porte A e B sul segnale invertito e la porta C sul segnale normale.
2. Preparazione degli animali e acquisizione di immagini
- Anestetizzare un mouse apoE-/- usando il 3% di isoflurano in una camera di induzione dell'anestesia. Una volta che l'animale è anestetizzato, spostare il mouse su un cono nasale per fornire l'1-2% di isoflurano.
- Applicare la lubrificazione oculare agli occhi degli animali per prevenire l'essiccazione corneale. Fissare le zampe del topo agli elettrodi integrati nello stadio riscaldato per monitorare la respirazione e la frequenza cardiaca dell'animale. Infine, inserire la sonda rettale per monitorare la temperatura corporea.
- Applicare la crema depilatoria per rimuovere i peli dall'addome dell'animale. Pulire dopo 30 s con una garza.
- Posizionare il trasduttore ad ultrasuoni sull'addome dell'animale e individuare l'aorta infrarenale. La vena renale sinistra e la triforcazione aortica nell'arteria della coda sono due punti di riferimento che aiuteranno l'utente a localizzare quest'area.
- Eseguire il laser per emettere luce a 1100 nm per indirizzare il sangue seguito da una luce a 1210 nm per indirizzare il lipide. Utilizzare occhiali di sicurezza laser appropriati quando il laser è in uso.
Risultati
Qui, i metodi VPAT sono stati utilizzati per eseguire l'imaging specifico dei lipidi e del sangue in vivo. Accoppiando un sistema laser e ultrasuoni, la luce è stata consegnata ai tessuti e sono state rilevate le onde acustiche risultanti. L'imaging ad ultrasuoni ci ha permesso di ottenere informazioni strutturali dell'aortainfrarenale (Figura 1a)che possono essere utilizzate per interpretare meglio le informazioni compositivi VPAT. In particolare, è stata utilizzata una luce di 1100 nm per l'immagine del sangue all'interno dell'aorta (Figura 1b) e una luce di 1210 nm è stata utilizzata per l'immagine dell'accumulo di grasso sottocutaneo e periaortico (Figura 1c). Dalle immagini ecografiche e VPAT, si può vedere che il grasso sottocutaneo segue la geometria della pelle, il grasso periaortico segue il contorno dell'aorta e il segnale sanguigno proviene dall'interno dell'aorta. Questi risultati confermano che, in effetti, VPAT può essere utilizzato per l'immagine del sangue e dell'accumulo di lipidi in vivo.
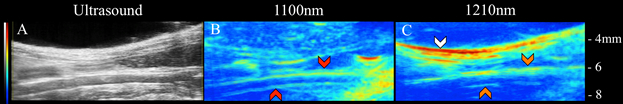
Figura 1: Ultrasuoni (a sinistra), VPAT nel sangue (al centro) e immagini lipidiche VPAT (a destra) di ApoE-/-. Il grasso sottocutaneo (frecce bianche), il grasso periaortico (frecce arancioni) e il sangue (frecce rosse) sono chiaramente visibili.
Applicazione e Riepilogo
VPAT è un metodo rapido, non invasivo e privo di etichette per l'immagine dell'accumulo di sangue e lipidi in vivo. Fornendo luce laser pulsata ai tessuti, sono state indotte propagazioni acustiche per ottenere densità relativa e localizzare componenti biologici. Se accoppiato con l'imaging a ultrasuoni, è possibile risolvere le informazioni compositive, strutturali ed emodinamiche dal tessuto. Un limite attuale di questa tecnica è la sua profondità di penetrazione, che è di circa 3 mm per l'imaging a base lipidica. Mentre questo è meglio delle attuali tecniche ottiche, i miglioramenti alle tecniche di erogazione della luce migliorerebbero la profondità di penetrazione. Un modo per migliorare questo è lo sviluppo di un trasduttore fotoacustico che massimizza l'erogazione della luce nella regione di interesse reindirizzando la luce riflessa nel tessuto. Mentre VPAT è una tecnica di imaging che è ancora agli inizi, ha ricevuto un grande interesse negli ultimi anni, rendendo probabile che questa tecnica sarà utilizzata in più laboratori e cliniche in futuro.
Il protocollo descritto può essere utilizzato per un'ampia varietà di applicazioni sia in ambito preclinico che clinico. Tre potenziali applicazioni VPAT includono l'utilizzo della tecnica per 1) studiare la progressione della malattia basata sui lipidi, 2) valutare terapie promettenti e 3) migliorare la diagnosi delle malattie a base lipidica. La capacità di tracciare le informazioni strutturali, emodinamiche e compositive rende VPAT una tecnologia interessante per studiare come i lipidi vascolari si accumulano nei modelli di piccoli animali (Figura 1). Inoltre, poiché il VPAT è un metodo non invasivo, può essere applicato per valutare gli effetti delle terapie negli studi longitudinali. Ciò potrebbe ridurre specificamente il costo della ricerca diminuendo il numero di animali necessari per la convalida della terapia. Infine, la capacità del VPAT di fornire informazioni compositive rende una tecnica interessante per l'immagine di diversi tipi di placche in pazienti che soffrono di malattie aterosclerotiche come la carotide e la malattia delle arterie periferiche. Una delle sfide attuali nella medicina cardiovascolare è prevedere quali placche sono soggette a rottura e quindi hanno il potenziale per indurre infarto miocardico e ictus ischemico. Pertanto, VPAT può anche svolgere un ruolo importante nella caratterizzazione di placche vulnerabili rispetto a placche stabili, grazie alla sua capacità di differenziare i componenti biologici. Nel complesso, VPAT ha il potenziale per avere un impatto significativo sia nella ricerca che nella pratica clinica della medicina.
Elenco dei materiali
| Nome | Società | Numero di catalogo | Commenti |
| Apparecchiature VPAT | |||
| Sistema ad ultrasuoni | VisualSonics | Vevo2100 · | |
| Nd: YAG OPO Laser | Continuum | Surelite EX | |
| Generatore di impulsi di zaffiro | Compositori quantistici | 9200 | 4 porte richieste |
| Cavi BNC | Laboratori Thor | 2249-C-120 | Diametro esterno 0,2'',la lunghezza del cavo BNC dipende dalle preferenze dell'utente. |
| Connettore B collegato a due cavi BNC | L-com | CTL4CAD-1,5 | Continuum fornisce anche questo connettore |
| Occhiali ottici | LaserShield | #37 0914 UV400 | Qualsiasi maschera con OD 7+ sarà sufficiente. |
Vai a...
Video da questa raccolta:

Now Playing
Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.9K Visualizzazioni

Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
36.0K Visualizzazioni

Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
24.0K Visualizzazioni

Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.5K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.8K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Imaging a risonanza magnetica cardiaca
Biomedical Engineering
15.0K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
11.9K Visualizzazioni

Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.4K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
12.1K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
106.5K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.5K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.2K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.3K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.2K Visualizzazioni