Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Panoramica
Fonte: Peiman Shahbeigi-Roodposhti e Sina Shahbazmohamadi, Dipartimento di Ingegneria Biomedica, Università del Connecticut, Storrs, Connecticut
Le nanoparticelle sono state sempre più utilizzate nella ricerca verso la somministrazione mirata di farmaci e il rilascio controllato di farmaci. Mentre la maggior parte di queste particelle sono state sviluppate come particelle polimeriche o liposomiali a causa della loro biocompatibilità, c'è una tendenza nella ricerca attuale verso l'uso di nanoparticelle metalliche e magnetiche. Queste nanoparticelle metalliche sono state originariamente utilizzate come mezzo di contrasto nell'imaging, ma i recenti progressi hanno dimostrato quanto possano essere importanti nella somministrazione di farmaci e geni e nelle terapie. L'oro, l'argento e le nanoparticelle paramagnetiche hanno la maggior parte nella ricerca in corso. Hanno dimostrato di avere una buona biocompatibilità e alcune varietà di nanoparticelle magnetiche sono già state sviluppate e distribuite come farmaci terapeutici mirati.
Questi elementi pesanti sono in genere ripresi per la ricerca utilizzando la fluorescenza per valutare la consegna e la distribuzione, ma i loro pesi atomici sono buone qualifiche per un maggiore contrasto nell'analisi elettronica backscatter utilizzando un microscopio elettronico a scansione (SEM). La spettroscopia a raggi X a dispersione di energia, che utilizza i raggi X caratteristici emessi dall'interazione del fascio di elettroni con il campione per identificare la composizione chimica, può essere utilizzata anche con il SEM. Questi metodi hanno i vantaggi di una maggiore risoluzione e di una maggiore fiducia nel rilevamento, in quanto l'EDS può garantire che il soggetto di un'immagine sia della giusta composizione, mentre gli attuali metodi di fluorescenza possono staccarsi dalle nanoparticelle e possono svanire rapidamente durante l'imaging.
Questa dimostrazione esaminerà la distribuzione delle nanoparticelle metalliche dipendenti dalle dimensioni negli organi del corpo nel tempo. Gli organi asportati saranno esaminati con SEM per varie dimensioni di particelle in un intervallo di tempo dopo la consegna delle particelle al corpo.
Principi
È difficile sopravvalutare l'importanza delle nanoparticelle (NP) per le applicazioni mediche. Sono usati come farmaci, portatori di farmaci, agenti di contrasto, ecc. Tuttavia, per utilizzare un certo tipo di nanoparticelle è necessario sapere come e dove verrà distribuito in ciascun organo dopo l'applicazione e quanto tempo ci vorrà prima di lasciare l'organo e, successivamente, il corpo. Questo è chiamato la sua biodistribuzione.
Il processo di somministrazione di farmaci con nanoparticelle può variare ampiamente nella sua complessità, dai farmaci passivi che non prendono di mira il tessuto ma vengono invece rilasciati in tutto il corpo, al targeting più attivamente manipolato dei farmaci a un organo o posizione molto precisa. La maggior parte dei farmaci e delle terapie utilizzerà il targeting passivo, che mostra ancora un grande successo a causa della maggiore permeabilità e ritenzione (effetto EPR) nei tumori con grandi quantità di flusso sanguigno e elevate quantità di perdite vascolari. Oltre al targeting passivo, il targeting attivo può essere fatto nell'elaborazione delle nanoparticelle attraverso l'attaccamento di ligandi specifici del sito tumorale, o può essere fatto dopo l'iniezione aggiungendo una forza magnetica alle nanoparticelle magnetiche. Questo campo magnetico estrae le nanoparticelle dal flusso sanguigno verso l'area colpita, riducendo così il tempo che il medicinale trascorre nel flusso sanguigno e aumentando la dose nella zona interessata. Questi diversi metodi di somministrazione dovrebbero influenzare notevolmente la distribuzione delle nanoparticelle dopo il trattamento, e questo esperimento mira a studiare sia la loro distribuzione iniziale, sia la loro distribuzione nel tempo.
Gli attuali metodi di misurazione della distribuzione delle nanoparticelle di solito comportano l'attaccamento di particelle di fluorescenza sulle nanoparticelle. A seconda della concentrazione delle nanoparticelle, delle dimensioni dell'area target e dell'intensità della fluorescenza, i topi traslucidi possono essere analizzati utilizzando l'imaging ottico mentre sono ancora vivi per determinare se le particelle si trovano nell'area corretta. La fluorescenza post-mortem può anche essere utilizzata per determinare i livelli di nanoparticelle in diversi organi di topi. Tuttavia, questi metodi mancano della risoluzione delle nanoparticelle e dell'affermazione che la fluorescenza non si è staccata dalle nanoparticelle.
L'attuale dimostrazione sfrutta la microscopia elettronica retrodisturbata (BEM) e la spettroscopia a dispersione di energia (EDS) per comprendere la biodistribuzione delle nanoparticelle magnetoelettriche (MEN) a seconda delle loro dimensioni e del tempo trascorso nel corpo. I MEN nel campione sono nanoparticelle magnetoelettriche di bario e titanio che sono state introdotte negli organi di topo attraverso l'iniezione e quindi mirate passivamente agli organi. I topi sono stati resi incoscienti e i loro organi rimossi e conservati a 1 settimana, 4 settimane e 8 settimane dopo l'iniezione. Gli organi: fegato, milza, polmoni, reni e cervello, sono stati quindi sezionati utilizzando una macchina a microtomo e preparati utilizzando i metodi di preparazione dei campioni descritti nel video educativo "SEM Imaging of Biological Samples". Come modalità di microscopia elettronica a scansione (SEM), BEM insieme all'analisi EDS fornisce un'analisi composizionale ad alta risoluzione che consente di rilevare singole nanoparticelle di diametro fino a 10 nm. Nel frattempo, questa dimostrazione può illustrare come diversi rivelatori possono essere utilizzati per rilevare, confermare e mappare diversi elementi e particelle in un ambiente di ricerca e anche come diversi parametri possono influenzare l'immagine risultante.
Procedura
1. Iniezione di nanoparticelle e prelievo di organi
- Iniettare nanoparticelle in un topo anestetizzato per via endovenosa per consentire il targeting passivo.
- Nei momenti desiderati, cioè 1, 4 e 8 settimane, dopo l'iniezione, eutanasizzano umanamente i topi secondo le linee guida dell'American Veterinary Medical Association (AVMA).
- Aprire la cavità corporea e rimuovere chirurgicamente gli organi di interesse. Mettere gli organi in formalina tamponata al 10% di fosfato in un contenitore di polipropilene fino alla preparazione del campione.
2. Preparazione del campione di tessuto
- Utilizzare una pinna per trasferire il tessuto di topo dal fissativo alla soluzione salina tamponata con fosfato (PBS). Scuotere il campione per 30 minuti, sostituendo il PBS ogni 10 minuti.
- Rimuovere il tessuto e asciugare con un kimwipe. Quindi posizionarlo in uno stampo di plastica contenente un composto di temperatura di taglio ottimale (OCT). Conservare a -80 °C durante la notte.
- Il giorno successivo, trasferire il campione al criostato e impostare la temperatura a -23 °C.
- Etichettare i vetrini con il tipo di organo e la dimensione delle nanoparticelle e posizionarli su uno scaffale nel criostato.
- Coprire il mandrino criostato con OCT e posizionare il campione sopra. Abbassare lo stantuffo dell'estrattore sul campione e lasciarlo equilibrare per 3-5 minuti.
- Montare il mandrino sul portacampioni e orientarlo in modo che la lama possa tagliare dritto attraverso il campione congelato. Avvicinare il campione alla lama per un rivestimento ruvido. Impostare lo spessore a 30 μm e affettare diverse sezioni fino a produrre una fetta tagliata uniformemente.
- Passare alla faccia fine diminuendo lo spessore della sezione a 7-8 μm. Raccogliere una sezione affettata premendo un vetrino etichettato sulla fetta. Posizionare due diapositive su ciascuna diapositiva e conservare in un rack di scorrimento. Lasciare asciugare a temperatura ambiente.
- Una volta asciutti, disidratare i campioni immergendo il portaslivelli in etanolo al 50% per 3 minuti per rimuovere l'OCT. Quindi trasferire il rack all'80% di etanolo per 3 minuti prima di posizionare il rack in un rapporto 1: 1 di metanolo freddo ad acetone per 10 minuti a -20 ° C.
- Rimuovere la griglia scorrevole e scaricare il solvente in eccesso su un tovagliolo di carta. Dopo 20-30 minuti, posizionare i vetrini in una scatola di diapositive e conservare in un congelatore a -20 °C fino all'imaging.
3. Imaging ad alta risoluzione con SEM ed EDS
- Preparare il campione come descritto in "SEM Imaging di campioni biologici". Quindi caricare il campione nel SEM.
- Accendere il SEM e regolare la distanza di lavoro a circa 5 mm e la tensione di accelerazione e la corrente del fascio a 25 keV, che normalmente sarebbero troppo alte per un campione biologico. Tuttavia, il campione è rivestito per conduttività e protezione.
- Inizia l'imaging e ingrandisci fino a circa 1.000-2.000X di ingrandimento per vedere le strutture che conterrebbero le nanoparticelle. Si noti che senza il rilevamento back-scatter (BSD) non è possibile distinguerli al di sotto di una certa profondità.
- Inserite il BSD con gli stessi parametri e spostate lo stage nella direzione z alla stessa distanza di lavoro di prima.
- Inizia a visualizzare all'incirca lo stesso ingrandimento e controlla di essere in grado di vedere un contrasto elevato in presenza di nanoparticelle. Salva le immagini.
- Utilizzare diverse configurazioni BSD (in cui le cariche sul rilevatore si allineano) per scegliere quella che mostra il contrasto più elevato per le nanoparticelle.
- Zoom su un'area ad alto contrasto che mostra una nanoparticella o un grumo di nanoparticelle.
- Aprire la2a telecamera della camera e guardare come si inserisce l'EDS nel sistema premendo il pulsante giù sull'attacco SEM. Una volta che l'EDS è vicino ma non tocca il BSD o la pistola, rilascia il pulsante.
- Apri il programma Aztec sul computer EDS (ancora sulla postazione di lavoro) e acquisisci un'immagine dal SEM. Usa il metodo "punta e spara" per fare clic su un'area molto densa in contrasto e nanoparticelle.
- L'EDS mostrerà lo spettro dei raggi X caratteristici da quel punto. Cerca sia i picchi di bario che quelli di titanio da identificare sul grafico. Ciò conferma che ciò che si sta osservando sono effettivamente le nanoparticelle e non alcun tipo di contaminazione.
- Tornare all'esempio e utilizzare il software Atlas per mappare i bordi dell'organo sulla diapositiva. Seleziona il protocollo "Organo" per creare un'immagine a mosaico dell'area e lasciala funzionare (questo può richiedere al massimo alcune ore).
- Una volta che l'immagine composita è stata creata e cucita dal software, esportarla come file Tif.
- Apri il file Tif in ImageJ, un software open source, e regola i valori di soglia di contrasto per evidenziare le aree di contrasto molto elevato (cioè le nanoparticelle). Utilizzare le funzioni integrate per quantificare il volume delle nanoparticelle utilizzando la dimensione dei pixel definita nel protocollo Organ (dovrebbe essere di circa 100 nm).
- Mentre questa procedura si riferisce solo al campione di 1 settimana del polmone del topo, questa procedura viene ripetuta con i campioni di altre settimane e altri organi per compilare un grafico che mostra la distribuzione.
- Dopo aver calcolato la biodistribuzione per ogni organo per ogni settimana, i grafici di biodistribuzione mostreranno i cambiamenti nella biodistribuzione e nella concentrazione di nanoparticelle nel corso delle 8 settimane. Questi mostrano la concentrazione di picco e forniscono anche informazioni su quanto tempo ci vuole perché le nanoparticelle si schiarino dall'organo.
Risultati
Le immagini seguenti illustrano come i dati di biodistribuzione possono essere estratti dalle immagini. Il contrasto delle nanoparticelle viene rilevato utilizzando il rivelatore della BSE, come mostrato nella Figura 1. I dati EDS, presentati nella Figura 2, mostrano dove i cluster di titanio e bario corrispondono ad aree ad alto contrasto nelle immagini raccolte utilizzando il rilevatore di BSE.

Figura 1: Immagine elettronica secondaria del polmone (a sinistra) e immagine elettronica di retrodiscaldazione della stessa area (a destra).

Figura 2: Dati EDS, che mostrano gruppi di titanio e bario nella parte inferiore centrale e superiore dell'immagine, corrispondenti alle aree ad alto contrasto osservate utilizzando il rilevatore di BSE.
In un'immagine composita, come mostrato nella Figura 3, i cerchi rossi indicano le aree ad alto contrasto e suggeriscono le posizioni contenenti nanoparticelle. Il volume delle aree di nanoparticelle bianche può quindi essere calcolato e mediato sulla dimensione dell'organo stesso. Questo fornisce un calcolo dell'area occupata dalle nanoparticelle. Quindi, i dati di più organi per diverse settimane possono essere aggregati per mostrare la distribuzione media delle particelle in un micron quadrato dell'immagine. Questi dati sono presentati nella Figura 4, che mostra una diminuzione complessiva delle nanoparticelle di dimensioni 30 nm nel corso delle 8 settimane, un'indicazione di clearance. Un'altra cosa da notare è l'aumento della concentrazione di nanoparticelle nel fegato dopo 4 settimane. Questo fornisce informazioni su come il corpo elabora le nanoparticelle e la grande migrazione di particelle al fegato mostra che il corpo potrebbe elaborare le nanoparticelle come tossine. Questa è un'informazione importante da sapere quando si sviluppano e si testano nanoparticelle in vivo.
Allo stesso modo, i dati sulla distribuzione d'organo di particelle di varie dimensioni sono presentati nella Figura 5. Questo grafico mostra come la dimensione mutevole delle nanoparticelle può aumentare l'assorbimento complessivo nelle cellule delle nanoparticelle o aumentare il tasso di clearance.

Figura 3: Sezioni dell'immagine composita create utilizzando il software Atlas.

Figura 4: Biodistribuzione di nanoparticelle da 30 nm nel polmone, nel fegato, nella milza e nei reni dopo l'iniezione in un topo.
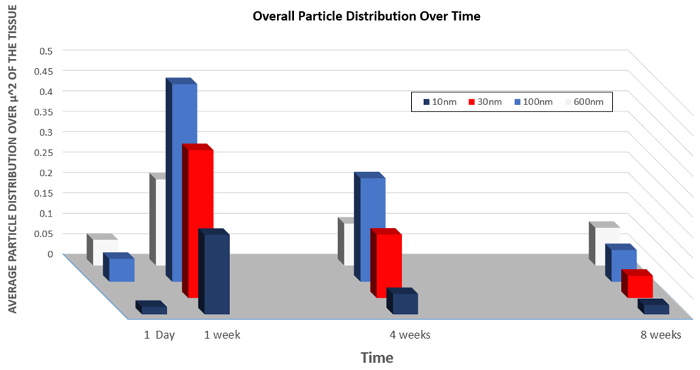
Figura 5: Biodistribuzione di nanoparticelle di dimensioni variabili nel tempo.
Applicazione e Riepilogo
Le nanoparticelle sono ampiamente utilizzate nella ricerca di ingegneria biomedica e hanno applicazioni come agenti di imaging, diagnostici e terapeutici. Ad esempio, le nanoparticelle sono in fase di sviluppo per l'uso nella consegna del vaccino. Incapsulando il vaccino in nanoparticelle, i componenti del vaccino sono protetti dalla degradazione e stimolano la massima risposta immunitaria.
Nelle applicazioni di imaging a risonanza magnetica, le nanoparticelle metalliche sono spesso utilizzate come agenti di contrasto per visualizzare la struttura e la funzione dei tessuti. Sono sonde diagnostiche utili nella rilevazione di placche artosclerotiche.
Le nanoparticelle che integrano capacità diagnostiche e terapeutiche sono chiamate teranostiche. Lì le nanoparticelle rilevano simultaneamente tumori in fase iniziale e forniscono agenti chemioterapici.
Questo esperimento ha dimostrato come il SEM possa essere utilizzato per calcolare la biodistribuzione delle nanoparticelle iniettate nel corpo nel tempo. Questo esperimento può essere replicato su altri campioni di nanoparticelle o colture cellulari che hanno nanoparticelle come un modo per analizzare le concentrazioni, la penetrazione cellulare o la clearance delle nanoparticelle.
Questa dimostrazione si è concentrata sullo studio e la misurazione della biodistribuzione delle nanoparticelle utilizzando sem. I risultati di tali misurazioni possono essere importanti in molti campi. Le aziende farmaceutiche e le strutture di ricerca possono utilizzare questi studi per lo sviluppo di farmaci e la ricerca sugli agenti di contrasto.
Elenco dei materiali
| Nome | Società | Numero di catalogo | Commenti |
| Attrezzatura | |||
| Slice sezionato (preparato prima) | |||
| ImageJ Open Source Software | |||
| Trave trasversale SEM | ZEISS | ||
| Software ATLAS 3D SEM | ZEISS |
Vai a...
Video da questa raccolta:

Now Playing
Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.5K Visualizzazioni

Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
36.3K Visualizzazioni

Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
24.1K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.8K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.9K Visualizzazioni

Imaging a risonanza magnetica cardiaca
Biomedical Engineering
15.0K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
11.9K Visualizzazioni

Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.4K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
12.1K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
106.9K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.7K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.3K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.3K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.2K Visualizzazioni