Imagerie d'échantillons biologiques par microscopie optique et confocale
Vue d'ensemble
Source: Peiman Shahbeigi-Roodposhti et Sina Shahbazmohamadi, Département de génie biomédical, Université du Connecticut, Storrs, Connecticut
Les microscopes optiques ont été autour depuis des siècles, et alors qu'ils ont atteint leur limitation théorique de la résolution il ya des décennies, de nouveaux équipements et techniques, telles que le traitement d'image confocale et numérique, ont créé de nouvelles niches dans le domaine de l'optique Imagerie. Les meilleurs microscopes optiques auront généralement une résolution jusqu'à 200 nm dans des conditions idéales. Cependant, les microscopes optiques sont limités par la diffraction des ondes, fonction de la longueur d'onde, qui est d'environ 500 nm pour la lumière visible. Bien que la résolution des microscopes optiques n'atteigne pas celle des microscopes électroniques, ils sont les outils les plus précieux dans l'imagerie des macrostructures biologiques et sont un aliment de base dans n'importe quel laboratoire biologique.
Dans les microscopes légers conventionnels, le signal produit à partir de l'objet imageur provient de toute l'épaisseur du spécimen, ce qui ne permet pas à la plupart d'entre eux d'être mis au point pour l'observateur. Cela provoque l'image d'avoir "flou hors de mise au point". Le microscope confocal, d'autre part, éclaire l'échantillon à travers un trou d'épingle, et est donc capable de filtrer la lumière floue d'en haut et en dessous du point de focalisation dans l'objet.
Cette démonstration offre une introduction à l'acquisition d'images à l'aide de méthodes de microscopie optique et confocale. Ici, un morceau sectionné du cerveau de souris sera étudié. L'acquisition et l'analyse d'images, y compris les outils pour générer des cartes topographiques et des images composites, seront couvertes. Les avantages et les inconvénients des différentes méthodes d'imagerie en ce qui concerne la résolution, la profondeur de mise au point et le type d'échantillon seront également discutés. Le but de cette démonstration est de fournir plus d'informations sur les microscopes optiques et confocales afin de déterminer si ces modules de microscopie sont les mieux adaptés à un type d'échantillon biologique.
Principles
Les microscopes optiques fonctionnent en utilisant au moins deux éléments de grossissement. La lentille principale, appelée l'objectif, détermine le grossissement total, et la lentille secondaire, appelée l'oculaire, concentre l'image virtuelle pour la visualisation. Le grossissement total est déterminé en multipliant les grossissements des deux lentilles. La focalisation de la lumière à travers ces sources, couplée à la focalisation de la lumière de la lampe sur l'échantillon, donne un plan de mise au point spécifié où le grossissement et la lumière de la lampe se rencontrent tous au même point, ce qui donne la meilleure résolution dans l'image. La figure ci-dessous montre comment le plan focal du spécimen est créé à travers les différentes lentilles. Les objets à l'extérieur du plan focal auront des faisceaux de lumière interférant à partir d'autres parties de l'échantillon en raison de la plus grande surface d'éclairage. Cela provoque le flou dans l'image. Par conséquent, pour se concentrer sur les différentes positions z d'un échantillon avec des hauteurs très variables, les tranches de z-direction doivent être déplacées dans le plan focal.

Figure 1. Lentilles de microscopie optique et plans focaux.
Les microscopes numériques fonctionnent sur le même principe que les micropscopes optiques, sauf qu'ils ne reposent pas sur un oculaire. C'est un microscope optique équipé d'un appareil photo numérique. L'appareil photo numérique agit comme un détecteur, et les images sont affichées sur un écran d'ordinateur. Ces microscopes sont idéaux pour l'analyse et la documentation des échantillons pendant la recherche et le développement (R-D), la fabrication et l'inspection, le contrôle de la qualité et l'assurance (QC/QA), ainsi que l'analyse des défaillances (FA). Ils offrent généralement des logiciels qui permettent aux utilisateurs d'analyser l'image de l'échantillon. La figure 2 montre une configuration numérique typique de microscope.

Figure 2. Principaux composants du microscope numérique.
Les principales composantes du système sont les :
- Moteur optique : Contient le capteur d'acquisition d'image et les lentilles pour zoomer sur l'image.
- Objectif : Acquiert et concentre la lumière de l'échantillon. Trois objectifs différents sont disponibles pour diverses tâches d'acquisition d'images.
- Étape de numérisation : Emplacement où l'échantillon doit être placé.
- Stand de microscope : Fournit le support pour le moteur optique et l'étape de balayage. Contrôle également la communication entre les composants attachés et l'ordinateur.
- Ordinateur : prend en charge les logiciels utilisateur et permet de visionnez les images sur l'écran.
- Contrôleur : Contrôle le microscope et le flux de travail à l'aide de gestes multi-touch et d'icônes sensibles au toucher et spécifiques au contexte. Les boutons de commande contrôlent la position d'image de zoom, de mise au point et de microscope.
Un microscope confocal, ou microscopie de balayage de laser confocal (CLSM), est un microscope avec la résolution optique et le contraste accrus. Confocal signifie « avoir la même attention ». L'objet et son image sont « confocals ».
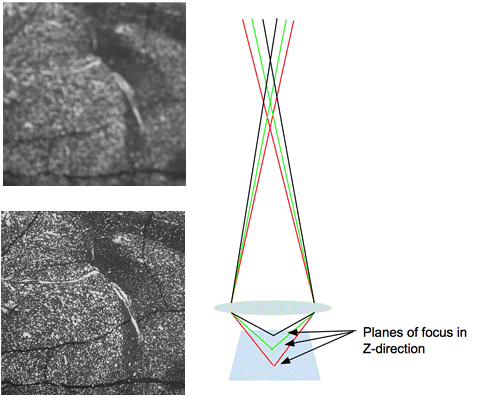
Figure 3. Flou et son effet sur une image. L'image de gauche montre une image floue avec des bords flous. La bonne image montre le chemin de la lumière à travers la lentille lors de l'imagerie d'un échantillon qui est au point.
Contrairement aux microscopes à lumière générale qui illuminent et imagent l'ensemble de l'échantillon en vue, les microscopes confocals utilisent un sténopé entre l'étape de l'échantillon et le détecteur de sorte que seul un faisceau de lumière plus petit est focalisé à un niveau de profondeur étroite à la fois. Ainsi, la seule zone visible de l'échantillon est le point d'intérêt. Le microscope confocal scanne ensuite la surface de l'échantillon avec ce faisceau de lumière beaucoup plus focal (ou laser). Les données sont ensuite assemblées en une image 2D qui a une meilleure résolution que la microscopie optique classique. En outre, parce que la lumière est concentrée sur une gamme très étroite de hauteurs, l'utilisateur peut mettre différents plans au point que la direction Z est déplacé. Grâce à des techniques de traitement d'images et des logiciels d'automatisation microscopes confocal aider à la reconstruction 3D des images composites multi-plan ciblées.
Les microscopes confocals ont la capacité grâce au traitement d'image de donner des données de direction Z sur un échantillon qui n'était pas disponible auparavant en microcopie optique. Par exemple, dans la démonstration décrite ci-dessous, l'utilisateur peut définir les plages supérieures et inférieures de mise au point pour un échantillon, puis non seulement développer une carte thermique montrant les mesures de la direction z, mais aussi créer une image composite qui montre toutes les parties de l'image dans Se concentrer. Ces caractéristiques sont particulièrement utiles lors de l'obtention de données 3D sur un échantillon.

Figure 4. Principaux composants d'un microscope confocal.
Les principaux composants du microscope confocal comprennent :
- Scanner la tête avec un lecteur Z fin et 4 mégapixels, se tenir avec z-drive grossier
- Objectifs: 2.5x/ 5x/ 10x/ 20x/ 50x/ 100x
- Étapes : étape de balayage et étape fixe
- Système informatique : logiciel d'imagerie de système de PC
- Contrôleur: x, y, z mouvement
Procédure
1. Imagerie confocale
- Chargez l'échantillon sur la scène. Centrez-le sous l'objectif. Il ne doit pas dépasser la limitation de poids de l'étape, qui dans ce cas est de 5 kg. L'échantillon ne doit pas avoir plus de 100 mm d'épaisseur.
- Ouvrez le logiciel d'imagerie et sélectionnez « Créer de l'emploi ».
- Sous la colonne Topographies, choisissez le bouton assistant.
- Créez une image d'aperçu au grossissement le plus bas, 2.5X. Avant de changer les grossissements, assurez-vous que l'échantillon est au point en changeant la position Z jusqu'à ce que vous voyez une image claire. Cela peut être fait en poussant vers le bas ou en tirant vers le haut sur le manipulateur de microscope 3D. Le mouvement Z plus fin est atteint en engageant le bouton sur le côté, ce qui provoque une lumière bleue sur les bords.
- Augmentez lentement le grossissement de la lentille, en continuant à jouer avec l'intensité lumineuse et la mise au point jusqu'à ce que vous soyez au grossissement désiré. Si vous le souhaitez, choisissez un autre domaine d'intérêt en déplaçant la scène dans les directions x et y en utilisant le manipulateur.
- Une fois qu'une image d'aperçu est prise au grossissement bas, appuyez sur le bouton suivant pour passer à l'étape du point de référence. Si vous le souhaitez, spécifiez un certain point de référence pour des raisons de mesure (c.-à-d. le coin de l'échantillon), bien qu'à cette fin le point de référence par défaut soit très bien.
- Appuyez sur la flèche suivante pour passer à la partie suivante de l'assistant.
- Modifier l'objectif souhaité pour voir une résolution appropriée à votre échantillon. Dans ce cas, la lentille objective 50X est utilisée pour visualiser les cellules de l'échantillon. Le 50X est l'objectif qui est le plus proche de l'échantillon, donc progressivement passer à l'objectif 50X en veillant à ce qu'il ya encore de la place pour diminuer la distance de travail après l'objectif 20X.
- Sur la page "Measuring Range Definition", déplacez légèrement la position Z (en cliquant sur le bouton latéral sur le manipulateur pour des réglages fins) de sorte que seul le haut de l'échantillon est au point et cliquez sur "Set Last". Déplacez ensuite la scène dans la direction Z (vers le bas) jusqu'à ce que seul le bas de l'échantillon soit mis au point et appuyez sur "Set First". Assurez-vous que le nombre de tranches calculées ne dépasse pas 1000 ou que le programme échouera.
- Assurez-vous que l'intensité de la lumière ne sursatrate pas (cause pixels rouges) dans l'image à l'un des niveaux, puis a frappé fait. Cela prendra l'image de tomographie et d'ouvrir le logiciel de tomographie.
- Dans le logiciel de tomographie, ouvrez des onglets tels que l'onglet Études pour afficher les données en 3D et prendre des mesures dans l'espace 2D ou 3D.
2. Imagerie au microscope optique numérique
- Chargez l'échantillon sur la scène. Centrez l'échantillon sous la lentille. Le poids de l'échantillon ne doit pas dépasser la limitation de poids de l'étape, qui dans ce cas est de 4 kg. L'échantillon ne doit pas dépasser 12 cm.
- Ouvrez le logiciel d'imagerie.
- Sélectionnez un Job à partir de la liste des modèles fournis. Il est également possible de travailler en dehors d'un emploi en appuyant sur l'examen gratuit, ce qui vous permet d'étudier un échantillon en dehors d'un emploi.
- Acquérir une image de vue d'ensemble qui montre toute la scène. Cela servira de carte plus tard pour afficher la partie de l'échantillon qui est consultée. Lors de l'acquisition de l'image, utilisez le contrôleur pour changer la mise au point et la position de l'image.
- Placez un système de coordonnées. Le système de coordonnées par défaut est à partir du coin arrière gauche de la scène et est très bien pour cette application. Si l'échantillon est tordu, vous pouvez ajuster les coordonnées ici.
- Nommez l'échantillon et l'emploi, ce qui l'ajoute à la liste des emplois afin que d'autres utilisateurs puissent y retourner.
- Sélectionnez le bouton de l'appareil photo sous Acquérir. Prenez une image initiale, puis appuyez sur le bouton en direct lorsque vous naviguez dans l'échantillon.
- Déplacez la mise au point vers le bas jusqu'à ce que l'échantillon soit clairement au point. Il peut également être nécessaire d'ajuster l'éclairage sous l'onglet Éclairage et ouverture.
- Optimisez l'image avec les outils sous le panneau d'optimisation d'image. Vous pouvez jouer avec différents paramètres sous l'onglet Améliorations d'image, tels que l'inclinaison de l'objectif, les niveaux d'éclairage sur l'échantillon, et la luminosité et le contraste, jusqu'à ce que l'image ait la netteté désirée.
- Effectuez des mesures en appuyant sur l'outil Crayon sur le logiciel. De là, vous avez accès à plusieurs outils de mesure, y compris les distances, les angles et la zone. Utilisez la distance et les outils de zone pour mesurer la taille de l'échantillon.
- Passez à l'onglet Résultats de flux de travail et vérifiez la disposition du flux de travail pour configurer la mise en page du rapport
- Appuyez sur le bouton enregistrer pour enregistrer votre travail afin que d'autres puissent utiliser le même flux de travail.
Résultats
Les images suivantes donnent un aperçu des résultats qui peuvent être obtenus d'un cerveau de souris à l'aide d'un microscope confocal. Ils montrent comment différents niveaux d'information peuvent être obtenus et comment une carte topographique des résultats révèle la hauteur de l'échantillon.
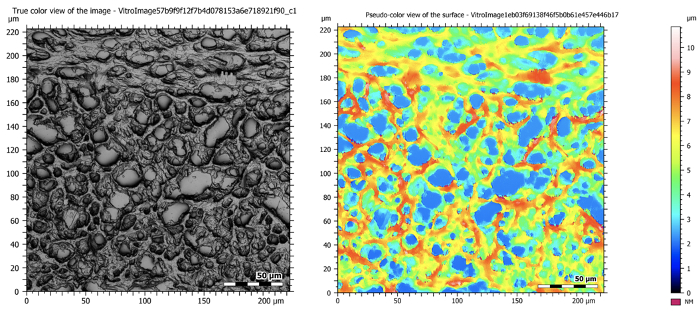
Figure 5: Images confocales au grossissement 50X montrant un cerveau de souris sectionné. L'image de gauche est une image composite qui prend tous les plans en cours de mise au point pendant la tomographie et crée une image haute résolution et profondément ciblée. L'image de droite montre la carte topographique de l'échantillon.

Figure 6: En tant qu'exemple représentatif des applications 3D du microscope confocal, un trou dans le plastique a été imagené et analysé. La carte topographique originale est sur la gauche et la reconstruction 3D est sur la droite.

Figure 7: Montre l'étendue de l'analyse logicielle ConfoMap pour l'observation d'un profil d'une reconstruction 3D. Les paramètres d'amplitude, le profil de rugosité, la caractérisation de la courbe sont affichés.
Les images suivantes donnent un aperçu des résultats qui peuvent être obtenus à partir de l'utilisation d'un microscope optique numérique sur la même tranche de cerveau de souris. Le microscope numérique donne un plus grand champ de vision, mais des images de faible résolution du microscope confocal, ce qui est idéal pour regarder de plus grands composants ou des structures biologiques. Le logiciel dispose d'outils d'analyse utiles pour mesurer l'échantillon.

Figure 8: Image d'aperçu montrant la tranche entière d'organe.

Figure 9: Zoomé à l'image d'un cerveau de souris sectionné. Voici un champ de vision de 300 microns obtenu avec un éclairage coaxial et ring mixte ainsi qu'une stabilisation électronique de l'image.

Figure 10: Démonstration des capacités de mesure du microscope optique numérique. Le diamètre de l'échantillon est mesuré sur la gauche, et un contour défini par l'utilisateur qui est utilisé pour calculer la zone interne du cerveau de souris sectionné est montré sur la droite. Ces outils sont utiles lors de l'analyse d'échantillons biologiques, qui peuvent ne pas avoir des bords qui sont les mêmes que les formes prédéfinies.
Applications et Résumé
Dans cette démonstration, la profondeur de mise au point, le champ de vision et la résolution maximale et le grossissement des microscopes optiques et confocals ont été optimisés pour voir des échantillons biologiques. Cette démonstration a été conçue pour aider le participant à décider quel module de microscopie est le meilleur pour une certaine application. Les deux modes de microscopie ont des avantages dans l'analyse des échantillons biologiques pour leur facilité de préparation et des images composites à haute résolution.
Les applications pour la microscopie optique et confocale sont de grande portée. En raison de la préparation limitée de l'échantillon et de la capacité d'intégrer des plans de mouvement et d'utiliser des techniques de lumière au-dessus de l'échantillon, ces outils sont en mesure d'obtenir des informations à partir de la plupart des ensembles de données. La microscopie a été une option très populaire lors de l'imagerie des cellules vivantes, telles que celles traitées avec la fluorescence, mais les applications peuvent aller des surfaces d'imagerie des dispositifs biomédicaux à la détection des défauts et de la rugosité avant de les implanter dans le corps. La microscopie confocale et optique est la norme actuelle pour l'imagerie d'échantillons biologiques.
Enfin, la microscopie confocale offre une imagerie améliorée avec des techniques de fluorescence. Les fluorophores d'un échantillon ont une durée de vie limitée et peuvent s'agripper lorsqu'ils sont exposés à des quantités élevées de lumière. Dans la microscopie lumineuse traditionnelle, l'échantillon entier est éclairé pendant l'imagerie, ce qui se traduit par un blanchiment rapide de la photo. Cependant, puisque seule une infime partie de l'échantillon est illuminée en même temps avec une microscopie confocale, la durée de vie du fluorophore est plus longue et il y a moins de défis associés au blanchiment photo.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
36.3K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
24.1K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.5K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.8K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.9K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
15.0K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.9K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.4K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
12.1K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
106.9K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.7K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.3K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.3K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.2K Vues