Imaging a risonanza magnetica cardiaca
Panoramica
Fonte: Frederick W. Damen e Craig J. Goergen,Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
In questo video, viene dimostrata la risonanza magnetica (MRI) ad alto campo e di piccolo diametro con monitoraggio fisiologico per acquisire circuiti cine gated del sistema cardiovascolare murino. Questa procedura fornisce una base per valutare la funzione ventricolare sinistra, visualizzare le reti vascolari e quantificare il movimento degli organi dovuto alla respirazione. Le modalità di imaging cardiovascolare di piccoli animali comparabili includono ultrasuoni ad alta frequenza e tomografia micro-computerizzata (TC); tuttavia, ogni modalità è associata a compromessi che dovrebbero essere considerati. Mentre gli ultrasuoni forniscono un'elevata risoluzione spaziale e temporale, gli artefatti di imaging sono comuni. Ad esempio, il tessuto denso (cioè lo sterno e le costole) può limitare la profondità di penetrazione dell'imaging e il segnale iperecoico all'interfaccia tra gas e liquido (cioè la pleura che circonda i polmoni) può offuscare il contrasto nel tessuto vicino. La micro-TC al contrario non soffre di tanti artefatti nel piano, ma ha una risoluzione temporale inferiore e un contrasto limitato dei tessuti molli. Inoltre, la micro-TC utilizza radiazioni a raggi X e spesso richiede l'uso di agenti di contrasto per visualizzare la vascolarizzazione, entrambi noti per causare effetti collaterali a dosi elevate, tra cui danni da radiazioni e lesioni renali. La risonanza magnetica cardiovascolare fornisce un buon compromesso tra queste tecniche negando la necessità di radiazioni ionizzanti e fornendo all'utente la possibilità di visualizzare senza agenti di contrasto (sebbene gli agenti di contrasto siano spesso utilizzati per la risonanza magnetica).
Questi dati sono stati acquisiti con una sequenza di risonanza magnetica Fast Low Angle SHot (FLASH) che è stata gated dai picchi R nel ciclo cardiaco e dai plateau espiratori nella respirazione. Questi eventi fisiologici sono stati monitorati attraverso elettrodi sottocutanei e un cuscino sensibile alla pressione che è stato fissato contro l'addome. Per garantire che il mouse fosse adeguatamente riscaldato, è stata inserita una sonda di temperatura rettale che è stata utilizzata per controllare l'uscita di una ventola di riscaldamento a prova di risonanza magnetica. Una volta che l'animale è stato inserito nel foro dello scanner MRI e sono state eseguite sequenze di navigazione per confermare il posizionamento, sono stati prescritti i piani di imaging FLASH gated e sono stati acquisiti i dati. Nel complesso, la risonanza magnetica ad alto campo è un potente strumento di ricerca in grado di fornire contrasto dei tessuti molli per lo studio di modelli di malattie di piccoli animali.
Principi
La risonanza magnetica è una tecnica che sfrutta le proprietà paramagnetiche dei tessuti per visualizzare il contrasto dei tessuti molli. Il foro di una macchina MRI viene convenzionalmente avvolto utilizzando una bobina solenoide che fornisce un campo magnetico omogeneo costante (B0) quando viene applicata una corrente elettrica. Nell'imaging murino ad alto campo presentato, viene utilizzata un'intensità del campo magnetico di 7 Tesla (T), che è circa 140.000 volte quella del campo magnetico terrestre e più del doppio delle comuni intensità cliniche dello scanner 3T e 1,5T. Questo campo magnetico omogeneo fa sì che i protoni di idrogeno inerenti a quasi tutti i tessuti viventi allineino i loro assi di rotazione. Questi spin possono quindi essere "ribaltati" usando onde a radiofrequenza (RF) ad un certo angolo rispetto all'asse di rotazione (cioè l'angolo di inversione). Mentre i protoni tentano di rilassarsi al loro orientamento originale, la componente del loro spin perpendicolare al loro asse principale induce un segnale elettrico rilevabile.
Inoltre, possono essere applicati gradienti magnetici che pertturano il campo magnetico principale e consentono eccitazioni RF isolate spazialmente per localizzare il segnale ricevuto. Specifica per i metodi qui descritti, la sequenza FLASH utilizza eccitazioni ripetitive ad angolo di capovolgimento basso per indurre un modello di stato stazionario nel movimento del protone. Questo paradigma consente ai tessuti che sono intrinsecamente dinamici, come nel sistema cardiovascolare, di essere ripresi rapidamente e ottenere istantanee relativamente stabili all'interno del ciclo cardiaco. Attraverso l'attivazione della sequenza FLASH con segnali fisiologici, è possibile acquisire immagini del sistema cardiovascolare che evidenziano sia il movimento cardiaco, vascolare e respiratorio.
Procedura
1. Preparazione animale
- Identificare il topo da immaginare nella sua gabbia e trasferirlo nella camera di induzione dell'anestesia.
- Anestetizzare il mouse usando isoflurano e confermare il knockdown usando una tecnica di pizzicamento delle dita dei piedi. Prendi la zampa tra il pollice e l'indice e pizzica con fermezza per verificare la risposta. Se l'animale ritira il piede, dovresti aspettare o rifare con l'anestesia secondo il protocollo approvato.
- Verificare che tutto il personale che entra nella struttura di imaging sia sicuro per la risonanza magnetica. Ciò include la rimozione di qualsiasi indumento / accessorio magnetico, la conferma dell'eliminazione di impianti magnetici o pacemaker e la rimozione di metalli contenenti piercing.
- L'isoflurano aperto scorre al naso nella sala risonanza magnetica. Ciò consente di innescare il tubo più lungo con anestetico prima del trasferimento del topo per garantire che l'animale non si svegli.
- Chiudere il flusso di isoflurano alla camera di induzione dell'anestesia e trasferire il mouse allo stadio di imaging. Posizionare il mouse sul palco in modo tale che la posizione approssimativa del cuore sia allineata con il centro del magnete.
- Fissare il cono del naso e riconfermare il knockdown utilizzando la tecnica del pizzicamento della punta.
- Inserire le tre condotte dell'elettrocardiogramma per via sottocutanea con una porta a sinistra e a destra del cuore e una alla base dell'arto posteriore sinistro.
- Inserire la sonda di temperatura rettale utilizzando una guainata di sonda sterile e lubrificante.
- Posizionare il sensore di respirazione del cuscino sulla regione epigastrica dell'addome e fissarlo in posizione utilizzando una piastra di cartone. Il cartone permetterà di garantire un segnale sensibile alla pressione.
- Verificare che tutti i segnali fisiologici vengano acquisiti tramite il software di monitoraggio all'esterno della sala scanner. Se viene rilevata una frequenza cardiaca, una frequenza respiratoria o una temperatura al di fuori del range normale, mettere in pausa l'imaging e valutare se l'animale è adeguatamente anestetizzato. Se l'animale è in difficoltà, la somministrazione di anestesia deve cessare e l'animale deve essere riportato alla gabbia per riprendersi.
- Impostare il modulo di riscaldamento e la ventola e iniziare a riscaldare il flusso d'aria verso l'animale. Fissare tutto il tubo dell'aria in posizione in modo che l'aria calda soffi verso il mouse a partire appena oltre la punta della coda.
- Posizionare la bobina di gradiente sopra l'animale e assicurarsi che tutti i cavi / tubi siano fissati.
2. Risonanza magnetica cardiaca - Questa sezione può essere adattata per altre applicazioni.
- Sintonizzare e abbinare la bobina di gradiente al di fuori del foro del magnete per garantire che il segnale massimo venga rilevato dal soggetto.
- Inserire lentamente lo stadio di imaging nel foro del magnete in modo tale che l'animale sia posizionato direttamente al centro del foro. Ciò include assicurarsi che la bobina di gradiente abbia una spaziatura uguale lungo tutte le direzioni radiali. Questa è la posizione in cui il campo magnetico principale sarà più omogeneo.
- Eseguire una scansione localizzatore/navigatore per confermare la posizione del mouse all'interno dello scanner. Alcuni segmenti del cuore dovrebbero essere visualizzati all'interno di tutti e tre i piani (cioè assiale, sagittale e coronale). In caso contrario, ripetere il processo di riposizionamento del mouse ed eseguire scansioni di localizzazione/navigazione fino a raggiungere la posizione desiderata.
- Impostate i parametri per la sequenza FLASH. Ad esempio: TR/TE = 8,0/2,0 ms, FA = 20°, FOV = 35 x 35 mm, matrice = 192 x 192 e NEX = 6. Quindi, seleziona il trigger esterno da "on".
- Sul software di monitoraggio, configurare i trigger esterni in modo tale che le sequenze mri vengano avviate identificando i picchi R nei cicli cardiaci e mentre la respirazione è stabile durante la fase espiratoria. Poiché queste due condizioni sono soddisfatte, la sequenza può essere eseguita in serie e i dati verranno acquisiti.
- Prescrivere ed eseguire una fetta di sequenza FLASH iniziale nella vista coronale in modo tale che il piano della fetta segua l'asse dall'apice del cuore attraverso la valvola aortica. Questo ciclo cine iniziale fornirà una visione a due camere del cuore.
- Facendo riferimento ai risultati della vista a due camere, prescrivere ed eseguire una nuova sequenza FLASH lungo l'asse della valvola apice-aortica per visualizzare una vista a quattro camere.
- Infine, prescrivere una fetta ad asse corto che sia perpendicolare all'asse della valvola apice-aortica approssimativamente a metà del cuore. I muscoli papillari dovrebbero essere distintamente visibili all'interno dell'uscita del ciclo cine in questa posizione.
- Ulteriori fette possono essere acquisite parallelamente a questa per costruire volumi del cuore sincronizzati nel tempo. Questi volumi vengono creati concatenando loop cine adiacenti in post-elaborazione.
- Una volta completata l'imaging, trasferire i dati acquisiti in una posizione appropriata per l'analisi e rimuovere l'animale dallo scanner.
Risultati
La Figura 1 mostra un ciclo cine di una vista ad asse corto del ventricolo sinistro, che è direttamente perpendicolare all'asse base-apice del cuore e in una posizione che include i muscoli papillari.

Figura 1: Imaging cinematico luminoso di un cuore di topo con 14 istantanee ad asse corto lungo tutto il ciclo cardiaco, tra cui diastole finale (t = 8) e sistole di picco (t = 13). Le regioni del segnale di dropout all'interno del lume del ventricolo sinistro indicano un rapido movimento del sangue, che originariamente era fuori piano e non taggato dall'eccitazione dell'onda RF.
La seconda immagine rappresentativa mostra una vista a 4 camere del cuore con afflusso di sangue brillante attraverso le valvole mitrale e tricuspide, che poi fuoriesce attraverso le valvole aortica e polmonare, rispettivamente.
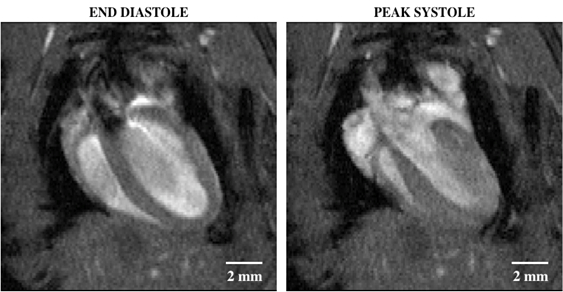
Figura 2: Cine imaging luminoso del sangue di un cuore di topo con una vista a quattro camere che mostra la diastole finale (a sinistra) e la sistole di picco (a destra). Le regioni del segnale di dropout all'interno del lume del ventricolo sinistro indicano un rapido movimento del sangue, che originariamente era fuori piano e non taggato dall'eccitazione dell'onda RF.
Infine, un terzo risultato rappresentativo è una proiezione di intensità massima (MIP) che mostra come le fette multiple possono essere combinate spazialmente per visualizzare il sistema cardiovascolare di tutto il corpo del topo.
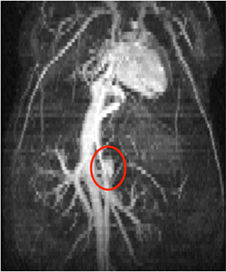
Figura 3: Proiezione di massima intensità di una pila tridimensionale di immagini di sangue luminoso bidimensionale sincronizzate nel tempo, che mostrano le regioni toraciche e addominali di un topo. Il cuore, la vena cava inferiore e il piccolo aneurisma dell'aorta addominale (cerchio rosso) possono essere visti da questa vista.
Applicazione e Riepilogo
Qui, la risonanza magnetica cardiaca viene utilizzata in combinazione con il gating cardiaco e respiratorio per acquisire i dati del ciclo cine-cine del cuore murino. Mentre il cuore è stato al centro della dimostrazione, ulteriori regioni del sistema cardiovascolare possono essere immaginate seguendo la stessa metodologia. Anche se la risonanza magnetica non soffre degli stessi artefatti comunemente osservati con altre modalità di imaging, esiste un notevole compromesso con la risoluzione spaziale raggiunta per durata di acquisizione. Questo compromesso è preoccupante quando il topo non può sopportare durate più lunghe di anestesia, come nei modelli di malattia grave. Tuttavia, la risonanza magnetica ha il vantaggio di visualizzare il tessuto sottostante senza il rischio di danni da radiazioni ionizzanti inerenti alla micro-TC. Utilizzando tecniche di risonanza magnetica, è possibile eseguire una valutazione in vivo del sistema cardiovascolare, gettando le basi per studi longitudinali sia sulla progressione della malattia che sulla risposta terapeutica associata in modelli di piccoli animali.
Come estensione della tecnica descritta, questa tecnologia può essere utilizzata per confrontare la cinematica dei cuori sani rispetto a quelli malati. I modelli murini di disfunzione cardiaca possono essere molto più controllati di quelli trovati in clinica, consentendo ai ricercatori di identificare fattori specifici che contribuiscono alle malattie cardiache e di studiare il processo di rimodellamento dopo lesioni meccaniche. Inoltre, uno sforzo di ricerca comparabile può essere eseguito con un focus vascolare come quello con formazione di aneurisma dell'aorta addominale (AAA). Dato che il sangue dà un segnale ad alta intensità con i metodi descritti, il contrasto può essere sfruttato per valutare l'espansione di un AAA e misurare i cambiamenti nelle proprietà biomeccaniche del vaso. Infine, gli studi che esaminano la vascolarizzazione del cervello possono essere condotti per confrontare le risposte angiogeniche a lesioni cerebrali traumatiche o ictus. Idealmente, come con la maggior parte delle immagini pre-cliniche, tecniche come la risonanza magnetica cardiovascolare ad alto campo possono migliorare la nostra comprensione dei processi delle malattie umane e stimolare l'innovazione verso la prossima generazione di tecnologia diagnostica.
Vai a...
Video da questa raccolta:

Now Playing
Imaging a risonanza magnetica cardiaca
Biomedical Engineering
14.7K Visualizzazioni

Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
35.7K Visualizzazioni

Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
23.5K Visualizzazioni

Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.3K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.4K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.7K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
11.7K Visualizzazioni

Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.2K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
11.9K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
104.8K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.5K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.0K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.2K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.0K Visualizzazioni