Esecuzione di reazioni al di sotto della temperatura ambiente
Panoramica
Fonte: Laboratorio della Dott.ssa Dana Lashley - College of William and Mary
Dimostrazione di: Matt Smith
Quando si formano nuovi legami nel corso di una reazione chimica, è necessario che le specie coinvolte (atomi o molecole) si avvicinino molto strettamente e si scontrino l'una con l'altra. Le collisioni tra queste specie sono più frequenti ed efficaci quanto maggiore è la velocità con cui queste molecole si muovono. Una regola empirica ampiamente utilizzata, che ha le sue radici nell'equazione di Arrhenius1, afferma che l'aumento della temperatura di 10 K raddoppierà approssimativamente la velocità di una reazione, e l'aumento della temperatura di 20 K quadruplicherà la velocità:
(1) 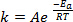
L'equazione (1) si trova spesso nella sua forma logaritmica:
(2) 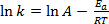
dove k è la velocità della reazione chimica, A è il fattore di frequenza (relativo alla frequenza delle collisioni molecolari), Ea è l'energia di attivazione richiesta per la reazione, R è la costante ideale del gas e T è la temperatura alla quale avviesi la reazione.
Una temperatura più elevata significa quindi che una reazione viene completata molto più velocemente. Tuttavia, in alcuni casi è auspicabile effettuare reazioni a basse temperature, nonostante l'effetto di abbassamento sulla velocità della reazione. Alcuni scenari a questo proposito sono elaborati più avanti.
Quando è utile eseguire una reazione al di sotto della temperatura ambiente, i chimici usano bagni di raffreddamento per mantenere una certa temperatura o intervallo di temperatura. Le reazioni vengono raffreddate alla temperatura desiderata posizionando il pallone di reazione all'interno di un bagno di raffreddamento appropriato. I reagenti nella reazione non entrano mai in contatto diretto con le sostanze chimiche nel bagno di raffreddamento. Il bagno di raffreddamento può essere costituito da un singolo componente criogenico (raffreddamento) (come ghiaccio, ghiaccio secco o azoto liquido) o può essere una miscela del componente criogenico con un determinato solvente e/o un sale additivo. Lo scopo del solvente è quello di trasferire efficacemente la temperatura dell'agente di raffreddamento al pallone di reazione e lo scopo dell'additivo è quello di abbassare (o deprimere) il punto di congelamento della miscela. (Si noti che è possibile che una sostanza sia sia un solvente che un additivo.)
Principi
Ricordiamo che quando una soluzione si congela a una temperatura inferiore rispetto al liquido puro, ciò è causato da una proprietà colligativa nota come depressione del punto di congelamento. L'effetto di abbassamento sul punto di congelamento è proporzionale alla quantità di soluto (additivo) che viene aggiunto a un solvente liquido. Questo effetto, è descritto dall'equazione (3):
(3) ΔDTf = Tf (solvente) − Tf (soluzione) = Kf × m
ΔDTf è la depressione del punto di congelamento ed è descritta dalla differenza di temperatura di congelamento del solvente stesso e da quella della soluzione con additivo/soluto.
Kf è la costante di depressione del punto di congelamento per il sistema e m è la molalità della soluzione. I chimici usano questo effetto a loro vantaggio per creare una diversità di temperature diverse con relativa facilità ed economicità.
Le temperature raggiunte dai bagni di raffreddamento possono fluttuare. Il bagno deve essere monitorato e le regolazioni devono essere apportate se necessario. Per ottenere i migliori risultati, la nave da bagno stessa dovrebbe essere ben isolata. Quando disponibile, un pallone Dewar deve essere utilizzato per il bagno di raffreddamento. In assenza di un pallone Dewar, è possibile allestire il bagno in un recipiente di vetro o gomma, con il recipiente isolato nel miglior modo possibile (utilizzando ad esempio un foglio di alluminio o un asciugamano). La nave usata deve essere termo-stabile alla temperatura desiderata e non deve rompersi.
Esistono molte diverse varianti di bagno per il raggiungimento relativamente economico e semplice di diverse temperature al di sotto della temperatura ambiente in un ambiente di laboratorio chimico.
- Per temperature appena sotto lo zero (ma se necessario fino a - 55 °C) servirà un bagno di acqua ghiacciata con diversa aggiunta di sali.
- Per temperature fino a -78 °C, vengono utilizzati bagni di ghiaccio secco in diversi solventi.
- Temperature inferiori a -78 °C fino a -196 °C possono essere ottenute utilizzando azoto liquido.
L'installazione di questi bagni di raffreddamento è relativamente semplice e le procedure sono incluse alla fine di questo documento.
Bagni di acqua ghiacciata
Questo tipo di bagno è molto facile da configurare e disponibile in ogni laboratorio di insegnamento universitario. C'è molta flessibilità nel tipo di vaso da bagno da utilizzare, perché i bagni di ghiaccio non raggiungono temperature molto basse e non vi è alcun rischio di rompere una nave.
Mentre l'acqua ghiacciata stessa ha una temperatura di 0 °C, una depressione del punto di fusione può essere ottenuta con l'aggiunta di alcuni sali come NaCl, MgCl2 o CaCl2. Le temperature finali raggiunte variano e possono essere regolate in base alla quantità di additivo utilizzato per 100 g di ghiaccio. Un comune bagno di ghiaccio è quello con NaCl come additivo in cui vengono aggiunti 33 g di NaCl per 100 g di ghiaccio. La temperatura finale raggiunta con questo mezzo è di circa -20 °C. La temperatura più fredda che un bagno di acqua ghiacciata può raggiungere è di circa -55 °C, che si ottiene con l'aggiunta di 143 g di CaCl2 esaidrato per 100 g di ghiaccio.
Bagni di ghiaccio secco
Il ghiaccio secco è anidride carbonica solida e sublima ad una temperatura di -78 °C. È un agente criogenico abbastanza economico e prontamente disponibile in molti laboratori. Per un efficiente trasferimento di calore di questa temperatura a un recipiente di reazione, è necessario un solvente con un punto di fusione inferiore a -78 °C. Possono essere utilizzati anche solventi con un punto di fusione più elevato, o mp, (meglio indicato come punto di congelamento in questo caso) e provocare una temperatura del bagno più elevata.
Un solvente che viene spesso utilizzato in un bagno di ghiaccio secco è l'acetone (mp = -95 °C), che è prontamente disponibile e poco costoso. Un bagno di ghiaccio secco in acetone mantiene una temperatura di -78 °C per un periodo di tempo, la cui durata dipende dal grado di isolamento. Questo è il sistema di bagno di ghiaccio secco più comune.
Per i bagni di ghiaccio secco a temperature più elevate, vengono utilizzati solventi con punti di congelamento più elevati. La temperatura del bagno acquisita non è sempre uguale al punto di congelamento del solvente. Si prega di fare riferimento alla Tabella 2 per le temperature ottenute da diversi sistemi.
A causa delle basse temperature raggiunte da questo tipo di bagno, i guanti di protezione criogenica devono essere sempre indossati quando si maneggia ghiaccio secco.
La nave da bagno per un bagno di ghiaccio secco è idealmente un Dewar. Se un Dewar non è disponibile, viene utilizzata una nave in vetro, gomma o acciaio inossidabile, ma tieni presente che l'isolamento non sarà molto ottimale e il bagno dovrà essere regolato più spesso.
| Temperature del bagno di raffreddamento con ghiaccio secco | |
| Mistura | T (°C) |
| p-xilene/Ghiaccio secco | +13 |
| Cicloesano/Ghiaccio secco | +6 |
| Benzene/Ghiaccio secco | +5 |
| Glicole etilenico/Ghiaccio secco | -15 |
| Tetracloruro di carbonio/Ghiaccio secco | -23 |
| 3-Eptanolo/Ghiaccio secco | -38 |
| Acetonenitrile/Ghiaccio secco | -42 |
| Cylcohexanone/Ghiaccio secco | -46 |
| Dietilcarcitolo/Ghiaccio secco | -52 |
| Cloroformio/Ghiaccio secco | -61 |
| Acetato di carbitolo/Ghiaccio secco | -67 |
| Etanolo/Ghiaccio secco | -72 |
| Acetone/Ghiaccio secco | -78 |
| Isopropanolo/Ghiaccio secco | -78 |
Tabella 2. Elenco delle diverse miscele di bagno di ghiaccio secco.
Bagni di azoto liquido
I bagni di fango di azoto liquido vengono utilizzati quando si desiderano temperature molto basse, inferiori a quelle di un bagno di ghiaccio secco. L'azoto liquido è un agente criogenico con un punto di fusione di -196 °C, che è la temperatura del bagno quando non viene utilizzato alcun solvente aggiuntivo. Si noti che, a differenza del ghiaccio secco, N2 è un liquido e l'uso di un solvente additivo per un trasferimento di calore uniforme non è necessario. Se si desidera una temperatura superiore a -196 °C, per miscele viene utilizzata una varietà di solventi organici diversi che si tradurranno in temperature diverse, come nel caso dei bagni di ghiaccio secco. Si prega di fare riferimento alla Tabella 3 per le temperature ottenute da diversi sistemi.
A causa delle temperature molto basse dei bagni liquidi N2, solo un Dewar deve essere usato come vaso da bagno e lavorare sempre con i guanti quando si maneggia questo agente criogenico.

Tabella 3. Elenco dei bagni di azoto liquido con diversi solventi. 2
Procedura
Configurazione del bagno di raffreddamento
Per un allestimento generale, preparare il bagno di raffreddamento preferito come descritto di seguito e immergere il pallone di reazione nel bagno (Figura 1). Non riempire il recipiente del bagno fino in fondo, ma lasciare abbastanza spazio per consentire l'immersione del pallone di reazione.
Nota: se la reazione è sensibile all'umidità, prestare molta attenzione quando si aggiungono reagenti al pallone o a qualsiasi altra parte dell'apparecchio(ad esempio un imbuto che cade). Se viene generata un'apertura mentre la vetreria è immersa nel bagno di raffreddamento, l'aria a temperatura ambiente scorre rapidamente all'interno e trasporta l'umidità.
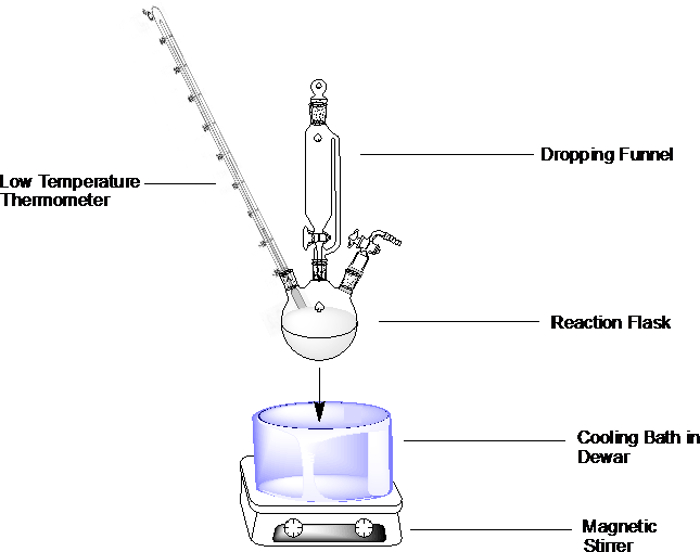
Figura 1. Esempio per un bagno di raffreddamento allestito in un pallone a fondo tondo a tre colli con imbuto cadente, termometro in atmosfera inerte.
1. Fare un bagno di acqua ghiacciata
- Per un bagno di acqua ghiacciata con un additivo, pesare e aggiungere la quantità appropriata di ghiaccio al recipiente da bagno scelto. Un Dewar è utile ma non necessario. Il recipiente può essere di plastica, gomma(ad esempio un secchio) o vetro(ad esempio un grande piatto di cristallizzazione). Per questo esperimento, aggiungere 500 g di ghiaccio a un recipiente da 1 L.
- Pesare la quantità appropriata di additivo consultando un bagno di ghiaccio (Tabella 1) e aggiungere l'additivo al ghiaccio. Per questo esperimento, pesare e aggiungere 165 g (=5x 33 g) di NaCl al recipiente del bagno.
- Aggiungere una piccola quantità di acqua deionizzata al recipiente del bagno e mescolare accuratamente usando un'asta di agitazione. Aggiungere acqua quanto basta fino a coprire tutto il ghiaccio.
- Controllare con un termometro per assicurarsi che sia stata raggiunta la temperatura desiderata. Regolare la quantità di additivo se necessario. Il bagno non manterrà la sua temperatura per molto tempo e le regolazioni devono essere effettuate in intervalli frequenti di circa ogni 20-30 minuti. Per questo potrebbe essere necessario pipettare parte dell'acqua nella vasca da bagno e aggiungere più ghiaccio e additivo.
| Sostanza | g/100 g H2O | Temperatura finale (°C) |
| Na2CO3 | 20 | -2.0 |
| NH4NO3 | 106 | -4.0 |
| NaC2H3O2 | 85 | -4.7 |
| NH4Cl | 30 | -5.1 |
| NaNO3 · | 75 | -5.3 |
| Na2S2O3 ● 5H2O | 110 | -8.0 |
| CaCl2● 6H2O | 41 | -9.0 |
| Kcl | 30 | -10.9 |
| KI | 140 | -11.7 |
| NH4NO3 | 60 | -13.6 |
| NH4Cl | 25 | -15.4 |
| NH4NO3 | 45 | -16.8 |
| NH4SCN | 133 | -18.0 |
| NaCl | 33 | -21.3 |
| CaCl2 ● 6H2O | 81 | -21.5 |
| H2SO4 (66,2%) | 23 | -25 |
| NaBr · | 66 | -28 |
| H2SO4 (66,2%) | 40 | -30 |
| C2H5OH (4°) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66,2%) | 91 | -37 |
| CaCl2 ● 6H2O | 123 | -40.3 |
| CaCl2 ● 6H2O | 143 | -55 |
Tabella 1. Miscele di raffreddamento sale/ghiaccio ottenute mescolando i sali con acqua o ghiaccio alle temperature specificate e nelle quantità specificate. 1
2. Fare un bagno di ghiaccio secco
- Indossare guanti di protezione criogenica e occhiali di sicurezza. Praticalo sempre quando maneggi il ghiaccio secco e non toccarlo mai a mani nude in quanto può bruciare rapidamente la pelle e causare congelamenti.
- Per una nave da bagno con un volume di circa 1 L, prendi circa 1/3 di un blocco di ghiaccio secco (di solito disponibile in blocchi da ~ 2 libbre) e suddividilo in alcuni pezzi più piccoli.
- Aggiungere i pezzi di ghiaccio secco al recipiente del bagno.
- Aggiungere lentamente il solvente organico(ad esempio acetone) al ghiaccio secco mescolando con un'asta di vetro. C'è una vigorosa frizzantezza a causa dello sviluppo di gas CO2.
- Continuare ad aggiungere lentamente solvente e mescolare fino a quando non si forma un impasto omogeneo e la maggior parte del ghiaccio secco si dissolve. Questo per garantire che il trasferimento di calore al pallone di reazione sia il più uniforme possibile.
- Inserire un termometro a temperatura fredda nella vasca da bagno per garantire che venga raggiunta la temperatura desiderata.
- Controllare il bagno di ghiaccio secco a intervalli regolari e aggiungere altri pezzi di ghiaccio secco quando si nota un aumento della temperatura del bagno. Il tempo di intervallo dipende dal grado di isolamento, ma di solito è di circa ogni 45-60 minuti.
3. Fare un bagno di azoto liquido
- Indossare guanti di protezione criogenica e occhiali di sicurezza. Praticalo sempre quando maneggi l'azoto liquido in quanto può bruciare rapidamente i tessuti cutanei e i fluidi oculari, causando congelamenti o danni permanenti agli occhi.
- Per un bagno senza additivi, aggiungere la quantità appropriata di N2 a un Dewar per ottenere una temperatura di -196 °C. Passare al passaggio 3.3 se questa è la temperatura desiderata.
- Per un bagno con additivi, aggiungere prima un solvente organico di scelta (consultare la Tabella 3 per trovare il solvente giusto per la giusta temperatura) al Dewar, quindi aggiungere lentamente il liquido N2 al solvente.
- Inserire un termometro a temperatura fredda nella vasca da bagno per assicurarsi che sia stata raggiunta la temperatura desiderata. A differenza degli altri bagni, il bagno liquido N2 all'interno di un Dewar mantiene la sua temperatura per ore alla volta.
- Controllare il bagno a intervalli appropriati (alcune ore) per vedere se è necessario più N2.
Applicazione e Riepilogo
Quando è utile eseguire una reazione a bassa temperatura?
Per rispondere a questa domanda esaminiamo quattro diverse applicazioni:
Applicazione 1. A volte le reazioni sono troppo vigorose ed esotermiche e la miscela di reazione deve essere raffreddata per evitare fuoriuscite e accumuli di pressione dovuti allo sviluppo di gas. Una reazione altamente esotermica può anche diventare un pericolo per la sicurezza in quanto la miscela di reazione può rapidamente bollire (molti solventi organici di solito hanno bassi punti di ebollizione) e schizzare fuori. Un'applicazione molto comune per questo è la fase di tempra o work-up in cui una reazione inizialmente effettuata in condizioni anidre viene fatto reagire con acqua e acido alla fine al fine di protonare il prodotto finale e di reagire a eventuali intermedi reattivi e reagenti rimanenti. Ad esempio, nella reazione di Grignard, una reazione molto comune in chimica organica, la fase di tempra alla fine richiederà il raffreddamento, anche se un bagno di acqua ghiacciata a 0 °C sarà sufficiente:
(4)
Applicazione 2. Il raffreddamento può anche essere richiesto per le fasi di aggiunta all'inizio di una reazione, quando una reazione esotermica comporterebbe altrimenti l'ebollizione del solvente organico. Questo è indesiderabile, perché le reazioni sono meglio eseguite in solventi. Dover aggiungere più solvente per compensare la perdita di solvente non è solo dispendioso e antieconomico, ma anche noioso in quanto i solventi in molte reazioni richiedono una fase di essiccazione preventiva per renderli anidri. Inoltre, è possibile che alcuni reagenti si decompongono termicamente a temperature più elevate.
Per evitare questi eventi in una reazione esotermica, un reagente viene spesso aggiunto gocciamente da siringa o imbuto di goccia a un pallone contenente un altro reagente in solvente, mentre si mescola e si raffredda. In questo modo, l'aggiunta può essere interrotta in qualsiasi momento se la reazione diventa troppo vigorosa. Spesso, la reazione deve essere raffreddata ben al di sotto di 0 °C e un bagno di acqua ghiacciata non è sufficiente.
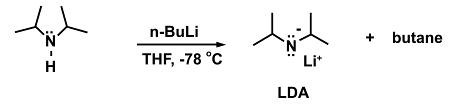
Un esempio di reazione in cui ciò è necessario è l'aggiunta della base forte n-butillitio (n-BuLi) alla diisopropilammina per formare la diisopropilamide di litio (LDA).
(5) 
In assenza di un bagno di raffreddamento l'n-BuLi può decomporsi al raggiungimento di temperature più elevate:
(6) 
Applicazione 3. In alcune reazioni chimiche c'è più di un possibile prodotto risultante da un percorso chimico concorrente. Un prodotto può essere il risultato del percorso con uno stato di transizione più stabile, che richiede meno energia di attivazione (Ea1),mentre l'altro prodotto può richiedere più energia di attivazione (Ea2)ma è complessivamente più stabile. Il primo è chiamato prodotto cinetico mentre il secondo è chiamato prodotto termodinamico (TD) (vedi diagramma energetico in Figura 2).
Controllando la temperatura di reazione possiamo controllare quale di questi prodotti si forma. Poiché il prodotto cinetico richiede meno energia di attivazione, è il prodotto che si forma a basse temperature. Condurre una reazione a basse temperature spesso assicura la formazione del prodotto cinetico sul prodotto termodinamico.
Un esempio classico nel regno della chimica degli enolati è la reazione del 2-metilcicloesanone con basi diverse in diverse condizioni di reazione. Il reagente è un chetone asimmetrico e quindi possiede due diversi tipi di α- idrogeno. Piccole basi, come il NaOH deprotonano il chetone sul lato più altamente sostituito, il che si traduce in un enolato termodinamico più stabile (7). Le basi, che sono più esigenti dal punto di vista sterico, deprotonano il chetone sul lato meno ostacolato, con conseguente enolato cinetico (8). La formazione dell'enolato cinetico avrà una resa molto più elevata quando la reazione viene effettuata a -78 °C rispetto alla temperatura ambiente. Le due forme dell'enolato possono quindi essere reagite con un elettrofilo appropriato, come il metioduro, per formare i prodotti α-alchilati mostrati di seguito.
(7) (8)
La base stericamente esigente utilizzata per ottenere l'enolato cinetico è spesso LDA, la cui preparazione è stata mostrata in precedenza nello schema (5). È importante controllare la temperatura a -78 °C per evitare che l'enolato cinetico si equilibra nell'enolato termodinamico. (Nota: non vi è alcun significato per la temperatura di -78 °C se non che è facilmente ottenibile da un bagno di ghiaccio secco in acetone.)
Oltre al controllo della temperatura, l'ordine di aggiunta e il modo di aggiunta dei reagenti sono cruciali. Per ottenere i migliori risultati favorendo l'enolato cinetico, una soluzione del reagente chetonico viene aggiunta gocciamente alla base LDA nel solvente. Il solvente anidro utilizzato per la reazione con LDA è spesso THF. Una reazione di esempio è mostrata nello schema (9).
(9) 
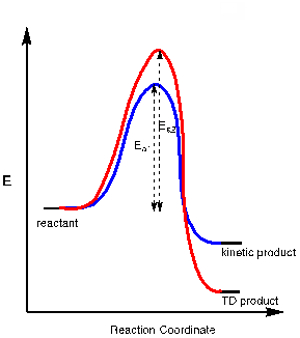
Figura 2. Diagramma energetico per una reazione che ha un prodotto cinetico e uno termodinamico.
Applicazione 4. In alcuni casi è possibile regolare le reattività dei reagenti con la temperatura. Si consideri ad esempio la riduzione di un estere. Le reazioni con l'agente riducente forte idruro di litio alluminio (LAH) provocano la riduzione dell'estere fino al rispettivo alcol primario (10). Tuttavia, l'uso dell'ingombrante agente riducente dell'idruro diisobutilaluminio (DIBAL) consente la riduzione selettiva di un estere alla rispettiva aldeide. È possibile evitare un'eccessiva riduzione dell'alcol primario, a patto che la temperatura di reazione sia mantenuta al di sotto di -78 °C (ma meglio fino a -90 °C) e che venga utilizzato un solo equivalente stechiometrico di DIBAL (12). A temperature superiori a -70 °C, DIBAL diventa troppo reattivo e riduce l'estere all'alcol primario (11).
(10)-(12)
Vai a...
Video da questa raccolta:

Now Playing
Esecuzione di reazioni al di sotto della temperatura ambiente
Organic Chemistry
70.8K Visualizzazioni

Introduzione alla catalisi
Organic Chemistry
34.7K Visualizzazioni

Assemblaggio di un sistema a riflusso per reazioni chimiche riscaldate
Organic Chemistry
168.6K Visualizzazioni

Trasferimento di solventi tramite linea Schlenk
Organic Chemistry
41.7K Visualizzazioni

Degasaggio di liquidi con ciclo freeze-pump-thaw
Organic Chemistry
56.4K Visualizzazioni

Preparazione di reagenti anidri e relativa strumentazione
Organic Chemistry
79.5K Visualizzazioni

Purificazione di composti tramite ricristallizzazione
Organic Chemistry
710.9K Visualizzazioni

Separazione di miscele tramite precipitazione
Organic Chemistry
158.2K Visualizzazioni

Estrazione solido-liquido (lisciviazione)
Organic Chemistry
238.4K Visualizzazioni

Rimozione dei solventi con evaporatore rotante
Organic Chemistry
213.0K Visualizzazioni

Distillazione frazionata
Organic Chemistry
335.1K Visualizzazioni

Preparazione di cristalli per l'analisi mediante diffrazione dei raggi X
Organic Chemistry
32.9K Visualizzazioni

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.3K Visualizzazioni

Cromatografia su colonna
Organic Chemistry
361.5K Visualizzazioni

Spettroscopia a risonanza magnetica nucleare (NMR)
Organic Chemistry
249.2K Visualizzazioni