Preparazione di reagenti anidri e relativa strumentazione
Panoramica
Fonte: Laboratorio della Dott.ssa Dana Lashley - College of William and Mary
Dimostrato da: Timothy Beck e Lucas Arney
Molte reazioni in chimica organica sono sensibili all'umidità e devono essere eseguite con un'attenta esclusione dell'acqua. In questi casi i reagenti hanno un'alta affinità di reagire con l'acqua proveniente dall'atmosfera e se lasciati esposti la reazione desiderata non avverrà né darà scarse rese, perché i reagenti sono chimicamente alterati.
Al fine di prevenire reazioni indesiderate con H 2 O questereazionidevono essere effettuate in atmosfera inerte. Un'atmosfera inerte viene generata eseguendo la reazione sotto azoto gassoso, o in casi più sensibili, sotto un gas nobile come l'argon.
Ogni componente in tale reazione deve essere completamente anidro o privo di acqua. Ciò include tutti i reagenti e solventi utilizzati, nonché tutti i bicchieri e le apparecchiature che entreranno in contatto con i reagenti. Le reazioni estremamente sensibili all'acqua devono essere eseguite all'interno di un vano portaoggetti che fornisce un ambiente anidro completamente sigillato sotto il quale lavorare tramite un paio di guanti che sporge verso uno dei lati della camera.
Principi
Essiccazione di bicchieri
I bicchieri devono essere completamente asciutti durante l'esecuzione di reazioni con molecole sensibili all'acqua. Il vetro, che consiste di biossido di silicio (SiO2), ha tracce microscopiche di acqua adsorbita alla sua superficie, anche quando sembra secca agli occhi. I legami Si-O attirano l'acqua e di conseguenza un film di molecole d'acqua inizia a rivestire la superficie del vetro e si accumula nel tempo. Per liberare il bicchiere dall'acqua può essere asciugato durante la notte in forno o in alternativa asciugato a fiamma direttamente prima di condurre la reazione. Evitare di lavare i bicchieri lo stesso giorno in cui si esegue una reazione al suo interno. Nota: per reazioni poco sensibili all'acqua è possibile risciacquare la vetreria con acetone direttamente prima dell'uso. Questo metodo di essiccazione è assolutamente insufficiente per reazioni come la reazione di Grignard.
Vantaggi e svantaggi dei diversi metodi:
L'essiccazione della vetreria in un forno richiede molto tempo, ma è anche molto comoda e funziona bene per tutti i tipi di bicchieri. L'essiccazione a fiamma dei bicchieri è molto più rapida, ma richiede l'installazione di un bruciatore Bunsen (che è sempre un ulteriore problema di sicurezza) e non può essere utilizzata con fiale coniche. A causa dello spessore della base rispetto al resto della fiala conica, la tensione creata durante il riscaldamento può causare crepe nel vetro. Mentre l'essiccazione della vetreria con acetone è una soluzione molto rapida per le reazioni che non sono eccessivamente sensibili, si dovrebbe sempre tenere a mente i rifiuti di solvente generati e il costo e l'onere ambientale associati a ciò.
Essiccazione dei solventi
Esistono molte tecniche diverse per l'essiccazione di solventi con vari gradi di efficacia. Alcuni laboratori utilizzano sistemi disponibili in commercio per l'essiccazione dei solventi. Questi sistemi impiegano i cosiddetti treni di essiccazione e possono asciugare diversi tipi di solventi contemporaneamente. Questo metodo è molto sicuro e conveniente ma piuttosto costoso e non disponibile nella maggior parte dei laboratori. I valori di contenuto di acqua residua di 1-10 ppm possono essere raggiunti in questo modo.
Un altro metodo di essiccazione dei solventi è l'uso di metalli altamente reattivi come il sodio nei cosiddetti alambidi solventi. Questo metodo pone diversi problemi di sicurezza a causa del rischio di incendi ed esplosioni e di solito non viene eseguito dagli studenti nei laboratori universitari. È tuttavia frequentemente utilizzato nei laboratori di ricerca da studenti e professionisti più avanzati. Gli alambicchi solventi forniranno solventi abbastanza secchi e dovrebbero essere impiegati per un'essiccazione estensiva di eteri (THF, dietiletere, ecc.) o idrocarburi. Nota: questo metodo non deve mai essere utilizzato per l'essiccazione di solventi clorurati perché potrebbe verificarsi una reazione esplosiva. Quando si asciuga con metallo di sodio, un indicatore chiamato benzofenone viene utilizzato per monitorare i progressi dell'essiccazione. In presenza di acqua la soluzione sarà limpida o gialla, ma quando il solvente è asciutto la soluzione sarà blu o viola. Il benzofenone è un chetone e reagisce con il sodio metallico (Na0) in un radicale chetilico, che ha un colore blu /viola. In presenza di acqua il radicale viene protonato per dare un prodotto incolore. Il contenuto di acqua residua ottenuto con questo metodo è in genere di circa 10 ppm.
L'acqua può anche essere rimossa da reagenti liquidi o solventi mediante l'uso di essiccanti o agenti essiccanti. Questi sono solidi altamente igroscopici, il che significa che assorbono facilmente e quindi rimuovono l'acqua da un liquido organico. Negli ultimi anni è stato sviluppato un metodo molto efficace utilizzando setacci molecolari per l'essiccazione di vari solventi. Questo metodo è molto più conveniente dell'uso di alambini di solventi metallici attivi e aggira i problemi di sicurezza di tale metodo. I setacci molecolari sono comunemente usati e probabilmente l'essiccante più efficace attualmente disponibile. Sono un materiale microporoso fatto di alluminosilicati di sodio e calcio. Le dimensioni dei pori dei setacci molecolari possono variare tipicamente tra 2-5 Å (0,2-0,5 nm) e vengono utilizzate per intrappolare o assorbire piccole molecole mentre le molecole più grandi non si adattano ai pori. I setacci molecolari sono disponibili in polvere o in forma di perlina e possono essere utilizzati per intrappolare l'acqua (una piccola molecola) rimuovendola così da un altro liquido con una dimensione molecolare maggiore. I setacci molecolari sono anche componenti comuni dei prodotti della vita di tutti i giorni, ad esempio le lettiere per gatti. I setacci molecolari vengono attivati in forno a temperature superiori a 300 °C a pressione atmosferica per un minimo di 3 ore ma meglio durante la notte. In un forno sottovuoto sarà sufficiente una temperatura di circa 200 °C. Questo processo di attivazione rimuove tutta l'acqua con cui i pori sono saturi anche in una bottiglia di setacci molecolari appena acquistata e appena aperta. Dopo l'attivazione, i setacci molecolari devono essere conservati in un forno di essiccazione convenzionale a temperature superiori a 120 °C o in un essiccatore per diverse settimane prima di richiedere la riattivazione. Nota: se i setacci molecolari sono ancora attivi può essere facilmente determinato posizionando una piccola quantità di perle in una mano guantata seguita da due equivalenti di volume d'acqua alle perle. Se i setacci sono ancora attivi diventeranno molto caldi al tatto.
I solventi vengono essiccati rimuovendo le perle dal forno o dall'essiccatore e raffreddati a temperatura ambiente prima di aggiungerli a un solvente di scelta. Il solvente viene essiccato sulle pere per almeno 12 ore-5 giorni prima che il solvente sia considerato anidro e possa essere utilizzato in una reazione.
La durata del tempo di conservazione dipende dal solvente, così come la quantità di setacci molecolari richiesti. Questo è tipicamente riportato come il carico % massa/volume (m/v) e descrive la quantità di setacci molecolari utilizzati per volume di solvente. Ad esempio, un m/v del 5% significa che vengono aggiunti 5 g di setacci molecolari per 100 ml di solvente.
Per solventi comuni come il diclorometano (DCM), l'acetonitrile o il toluene un tempo di conservazione di 24 ore su setacci molecolari 3-Å con il 10% m/v è sufficiente per raggiungere valori di ppm molto bassi per il contenuto di acqua residua (0,1-0,9 ppm). Il tetraidrofurano (THF) d'altra parte deve essere essiccato per una durata di 3 giorni utilizzando il 20% m/v di setacci molecolari 3-Å per raggiungere basse quantità residue di acqua di circa 4 ppm. Gli alcoli di massa inferiore come metanolo o etanolo dovrebbero anche essere conservati circa 5 giorni su setacci molecolari 3-Å e 20% m / v, che produrrà un contenuto di acqua residua di 8-10 ppm. Gli alcoli di peso molecolare più elevato devono essere essiccati utilizzando setacci in polvere da 3 Å piuttosto che perle. I setacci molecolari in polvere assorbono a un ritmo molto più veloce rispetto alle perle. Ciò si traduce in un adsorbimento non selettivo di molecole di solvente che sono di dimensioni abbastanza piccole da competere con l'acqua per l'ingresso nel poro del setaccio(ad esempio piccole molecole di alcol, come il metanolo). Per gli alcoli di grande peso molecolare è sicuro usare la forma in polvere più attiva dei setacci perché sono troppo grandi per competere con l'acqua per i pori. 1 Nota: gli alcoli sono in genere molto igroscopici e non è possibile raggiungere quantità di acqua residua molto basse. La Tabella 1 riassume i risultati per i solventi comuni sopra descritti.
Si noti che le perle 4-Å leggermente più grandi vengono utilizzate per l'essiccazione di ammine, dimetilformammide (DMF) ed esalmetilfosforammide (HMPA) conservandole sulle perle usando il 5% p / v per almeno 24 ore. I setacci molecolari non devono essere usati per essiccare l'acetone, perché sono basici e inducono una reazione aldolica nell'acetone.
Un altro grande vantaggio dei setacci molecolari è che possono essere riciclati risciacquandoli accuratamente con un solvente organico volatile, seguito dall'essiccazione a 100 °C per alcune ore prima (o in alternativa all'essiccazione all'aria) prima di riattivarli come al solito a temperature superiori a 300 °C per almeno 3 ore. L'acetone può auto-accendersi ad alte temperature di > 400 °C. Quindi bisogna essere sicuri che sia completamente evaporato prima di spostare le pere nel forno ad alta temperatura. Nota: nei laboratori universitari i solventi vengono talvolta essiccati utilizzando gli agenti essiccanti elencati nella Tabella 2 nella sezione seguente. Questo metodo è sufficiente per reazioni che non sono molto sensibili all'acqua ma non rendono solventi sufficientemente secchi per eseguire reazioni sensibili come una reazione di Grignard.
| Solvente | % m/v | Tempo di conservazione del solvente su setacci molecolari 3 Å | Contenuto di acqua residua (ppm) |
| DCM | 10% | 24 ore | ~0,1 |
| Acetonitrile | 10% | 24 ore | ~0,5 |
| Toluene | 10% | 24 ore | ~0,9 |
| THF · | 20% | 3 giorni | ~4,1 |
| Metanolo | 20% | 5 giorni | ~10,5 |
| Etanolo | 20% | 5 giorni | ~8,2 |
Tabella 1. Quantità essiccante, tempo di essiccazione e contenuto di acqua residua per vari solventi essiccati su setacci molecolari da 3 Å. 2
Essiccazione dei reagenti
I reagenti in una reazione chimica possono essere solidi o liquidi (e in casi molto rari gas). Per asciugare i solidi vengono impiegati metodi diversi da quelli utilizzati per asciugare i liquidi.
I reagenti liquidi possono generalmente essere resi anidri con metodi simili a quanto per i solventi sopra descritti. I reagenti appena acquistati sono spesso sufficientemente anidri. I reagenti devono essere essiccati se non sono freschi o se sono stati sintetizzati come parte di una sintesi a più fasi. In una sintesi a più fasi il prodotto di una fase di reazione è il reagente per la fase successiva. La formazione del prodotto di molte reazioni richiede una fase di tempra, il che significa contatto con una grande quantità di acqua. Successivamente il prodotto, sia esso solido o liquido, deve essere essiccato al fine di garantire condizioni anidre per la fase successiva. Ciò è garantito in primo luogo dall'estrazione, un metodo con cui la fase acquosa viene separata dalla fase organica rimuovendo così quantità macroscopiche di acqua. Dopo l'estrazione la fase organica, che contiene il prodotto disciolto in un solvente organico, avrà ancora tracce microscopiche di acqua presente. Dopo l'estrazione la fase organica deve essere essiccata su un essiccatore altamente igroscopico che di solito è un sale inorganico. Esistono molti agenti essiccanti diversi e alcuni dei più comuni sono elencati nella Tabella 2.
Ai fini dell'essiccazione, l'agente essiccante viene aggiunto alla fase organica fino a quando l'agente essiccante appena aggiunto non si aggredia più ma rotola liberamente e la soluzione è limpida e non torbia. La fase organica deve essere coperta e conservata sopra l'agente essiccante per un breve periodo di tempo (di solito un'ora) per garantire l'essiccazione. Successivamente l'agente essiccante viene filtrato e il solvente viene rimosso a pressione ridotta in un evaporatore rotante.
Per un prodotto che è un liquido, è possibile ottenere un'ulteriore essiccazione conservandolo su un agente essiccante e distillandolo fresco prima dell'uso. Per un prodotto solido, l'essiccazione si ottiene preferibilmente mediante conservazione in forno sottovuoto ad una temperatura inferiore al suo punto di fusione (mp). Ad esempio, se il mp del solido è inferiore a 100 °C, il forno deve essere impostato su una temperatura di circa 15-20 °C al di sotto del suo mp. L'acqua evaporerà ancora nel tempo e il vuoto applicato accelererà il processo. In alternativa il solido può essere essiccato mediante stoccaggio all'interno di un essiccatore sottovuoto su un apposito agente essiccante (tipicamente P2O5). Questo può essere indicato per i casi in cui l'mp del solido è estremamente basso (inferiore a ~ 50 ° C) o quando non è disponibile un forno a vuoto. Dopo l'essiccazione, il reagente anidro deve essere conservato in una bottiglia in atmosfera inerte (N2o Ar) e il coperchio del flacone deve essere sigillato ermeticamente con Parafilm. Il flacone deve essere conservato all'interno di un essiccatore fino a quando il reagente non è necessario. Nota: alcuni reagenti solidi, come il magnesio metallico per una reazione di Grignard, possono essere essiccati all'interno dell'apparecchio durante il processo di essiccazione a fiamma.
I reagenti liquidi possono in alternativa essere essiccati mediante setacci molecolari come descritto nella sezione precedente per i solventi. Questo è indicato quando è necessario asciugare grandi quantità di un reagente. In genere i reagenti nelle sintesi su piccola scala sono usati in piccole quantità (pochi ml o meno). L'essiccazione di quantità così piccole con setacci molecolari non è pratica e l'essiccazione con i metodi di cui sopra dovrebbe essere sufficiente.
| Agente essiccante | Capacità | Velocità | Idoneità |
| Na2SO4 | alto | basso | Generalmente utile |
| MgSO4 | alto | alto | Generalmente utile |
| CaCl2 | alto | Medio | Utile per gli idrocarburi* |
| CaSO4 | basso | alto | Generalmente utile |
| * I liquidi organici che non sono idrocarburi, come alcoli, ammine e diversi composti contenenti carbonile vengono assorbiti anche da CaCl2. Non può essere usato per asciugare questi liquidi, ma può aiutare a rimuovere questi tipi di impurità da un idrocarburo. | |||
Tabella 2. Gli agenti essiccanti più comunemente usati nei laboratori biologici.
Procedura
Essiccazione di bicchieri
1. Essiccazione in forno
- Rimuovi tutti i pezzi che non sono fatti di vetro, come il rubinetto di un imbuto aggiuntivo.
- Posizionare tutti gli oggetti di vetro che fanno parte dell'apparecchio in un forno di essiccazione impostato a circa 125 °C per almeno 24 ore prima dell'uso.
- Indossare guanti di protezione dal calore e rimuovere la vetreria dal forno. Prestare molta attenzione quando si maneggia il vetro caldo durante l'assemblaggio dell'apparecchio.
- Per ottenere i migliori risultati, lavare l'apparecchio con un gas inerte come N2 durante l'assemblaggio dell'apparecchio.
2. Essiccazione a fiamma
- Impostare l'intero apparato ma rimuovere tutti i componenti che non sono fatti di vetro (come rubinetti di imbuti cadenti o manicotti di gomma ecc.). Non attaccare alcun tubo all'apparecchio a questo punto.
- Indossare guanti di protezione dal calore.
- Impostare un bruciatore Bunsen e asciugare accuratamente l'apparecchio. Inizia dal basso e sposta la fiamma verso l'alto, "accompagnando" l'acqua mentre esce. Il vapore svilupperà e appanna la vetreria. Continuare l'essiccazione a fiamma fino a quando l'appannamento si ferma.
- Attendere che l'apparecchio si raffreddi a circa 60 °C. Questo richiede un paio di minuti e il vetro sarà ancora caldo al tatto, ma non causerà ustioni se il contatto è breve.
- Aggiungere con attenzione il resto dell'apparecchio che non è fatto di vetro, come tubi e rubinetti. Non rimuovere i guanti di protezione termica durante la manipolazione dell'apparecchio per evitare ustioni.
- Dopo che tutto è stato correttamente assemblato, lavare l'apparecchio con un gas inerte come N2per accelerare il raffreddamento della vetreria fino al punto in cui i reagenti possono essere aggiunti.
Nota: durante il processo di essiccazione a fiamma non avere mai alcun solvente o la barra magnetica all'interno del pallone né alcuno dei reagenti, a meno che non sia specificamente richiesto dalla procedura. (Tuttavia, quando si esegue la reazione di Grignard va bene lasciare i trucioli di magnesio nel pallone durante l'essiccazione a fiamma).
3. Essiccazione con acetone
- Risciacquare la vetreria con acetone.
- Raccogliere i risciacqui di acetone in un contenitore di rifiuti di solvente designato.
- Lavare la vetreria con gas N2 o aria compressa secca per accelerare l'essiccazione.
Essiccazione dei solventi
1. Essiccazione con metallo di sodio attivo
- Tagliare con cura il metallo di sodio sotto l'etere di petrolio per ridurre al minimo il rischio di accensione poiché il metallo reagisce con l'aria. La superficie metallica si ossida rapidamente dando un residuo bianco. Tagliare il metallo in fette sottili esponendo quanta più superficie metallica possibile.
- Sotto N2 gas aggiungere i trucioli di metallo a un pallone di distillazione contenente solvente.
- Quindi aggiungere benzofenone, un indicatore che viene utilizzato per monitorare la reazione. In presenza di acqua la soluzione è limpida o gialla, ma quando il solvente è asciutto la soluzione è blu o viola.
- Reflussare la soluzione utilizzando un mantello riscaldante fino a quando non si osserva un cambiamento di colorazione in blu / viola.
- Distillare il solvente, raccoglierlo in un matraccio asciutto e utilizzarlo in una reazione immediatamente dopo il raffreddamento.
Smaltimento dei rifiuti: dopo il processo di essiccazione è importante smaltire in modo sicuro l'eventuale sodio residuo nel pallone di distillazione. - Per questo, aggiungere con attenzione etanolo al sodio fino a quando l'evoluzione dell'idrogeno non è cessata.
- Mescolare la soluzione con attenzione, ma bene, e assicurarsi che non rimangano grumi di sodio che potrebbero avere metallo di sodio attivo intrappolato all'interno.
- Aggiungere con attenzione metanolo alla miscela e lasciare la miscela nella parte posteriore del cappuccio per diverse ore per assicurarsi che il sodio sia completamente consumato.
- Infine, aggiungere la miscela con molta attenzione a un grande eccesso di acqua e smaltire la miscela in un apposito contenitore per lo smaltimento dei rifiuti.
2. Essiccazione su setacci molecolari
- Aprire una bottiglia contenente setacci molecolari e riempirli in un bicchiere di vetro termostudele. Asciugare più del necessario per l'esperimento corrente per un uso futuro.
- Per l'attivazione, posizionare il becher con le perle in un forno ad alta temperatura e conservare per 3-3,5 ore ad una temperatura di 300-350 °C. In alternativa, se disponibile, conservare in forno sottovuoto a 200 °C per lo stesso periodo di tempo.
- Utilizzando guanti ad alta resistenza al calore rimuovere il becher con le pere e metterlo in un forno di essiccazione convenzionale a temperature superiori a 120 °C. In alternativa conservare il becher con le perle all'interno di un essiccatore. Le pere possono essere conservate per settimane prima dell'uso.
- Rimuovere il becher con le perle dal forno di essiccazione o dall'essiccatore. Lavora velocemente da questo punto in poi per ridurre al minimo il contatto delle pere con l'acqua atmosferica.
- Se si rimuovono le perle da un forno, lasciarle raffreddare a circa la temperatura ambiente. Coprire il becher con un asciugamano asciutto per ridurre al minimo l'esposizione all'aria durante questo periodo di raffreddamento.
- Per verificare se le pere sono ancora attive, indossare guanti monouso e mettere una piccola quantità di pere in mano. Aggiungere circa 2 volumi equivalenti di acqua. Se le pere diventano molto calde, significa che sono attivate.
- Pesare la quantità necessaria di pere attive su una bilancia. Ad esempio, per ottenere un 10% m/v di perle in una bottiglia di solvente da 500 ml, sono necessari 50 g di perle.
- Aggiungere le pere a temperatura ambiente in una bottiglia di solvente appena aperta. Assicurati che le pere siano raffreddate, specialmente se il solvente è volatile. Non aggiungere mai le perle a un solvente direttamente dopo averle rimosse dal forno.
- Per un solvente volatile, come DCM, lasciare il coperchio sulla parte superiore della bottiglia, ma attendere alcuni minuti prima di avvitare completamente il coperchio sulla bottiglia per evitare l'accumulo di pressione.
- Sigillare l'area intorno al coperchio avvolgendola con Parafilm per tenere fuori l'umidità.
- Conservare il solvente sulle pere per il periodo di tempo appropriato, ad esempio 24 ore.
Essiccazione dei reagenti
1. Essiccazione della fase organica dopo l'estrazione
- Dopo la separazione delle fasi in un imbuto separatore, trasferire la fase organica in un contenitore di vetro asciutto, come un becher o un pallone Erlenmeyer (o una provetta per piccole scale).
- Aggiungere un agente essiccante della Tabella 2 (di solito NaSO4o MgSO4) alla fase organica usando una spatola. Inizialmente l'agente essiccante si aggrezza insieme.
- Continuare l'aggiunta fino a quando l'agente essiccante appena aggiunto non si aggregola e rotola liberamente. Inoltre, la soluzione dovrebbe essere chiara e non torbia.
- Se disponibile, coprire il contenitore di vetro con un tappo, altrimenti con un foglio di alluminio.
- Lasciare riposare la soluzione per circa 1 ora sopra l'agente essiccante. Va bene permettergli di stare in piedi per periodi di tempo più lunghi, ad esempio durante la notte.
- Assemblare un apparecchio di filtrazione sottovuoto con imbuto Büchner e pallone a braccio laterale.
- Aggiungere una carta da filtro all'imbuto Büchner e accendere il vuoto.
- Decantare lentamente la fase organica nell'imbuto di Büchner. Inizialmente, cerca di non trasferire nessuno degli agenti essiccanti o il filtro si ostruirà.
- Quando la maggior parte del liquido è stato trasferito sull'imbuto e sgocciolato nel pallone sottostante, aggiungere il resto della fase organica insieme all'agente essiccante e lasciare riposare per alcuni minuti.
- Spegnere il vuoto e trasferire la fase organica in un matraccio a fondo tondo asciutto.
- Collegare il pallone a fondo tondo a un evaporatore rotante e rimuovere tutto il solvente a pressione ridotta.
- Se il prodotto è un liquido, conservarlo su un agente essiccante e distillarlo fresco prima dell'uso.
2. Essiccazione dei reagenti solidi
- Posizionare il reagente solido all'interno di un contenitore di vetro aperto e determinare il peso combinato.
- Posizionare il contenitore con il reagente in un forno di essiccazione impostato a una temperatura inferiore al punto di fusione del solido. Se disponibile, utilizzare un forno a vuoto. Utilizzare guanti di protezione dal calore, se necessario.
- Lasciare asciugare il reagente per diverse ore all'interno del forno.
- Rimuovere il contenitore con il reagente dal forno.
- Lasciare raffreddare il campione a temperatura ambiente, idealmente all'interno di un essiccatore.
- Determinare il peso e assicurarsi che sia inferiore rispetto a prima dell'essiccazione. Se necessario, ripetere i passaggi 2.2 – 2.5.
- Una volta che il reagente è raffreddato a temperatura ambiente è pronto per l'uso.
- Se il reagente non deve essere utilizzato immediatamente, lavare il contenitore con un gas inerte, ad esempio N2 e sigillarlo saldamente con un coperchio e posizionare Parafilm attorno al coperchio.
- Posizionare il contenitore all'interno di un essiccatore e conservarlo lì fino a quando il reagente non è necessario.
3. Essiccazione di reagenti solidi sensibili al calore
- Preparare un essiccatore posizionando l'agente essiccante anidro fresco nel compartimento inferiore (tipicamente P2O5).
- Posizionare il reagente solido all'interno di un contenitore di vetro aperto e determinarne il peso.
- Posizionare il contenitore con il reagente all'interno di un essiccatore.
- Chiudere il coperchio dell'essiccatore, facendolo scorrere orizzontalmente dal lato per garantire una corretta tenuta.
- Applicare un vuoto all'essiccatore utilizzando la connessione del rubinetto.
- Dopo alcuni minuti chiudere il rubinetto e spegnere l'aspirapolvere.
- Lasciare asciugare il reagente all'interno dell'essiccatore per almeno alcune ore.
- Aprire il rubinetto sull'essiccatore e consentire all'aria di fluire.
- Far scorrere con attenzione il coperchio dell'essiccatore orizzontalmente. Non tentare di staccare il coperchio verticalmente.
- Rimuovere il reagente dall'essiccatore e pesarlo. Dovrebbe avere un peso inferiore rispetto a prima che fosse asciugato.
- Se necessario, ripetere i passaggi 3.3 – 3.10 fino a quando il peso rimane stabile e il reagente è completamente asciutto.
- Se il reagente non deve essere utilizzato immediatamente, lavare il contenitore con un gas inerte come N2 e sigillarlo saldamente con un coperchio e posizionare Parafilm attorno al coperchio.
- Posizionare il contenitore all'interno di un essiccatore e conservarlo lì fino a quando il reagente non è necessario.
Risultati
Un esempio classico di reazione che deve essere fatta in condizioni anidre è la reazione di Grignard. (Equazione 1)
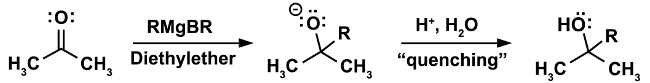
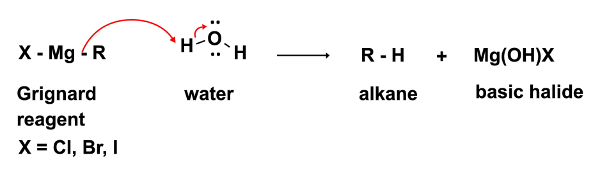
Nella prima fase della reazione, l'attacco nucleofilo del reagente di Grignard RMgX si verifica su un elettrofilo (in questo caso un chetone). In questa fase è imperativo che non siano presenti nemmeno le più piccole tracce di acqua. Il reagente di Grignard, pur essendo un forte nucleofilo, è una base ancora più forte. In presenza di acqua fungerà preferenzialmente da acqua base e deprotonata, con conseguente perdita del reagente nucleofilo di Grignard e formazione di un alcano, un sottoprodotto indesiderato. (Equazione 2)
Vai a...
Video da questa raccolta:

Now Playing
Preparazione di reagenti anidri e relativa strumentazione
Organic Chemistry
79.5K Visualizzazioni

Introduzione alla catalisi
Organic Chemistry
34.7K Visualizzazioni

Assemblaggio di un sistema a riflusso per reazioni chimiche riscaldate
Organic Chemistry
168.6K Visualizzazioni

Esecuzione di reazioni al di sotto della temperatura ambiente
Organic Chemistry
70.8K Visualizzazioni

Trasferimento di solventi tramite linea Schlenk
Organic Chemistry
41.7K Visualizzazioni

Degasaggio di liquidi con ciclo freeze-pump-thaw
Organic Chemistry
56.4K Visualizzazioni

Purificazione di composti tramite ricristallizzazione
Organic Chemistry
711.0K Visualizzazioni

Separazione di miscele tramite precipitazione
Organic Chemistry
158.2K Visualizzazioni

Estrazione solido-liquido (lisciviazione)
Organic Chemistry
238.4K Visualizzazioni

Rimozione dei solventi con evaporatore rotante
Organic Chemistry
213.1K Visualizzazioni

Distillazione frazionata
Organic Chemistry
335.1K Visualizzazioni

Preparazione di cristalli per l'analisi mediante diffrazione dei raggi X
Organic Chemistry
32.9K Visualizzazioni

Performing 1D Thin Layer Chromatography
Organic Chemistry
290.3K Visualizzazioni

Cromatografia su colonna
Organic Chemistry
361.6K Visualizzazioni

Spettroscopia a risonanza magnetica nucleare (NMR)
Organic Chemistry
249.2K Visualizzazioni