실온 이하의 반응 수행
Overview
출처: 다나 래슬리 박사연구소 - 윌리엄 대학교와 메리
데모: 맷 스미스
새로운 결합이 화학 반응의 과정에서 형성될 때, 관련 종 (원자 또는 분자)이 매우 근접하여 서로 충돌해야합니다. 이 종 사이 충돌은 이 분자가 움직이는 더 높은 속도 더 빈번하고 효과적입니다. Arrhenius 방정식1에뿌리를 두고 있는 널리 사용되는 엄지 손가락 규칙은 온도를 10K로 올리는 것이 반응 속도의 약 두 배가 되며 온도를 20K로 올리는 속도가 속도의 네 배가 될 것이라고 명시합니다.
(1) 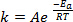
방정식 (1)은 종종 그 로그 와이트 형태로 발견된다 :
(2) 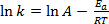
여기서 K는 화학 반응의 속도이고, A는 주파수 인자(분자 충돌의 주파수에 관한),Ea는 반응에 필요한 활성화 에너지이며, R은 이상적인 가스 상수이며, T는 반응이 일어나는 온도이다.
따라서 온도가 높을수록 반응이 훨씬 더 빨리 완료된다는 것을 의미합니다. 그럼에도 불구하고, 어떤 경우에는 반응속도에 대한 저하 효과에도 불구하고 저온에서 반응을 수행하는 것이 바람직하다. 이 와 관련하여 몇 가지 시나리오는 아래에 자세히 설명되어 있습니다.
실온 보다 낮은 반응을 실행하는 것이 유용할 때, 화학자는 특정 온도 또는 온도 범위를 유지하기 위해 냉각 목욕을 사용합니다. 반응은 적절한 냉각 목욕 내부에 반응 플라스크를 배치하여 원하는 온도로 냉각됩니다. 반응의 시약은 냉각 목욕의 화학 물질과 직접 접촉하지 않습니다. 냉각 배스는 단일 극저온(냉각) 성분(예: 얼음, 드라이 아이스 또는 액체 질소)으로 구성될 수 있거나 특정 용매 및/또는 첨가제 염을 가진 극저온 성분의 혼합물일 수 있다. 용매의 목적은 냉각제의 온도를 효과적으로 반응 플라스크로 이송하는 것이며, 첨가제의 목적은 혼합물의 동결점을 낮게(또는 우울)하는 것이다. (물질이 용매와 첨가제일 수 있습니다.)
Principles
용액이 순수한 액체보다 낮은 온도에서 동결될 때, 이것은 동결점 우울증으로 알려진 회개 특성에 기인한다는 것을 기억하십시오. 동결점에 대한 하강 효과는 액체 용매에 첨가되는 솔루트(첨가제)의 양에 비례한다. 이 효과는 방정식(3)에 의해 설명됩니다.
(3) ΔDTf = Tf (용매) - Tf (솔루션) = Kf × m
ΔDTf는 동결점 우울증이며 용매의 동결 온도 의 차이 에 의해 그 자체로, 첨가제/솔테를 가진 용액의 차이에 의해 설명된다.
Kf는 시스템에 대한 동결 점 우울증 상수이며, m은 용액의 용약이다. 화학자는 이 효과를 사용하여 상대적으로 용이성과 비용 효율성으로 다양한 온도를 만듭니다.
냉각 목욕에 의해 달성 된 온도 변동 할 수 있습니다. 목욕을 모니터링하고 필요에 따라 조정해야합니다. 최상의 결과를 얻으려면 목욕 용기 자체가 잘 절연되어야합니다. 사용 가능한 경우, 데와르 플라스크는 냉각 욕조에 사용해야합니다. 드와르 플라스크가 없는 경우, 가능한 한 최선을 다해 절연된 용기(예: 알루미늄 호일 또는 수건 사용)로 유리 또는 고무 용기에 목욕을 설정할 수 있습니다. 사용된 용기는 원하는 온도에서 열안정이 필요하며 균열해서는 안됩니다.
화학 실험실 환경에서 실온 이하의 다른 온도의 비교적 경제적이고 간단한 달성을 위해 많은 다른 목욕 변화가 존재합니다.
- 영하의 온도(필요한 경우 - 55°C)의 경우 소금이 다른 얼음 수조가 제공됩니다.
- -78°C까지의 온도의 경우 다른 용매의 드라이 아이스 욕조가 사용됩니다.
- -78°C 이하의 온도 -196°C까지 액체 질소를 사용하여 얻을 수 있다.
이러한 냉각 목욕을 설정하는 것은 비교적 간단하며 절차는이 문서의 끝에 포함되어 있습니다.
얼음 수탕
이러한 유형의 목욕은 모든 학부 교육 실험실에서 설치가 매우 쉽고 사용할 수 있습니다. 얼음 목욕이 매우 낮은 온도에 도달하지 못하고 선박을 균열의 위험이 없기 때문에, 목욕 선박의 유형에 많은 유연성이있다.
얼음-물 자체는 0°C의 온도를 가지고 있지만, 낙해점 우울증은 NaCl, MgCl2 또는 CaCl2와같은 특정 염의 첨가에 의해 달성될 수 있다. 달성된 최종 온도는 다양하며 얼음 100g당 사용되는 첨가제의 양에 따라 조정할 수 있습니다. 일반적인 얼음 목욕은 NaCl과 함께 100g의 얼음당 33g의 NaCl을 첨가하는 첨가제입니다. 이 수단에 의해 달성 된 최종 온도는 약 -20 °C입니다. 얼음-수조가 도달할 수 있는 가장 추운 온도는 약 -55°C이며, 얼음 100g당 CaCl2 헥사하이드레이트 143g을 첨가하여 얻을 수 있습니다.
드라이 아이스 목욕
드라이 아이스는 고체 이산화탄소이며 -78 °C의 온도에서 숭고합니다. 그것은 상당히 저렴 한 극저 온 에이전트 이며 많은 실험실에서 쉽게 사용할 수. 이 온도를 반응 용기로 효율적으로 열 전달하려면 -78°C 이하의 융점을 가지는 용매가 필요합니다. 더 높은 융점 또는 mp를 가진 용매는 또한 이용될 수 있고 더 높은 목욕 온도를 초래할 수 있습니다(이 경우에 동결점이라고 도) 또한 이용될 수 있습니다.
드라이 아이스 욕조에서 자주 사용되는 용매는 아세톤(mp = -95°C)으로 쉽게 이용 가능하고 저렴합니다. 아세톤의 드라이 아이스 목욕은 시간 동안 -78 °C의 온도를 유지하며, 그 길이는 절연 정도에 따라 달라집니다. 이것은 가장 일반적인 드라이 아이스 목욕 시스템입니다.
고온 드라이 아이스 욕조의 경우, 더 높은 동결 점을 가진 용매가 사용됩니다. 획득 된 목욕 온도가 항상 용매의 동결 점과 같지는 않습니다. 다른 시스템에서 얻은 온도는 표 2를 참조하십시오.
이러한 종류의 욕조에 의해 도달 낮은 온도 로 인해, 냉동 보호 장갑은 항상 드라이 아이스를 처리 할 때 착용해야합니다.
드라이 아이스 목욕을 위한 목욕 용기는 이상적으로 드와르입니다. Dewar를 사용할 수 없는 경우 유리, 고무 또는 스테인레스 스틸 용기가 사용되지만 절연이 매우 최적이 아니며 목욕을 더 자주 조정해야합니다.
| 드라이 아이스 쿨링 목욕 온도 | |
| 혼합 | T (°C) |
| p-자일렌/드라이 아이스 | +13 |
| 사이클로헥산/드라이 아이스 | +6 |
| 벤젠/드라이 아이스 | +5 |
| 에틸렌 글리콜/드라이 아이스 | -15 |
| 탄소 테트라클로라이드/드라이 아이스 | -23 |
| 3-헵타네네/드라이 아이스 | -38 |
| 아세토니틀/드라이 아이스 | -42 |
| 실코헥사네/드라이 아이스 | -46 |
| 디틸 카비톨/드라이 아이스 | -52 |
| 클로로폼/드라이 아이스 | -61 |
| 카비톨 아세테이트/드라이 아이스 | -67 |
| 에탄올/드라이 아이스 | -72 |
| 아세톤/드라이 아이스 | -78 |
| 이소프로판올/드라이 아이스 | -78 |
표 2. 다른 드라이 아이스 목욕 혼합물의 목록.
액체 질소 목욕
액체 질소 슬러시 목욕은 건조 얼음 목욕의 그 이하의 매우 낮은 온도가 원하는 경우 사용됩니다. 액체 질소는 -196°C의 융점을 가진 극저온제이며, 이는 추가 용매가 사용되지 않는 경우 목욕의 온도이다. 참고, 드라이 아이스와 는 달리,N2는 액체이며 균일한 열 전달을 위한 첨가제 용매의 사용은 필요하지 않습니다. -196°C보다 높은 온도가 바람직한 경우, 건조 아이스-목욕의 경우와 유사한 다른 온도를 초래할 혼합물에 다양한 유기 용매가 사용된다. 다른 시스템에서 얻은 온도에 대해서는 표 3을 참조하십시오.
액체 N2 목욕의 매우 낮은 온도로 인해, 단지 Dewar 목욕 용기로 사용되어야하며,이 극저온 에이전트를 처리 할 때 항상 장갑과 함께 작동해야합니다.

표 3. 다른 용매와 액체 질소 목욕의 목록. 2
Procedure
쿨링 배스 설정
일반적인 설정의 경우, 아래에 설명된 대로 선택가능한 냉각 목욕을 준비하고 반응 플라스크를 욕조에 담급니다(도1). 목욕 용기를 끝까지 채우지 말고 반응 플라스크를 침수 할 수있는 충분한 공간을 남겨 둡니다.
참고: 반응이 수분에 민감한 경우 플라스크 또는 장치의 다른부분(예: 낙하 깔때기)에 시약을 추가할 때 매우 주의하십시오. 유리 제품이 냉각 욕조에 침지되는 동안 개구부가 생성되면 실온 공기가 빠르게 내부로 흐르고 수분을 운반합니다.
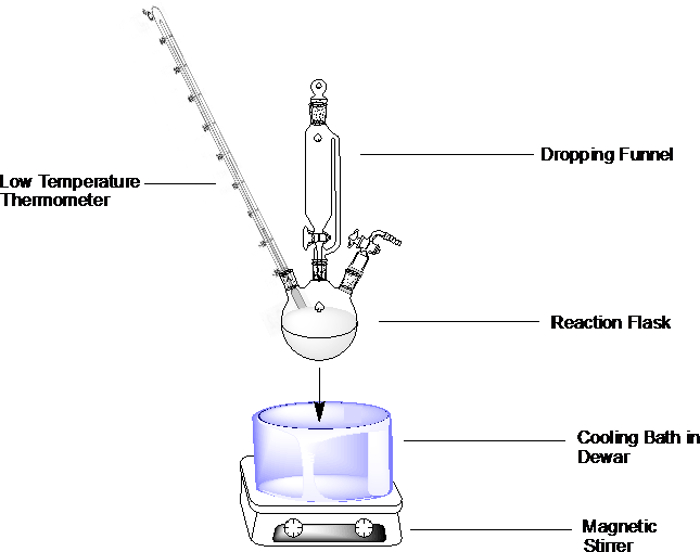
그림 1. 유입경로, 불활성 대기 하에서 온도계를 떨어뜨리는 3넥 라운드 하부 플라스크에 냉각 목욕 을 설정하는 예.
1. 얼음수탕 만들기
- 첨가제를 첨가한 얼음 수조의 경우, 계량하고 적절한 양의 얼음을 배용기에 추가합니다. 드와르는 도움이 되지만 필요하지는 않습니다. 용기는 플라스틱,고무(예: 양동이) 또는유리(예: 큰 결정화 접시)일 수 있다. 이 실험을 위해 1L 용기에 500g의 얼음을 추가합니다.
- 적정량의 첨가제를 아이스목욕(표1)에계량하고 얼음에 첨가제를 넣습니다. 이 실험을 위해 무게와 목욕 용기에 NaCl의 165g (= 5x 33g)를 추가합니다.
- 소량의 탈이온된 물을 목욕 용기에 넣고 저어주봉을 사용하여 철저히 저어줍니다. 모든 얼음이 덮여있을 때까지 충분한 물을 추가합니다.
- 온도계를 확인하여 원하는 온도에 도달했는지 확인합니다. 필요한 경우 첨가제양을 조정합니다. 목욕은 매우 오랫동안 온도를 유지하지 않으며 조정은 약 20-30 분마다 자주 간격으로 이루어져야합니다. 이를 위해 목욕의 물 중 일부를 피펫하고 얼음과 첨가제를 더 추가해야 할 수도 있습니다.
| 물질 | g/100 g H2O | 최종 온도(°C) |
| 나2CO3 | 20 | -2.0 |
| NH4NO3 | 106 | -4.0 |
| NaC2H3O2 | 85 | -4.7 |
| NH4Cl | 30 | -5.1 |
| 나노3 | 75 | -5.3 |
| Na2S2O3 ● 5H2O | 110 | -8.0 |
| CaCl2● 6H2O | 41 | -9.0 |
| KCl | 30 | -10.9 |
| 기 | 140 | -11.7 |
| NH4NO3 | 60 | -13.6 |
| NH4Cl | 25 | -15.4 |
| NH4NO3 | 45 | -16.8 |
| NH4SCN | 133 | -18.0 |
| 나Cl | 33 | -21.3 |
| CaCl2 ● 6H2O | 81 | -21.5 |
| H2SO4 (66.2%) | 23 | -25 |
| 나브르 | 66 | -28 |
| H2SO4 (66.2%) | 40 | -30 |
| C2H5OH(4°) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66.2%) | 91 | -37 |
| CaCl2 ● 6H2O | 123 | -40.3 |
| CaCl2 ● 6H2O | 143 | -55 |
표 1. 소금/얼음 냉각 혼합물은 소금을 지정된 온도와 지정된 양에서 물이나 얼음과 혼합하여 얻을 수 있습니다. 1
2. 드라이 아이스 목욕 만들기
- 극저온 보호 장갑과 안전 고글을 착용하십시오. 마른 얼음을 다룰 때 항상 연습하고 피부를 빠르게 태우고 동상을 일으킬 수 있으므로 맨손으로 만지지 마십시오.
- 약 1L의 부피가 있는 목욕 용기의 경우, 드라이 아이스 블록의 약 1/3(보통 ~2lb 블록에서 사용 가능)을 가지고 몇 개의 작은 조각으로 분해하십시오.
- 목욕 용기에 드라이 아이스 조각을 추가합니다.
- 유리 막대로 저어주면서 건조 얼음에 유기 용매(예 : 아세톤)를 천천히 추가합니다. CO2 가스 개발의 결과로 활발한 피싱이 있습니다.
- 용매를 천천히 추가하고 균일한 슬러리가 형성되고 대부분의 드라이 아이스가 녹을 때까지 저어줍니다. 이는 반응 플라스크로의 열 전달이 가능한 한 균일하도록 하기 위한 것입니다.
- 원하는 온도에 도달할 수 있도록 고온 온도계를 욕조에 삽입합니다.
- 정기적으로 드라이 아이스 목욕을 확인하고 목욕 온도가 상승하면 드라이 아이스 덩어리를 더 추가하십시오. 간격 시간은 절연정도에 따라 다르지만, 보통 45~60분마다 다릅니다.
3. 액체 질소 목욕 만들기
- 극저온 보호 장갑과 안전 고글을 착용하십시오. 액체 질소를 취급할 때 항상 이것을 연습하는 것은 급속하게 피부 조직 및 눈 액체를 점화할 수 있기 때문에, 동상 또는 영원한 눈 손상을 일으키는 원인이 됩니다.
- 첨가제없이 목욕의 경우, -196 °C의 온도를 얻기 위해 드와르에N2의 적절한 양을 추가합니다. 원하는 온도인 경우 3.3단계로 이동합니다.
- 첨가제가 있는 목욕의 경우, 선택한 유기 용매(표 3참조)를 드와르에 먼저 추가한 다음, 용매에 액체N2를 천천히 추가합니다.
- 원하는 온도에 도달했는지 확인하기 위해 고온 온도계를 욕조에 삽입합니다. 다른 목욕탕과 는 달리, 데와르 내부의 액체 N2 목욕은 한 번에 몇 시간 동안 온도를 유지합니다.
- 적절한 간격(몇 시간)으로 목욕을 확인하여 더 많은 N2가 필요한지 확인하십시오.
Application and Summary
저온에서 반응을 실행하는 것이 언제 유용합니까?
이 질문에 답하기 위해 다음 네 가지 응용 프로그램을 조사해 보겠습니다.
응용 프로그램 1. 때로는 반응이 너무 활발하고 외형적이며 가스 발달로 인한 유출 및 압력 축적을 방지하기 위해 반응 혼합물을 냉각해야합니다. 반응 혼합물이 급속히 끓어 오르고 (많은 유기 용매는 일반적으로 낮은 비등점이 있음) 및 분출 할 수 있기 때문에 매우 외동적인 반응은 안전 위험이 될 수 있습니다. 이를 위한 매우 일반적인 적용은 최종 생성물을 프로토네이트하고 남은 반응성 중간체 및 반응제에서 반응하기 위해 무수 조건하에서 처음에 수행된 반응이 물과 산과 반응하는 담금질 또는 작업 단계입니다. 예를 들어, 그리나드 반응에서, 유기 화학에 있는 매우 일반적인 반응에서는, 끝에 있는 담금질 단계는 0°C에 있는 얼음 수조가 충분하더라도 냉각을 요구할 것입니다:
(4)
응용 프로그램 2. 반응의 시작 부분에 추가 단계에 냉각이 필요할 수 있으며, 그렇지 않으면 외동반응이 유기 용매의 끓어 오르게 됩니다. 반응이 용매에서 가장 잘 수행되기 때문에 이것은 바람직하지 않습니다. 용매의 손실을 보상하기 위해 용매를 더 추가하는 것은 낭비적이고 비경제적일 뿐만 아니라 많은 반응에서 용매가 이전에 건조 단계를 요구하므로 지루합니다. 또한, 특정 시약이 더 높은 온도에서 열분해될 수 있습니다.
이러한 발생을 피하기 위해, 시약은 종종 교반 및 냉각하면서 용매에 다른 시약을 포함하는 플라스크에 주사기 또는 낙하 깔때기에 의해 드롭 와이즈를 추가합니다. 이러한 방식으로 반응이 너무 활발해지면 언제든 추가를 중지할 수 있다. 종종 반응은 0 °C 이하로 잘 냉각되어야하며 얼음 수조로 충분하지 않습니다.
이것이 필요한 반응의 예는 리튬 디이소프로필라미드(LDA)를 형성하기 위해 이소프로필라민에 강한 염기 n-부틸리튬(n-BuLi)을 첨가하는 것이다.
(5) 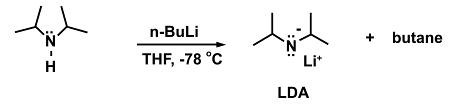
냉각 목욕이 없는 경우 n-BuLi는 더 높은 온도에 도달하면 분해될 수 있습니다.
(6) 
응용 프로그램 3. 일부 화학 반응에서 경쟁 화학 경로에서 발생 하는 하나 이상의 가능한 제품. 한 제품은 보다 안정적인 전이 상태를 가진 경로의 결과일 수 있으며, 활성화 에너지(Ea1)가적어야 하며, 다른 제품은 더 많은 활성화 에너지(Ea2)를필요로 할 수 있지만 전반적으로 더 안정적입니다. 전자는 운동성 제품이라고 하며 후자는 열역학(TD) 제품이라고 합니다(그림 2의에너지 다이어그램 참조).
반응 온도를 제어함으로써 우리는 이러한 제품 중 하나가 형성되는 것을 제어 할 수 있습니다. 운동 성 제품은 더 적은 활성화 에너지를 필요로하기 때문에 저온에서 형성되는 제품입니다. 저온에서 반응을 수행하면 종종 열역학 제품보다 운동 성 제품이 형성됩니다.
에노레이트 화학 영역에서의 고전적인 예는 다른 반응 조건 하에서 다른 기지를 가진 2-메틸 시클로헥사네의 반응이다. 반응제는 비대칭 케톤이므로 두 가지 유형의 α 수소를 가지고 있습니다. NaOH와 같은 작은 염기는 케톤을 더 많이 대체한 쪽에서 데프로토토네이트하여 보다 안정적이고 열역학적 인 에노레이트 (7)를 초래합니다. 더 까다롭고, 덜 방해받는 쪽에 케톤을 분해하여 운동 에놀레이트(8)를 생성합니다. 운동 성 유노레이트의 형성은 실온에 비해 -78 °C에서 반응이 수행될 때 훨씬 더 높은 수율을 가질 것이다. 상기 두 형태의 유산은 메티오디드와 같은 적절한 전기필로 반응하여 아래에 표시된 α 알키화 제품을 형성할 수 있다.
(7) (8)
운동 성 황량증을 얻기 위해 사용되는 sterically 까다로운 베이스는 종종 LDA이며, 그 준비는 계획 (5)에서 일찍 나타났다. 온도 -78°C로 온도를 조절하여 운동성 에놀레이트가 다시 열역학 적폐체로 평형화되는 것을 방지하는 것이 중요합니다. (참고: 아세톤에서 드라이 아이스 목욕에 의해 쉽게 얻을 수 있다는 것 이외에 -78°C의 온도에 의미가 없습니다.)
온도 제어 외에도 시약의 추가 순서와 추가 방식이 중요합니다. 운동 성 유황을 선호하는 최상의 결과를 위해, 케톤 반응제의 용액이 용매의 LDA 베이스에 드롭 와이즈를 추가합니다. LDA와의 반응에 사용되는 무수성 용매는 종종 THF입니다. 예시 반응은 계획(9)에 도시된다.
(9) 
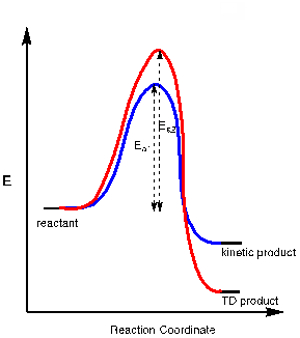
그림 2. 운동 및 열역학 적 제품이있는 반응을위한 에너지 다이어그램.
응용 프로그램 4. 경우에 따라 온도로 시약의 시동을 조절할 수 있습니다. 예를 들어 에스테르의 감소를 고려하십시오. 강한 수화물 환원제 리튬 알루미늄 수화물(LAH)을 갖는 반응은 각각의 1차 알코올(10)까지 에스테르를 감소시키는 결과를 낳는다. 그러나, 부피가 큰 수화물 환원제 디이소부틸 알루미늄 수화물(DIBAL)을 사용하면 각각의 알데히드에 에스테르를 선택적으로 감소시킬 수 있다. 1차 알코올에 대한 과다 감소는 피할 수 있으며, 반응 온도가 -78°C 이하로 유지되는 한(-90°C까지 더 좋음) DIBAL의 1개의 스토이치오메트릭(12)만 사용된다. -70°C 이상의 온도에서 DIBAL은 너무 반응성이 높아지며 에스테르를 1차 알코올(11)으로 감소시게 됩니다.
(10)-(12)
References
- Gordon, A. J., Ford, R. A. The Chemist's Companion - A Handbook of Practical Data, Techniques, and References. Chapter 11 (1973) ISBN: 978-0-471-31590-2.
- Rondeau, R. E. Slush baths. J. Chem. Eng. Data. 11, 124 (1966)
건너뛰기...
이 컬렉션의 비디오:

Now Playing
실온 이하의 반응 수행
Organic Chemistry
70.4K Views

촉매 소개
Organic Chemistry
34.1K Views

가열된 화학 반응을 위한 역류 시스템의 조립
Organic Chemistry
166.6K Views

솔벤트의 슐렌크 라인 전송
Organic Chemistry
41.5K Views

동결 펌프 해동 사이클링으로 액체 를 탈기
Organic Chemistry
56.0K Views

무수성 시약 및 장비 준비
Organic Chemistry
79.1K Views

재결정화로 화합물 정화
Organic Chemistry
706.2K Views

침전을 통한 혼합물의 분리
Organic Chemistry
157.3K Views

고체 액체 추출
Organic Chemistry
237.4K Views

용매제거를 위한 로타리 증발
Organic Chemistry
212.5K Views

분수 증류
Organic Chemistry
333.3K Views

X선 회절 분석을 위한 커지는 결정
Organic Chemistry
32.3K Views

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.7K Views

열 크로마토그래피
Organic Chemistry
358.9K Views

핵 자기 공명 (NMR) 분광기
Organic Chemistry
247.0K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유