Introduzione alla catalisi
Panoramica
Fonte: Laboratorio del Dr. Ryan Richards — Colorado School of Mines
La catalisi è tra i campi più importanti della tecnologia moderna e attualmente rappresenta circa il 35% del prodotto interno lordo (PIL) e il sostentamento di circa il 33% della popolazione mondiale attraverso fertilizzanti prodotti attraverso il processo Haber. 1 I catalizzatori sono sistemi che facilitano le reazioni chimiche abbassando l'energia di attivazione e influenzando la selettività. La catalisi sarà una tecnologia centrale nell'affrontare le sfide energetiche e ambientali dei tempi moderni.
Principi
I catalizzatori eterogenei sono tipicamente costituiti da un'entità catalitica su scala nanometrica (tipicamente un metallo) dispersa su un materiale di supporto (tipicamente carbonio o ossido di metallo), che aumenta la superficie e spesso conferisce una certa stabilità contro l'aggregazione delle nanoparticelle. La nanoparticella catalizzante ha siti attivi sulla sua superficie, dove avviene la reazione. A seconda della reazione, questi siti attivi potrebbero essere facce planari o bordi cristallini sulla superficie della particella. Tipicamente, le nanoparticelle più piccole hanno una maggiore attività catalitica, a causa della maggiore quantità di atomi di superficie per mole di catalizzatore. 2
La reazione sulla superficie del catalizzatore inizia con l'adsorbimento dei reagenti al sito attivo, seguita dalla reazione sulla superficie. La reazione superficiale può verificarsi tra una specie adsorbita e una alla rinfusa, chiamata meccanismo di Eley-Rideal, o tra due specie adsorbite, chiamate meccanismo di Langmuir-Hinshelwood. La specie reagita quindi desorbe dalla superficie alla rinfusa. 2
Le particelle di palladio su scala nanometrica supportate hanno mostrato attività in molte importanti reazioni catalitiche e rappresentano un sistema modello per dimostrare un catalizzatore eterogeneo. Gli sforzi di ricerca sui catalizzatori basati sul palladio sono ampi e hanno spaziato dall'aggiornamento della biomassa alla decomposizione dei coloranti chimici nei flussi di acque reflue. L'uso di catalizzatori di palladio come rappresentante per catalizzatori eterogenei è auspicabile perché consente una facile separazione del catalizzatore dai prodotti. 2
Qui, il catalizzatore eterogeneo è costituito da particelle di palladio su scala nanometrica disperse su un supporto di carbonio ad alta superficie. Attualmente, diversi catalizzatori di palladio supportati sono disponibili in commercio. In questo articolo educativo vengono utilizzati due materiali di palladio supportati disponibili in commercio, l'1% di palladio supportato su carbone attivo e lo 0,5% di palladio supportato su carbonio granulare. Un altro materiale, il carbone attivo, viene utilizzato come esperimento di controllo. La riduzione del 4-nitrofenolo viene scelta per la reazione catalitica perché è facile da lavorare e i risultati sono visibili attraverso un cambio di colore. Questo protocollo sperimentale fornisce una dimostrazione visiva molto chiara di una tipica reazione catalitica.
Procedura
1. Preparazione della soluzione di 4-nitrofenolo miscelata con boroidro di sodio
- Pesare 14 mg di 4-nitrofenolo e sciogliere in 10 ml di acqua DI in un flaconcino di vetro.
- Pesare 57 mg di boroidro di sodio e sciogliere in 15 ml di acqua DI.
- Mescolare le due soluzioni e mescolare magneticamente per 30 minuti a temperatura ambiente in una soluzione uniforme. Cappotto da laboratorio, maschera di sicurezza e guanti sono necessari come protezione del protocollo standard.
2. Preparazione della soluzione catalizzante
- Pesare rispettivamente 10 mg di palladio su carbone attivo e palladio su carbonio granulare. Pesare 10 mg di carbone attivo come gruppo di controllo.
- Trasferire i catalizzatori pesati in un flaconcino e aggiungere 100 ml di acqua DI a ciascun flaconcino.
- Sonicare i flaconcini con una potenza di uscita di 135 W per 10 minuti fino a quando i catalizzatori non sono ben distribuiti in acqua.
3. Riduzione catalitica del 4-nitrofenolo
- Misurare 1,15 mL di soluzione preparata di 4-nitrofenolo e boroidrato di sodio, trasferire in un flaconcino di vetro da 5 mL.
- Registrare il colore della soluzione nel flaconcino, attendere 10 minuti e registrare se vi è qualche cambiamento nel colore della soluzione.
- Aggiungere 1 mL di palladio preparato su soluzione catalizzante a carbone attivo al flaconcino, agitare il flaconcino a mano per 20 s. Osservare la reazione per 20 minuti, registrare quando il colore della soluzione inizia a cambiare e quando il colore della soluzione svanisce completamente in trasparente.
- Ripetere la stessa procedura con il palladio su soluzione catalizzante di carbonio granulare.
- Ripetere la stessa procedura con la soluzione catalizzante a carbone attivo.
- Confronta il cambiamento di colore tra tre catalizzatori dopo 0, 5, 10, 15 e 20 minuti di tempo di reazione. Per quantificare questo cambiamento, misurare gli spettri UV-Vis del campione durante l'intervallo di reazione di 20 minuti.
Risultati
La riduzione del 4-nitrofenolo con un catalizzatore è una reazione di riferimento in letteratura per valutare le prestazioni del catalizzatore e misurare la cinetica. Prima dell'aggiunta del catalizzatore, il colore della soluzione è giallo chiaro, che corrisponde allo ione 4-nitrofenolo in condizioni alcaline. Senza l'aggiunta di un catalizzatore, il colore giallo non svanisce, questo indica che il sistema di miscela di 4-nitrofenolo e boroidrofuro di sodio è stabile.
Dopo l'aggiunta di palladio su carbone attivo e palladio su soluzioni catalizzate di carbonio granulare, il colore giallo della soluzione di 4-nitrofenolo svanisce gradualmente. Ad una scala temporale di circa 20 minuti, la soluzione diventa incolore, suggerendo una completa riduzione del 4-nitrofenolo da parte del catalizzatore.
Dopo l'aggiunta della soluzione di carbone attivo, senza catalizzatore, il colore giallo del 4-nitrofenolo rimane inalterato all'interno della finestra di reazione di 20 minuti. Il carbonio agisce solo come materiale di supporto per il palladio, quindi il carbonio da solo non dimostra alcun effetto catalitico sulla reazione. Il gruppo di controllo qui mostra che le particelle di palladio su scala nanometrica supportate sul carbonio sono un catalizzatore attivo mentre il carbonio stesso non è un catalizzatore. Questo esperimento di controllo mostra anche che il 4-nitrofenolo non viene semplicemente assorbito dal carbonio e rimosso dalla soluzione.
L'osservazione degli spettri di assorbimento UV-Vis indica una diminuzione graduale a circa 400 nm mentre aumenta a circa 300 nm. Questo cambiamento è indicativo della riduzione del 4-nitrofenolo durante il processo. La concentrazione relativa di 4-nitrofenolo è rappresentata dall'intensità relativa dell'assorbimento a 400 nm. Un grafico ln(At/A0) vs. tempo mostra la reazione che procede in modo quantificato. Un grafico rappresentativo è mostrato nella Figura 1.
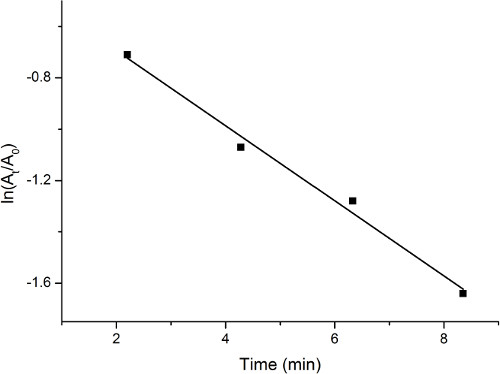
Figura 1. Grafico dell'assorbimento rispetto al tempo durante la riduzione del 4-nitrofenolo da parte del catalizzatore di palladio sul carbone attivo.
Per entrambi i catalizzatori di palladio utilizzati, non vi è alcuna differenza tra il loro comportamento di cambiamento di colore e i loro spettri. Questo risultato indica che il palladio è attivo nella riduzione catalitica del 4-nitrofenolo indipendentemente dal fatto che sia supportato da carbone attivo o carbone granulare.
Applicazione e Riepilogo
Come reazione di riferimento, l'applicazione catalitica di particelle di palladio su scala nanometrica può essere estesa ad altri campi. Simile alla riduzione del 4-nitrofenolo, che è un colorometrico (la reazione è osservata come un cambiamento di colore), l'idrogenazione dei coloranti chimici può essere realizzata con lo stesso protocollo. I processi di idrogenazione chimica sono molto importanti in molte reazioni industriali e nello smaltimento dei rifiuti. I ricercatori hanno trovato applicazioni di catalizzatori nelle reazioni di idrogenazione in campi come i prodotti petrolchimici. Negli Stati Uniti, la produzione di benzene ha raggiunto 415.144 milioni di galloni durante il quarto trimestre del 2010, dove il processo di idrogenazione ha svolto un ruolo importante.
In presenza di un catalizzatore di palladio e di un ambiente di base, si verificano reazioni di accoppiamento C-C tra alogenuri arilici/vinilici e alcheni. 3,4 Questa reazione è nota come reazione di Heck. Le reazioni di accoppiamento C-C sono di vitale importanza per risolvere le sfide energetiche che la società deve ora affrontare. L'implicazione è così importante che il premio Nobel per la chimica 2010 è stato assegnato per il lavoro sulla reazione di accoppiamento incrociato catalizzato dal palladio. I catalizzatori sono anche usati nella sintesi di nanoparticelle polimeriche. In questa applicazione, i rami polimerici vengono miscelati con un catalizzatore per indurre la formazione di particelle stellari. 5 Infine, i catalizzatori si trovano ampiamente in natura e guidano le reazioni biologiche. Qui, esistono naturalmente come enzimi specifici della forma. 6
Riferimenti
- Armor, J. What is catalysis? North American Catalysis Society. (2008).
- Thomas, J.M., Thomas, W.J. Principles and Practice of Heterogeneous Catalysis. Wiley-VCH. Germany (2015).
- Heck, R.F., Nolley, J.P. Palladium-catalyzed v Vinylic Hydrogen Substitution Reactions with Aryl, Benzyl and Styryl Halides. J. Org. Chem. 37 (14), (1972).
- Oberholzer, M., Frech, C. M. Mizoroki-Heck Cross-coupling Reactions Catalyzed by Dichloro{bis[1,1',1''-(phosphinetriyl)tripiperidine]}palladium Under Mild Reaction Conditions. J. Vis. Exp. (85), e51444, (2014).
- Liu, J., Gao, A. X., Johnson, J. A. Particles without a Box: Brush-first Synthesis of Photodegradable PEG Star Polymers under Ambient Conditions. J. Vis. Exp. (80), e50874, (2013).
- Fowler, M. L., Ingram-Smith, C. J., Smith, K. S. Direct Detection of the Acetate-forming Activity of the Enzyme Acetate Kinase. J. Vis. Exp. (58), e3474, (2011).
Vai a...
Video da questa raccolta:

Now Playing
Introduzione alla catalisi
Organic Chemistry
34.1K Visualizzazioni

Assemblaggio di un sistema a riflusso per reazioni chimiche riscaldate
Organic Chemistry
166.3K Visualizzazioni

Esecuzione di reazioni al di sotto della temperatura ambiente
Organic Chemistry
70.3K Visualizzazioni

Trasferimento di solventi tramite linea Schlenk
Organic Chemistry
41.5K Visualizzazioni

Degasaggio di liquidi con ciclo freeze-pump-thaw
Organic Chemistry
55.9K Visualizzazioni

Preparazione di reagenti anidri e relativa strumentazione
Organic Chemistry
79.1K Visualizzazioni

Purificazione di composti tramite ricristallizzazione
Organic Chemistry
705.3K Visualizzazioni

Separazione di miscele tramite precipitazione
Organic Chemistry
157.2K Visualizzazioni

Estrazione solido-liquido (lisciviazione)
Organic Chemistry
237.1K Visualizzazioni

Rimozione dei solventi con evaporatore rotante
Organic Chemistry
212.3K Visualizzazioni

Distillazione frazionata
Organic Chemistry
332.8K Visualizzazioni

Preparazione di cristalli per l'analisi mediante diffrazione dei raggi X
Organic Chemistry
32.3K Visualizzazioni

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Visualizzazioni

Cromatografia su colonna
Organic Chemistry
358.4K Visualizzazioni

Spettroscopia a risonanza magnetica nucleare (NMR)
Organic Chemistry
246.7K Visualizzazioni