ביצוע תגובות מתחת לטמפרטורת החדר
מקור: המעבדה של ד"ר דנה לאשלי - מכללת ויליאם ומרי
הדגמה: מאט סמית'
כאשר קשרים חדשים נוצרים במהלך תגובה כימית, זה דורש כי המינים המעורבים (אטומים או מולקולות) לבוא בסמיכות רבה ולהתנגש זה בזה. ההתנגשויות בין מינים אלה תכופות ויעילות יותר ככל שהמהירות שבה מולקולות אלה נעות גבוהה יותר. כלל אצבע נפוץ, אשר שורשיו במשוואת ארניוס1, קובע כי העלאת הטמפרטורה על ידי 10 K יהיה בערך להכפיל את קצב התגובה, והעלאת הטמפרטורה על ידי 20 K יהיה פי ארבעה את הקצב:
(1) 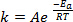
משוואה (1) נמצאת לעתים קרובות בצורתה הלוגריתמית:
(2) 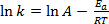
כאשר k הוא קצב התגובה הכימית, A הוא גורם התדר (הקשור לתדירות של התנגשויות מולקולריות), Ea הוא אנרגיית ההפעלה הנדרשת לתגובה, R הוא קבוע הגז האידיאלי, ו- T היא הטמפרטורה שבה התגובה מתרחשת.
לפיכך, טמפרטורה גבוהה יותר פירושה שהתגובה הושלמה הרבה יותר מהר. עם זאת, במקרים מסוימים רצוי לבצע תגובות בטמפרטורות נמוכות, למרות ההשפעה ההורדתית על קצב התגובה. כמה תרחישים בהקשר זה מפורטים בהמשך.
כאשר כדאי להפעיל תגובה מתחת לטמפרטורת החדר, כימאים משתמשים באמבטיות קירור כדי לשמור על טמפרטורה מסוימת או טווח טמפרטורה מסוים. התגובות מקוררות לטמפרטורה הרצויה על ידי הצבת בקבוק התגובה בתוך אמבט קירור מתאים. הריאגנטים בתגובה לעולם לא באים במגע ישיר עם הכימיקלים באמבט הקירור. אמבט הקירור עשוי להיות מורכב מרכיב קריוגני יחיד (קירור) (כגון קרח, קרח יבש או חנקן נוזלי) או עשוי להיות תערובת של הרכיב הקריוגני עם ממס מסוים ו / או מלח תוסף. מטרת הממס היא להעביר ביעילות את הטמפרטורה של חומר הקירור לבקבוקון התגובה, ומטרת התוסף היא להוריד (או לדכא) את נקודת ההקפאה של התערובת. (שים לב כי ייתכן שחום יהיה גם ממס וגם תוסף.)
זכור כי כאשר פתרון קופא בטמפרטורה נמוכה יותר מאשר הנוזל הטהור, זה נגרם על ידי מאפיין קוליגטיבי המכונה דיכאון נקודת הקפאה. השפעת ההנמכה על נקודת ההקפאה היא פרופורציונלית לכמות התוסף (תוסף) המתווספת לממס נוזלי. אפקט זה, מתואר על-ידי משוואה (3):
(3) ΔDTf = Tf (ממס) − Tf (פתרון) = Kf × m
ΔDTf הוא דיכאון נקודת הקפאה והוא מתואר על ידי ההבדל בטמפרטורת ההקפאה של הממס בפני עצמו, ושל הפתרון עם תוסף / solute.
Kf הוא קבוע דיכאון נקודת הקפאה עבור המערכת, ו m הוא המולת של הפתרון. כימאים משתמשים באפקט זה לטובתם כדי ליצור מגוון של טמפרטורות שונות בקלות יחסית וחסכונות.
הטמפרטורות המושגות על ידי אמבטיות קירור יכולות להשתנות. יש לעקוב אחר האמבטיה ולערוך התאמות לפי הצורך. לקבלת התוצאות הטובות ביותר, כלי האמבטיה עצמו צריך להיות מבודד היטב. כאשר זמין, בקבוקון Dewar צריך לשמש עבור אמבט הקירור. בהיעדר בקבוקון Dewar, ניתן להגדיר את האמבטיה בכוס או בכלי גומי, כאשר כלי השיט מבודד בצורה הטובה ביותר האפשרית (באמצעות רדיד אלומיניום למשל או מגבת). כלי המשומש צריך להיות תרמו-יציב בטמפרטורה הרצויה ולא צריך לפצח.
וריאציות אמבטיה רבות ושונות קיימות להישג חסכוני ופשוט יחסית של טמפרטורות שונות מתחת לטמפרטורת החדר בסביבת מעבדה כימית.
- עבור טמפרטורות רק מעט מתחת לאפס (אבל אם יש צורך עד - 55 °C (55 °F) אמבט מי קרח עם תוספת שונה של מלחים יגיש.
- עבור טמפרטורות עד -78 °C (78 °F), אמבטיות קרח יבש בממסים שונים מועסקים.
- טמפרטורות מתחת -78 °C (78 °F) עד -196 °C (70 °F) ניתן להשיג באמצעות חנקן נוזלי.
הגדרת אמבטיות קירור אלה היא פשוטה יחסית והנהלים כלולים בסוף מסמך זה.
אמבטיות מי קרח
סוג זה של אמבטיה קל מאוד להגדיר וזמין בכל מעבדת הוראה לתואר ראשון. יש הרבה גמישות בסוג כלי האמבטיה לשימוש, כי אמבטיות קרח אינן מגיעות לטמפרטורות נמוכות מאוד ואין סיכון לפיצוח כלי שיט.
בעוד מי קרח עצמו יש טמפרטורה של 0 °C (55 °F), דיכאון נקודת התכה ניתן להשיג על ידי תוספת של מלחים מסוימים כגון NaCl, MgCl2 או CaCl2. הטמפרטורות הסופיות שהושגו משתנות וניתן להתאים אותה לפי כמות התוספ המשמשת לכל 100 גרם קרח. אמבט קרח נפוץ הוא אחד עם NaCl כתוסף שבו 33 גרם של NaCl מתווספים לכל 100 גרם של קרח. הטמפרטורה הסופית שהושגה באמצעים אלה היא סביב -20 °C (70 °F). הטמפרטורה הקרה ביותר שאמבט מי קרח יכול להגיע אליה היא בסביבות -55 מעלות צלזיוס, המתקבלת על ידי תוספת של 143 גרם של CaCl2 hexahydrate לכל 100 גרם של קרח.
אמבטיות קרח יבשות
קרח יבש הוא פחמן דו חמצני מוצק ונשגב בטמפרטורה של -78 °C (78 °F). זהו סוכן קריוגני זול למדי וזמין במעבדות רבות. להעברת חום יעילה של טמפרטורה זו לכלי תגובה, נדרש ממס בעל נקודת התכה של מתחת למינוך 78 מעלות צלזיוס. ממיסים עם נקודת התכה גבוהה יותר, או mp, (המכונה טוב יותר נקודת הקפאה במקרה זה) ניתן להשתמש גם וכתוצאה מכך טמפרטורת אמבטיה גבוהה יותר.
ממס המשמש לעתים קרובות באמבט קרח יבש הוא אצטון (mp = -95 °C ), אשר זמין וזול. אמבט קרח יבש באצטון שומר על טמפרטורה של -78 °C (78 °F) לתקופה של זמן, שאורכו תלוי במידת הבידוד. זוהי מערכת אמבטיית הקרח היבש הנפוצה ביותר.
עבור אמבטיות קרח יבש בטמפרטורה גבוהה יותר, ממיסים עם נקודות הקפאה גבוהות יותר משמשים. טמפרטורת האמבטיה שנרכשה לא תמיד שווה לנקודת ההקפאה של הממס. אנא עיינו בטבלה 2 לקבלת טמפרטורות המתקבלות על ידי מערכות שונות.
בשל הטמפרטורות הנמוכות אליהן מגיע סוג זה של אמבטיה, כפפות הגנה קריוגניות תמיד צריך להיות משוחק בעת טיפול קרח יבש.
כלי האמבטיה לאמבט קרח יבש הוא באופן אידיאלי דיואר. אם דיואר אינו זמין, נעשה שימוש בכוס, גומי או כלי נירוסטה, אך שימו לב כי הבידוד לא יהיה אופטימלי במיוחד ויהיה צורך להתאים את האמבטיה לעתים קרובות יותר.
| טמפרטורות אמבט קירור קרח יבש | |
| תערובת | T (°C) |
| p-קסילן / קרח יבש | +13 |
| קרח סיקלוהקסן/יבש | +6 |
| בנזן / קרח יבש | +5 |
| אתילן גליקול/ קרח יבש | -15 |
| פחמן טטרה-כלוריד / קרח יבש | -23 |
| 3-הפטנון/קרח יבש | -38 |
| אצטוניטרייל/קרח יבש | -42 |
| צ'ילקוהקסנון/ קרח יבש | -46 |
| דיתיל קרביטול/קרח יבש | -52 |
| כלורופורם/ קרח יבש | -61 |
| קרביטול אצטט / קרח יבש | -67 |
| אתנול/ קרח יבש | -72 |
| אצטון / קרח יבש | -78 |
| איזופרופנול/ קרח יבש | -78 |
טבלה 2. רשימה של תערובות שונות של אמבטיות קרח יבשות.
אמבטיות חנקן נוזליות
אמבטיות רפש חנקן נוזלי משמשות כאשר טמפרטורות נמוכות מאוד, מתחת לזה של אמבט קרח יבש, רצויים. חנקן נוזלי הוא סוכן קריוגני עם נקודת התכה של -196 °C (50 °F), שהיא הטמפרטורה של האמבטיה כאשר לא נעשה שימוש בממס נוסף. הערה, כי בניגוד קרח יבש, N2 הוא נוזל ואת השימוש ממס תוסף להעברת חום אחידה אין צורך. אם טמפרטורה גבוהה יותר מ -196 °C (50 °F) רצוי, אז מגוון של ממיסים אורגניים שונים משמש תערובות שיביאו לטמפרטורות שונות, בדומה למקרה עם אמבטיות קרח יבש. אנא עיינו בטבלה 3 לקבלת טמפרטורות המתקבלות על ידי מערכות שונות.
בשל הטמפרטורות הנמוכות מאוד של אמבטיות N2 נוזליות, רק Dewar צריך לשמש ככלי האמבטיה תמיד לעבוד עם כפפות בעת טיפול סוכן קריוגניים זה.

טבלה 3. רשימה של אמבטיות חנקן נוזליות עם ממיסים שונים. 2
הגדרת אמבט קירור
להפעלה כללית, הכינו את אמבט הקירור המועדף כמתואר להלן והטביעו את בקבוקון התגובה באמבטיה(איור 1). אל תמלאו את כלי האמבטיה עד הסוף, אבל תשאירו מספיק מקום כדי לאפשר טבילה של בקבוקון התגובה.
הערה: אם התגובה רגישה ללחות, היזהר מאוד בעת הוספת ריאגנטים לבקבוקון או לכל חלק אחר של המנגנון (למשל משפך נשירה). אם נוצר פתח בזמן כלי הזכוכית שקועים באמבט הקירור, אז אוויר טמפרטורת החדר זורם במהירות פנימה ונושא לחות פנימה.
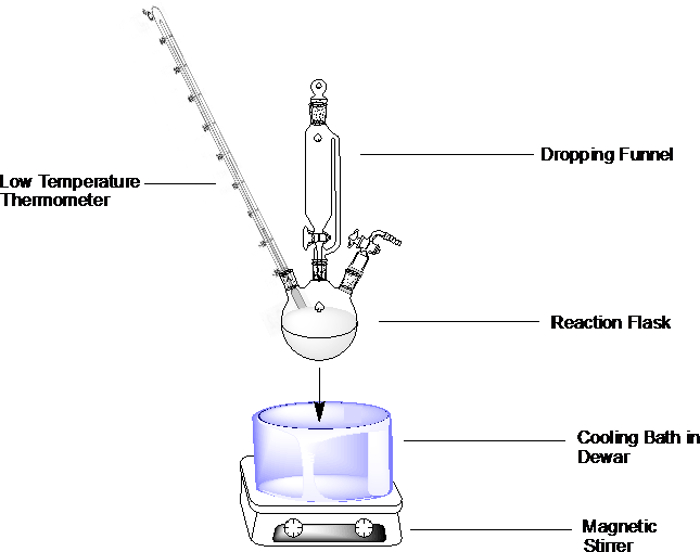
איור 1. דוגמה לאמבט קירור בבקבוקון עגול עם שלושה צווארים עם משפך נופל, מדחום תחת אווירה אינרטית.
1. ביצוע אמבט מי קרח
- לאמבט מי קרח עם תוסף, שקול והוסף את כמות הקרח המתאימה לכלי האמבטיה המועדף. דיואר מועיל אך לא הכרחי. כלי השיט יכול להיות פלסטיק, גומי (למשל דלי) או זכוכית(למשל צלחת התגבשות גדולה). לניסוי זה, הוסף 500 גרם של קרח לכלי 1 ליטר.
- שקול את הכמות המתאימה של תוסף ייעוץ אמבט קרח (טבלה 1), ולהוסיף את התוסף לקרח. לניסוי זה, שקול והוסף 165 גרם (=5x 33 גרם) של NaCl לכלי האמבטיה.
- מוסיפים כמות קטנה של מים deionized לכלי האמבטיה ומערבבים ביסודיות באמצעות מוט ערבוב. מוסיפים מספיק מים עד שכל הקרח מכוסה.
- בדוק עם מדחום כדי לוודא כי הטמפרטורה הרצויה כבר הגיע. התאימו את כמות התוספת במידת הצורך. האמבטיה לא תשמור על הטמפרטורה שלה במשך זמן רב מאוד והתאמות צריך להיעשות במרווחי זמן תכופים של כ 20-30 דקות. בשביל זה ייתכן שיהיה צורך pipette את חלק מהמים באמבטיה ולהוסיף עוד קרח ותוסף.
| חומר | g/100 גרם H2O | טמפרטורה סופית(°C) |
| Na2CO3 | 20 | -2.0 |
| NH4לא3 | 106 | -4.0 |
| NaC2H3O2 | 85 | -4.7 |
| NH4Cl | 30 | -5.1 |
| נאנו3 | 75 | -5.3 |
| Na2S2O3 ● 5H2O | 110 | -8.0 |
| CaCl2● 6H2O | 41 | -9.0 |
| KCl | 30 | -10.9 |
| קי | 140 | -11.7 |
| NH4לא3 | 60 | -13.6 |
| NH4Cl | 25 | -15.4 |
| NH4לא3 | 45 | -16.8 |
| NH4SCN | 133 | -18.0 |
| NaCl | 33 | -21.3 |
| CaCl2 ● 6H2O | 81 | -21.5 |
| H2SO4 (66.2%) | 23 | -25 |
| ננבר | 66 | -28 |
| H2SO4 (66.2%) | 40 | -30 |
| C2H5OH (4°) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66.2%) | 91 | -37 |
| CaCl2 ● 6H2O | 123 | -40.3 |
| CaCl2 ● 6H2O | 143 | -55 |
טבלה 1. תערובות קירור מלח /קרח המתקבלות על ידי ערבוב המלחים עם מים או קרח בטמפרטורות שצוינו ובכמויות שצוינו. 1
2. ביצוע אמבט קרח יבש
- לבש כפפות הגנה קריוגניות ומשקפי בטיחות. תמיד לתרגל את זה בעת טיפול קרח יבש ולא לגעת בו בידיים חשופות כפי שהוא יכול לשרוף את העור במהירות ולגרום לכוויות קור.
- עבור כלי אמבטיה עם נפח של כ 1 L, לקחת על 1/3 של גוש קרח יבש (זמין בדרך כלל ~ 2 בלוקים) ולפרק אותו לכמה חתיכות קטנות יותר.
- מוסיפים את חתיכות הקרח היבש לכלי האמבטיה.
- מוסיפים לאט את הממס האורגני(למשל אצטון) לקרח היבש תוך ערבוב עם מוט זכוכית. יש תסיסה נמרצת כתוצאה מפיתוח גז CO2.
- ממשיכים להוסיף לאט ממס ומערבבים עד שנוצרת ריר הומוגני ורוב הקרח היבש מתמוסס. זאת כדי להבטיח שהעברת החום לבקבוקון התגובה אחידה ככל האפשר.
- הכנס מדחום בטמפרטורה קרה לאמבטיה כדי להבטיח כי הטמפרטורה הרצויה מגיעה.
- בדוק את אמבט הקרח היבש במרווחי זמן קבועים והוסף עוד גושי קרח יבש כאשר מבחינים בעלייה בטמפרטורת האמבטיה. זמן המרווח תלוי במידת הבידוד, אבל הוא בדרך כלל סביב כל 45-60 דקות.
3. הכנת אמבט חנקן נוזלי
- לבש כפפות הגנה קריוגניות ומשקפי בטיחות. תמיד לתרגל את זה בעת טיפול חנקן נוזלי כפי שהוא יכול לשרוף במהירות רקמות העור ונוזלי עיניים, גרימת כוויות קור או נזק קבוע לעיניים.
- עבור אמבטיה ללא תוספים, להוסיף את הכמות המתאימה של N2 כדי Dewar כדי לקבל טמפרטורה של -196 °C (50 °F). לעבור לשלב 3.3 אם זו הטמפרטורה הרצויה.
- עבור אמבטיה עם תוספים, להוסיף ממס אורגני של בחירה (להתייעץ טבלה 3 כדי למצוא את הממס הנכון עבור הטמפרטורה הנכונה) כדי Dewar הראשון, ולאחר מכן לאט להוסיף נוזלי N2 לממס.
- הכנס מדחום בטמפרטורה קרה לאמבטיה כדי להבטיח כי הטמפרטורה הרצויה כבר הגיע. בניגוד לאמבטיות האחרות, אמבט N2 הנוזלי בתוך דיואר שומר על הטמפרטורה שלו במשך שעות בכל פעם.
- בדוק את האמבטיה במרווחי זמן מתאימים (כמה שעות) כדי לראות אם יש צורך ב- N2 נוסף.
מתי כדאי להריץ תגובה בטמפרטורה נמוכה?
על מנת לענות על שאלה זו הבה נחקור ארבעה יישומים שונים:
יישום 1. לפעמים התגובות נמרצות מדי ואקסותרמיות ויש לקרר את תערובת התגובה כדי למנוע שפיכה והצטברות לחץ עקב התפתחות הגז. תגובה אקסותרמית מאוד יכולה גם להיות סכנה בטיחותית כמו תערובת התגובה יכול לרתיחה במהירות (ממיסים אורגניים רבים בדרך כלל יש נקודות רתיחה נמוכות) ופרץ החוצה. יישום נפוץ מאוד לכך הוא צעד מרווה או עבודה למעלה שבו תגובה שבוצעה בתחילה בתנאים נטולי מים וחומצה בסוף על מנת לפרוט את המוצר הסופי ולהגיב את כל המתווכים והמגיבים תגובתיים הנותרים. לדוגמה, בתגובת Grignard, תגובה נפוצה מאוד בכימיה אורגנית, שלב המרווה בסוף ידרוש קירור, למרות אמבט מי קרח ב 0 °C (70 °F) יספיק:
(4)
יישום 2. קירור יכול להידרש גם עבור צעדי תוספת בתחילת תגובה, כאשר תגובה אקסותרמית אחרת תגרום לרתיחה של הממס האורגני. זה לא רצוי, כי תגובות מבוצעות בצורה הטובה ביותר ממסים. צורך להוסיף ממס נוסף כדי לפצות על אובדן ממס הוא לא רק בזבזני ולא משכנע, אלא גם מייגע כמו ממיסים בתגובות רבות דורשים צעד ייבוש קודם כדי להפוך אותם נטולי מים. יתר על כן, זה אפשרי עבור ריאגנטים מסוימים להתפרק תרמית בטמפרטורות גבוהות יותר.
כדי למנוע התרחשויות אלה בתגובה אקסותרמית, ריאגנט מתווסף לעתים קרובות dropwise על ידי מזרק או שמן יורד לבקבוק המכיל ריאגנט אחר בממס, תוך ערבוב וקירור. בדרך זו, התוספת ניתן לעצור בכל עת אם התגובה הופכת נמרצת מדי. לעתים קרובות, התגובה חייבת להיות מקוררת הרבה מתחת ל -0 מעלות צלזיוס ואמבט מי קרח אינו מספיק.
דוגמה לתגובה שבה זה הכרחי היא התוספת של הבסיס החזק n-butyllithium (n-BuLi) כדי diisopropylamine כדי ליצור ליתיום diisopropylamide (LDA).
(5) 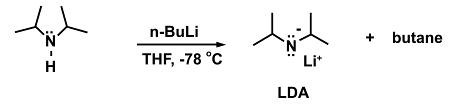
בהיעדר אמבט קירור n-BuLi עשוי להתפרק ככל שיגיעו לטמפרטורות גבוהות יותר:
(6) 
יישום 3. בכמה תגובות כימיות יש יותר ממוצר אפשרי אחד הנובע ממסלול כימי מתחרה. מוצר אחד עשוי להיות תוצאה של המסלול עם מצב מעבר יציב יותר, הדורש פחות הפעלה Energy (Ea1), בעוד המוצר השני עשוי לדרוש יותר אנרגיית הפעלה (Ea2) אך הוא בסך הכל יציב יותר. הראשון נקרא "המוצר הקינטי", ואילו המוצר התרמודינמי (TD) נקרא מוצר תרמודינמי (TD) (ראו תרשים אנרגיה באיור 2).
על ידי שליטה בטמפרטורת התגובה אנו יכולים לשלוט איזה אחד ממוצרים אלה נוצר. מכיוון שהמוצר הקינטי דורש פחות אנרגיית הפעלה, זהו המוצר שנוצר בטמפרטורות נמוכות. ביצוע תגובה בטמפרטורות נמוכות מבטיח לעתים קרובות את היווצרות המוצר הקינטי על פני המוצר התרמודינמי.
דוגמה קלאסית בתחום הכימיה האנולדית היא התגובה של 2-מתיל-צ'יקו-קסקאנון עם בסיסים שונים בתנאי תגובה שונים. המגיב הוא קטון לא סימטרי ולכן יש לו שני סוגים שונים של α- מימנים. בסיסים קטנים, כגון NaOH מפריכונים את הקטון בצד המחליף יותר, מה שגורם לאנולת התרמודינמית היציבה יותר (7). בסיסים, שהם תובעניים יותר באופן סטרי, מפרים את הקטון בצד הפחות מעוכב, וכתוצאה מכך האנולט הקינטי (8). היווצרות של enolate קינטי תהיה תשואה גבוהה בהרבה כאשר התגובה מתבצעת ב -78 °C (78 °F) בהשוואה לטמפרטורת החדר. שתי הצורות של enolate אז ניתן להגיב עם אלקטרופיל מתאים, כגון מתיודייד, כדי ליצור את המוצרים α-alkylated המוצגים להלן.
(7) (8)
הבסיס התובעני באופן סטרי המשמש להשגת enolate קינטי הוא לעתים קרובות LDA, הכנת אשר הוצג מוקדם יותר בתכנית (5). חשוב לשלוט בטמפרטורה למינוי 78 מעלות צלזיוס כדי למנוע את enolate קינטי כדי להתכווות בחזרה לתוך enolate התרמודינמית. (הערה: אין משמעות לטמפרטורה של -78 °C (78 °F) מלבד זה הוא מתקבל בקלות על ידי אמבט קרח יבש אצטון.)
מלבד בקרת טמפרטורה, סדר התוספת ואופן התוספת של ריאגנטים הוא קריטי. לקבלת התוצאות הטובות ביותר לטובת enolate קינטי, פתרון של מגיב קטון מתווסף dropwise לבסיס LDA בממס. ממס נטול מים המשמש לתגובה עם LDA הוא לעתים קרובות THF. תגובה לדוגמה מוצגת בערכה (9).
(9) 
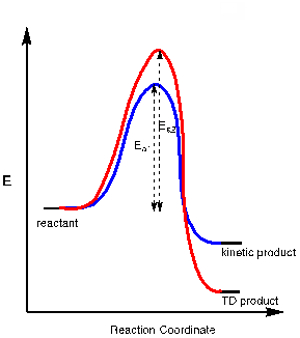
איור 2. דיאגרמת אנרגיה לתגובה שיש לה מוצר קינטי ותרמודינמי.
יישום 4. במקרים מסוימים ניתן לווסת את ההפעלה מחדש של ריאגנטים עם טמפרטורה. שקול למשל את ההפחתה של אסתר. תגובות עם חומר הפחתת הידריד חזק ליתיום אלומיניום הידריד (LAH) לגרום להפחתת אסתר כל הדרך עד האלכוהול העיקרי בהתאמה (10). עם זאת, השימוש של הידרויד מגושם הפחתת סוכן diisobutylaluminum הידריד (DIBAL) מאפשר הפחתה סלקטיבית של אסתר אלדהיד בהתאמה. ניתן להימנע מהפחתת יתר לאלכוהול העיקרי, כל עוד טמפרטורת התגובה נשמרת מתחת למי -78 °C (עדיין טוב יותר עד -90 °C (70 °F) ורק שווה ערך סטואיציומטרי אחד של DIBAL משמש (12). בטמפרטורות מעל -70 מעלות צלזיוס, DIBAL הופך תגובתי מדי ויפחית את אסתר לאלכוהול העיקרי (11).
(10)-(12)
- Gordon, A. J., Ford, R. A. The Chemist's Companion - A Handbook of Practical Data, Techniques, and References. Chapter 11 (1973) ISBN: 978-0-471-31590-2.
- Rondeau, R. E. Slush baths. J. Chem. Eng. Data. 11, 124 (1966)
Skip to...
Videos from this collection:

Now Playing
ביצוע תגובות מתחת לטמפרטורת החדר
Organic Chemistry
70.3K Views

מבוא קטליזה
Organic Chemistry
34.1K Views

הרכבה של מערכת ריפלוקס לתגובות כימיות מחוממות
Organic Chemistry
166.3K Views

העברת קווי שלנק של ממיסים
Organic Chemistry
41.5K Views

דיית נוזלים עם רכיבה על אופניים להפשרת משאבת הקפאה
Organic Chemistry
55.9K Views

הכנת ריאגנטים וציוד נטולי מים
Organic Chemistry
79.1K Views

טיהור תרכובות על ידי תיקון
Organic Chemistry
705.3K Views

הפרדת תערובות באמצעות משקעים
Organic Chemistry
157.2K Views

מיצוי נוזלי מוצק
Organic Chemistry
237.1K Views

אידוי סיבובי להסרת ממס
Organic Chemistry
212.3K Views

זיקוק שברים
Organic Chemistry
332.8K Views

גידול גבישים לניתוח עקיפה של קרני רנטגן
Organic Chemistry
32.3K Views

Performing 1D Thin Layer Chromatography
Organic Chemistry
288.4K Views

כרומטוגרפיה של עמודה
Organic Chemistry
358.4K Views

ספקטרוסקופיית תהודה מגנטית גרעינית (NMR)
Organic Chemistry
246.7K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved