Method Article
פרופיילינג גנטי וסינון נשירה בקנה מידה גנומי לזיהוי מטרות טיפוליות במודלים עכבריים של גידול ממאיר במעטפת עצב היקפית
In This Article
Summary
פיתחנו גישה אונקוגנומית השוואתית חוצת מינים המשתמשת בניתוחים גנומיים ובמסכים גנומיים פונקציונליים כדי לזהות ולהשוות מטרות טיפוליות בגידולים הנובעים ממודלים של עכברים מהונדסים גנטית וסוג הגידול האנושי המתאים.
Abstract
גידולי מעטפת עצב היקפית ממאירים (MPNST) נגזרים מתאי Schwann או מבשריהם. בחולים עם תסמונת רגישות הגידול נוירופיברומטוזיס סוג 1 (NF1), MPNST הם הממאירות הנפוצה ביותר וסיבת המוות המובילה. סרקומות נדירות ואגרסיביות אלה של רקמות רכות מציעות עתיד עגום, עם שיעורי הישרדות ללא מחלות במשך 5 שנים של 34-60%. אפשרויות הטיפול עבור אנשים עם MPNST מוגבלות באופן מאכזב, כאשר ניתוח מעוות הוא אפשרות הטיפול המובילה. טיפולים רבים שהיו בעבר מבטיחים כגון tipifarnib, מעכב איתות Ras, נכשלו קלינית. כמו כן, ניסויים קליניים שלב II עם erlotinib, אשר מכוון גורם גדילה אפידרמיס (EFGR), ו sorafenib, אשר מכוון קולטן גורם גדילה אנדותל כלי הדם (VEGF), קולטן גורם גדילה נגזר טסיות (PDGF), ו Raf, בשילוב עם כימותרפיה סטנדרטית, גם לא הצליחו לייצר תגובה בחולים.
בשנים האחרונות, שיטות סינון גנומיות תפקודיות בשילוב עם פרופיל גנטי של קווי תאים סרטניים הוכחו כיעילות לזיהוי מסלולי איתות ציטופלזמיים חיוניים ולפיתוח טיפולים ספציפיים למטרה. במקרה של סוגי גידולים נדירים, וריאציה של גישה זו המכונה אונקוגנומיקה השוואתית בין מינים משמשת יותר ויותר לזיהוי מטרות טיפוליות חדשות. באונקוגנומיקה השוואתית בין מינים, פרופיל גנטי וגנומיקה פונקציונלית מבוצעים במודלים של עכברים מהונדסים גנטית (GEM) והתוצאות מאומתות לאחר מכן בדגימות האנושיות הנדירות ובקווי התאים הזמינים.
מאמר זה מתאר כיצד לזהות מוטציות גנטיות של מניעים מועמדים בתאי MPNST אנושיים ועכבריים באמצעות ריצוף אקסומי שלם (WES). לאחר מכן אנו מתארים כיצד לבצע מסכי shRNA בקנה מידה גנומי כדי לזהות ולהשוות מסלולי איתות קריטיים בתאי MPNST של עכברים ובני אדם ולזהות מטרות ניתנות לסמים במסלולים אלה. מתודולוגיות אלה מספקות גישה יעילה לזיהוי מטרות טיפוליות חדשות במגוון סוגי סרטן אנושיים.
Introduction
גידולי מעטפת עצב היקפיים ממאירים (MPNST) הם גידולים אגרסיביים ביותר של תאי ציר המתעוררים בקשר עם תסמונת רגישות הגידול נוירופיברומטוזיס מסוג 1 (NF1), באופן ספורדי באוכלוסייה הכללית ובאתרים של הקרנות קודמות 1,2,3. חולי NF1 נולדים עם עותק פראי של הגן מדכא הגידול NF1 ואלל NF1 שני עם מוטציה של אובדן תפקוד. מצב זה של אי ספיקת הפלואים הופך את חולי NF1 לפגיעים למוטציה שנייה של אובדן תפקוד בגן NF1 הפראי שלהם, המעוררת גידולים. כאשר מוטציית NF1 "מכה שנייה" זו מתרחשת בתא בשושלת תאי Schwann, הגידול שנוצר הוא נוירופיברומה עורית המתעוררת בעור או נוירופיברומה פרספקס המתפתחת בעצבים גדולים או מקלעי עצבים. למרות שהפתולוגיה של נוירופיברומות עוריות ופרסיפורמות זהה, ההתנהגות הביולוגית שלהם שונה למדי - למרות שגם נוירופיברומות עוריות וגם פרספורמיות הן שפירות, רק נוירופיברומות פרספקס יכולות לעבור טרנספורמציה ולעורר MPNSTs. בנוסף לאובדן נוירופיברומין, החלבון מפעיל Ras GTPase המקודד על ידי הגן NF1, MPNST נושאים מוטציות של גנים מדכאי גידול רבים אחרים, כולל TP53 4,5,6,7, CDKN2A 8,9 ו- PTEN 10, מוטציות של גנים המקודדים רכיבים של קומפלקס דיכוי פוליקומב 2 11,12 (PRC2; גנים SUZ12 ו-EED) וביטוי חריג של קולטן טירוזין קינאזות 1,2. מוטציות של NF1 והגנים האחרים שצוינו לעיל קיימות גם ב- MPNST ספורדיים והמושרים על ידי קרינה11,12.
בעוד שהתקדמות זו בהבנתנו את החריגות הגנומיות ב- MPNST הייתה רבת ערך להבנת הפתוגנזה שלהם, הם עדיין לא הביאו לפיתוח טיפולים חדשים ויעילים עבור MPNST. חסם מרכזי המעכב פיתוח טיפולים חדשים הוא העובדה כי MPNST הם סוגי סרטן נדירים. מסיבה זו, קשה להשיג את המספר הגדול של דגימות חולים הדרושות לניתוחים גלובליים המגדירים מוטציות מניעות מרכזיות כגון אלה שבוצעו על ידי אטלס גנום הסרטן (TCGA). מניסיוננו, צבירת אפילו מספר צנוע של דגימות MPNST אנושיות יכולה לקחת שנים. כדי להתגבר על מגבלות אלה, חוקרים רבים החוקרים סוגי סרטן נדירים אחרים פנו לשימוש באונקוגנומיקה השוואתית בין מינים כדי לזהות מוטציות גנטיות מניעות חיוניות, להגדיר את מסלולי האיתות הציטופלזמיים החיוניים בגידול המעניין אותם, ולזהות מטרות טיפוליות חדשות. מכיוון שמסלולי האיתות החיוניים לגידולים נשמרים מאוד בין בני אדם למיני חולייתנים אחרים, יישום גישות גנומיות פונקציונליות כגון מסכי shRNA בקנה מידה גנומי יכול להיות אמצעי יעיל לזיהוי מוטציות מניעות חדשות אלה, מסלולי איתות ומטרות טיפוליות 13,14,15,16,17,18,19 במיוחד כאשר חוקרים סוגי גידולים נדירים בבני אדם הזמינים במספרים מוגבליםשל 20.,
במתודולוגיות המוצגות כאן, אנו מתארים גישה זו לביצוע פרופיל גנומי בקווי תאי MPNST אנושיים ותרביות MPNST מוקדמות שמקורן בעכברי P 0-GGFβ3, מודל עכבר מהונדס גנטית (GEM) שבו ביטוי יתר ספציפי לתאי Schwann של גורם הגדילה neuregulin-1 (NRG1) מקדם את הפתוגנזה של נוירופיברומות פרסידיפורמיות ואת התקדמותן לאחר מכן ל- MPNSTs 21, 22,23. הצעד הראשון בגישה זו הוא לזהות גנים מניעים מועמדים ב- P 0-GGFβ3 MPNSTs, קווי תאי MPNST אנושיים ו- MPNST אנושיים שעברו ניתוח. כדי לאמת באופן פונקציונלי את מסלולי האיתות המושפעים מהמוטציות האלה, אנו משתמשים במסכי shRNA בקנה מידה גנומי כדי לזהות את הגנים הדרושים להתרבות ולהישרדות בשורות תאי MPNST אנושיים ועכבריים. לאחר זיהוי הגנים הדרושים להתרבות ולהישרדות, אנו מזהים את תוצרי הגנים הניתנים לתרופות בתוך אוסף ה"להיטים" באמצעות מסד הנתונים של אינטראקציה בין גנים של תרופות. אנו גם משווים את ה"פגיעות" בתאי MPNST אנושיים ובעכברים, כדי לקבוע אם מודל GEM ו- MPNST אנושיים מפגינים תלות דומה באותם גנים ומסלולי איתות. זיהוי חפיפות בגנים הדרושים להתרבות ולהישרדות ומסלולי האיתות המושפעים משמש כאמצעי לאימות מודל העכבר P 0-GGFβ3 ברמה המולקולרית. גישה זו מדגישה גם את היעילות של שילוב מסכים אנושיים ועכבריים לזיהוי מטרות טיפוליות חדשות, כאשר מודל העכבר יכול לשמש כהשלמה למסכים האנושיים. הערך של גישה חוצת מינים זו בולט במיוחד כאשר מחפשים מטרות טיפוליות בגידולים נדירים, שבהם קשה להשיג גידולים אנושיים וקווי תאים.
Protocol
לפני תחילת המחקרים, יש לבדוק ולאשר נהלים ופרוטוקולים של בעלי חיים לטיפול בווקטורים נגיפיים על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) והוועדה המוסדית לבטיחות ביולוגית (IBC). הנהלים המתוארים כאן אושרו על ידי מועצות IACUC ו- IBC של האוניברסיטה הרפואית של דרום קרוליינה ובוצעו על ידי אנשי צוות מאומנים כראוי בהתאם למדריך NIH לטיפול ושימוש בחיות מעבדה והנחיות הטיפול בבעלי חיים מוסדיים של MUSC.
1. ניתוח WES-Seq וזיהוי וריאנטים פתוגניים
- בודד DNA גנומי מדגימת גידול או מתאי MPNST תת-משתלבים (70%) הגדלים על צלחת 60 מ"מ, תוך שימוש בשיטות סטנדרטיות המבוססות על ג'ל סיליקה ספיחה הזמינות מסחרית (עיין בפרוטוקול היצרנים לקבלת שלבים מפורטים). זרימת העבודה הכללית מתוארת בתרשים באיור 1.
- שלח לפחות 10 μL של DNA גנומי ב- 50 ng/μL לליבת הריצוף, אלא אם כן צוינו כמויות או ריכוזים שונים של DNA גנומי.
- מתקן הליבה מפרק את הדנ"א הגנומי על ידי סוניקציה ולאחר מכן מטהר אותו בשיטה המועדפת. לכידת Exome ובניית הספרייה מבוצעות באמצעות ערכת ריצוף Exome המועדפת ותגי אינדקס מתווספים ל- Exome שנלכד בהגברה.
- שלח דגימות לליבת הרצף כדי לבצע ריצוף אקסומי שלם (WES; רצף של 100 bp מכל קצה).
- קבצי FASTQ שנוצרו על ידי הליבה מסופקים לחוקר. השתמש רק בקובצי FASTQ שעוברים מדדי איכות לניתוח.
- יישר ונתח את קבצי FASTQ באמצעות תוכנות זמינות מסחרית (לדוגמה, DNAStar19,20, Partek21 או Varsome). ישר את קובצי FASTQ לגנום הייחוס לעכבר GRCm38/mm10 באמצעות הגדרות ברירת המחדל.
הערה: באמצעות DNAStar ודגימת MPNST של עכבר כדוגמה, זרימת העבודה הכללית מתוארת בדיאגרמה ב- תרשים 1 והסבר בקצרה להלן.- פתח את תוכנת DNAStar ובחר את זרימת העבודה של SeqMan NGen.
- בחר זרימת עבודה על-ידי בחירה באפשרות ניתוח וריאנטים/ריצוף מחדש וסוג ניתוח הריצוף Amplicon מבוסס NGS, פאנל גנים או אקסומה. לחץ על הבא.
- בחר את רצף הייחוס המועדף על-ידי בחירה באפשרות הורד את גנום הגנום ואת גנום הייחוס המתאים (למשל Mus_musculus-GRCm38-dbSNP146.zip או הומו ספייאן-GRCh37.p13.zip). אם מתקן הליבה סיפק קובץ מיטה, העלה קובץ עזר זה. לחץ על הבא.
- בחרו 'רצפי קלט' על ידי בחירת טכנולוגיית הרצף המתאימה, Illumina, וקבעו שקריאות הרצף יהיו זוגיות. לאחר מכן, בחר את הגדרת הניסוי, דגימה מרובת דגימות והעלה את קבצי הרצף FASTQ על ידי בחירה באפשרות הוסף. אם אתה מפעיל מספר דגימות, הקצה כל קבוצה של קצה מזווג עם ניסוי ייחודי או שם מדגם גידול, קו תא או A18, A202... לחץ על הבא.
- הגדר את ערכת הנתונים של הפקד, אם קיימת כזו. לחץ על הבא ולחץ על הבא שוב תחת אפשרויות הרכבה. תחת אפשרויות ניתוח, לחץ על מצב זיהוי המשתנים המתאים כדיפלואיד ולאחר מכן לחץ על הבא. תחת פלט הרכבה, תן שם וייעד את מיקום שמירת הקבצים של הפרויקט; לחץ על הבא. הפעל את ההרכבה במחשב המקומי או בענן.
הערה: ניתן לפתוח את קובצי היישור המתקבלים בתהליך העבודה של ArrayStar עבור ביאור משתנה של פולימורפיזמים של נוקלאוטידים בודדים (SNPs) שזוהו. זרימת עבודה זו מזהה SNPs, לא רווחים או הפסדים של מספר עותק גנטי. ניתוח נפרד שנקרא מערך SNP בצפיפות גבוהה מזהה שינויים במספר ההעתקה; ריצוף אקסומי שלם אינו מזהה באופן מהימן שינויים במספר העותקים. עיין במדריך למשתמש של התוכנית לקבלת השלבים הספציפיים שיש לבצע עם תוכנית היישור. - החל מסננים המוגדרים על-ידי המשתמש על ביאור הווריאנטים של SNPs שזוהו כדי לכלול או לא לכלול נתונים מסוימים. כדי לקבל רשימה מרוכזת של וריאנטים רלוונטיים מבחינה תפקודית, החל את המסננים הבאים על ערכות הנתונים של הווריאנטים בהיררכיה זו: לא בשליטה (אם דגימת בקרה רגילה זמינה), תדירות אוכלוסייה (gnomAD, ExAC, 1,000 תדרי גנום), תדירות אלל (כולל ≤0.001 או 0.1%), עומק כיסוי (לא כולל <10 עומק), פתוגניות או מחלקת ClinVar (כולל: פתוגני, פתוגני סביר; לא כולל: לא בטוח, סביר להניח שפיר, שפיר), ואם תרצה סוג SNP והשפעת קידוד (כולל: לא נרדף, missense, שטויות, frameshift, בתוך מסגרת, שחבור).
הערה: רשימת גנים רלוונטיים ידועים לסרטן יכולה גם להיות מיושמת ברשימה הסופית כדי למשוך רק גנים ספציפיים הרלוונטיים למחלה, ראה שלב 1.3.7. מסננים אלה יכולים להפחית את רשימת הגנים של הווריאנטים לפחות מ-20 גנים.- השתמש בתדירות האלל המשתנה כדי לסנן SNPs של שגיאת ריצוף. וריאנטים הומוזיגוטיים והטרוזיגוטיים יוצגו בקירוב ב-100% וב-50%, בהתאמה עבור אוכלוסיית תאים טהורה שאינה מזהמת (קו תאים מבוסס שמקורו בגידול צריך לייצג אוכלוסייה יחידה של תאי גידול איזוגניים). במקרה זה, להחיל 100-90% ו 50-40% תדרי אלל עבור וריאנטים כמו מסנן, ובכך להסיר את כל הווריאנטים מתחת לזה. אם נתוני מערך SNP בצפיפות גבוהה זמינים גם עבור אותו מערך נתונים, החל רווח או אובדן של מספר העתקה על SNPs עם תדרי אלל משתנים הנמוכים מיחסים הומוזיגוטיים או הטרוזיגוטיים (כלומר, רווח מספר העתק וכתוצאה מכך 2 עותקים של אלל A ועותק 1 של אלל B יגרום לתדרי אלל משתנה מתאימים של 75%, 25%, בהתאמה).
- לאחר זיהוי וריאנטים פתוגניים עם ArrayStar, יצא ושמור את רשימת הגנים של הווריאנטים כקובץ csv, txt או xls והשווה את הגנים המכילים מוטציות אלה לאלה בקבוצה של גידולים שנוצרו על ידי P 0-GGFβ3 כדי לקבוע רשימות גנים חופפות וייחודיות של מוטציות. השווה את הגנים שעברו מוטציה לגנים מוטנטים ידועים הקשורים לעמיתיהם האנושיים (כלומר, רשימת גנים לסרטן במעבדת בושמן או רשימה שנאספה על ידי המשתמש).
- אופציונלי, לפני החלת מסננים המוגדרים על-ידי המשתמש (1.3.6), יצא ושמור את הקובץ עם ההערות כקובץ VCF.
הערה: ניתן להעלות קובץ VCF זה לתוכנת חיזוי אפקט משתנה אחרת Varsome או VEP לצורך השוואה כניתוח משני. ניתוח ביולוגי ומסלולים יכול להתבצע גם ברשימות הגנים של הווריאנטים המסוננים.
- אופציונלי, לפני החלת מסננים המוגדרים על-ידי המשתמש (1.3.6), יצא ושמור את הקובץ עם ההערות כקובץ VCF.
- בצע סיווג פונקציונלי של רשימת גנים משתנים באמצעות מסד נתונים מועדף על ידי המשתמש כדי לקבל סוג חלבון, מסלול, רכיב מסלול, ומידע על משפחת גנים ואונטולוגיה.
הערה: PANTHER (pantherdp.org) משמש כדוגמה כאן.- העלה רשימת גנים מסוננים עם מזהה גן.
- בחר את האורגניזם (Mus musculus).
- בחר אנליזה (סיווג פונקציונלי נצפה ברשימת גנים) ולחץ על שלח ניתוח ביולוגי ומסלול ברשימות גנים של וריאנטים מסוננים.
2. מסכי shRNA בקנה מידה גנומי
הערה: קיימות מספר ספריות shRNA ו-CRISPR שניתן להשתמש בהן עבור מסכים פונקציונליים בקנה מידה גנומי עם תרביות גידול במעבר נמוך. כאן, אנו מתארים את השימוש בספריות shRNA מפענחות CELLECTA כדוגמה. ספריות CELLECTA DECIPHER lentiviral shRNA מותאמות למסכים גנטיים של RNAi בפורמט מאוגד. כל תעתיק ממוקד על ידי לפחות 5-6 shRNA ייחודיים וכל וקטור shRNA לנטיויראלי מכיל ברקוד גנטי ייחודי שמשני צדדיו אתרי פריימר PCR. ספריות אלה מכסות את רוב הגנים הרלוונטיים למחלות בני אדם ועכברים, אך אינן מכסות את כל הגנים בגנום. מאגרי הפלסמיד של ספריית סלקטה זמינים בשלושה מודולים (מודול אנושי I, II, III; מכוון ל-15,377 גנים) ואילו מאגרי הפלסמיד של ספריית העכבר זמינים בשני מודולים (מודולי עכבר I ו-II; מכוונים ל-9,145 גנים). ספריות אלה משמשות לביצוע מבחני "נשירה" שבהם גנים ממוקדים הדרושים להתרבות ו/או הישרדות באים לידי ביטוי באופן דיפרנציאלי בנקודות זמן שונות לאחר התמרה ויראלית.
- אריזה Lentiviral
- יום 0: צלחת 10 מנות של 10 מיליון תאים 293T / צלחת 15 ס"מ ב 30 מ"ל / צלחת DMEM ללא אנטיביוטיקה המכיל 10% סרום בקר עוברי (FBS).
- יום 1: אשרו שהתאים הם ~80% מתמזגים למחרת ומוכנים לטרנספיקציה. בצינור חרוטי של 50 מ"ל, מערבבים את הדברים הבאים בסדר זה: 600 μL של תערובת פלסמיד אריזה (0.5 מיקרוגרם / μL), 60 μL של ספריית ברקוד פלסמיד, 12 מ"ל של DMEM (ללא סרום או אנטיביוטיקה), ו 600 μL של מגיב טרנספקציה. יש לדגור בטמפרטורת החדר למשך 15 דקות.
- מניחים 900 μL של מגיב transfection ו 12 מ"ל DMEM בצינור חרוטי נפרד 15 מ"ל ומערבבים על ידי מערבולת. הוסף 12.9 מ"ל של תערובת מגיב טרנספקציה/DMEM לתערובת ה- DNA והחלק כדי לערבב. דוגרים בטמפרטורת החדר במשך 15 דקות ללא ערבוב נוסף. הוסיפו 2.5 מ"ל של תערובת זו, טיפתית, לכל צלחת של 15 ס"מ של 293T תאים ודגרו לילה באינקובטור תרבית רקמות.
- יום 2: החליפו את המדיה למחרת במצע גדילה רגיל המכיל אנטיביוטיקה.
- יום 3: קציר הנגיף על ידי איסוף המדיה והעברתה דרך יחידת סינון של 0.2 מיקרומטר וכניסה לצינורות חרוטיים של 15 מ"ל; גם להכין חמישה 1 מ"ל aliquots של וירוס מסונן cryovials לשימוש titering ויראלי (נחשב 48 שעות וירוס); יש לאחסן את הנגיף במקפיא בטמפרטורה של -80°C. החלף את המדיה עם 30 מ"ל של מצע גידול על הצלחות אחד בכל פעם כדי למנוע התייבשות של תאים.
- יום 4: קציר הנגיף על ידי איסוף המדיה והעברתה דרך יחידת סינון של 0.2 מיקרומטר. וירוס Aliquot לתוך 15 מ"ל צינורות חרוטיים. זה נחשב וירוס 72 שעות; יש לאחסן את הנגיף במקפיא בטמפרטורה של -80°C.
- בריכות Titer Lentiviral
- הוסף 65 μL של פולימר קטיוני (10 מ"ג / מ"ל) ל 65 מ"ל של מצע גידול תאים סרטניים. פיפטה 1 מ"ל / באר של התווך המכיל פולימר לאחד עשר לוחות תרבית רקמה 6 באר. טריפסינזציה של תאי גידול במעבר מוקדם וספירת תאים בשיטה המועדפת כך שכל באר תקבל 50,000 תאים / מ"ל / באר. להפשיר 1 מ"ל aliquots של 48 h lentivirus מהמקפיא באמבט מים 37 °C.
- עבור כל מודול ויראלי, הכינו את הזיהום כפי שמוצג בטבלה 1.
- מניחים את כל צלחות 6 הבארות באינקובטור לתרבית רקמות. למחרת, להסיר מדיה ויראלית ולחדש עם מדיה צמיחה חדשה. בשעה 48 יש להוסיף מדיה המכילה פורומיצין לכל הבארות המקבלות סלקציה. לפני שתאי הבקרה נפגשים, בצע ספירת תאים של שיבוטים ששרדו בשיטה המועדפת.
הערה: ריכוז הפורומיצין הדרוש להרוג תאים שאינם מותמרים חייב להיקבע מראש אמפירית על ידי בדיקת טווח ריכוזים בעקומת "הריגה". השתמש בריכוז הנמוך ביותר שגורם באופן אחיד למוות של תרבויות לא מותמרות.
- זיהום לנטיויראלי של תאי מטרה
- טריפסיניזציה של תאי MPNST וספירה. צלחת 2.5 מיליון תאים לצלחת 15 ס"מ ובסך הכל עשרים מנות 15 ס"מ למודול. הפשירו את הנגיף והעבירו את התאים עם הנגיף ב-MOI של 0.5 בנוכחות 5 מיקרוגרם/מ"ל של פולימר קטיוני (איור 2A).
- הסר מדיה המכילה וירוסים למחרת בבוקר והחלף במצע גידול טרי. תרבית תאים במשך יומיים נוספים כדי לאפשר ביטוי של סמן הבחירה ולאחר מכן להוסיף puromycin לתרביות כדי לחסל תאים שאינם מותמרים.
- שלושה ימים לאחר הוספת פורומיצין, טריפסינזציה של התאים והצנטריפוגה מחצית מאוכלוסיית התאים ב 200 × גרם במשך 5 דקות בצנטריפוגה שולחנית. לאחסן את התאים כדוריים במקפיא -80 ° C להכנת DNA גנומי בעתיד; זוהי נקודת זמן הייחוס, או נקודת זמן 1 (T1).
- להחזיר את המחצית השנייה של אוכלוסיית התאים ולגדל אותה לכ-7 הכפלות אוכלוסייה לפני הקציר והצנטריפוגה כנ"ל. גלולת התא הזו תשמש כנקודת הזמן הסופית (נקודת זמן 2, T2) והיא מאוחסנת בטמפרטורה של -80°C לצורך בידוד דנ"א גנומי עתידי (איור 2).
- בידוד DNA גנומי מתאים שהותמרו במאגרי וירוסים
- הפשירו את גלולת התא מהמקפיא בטמפרטורה של -80°C והשהו מחדש את הגלולה ב-10 מ"ל של חיץ תרחיף עם הוספת RNAse, ומיד התפצלו לשתי צינוריות פולימתילפנטן של 15 מ"ל (איור 2B).
- יש להוסיף 500 μL של 10% SDS לכל 5 מ"ל, לערבב ולדגור בטמפרטורת החדר למשך 5 דקות. לאחר מכן, הכניסו צינורות למכשיר גזירת DNA כדי להפעיל את הדנ"א למשך 25 מחזורים של 30 שניות על / 30 שניות כבויות, והקפידו לשמור על הטמפרטורה ב -4 מעלות צלזיוס.
- יש להוסיף 5 מ"ל פנול/כלורופורם, pH 8.0 (מאוחסן ב-4°C), ולהקפיד לערבב את הפנול/כלורופורם היטב לפני השימוש. לאחר הוספת פנול/כלורופורם, יש לערבב היטב על ידי ערבול נמרץ על הגדרה מקסימלית של 45-60 שניות. צנטריפוגה למשך 60 דקות, -20°C ב-7,200 × גרם.
הערה: מראה מקציף/חלבי לאחר מערבולות יסמן השעיה מלאה. - העבירו 3 מ"ל של השלב העליון השקוף לצינור טרי של 15 מ"ל והוסיפו 0.5 מ"ל של 3 מ"ל נתרן אצטט ו-4 מ"ל של איזופרופנול וערבבו היטב (איור 2C). צנטריפוגה למשך 30 דקות ב-20°C ב-7,200 × גרם.
- לאחר הצנטריפוגה, יש להשליך את הסופרנאטנט ולאחר מכן להשליך בזהירות פיפטה מהנוזל שנותר. מוסיפים 0.5 מ"ל של 70% אתנול ומוציאים את הגלולה על ידי פיפטינג למעלה ולמטה. מעבירים את הגלולה התלויה מחדש לצינור צנטריפוגה בנפח 1.5 מ"ל ומשלבים את שני הכדוריות מאותה דגימה לצינור צנטריפוגה יחיד בנפח 1.5 מ"ל. צנטריפוגה במהירות מרבית בצנטריפוגה על ספסל למשך 5 דקות.
- השליכו את הסופרנאטנט והשתמשו במגבון מעבדה כדי לספוג שאריות של 70% אתנול. יש להשהות מחדש את הגלולה ב-0.5 מ"ל מים מזוקקים, ולהקפיד לא לתת לגלולה להתייבש מכיוון שהדבר יקשה על ההשעיה. יש לאחסן דגימות בטמפרטורה של 4°C לפני מדידת ריכוז ה-DNA.
- PCR מקונן להגברת ברקודי shRNA
הערה: יש לאחזר DNA מהאחסון ולהניח אותו על קרח. אם ריכוז הדנ"א נמוך מ-100 ננוגרם/מיקרוליטר, ייבוש מהיר של הדנ"א ואקום והשהיה מחדש בנפח מתאים של מים מזוקקים. אנו ממליצים לעבד רק מודול אחד בכל פעם (נקודת זמן 1 (T1) או נקודת זמן 2 (T2)). לבצע שתי הכנות של כל נקודת זמן אשר יש לאגד בסוף; לכן, חשוב לא לעבד נקודות זמן משוכפלות באותו יום. הפרוטוקול הבא הוא עבור נקודת זמן אחת של DNA גנומי.- הציבו 7 צינורות ותייגו אותם כמתואר: בקרה שלילית, בקרה חיובית, 4 צינורות לדנ"א גנומי ואחד לתערובת אב (איור 3A). השליטה השלילית היא מים מזוקקים; הבקרה החיובית היא DNA פלסמיד המשמש טרנספקציה 293T כדי לייצר lentivirus.
- הוסיפו תחילה מים לכל צינור כפי שמצוין בטבלה 2.
- הכינו מאסטר מיקס (MM) כפי שמוצג בטבלה 3.
- הוסף 18 μL של MM לכל צינור המכיל מים. לאחר מכן, הוסף 25 μL של DNA גנומי לכל אחת מארבע שפופרות התבנית. לאחר מכן, הוסף 1 μL של שליטה חיובית (10 ng / μL) לצינור הבקרה החיובית, תוך זהירות לא לזהם צינורות אחרים עם DNA בקרה חיובי. לבסוף, הוסף 2 μL של פולימראז לכל צינור, הוספת 4 צינורות הדגימה הראשון ואת צינור הבקרה החיובית האחרון; ערבבו וסובבו את צינורות ה-PCR (איור 3).
- ביצוע תגובת PCR בתנאים המפורטים בטבלה 4.
- בזמן שה-PCR הראשון פועל, הכינו צינורות ל-PCRהשני כפי שמצוין בטבלה 5. הקימו שבעה צינורות: בקרה שלילית, בקרה חיובית, 4 צינורות עבור דנ"א גנומי ואחד עבור MM (איור 3B).
- הוסף 22 μL של MM לכל צינור המכיל מים והמתן לסיום הסבב הראשון של PCR לפני הוספת ה- DNA והפולימראז.
- לאחר השלמת הסבב הראשון של PCR, יש לשלב 4 צינורות דגימה לצינור מיקרוצנטריפוגה אחד ולערבב.
- הוסף 25 μL לכל צינור דגימה המכיל מים.
- לאחר מכן, הוסף 2 μL של הבקרה השלילית הראשונה של PCR ו -2 μL של הבקרה החיובית הראשונה של PCR לצינורות המסומנים כראוי.
- הוסף 2 μL של פולימראז לכל צינור, הוספת 4 צינורות הדגימה הראשון ואת הבקרה השלילית האחרונה.
- ביצוע תגובת PCR כאמור בטבלה 6.
הערה: עם ניתוח התוצאות מתגובת ה- PCR הראשונה על ידי אלקטרופורזה על ג'ל אגרוז 3.5%, אם מתקבל שפע של מוצר, ניתן להפחית את מספר המחזורים ל 9-10 עבור החזרה הבאה של הליך זה; כמו כן, אם תפוקת המוצר נמוכה, מחזורים ניתן להגדיל ל 14. - כאשר תגובת ה-PCR השנייה הושלמה, יש לשלב 4 דגימות לצינור מיקרוצנטריפוגה אחד בתוספת 80 μL של צבע העמסה פי 6. עבור בקרות חיוביות ושליליות, השתמש ב- 20 μL של הדגימה.
- הכינו ג'ל אגרוז 3.5% במאגר Tris-Borate-EDTA (TBE) (איור 4A). כדי להכיל את נפח הדגימה הגדול, צור באר אחת גדולה במסרק הג'ל על ידי הדבקת מספר בארות יחד (אם מסרק שיתאים לנפח אינו זמין), הקפד להשאיר שתי בארות זמינות לבקרות החיוביות והשליליות. הפעל את הג'ל ב 90 V במשך 1 שעה.
- דמיינו את הג'ל ואשרו רצועה בכ-250 זוגות בסיסים (bp).
- טיהור ראשון: מיצוי ג'ל
- בעזרת אזמל נקי או סכין גילוח, מסירים את הרצועה של 250 bp, חותכים כמה שיותר ג'ל. מחלקים את הרצועה הגדולה ל-4 חלקים ומעבירים כל חתיכה לצינור מיקרוצנטריפוגה נקי. מדדו ותיעדו את משקלה של כל פרוסת ג'ל.
הערה: כל חתיכה צריכה להיות בערך 200 מ"ג או פחות לכל צינור. - הוסף 6 נפחים של חיץ מסיסות (למשל, אם חתיכת הג'ל שוקלת 200 מ"ג, הוסף 1.2 מ"ל של חיץ). מניחים את הצינורות באמבט מים בטמפרטורה של 50 מעלות צלזיוס ומסובבים כל 10-15 דקות עד להמסת פרוסות הג'ל. לאחר מכן, הוסף נפח אחד של איזופרופנול לכל צינור (למשל, 0.2 מ"ל של איזופרופנול אם חתיכת הג'ל שוקלת 200 מ"ג).
- באמצעות שתי עמודות ספין לטיהור, טען את הדגימות מכל 4 הצינורות לתוך העמודות. בצע סיבובים מרובים כדי לעבד את כל נפח הדגימה מכיוון שהעמודות מחזיקות רק 750 μL. סובב את העמודות ב- 17,900 × גרם למשך דקה אחת במיקרו-צנטריפוגה רגילה של ספסל והשלך את הזרימה בכל פעם.
- שטפו את העמודים עם 750 מיקרוליטר של חיץ כביסה וצנטריפוגה ב-17,900 × גרם למשך דקה אחת. לאחר השטיפה, יש להשליך את הזרם ולייבש את עמוד הסחיטה על ידי צנטריפוגה במשקל של 17,900 × גרם למשך 3 דקות. יש להקפיד על הדנ"א עם 50 μL מים מזוקקים לכל עמוד וצנטריפוגה כבעבר למשך דקה אחת ולשלב את שני הצינורות לקבלת נפח כולל של 100 μL של הדגימה.
- בעזרת אזמל נקי או סכין גילוח, מסירים את הרצועה של 250 bp, חותכים כמה שיותר ג'ל. מחלקים את הרצועה הגדולה ל-4 חלקים ומעבירים כל חתיכה לצינור מיקרוצנטריפוגה נקי. מדדו ותיעדו את משקלה של כל פרוסת ג'ל.
- טיהור שני
- שלב הטיהור הבא ישתמש ב- Binding Buffer 2 (מתוך ערכת טיהור PCR), שאינו מבטל שברים קטנים. הוסיפו 400 μL של מאגר ל-100 μL של דנ"א, וטענו אותו על עמוד ספין אחד (איור 4B). צנטריפוגה את הדגימה ב 17,900 × גרם במשך 1 דקה.
- לאחר מכן, לשטוף את הממברנה עם 650 μL של חיץ לשטוף ולסובב כפי שבוצע בעבר. יבש את עמוד הסחיטה עם צנטריפוגה נוספת כנ"ל במשך 3 דקות.
- יש להקפיד על הדנ"א עם 30 μL מים מזוקקים ולסובב במהירות מרבית למשך דקה אחת. לאחר ההדבקה, לבדוק את הריכוז על ספקטרופוטומטר; ודא שהריכוז אינו נמוך מ- 10 ng/μL או גבוה מ- 70-80 ng/μL. אחסן את ה- DNA במקפיא של -20 ° C.
- רצף של ברקודים מוגברים
- לריצוף, דללו ברקודים מטוהרים ל-0.75 ננוגרם/מיקרוליטר באמצעות מאגר אלוציה (EB). כדי להוסיף גיוון רצפים, אמפליקונים מקובצים באשכולות של 17 pM, כולל 30% (v/v) PhiX. בצע אשכולות חד-צדדיים (SE) במערכת אוטומטית ליצירת אשכולות בהתאם לפרוטוקול היצרן.
- בקש מליבת הרצף לבצע בסך הכל 36 מחזורים של רצף חד-קצה ברצף NextGen (איור 4C). הוסף פריימר מותאם אישית GexSeqS לפריימרים של ריצוף Illumina ב- 0.5 מיקרומטר.
- השתמש בתוכנת הניתוח המוזכרת כדי ליצור קבצי Fastq ולעבד אותם באמצעות תוכנה כדי לקצר את אורכי הקריאה ל- 18 נוקלאוטידים.
- השתמש בתוכנת Barcode Analyzer ו- Deconvoluter כדי לבטל קריאות גזומות. חשב ציוני דלדול קיפול עבור כל shRNA כיחס בין ספירת הקריאה בנקודת זמן הייחוס (T1) לעומת נקודת הזמן הסופית (T2).
- ניתוח תוצאות בדיקות shRNA וזיהוי מטרות טיפוליות מועמדות
הערה: בספריית ה-shRNA של סלקטה, רוב הגנים מכוונים על-ידי 5 (67%) או 6 shRNA שונים (32%). עם זאת, מספר גנים של משק בית, שאמורים להיפגע ברוב התאים, ממוקדים על ידי מספר רב של shRNA ומשמשים כבקרות המגדירות את טווח הציונים לשליליים.- כדי למנוע הטיה כלפי גנים הממוקדים על ידי מספר גדול יותר של shRNAs, יומן לשנות את ציוני הדלדול. לבצע הערכה כמותית על ידי חישוב אחוזון 80 עבור כל גן מתוך ההתפלגות האמפירית שלו.
- כדי ליצור התפלגות אפס של ציוני דלדול לוג, הניחו ש->95% מהגנים לא יתרוקנו ושציוני לוג-קוונטיל שלהם יהיו בעלי התפלגות נורמלית. השתמש בחציון של ההתפלגות האמפירית כדי להעריך את הממוצע של התפלגות האפס. באמצעות התפלגות אפס זו, סווגו את כל הגנים עם ציוני דלדול לוג-פולד הגדולים מהאחוזון ה-95 של התפלגות האפס כ"להיטים".
הערה: לכל הפגיעות צריכים להיות לפחות שני shRNA עם ציוני דלדול מעל נקודת החיתוך (איור 5). - כדי להעריך את איכות נתוני מסך הנשירה של RNAi ואת תוקפה של נקודת החיתוך, השתמש בקבוצת גנים שהוגדרו כ"חיוניים ליבה" על ידי יוזמת בדיקת ה- RNAi לסרטן COLT24,25 לשם השוואה. הסר CEGs מרשימת הפגיעות כדי לייצר את הרשימה הראשונית של מטרות טיפוליות פוטנציאליות.
הערה: גנים בקבוצת COLT קיבלו ציון להיט ב->50% מתוך 72 שורות התאים הסרטניים שנבדקו על ידי COLT. רשימת הגנים החיוניים מכילה 640 גנים. - כדי לזהות מטרות טיפוליות פוטנציאליות שנדרשות בדרך כלל או באופן אחיד על-ידי קווי תאי MPNST מרובים, בנו דיאגרמות Venn של פגיעות שאינן CEG שזוהו במסכים של קווי תאי MPNST שונים או תרביות מעבר מוקדמות (איור 6A). תעדוף להיטים שאינם CEG הנדרשים בכל או ברוב קווי MPNST או תרבויות.
- לחלופין, בצע ניתוחי מסלולים ברשימת הפגיעה שאינה CEG מכל קו תא או תרבית מעבר מוקדמת כדי לזהות גנים שתוצריהם מקודדים רכיבים של מסלולי איתות הדרושים להתרבות ו / או הישרדות תאי גידול. לאחר מכן, השווה את מסלולי האיתות המזוהים בניתוח המסלולים של שאינם CEGs למסלולי האיתות שזוהו כמושפעים ממוטציות המזוהות עם WES.
הערה: אנו מוצאים שזה שימושי במיוחד לזהות מסלולי איתות המושפעים באופן עקבי ממוטציות שזוהו ב- WES ולהשוות אותם למסלולי איתות המזוהים כקריטיים במסכי shRNA.
- לחלופין, בצע ניתוחי מסלולים ברשימת הפגיעה שאינה CEG מכל קו תא או תרבית מעבר מוקדמת כדי לזהות גנים שתוצריהם מקודדים רכיבים של מסלולי איתות הדרושים להתרבות ו / או הישרדות תאי גידול. לאחר מכן, השווה את מסלולי האיתות המזוהים בניתוח המסלולים של שאינם CEGs למסלולי האיתות שזוהו כמושפעים ממוטציות המזוהות עם WES.
- כדי לזהות מטרות ניתנות לתרופות שעבורן כבר זמינים חומרים טיפוליים, סנן את רשימת הפגיעות שנותרו לאחר הסרת הגנים החיוניים העיקריים באמצעות מסד הנתונים של אינטראקציה בין גנים של תרופות (dgidb.org).
הערה: מסד נתונים זה מאפשר הזנה וסינון של גנים בו-זמנית ומספק הנחיות לגבי תרופות הזמינות כיום למיקוד גנים אלה. - אמת תחילה את המטרות המזוהות בעלות עניין רב על ידי הפלת ביטוי הגנים שלהן באמצעות shRNAs שונים מאלה המשמשים במסך הספרייה הראשוני בפורמט אצווה יחיד (לא פורמט אצוות ספרייה שתואר זה עתה). כדי להפיל את ביטוי הגנים, השתמש בשניים עד שלושה shRNA לנטי-ויראלי שונים. שלושה עד ארבעה ימים לאחר ההדבקה, לקבוע את ההשפעה שיש לכך על התפשטות תאי הגידול והישרדותם כמתואר להלן.
3. לבצע בדיקות ציטומטר של מספרי תאים וכדאיות בתאי MPNST המאותגרים עם סוכנים טיפוליים מועמדים
- לגדל תאי MPNST ב- DMEM למפגש של 80%. יש לשטוף תאים בתמיסת מלח מאוזנת (HBSS) בטמפרטורת החדר.
הערה: אין לגדל תאים למפגש מכיוון שצמיחתם של תאים אלה תתעכב זמן מה לאחר ציפוי מחדש. - נתק תאים מהמצע על ידי כיסוי תאים למשך 30 שניות עד דקה אחת בתמיסת דיסוציאציה של תאים לא אנזימטיים. הוסף 5 מ"ל DMEM לכל 1 מ"ל של תמיסת הדיסוציאציה ופיזר בעדינות תאים למעלה ולמטה כדי להתנתק מהמצע.
- ספירת תאים באמצעות המוציטומטר. תאי לוחות בצפיפות של 1,200 תאים לבאר בלוחות בעלי דופן שחורה של 96 בארות; צלחות לפחות שלוש בארות לכל דילול תרופה שייבדקו ויבצעו שלושה שכפולים ביולוגיים של ניסויים אלה.
- כדי לקבוע את הריכוזים הראשוניים של התרופה שתיבדק, עיין בספרות כדי להעריך אילו ריכוזים היו יעילים נגד סוגי תאים סרטניים אחרים. בניסויים ראשוניים, בדקו טווח של שני סדרי גודל מעל ושני סדרי גודל מתחת לריכוז התרופה המשמשת עם סוגי סרטן אחרים.
- הכינו דילולים של התרופה לבדיקה והוסיפו כל דילול או רכב לשלוש בארות משוכפלות לפחות.
- הערך מספרי תאים ישירים 1, 3, 5 ו -7 ימים לאחר הוספת תרופות. מוסיפים את Hoechst 33342 לריכוז סופי של 5 מיקרוגרם/מ"ל ודגרים על צלחות למשך 30 דקות ב-37°C. קריאת לוחות על ציטומטר הדמיה בתפוקה גבוהה באמצעות האפשרות ספירת תאים ישירה עבור מספר תאים כולל עם זמני חשיפה של 100,000 אלפיות השנייה.
- נתח את הקריאות באמצעות התוכנה וייצא אותן לגיליון אלקטרוני והשתמש בתוכנה מתאימה לניתוחים סטטיסטיים.
- אם נצפתה ירידה מובהקת סטטיסטית במספר התאים בבארות שטופלו בתרופות, בצע בדיקת "חי/מת" כדי לקבוע אם ירידה זו נובעת, בחלקה, מהשראת מוות תאי.
- תאי לוחות בלוחות 96 בארות בעלי דופן שחורה כמתואר בשלב 3.3.
- הכן והוסף תרופות כמתואר בשלב 3.5.
- להעריך את כדאיות התא ואת המוות 1, 3, 5, ו 7 ימים לאחר הוספת התרופה. הוסף calcein AM לריכוז סופי של 1 μM ויודיד פרופידיום לריכוז סופי של 1 μM בכל באר. לדגור על תאים במשך 15 דקות ב 37 ° C.
- תמונה של תאים בציטומטר הדמיה באמצעות אפשרות התוכנה Live+Dead . נתח את הקריאות באמצעות התוכנה וייצא אותן לגיליון אלקטרוני והשתמש בתוכנה מתאימה לניתוחים סטטיסטיים.
תוצאות
איור 5 מציג ציוני דלדול של גנים חיוניים לליבה (CEGs) שסומנו כ-TRUE בהשוואה לגנים שאינם CEG (שסומנו כ-FALSE) בכל קו תאים אנושי שנבדק. נקודות מייצגות log2 של ציוני דלדול קיפול עבור גנים בודדים, אשר משורטטים על פני תרשים תיבה המייצג את התפלגות הניקוד הכוללת. מבחן t של סטודנט שימש לבדיקת הבדל משמעותי בממוצע ציוני הדלדול בין שתי הקבוצות בכל קו תא. ערכי ה-p המתקבלים מצוינים בכל חלונית. שים לב שציוני דלדול הקיפול הממוצעים גבוהים משמעותית עבור CEGs מאשר אלה שאינם CEGs. זה צפוי מכיוון שגני ליבה חיוניים, מעצם הגדרתם, נדרשים באופן עקבי להתרבות ו / או הישרדות ברוב סוגי התאים.
איור 6A מציג דיאגרמת Venn של ה"פגיעות" עבור שלושה קווי תאי MPNST אנושיים. בדרך כלל אנו מוצאים כי מספר רב של גנים משותפים בין מספר שורות; פגיעות אלה נמצאות בעדיפות גבוהה מכיוון שהן מייצגות גנים המקודדים חלבונים שעשויים להיות חיוניים להתרבות ו / או הישרדות של תת-קבוצה גדולה של MPNST. שימו לב גם שישנם מספר גנים שנפגעים רק בקו תא אחד. אנו נתקלים בכך לעתים קרובות ואין לראות בכך אינדיקציה לכך שהמסכים באיכות ירודה. הגנים הנפוצים בין שורות מרובות מוערכים לאחר מכן באמצעות מסד הנתונים של אינטראקציה בין גנים של תרופות כדי לזהות גנים בתוך תת-קבוצה זו המקודדים חלבונים הניתנים לתרופה עם חומרים קיימים. לאחר מכן אנו בוחרים כמה מהם ומבצעים אימות ראשוני על ידי הפלת הביטוי של mRNA המתאים עם shRNAs. מכיוון שלחלק מה-shRNA יהיו השפעות מחוץ למטרה, אנו תמיד בודקים מספר shRNA המכוון לאותו תמליל. איור 6B מראה תוצאה מייצגת שבה התמרנו תאי MPNST עם בקרה ללא מיקוד ומספר shRNA המכוון ל-BCL6. מספרי התאים נקבעו אז בזמנים משתנים לאחר הטרנסדוקציה. שימו לב שכמה מה-shRNA של BCL6 הפחיתו במידה ניכרת את מספר התאים; כפי שניתן לראות באימונובלוט הנלווה, מידת הירידה במספר התאים מתואמת עם מידת ההפלה של BCL6. איור 6C מראה עקומת צמיחה מייצגת עבור מעבר מוקדם P 0-GGFβ3 MPNST culture.

איור 1: זרימת עבודה לביצוע ריצוף אקסומי שלם של רקמת MPNST או תאי MPNST במעבר מוקדם. סכמטי מדגים את זרימת העבודה הכללית של זיהוי וריאנטים הקיימת בתרביות מעבר מוקדמות שמקורן בגידול. לבודד DNA מתרביות מעבר מוקדמות (1) ולהגיש DNA איכותי לליבת הריצוף בהתאם לפרוטוקולי ההגשה שלהם (2). ליבת הריצוף תבדוק את איכות הדנ"א שהוגש ותבצע את כל הכנת הדגימות וספריית הגנום הדרושות. מתקן הליבה יספק למשתמשים קבצי רצף FASTQ עם מדדי בקרת איכות (3). המשתמשים יעלו את קבצי ה-FASTQ לתוכנית יישור גנום ו-variant caller לפי בחירתם. (4) וריאנטים מבוארים מסוננים לפי קריטריונים שהוגדרו על-ידי המשתמש כדי להסיר וריאנטים שאינם רלוונטיים. נתונים מייצגים המוצגים משווים דגימת גידול MPNST אנושית שנכרתה לעומת קו תאים הנגזר מהגידול26. (5) לבצע ניתוח סיווג פונקציונלי עם PANTHER. קיצור: MPNST = גידול ממאיר במעטפת העצבים ההיקפית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
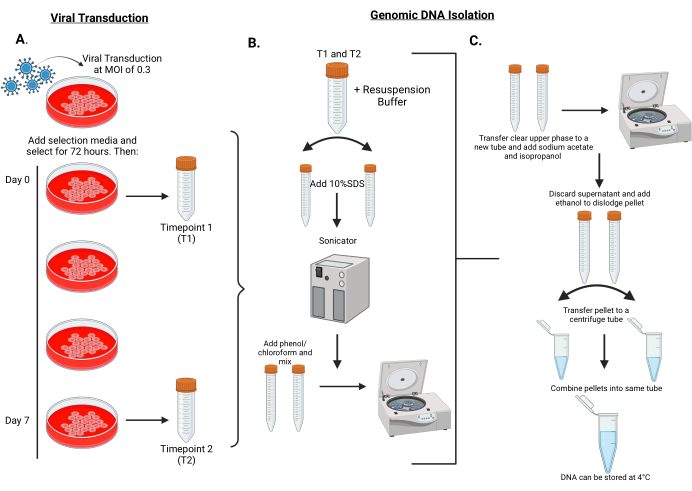
איור 2: תהליך עבודה לביצוע התמרה נגיפית של ספריות shRNA לתאי MPNST ובידוד דנ"א גנומי מהתאים בנקודת זמן 1 ובנקודת זמן 2. (A) תאי מטרה נגועים ב-MOI נמוך של 0.3 בחלקיקים לנטי-ויראליים מקודדים ונבחרים למשך 72 שעות. התאים עוברים להכפלת אוכלוסייה של 5-7 (כ-7 ימים). כדורי התא ביום 0 וביום 7 מאוחסנים בטמפרטורה של -80 מעלות צלזיוס לצורך בידוד DNA גנומי. יום 0 מכונה נקודת זמן 1 (T1) ויום 7 מכונה נקודת זמן 2 (T2). (B) בידוד דנ"א גנומי מתחיל עם השעיה של כדורי תאים בחיץ תרחיף שמפוצלים לאחר מכן לשני צינורות של 15 מ"ל. כדי להקל על ליזה של תאים, מוסיפים 10% SDS לכל צינור ועוברים סוניקציה למשך 25 מחזורים של 30 שניות על / 30 שניות כבויות. לאחר סוניקציה, פנול/כלורופורם מתווסף לכל צינור ומערבל במרץ במשך 45-60 שניות. צינורות לאחר מכן הם צנטריפוגות. (C) שלב עליון שקוף מסולק ומתווסף לצינורית נקייה בתוספת נתרן אצטט/איזופרופנול ומעורבב היטב. צינורות הם צנטריפוגות שוב. הפעם, supernatant הוא זרק, ואת הגלולה הוא עקר עם תוספת של 70% אתנול. שלב את הכדוריות התלויות לצינור אחד וסובב במהירות מרבית בצנטריפוגה על ספסל. השליכו את הסופרנאטנט והשהו מחדש את הגלולה במים מזוקקים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
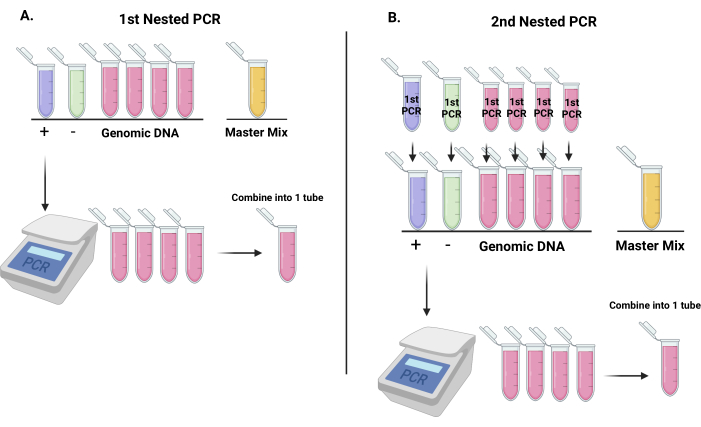
איור 3: זרימת עבודה להגברת רצפי ברקוד מווקטורי shRNA לנטי-ויראליים כהכנה לכימות ברקודים עם ריצוף מהדור הבא. (A) ייצוג של אופן הגדרת צינורות לתגובת PCR המקוננת הראשונה (7 צינורות: אחת לבקרה שלילית, אחת לבקרה חיובית ו-4 הנותרות לדנ"א גנומי. הצינור האחרון ישמש כצינור המיקס הראשי). לאחר תגובת ה-PCR הראשונה, יש לשלב את צינורות הדנ"א הגנומי לצינור אחד ולערבב. (B) המוצרים מתגובת ה-PCR המקוננת הראשונה ישמשו כתבניות לתגובת ה-PCR המקוננת השנייה. לאחר ה-PCR השני, יש לשלב את צינורות הדנ"א הגנומי לצינור אחד ולערבב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
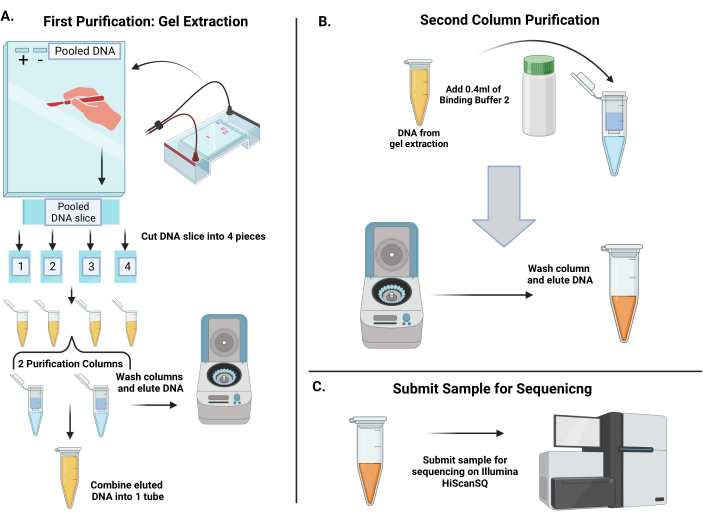
איור 4: זרימת עבודה לטיהור ברקודי shRNA מוגברים וברקודי ריצוף לכימות הייצוג שלהם בנקודת זמן 1 ובנקודת זמן 2 . (A) יוצקים ג'ל אגרוז 3.5%. מכיוון שנפח הדנ"א המצטבר חורג מהגבול עבור באר אחת, הדביקו יחד 4-6 שיניים של מסרק ג'ל כדי לייצר באר אחת גדולה. הכינו מוצרי PCR עם צבע העמסה פי 6 וטענו את הבקרה החיובית, הבקרה השלילית ואיגום הדנ"א לתוך הג'ל. לאחר אלקטרופורזה, פס גדול בכ-250 זוגות בסיסים אמור להופיע בנתיב הדנ"א המאוגם. באמצעות אזמל נקי, הבלו את כל הלהקה, ולאחר מכן לחתוך ל 4 פרוסות ג'ל. המסיסים את חתיכות הג'ל ולאחר מכן משלבים אותן לשני טורי סיבוב כדי להאיר DNA. ערבבו את הדנ"א המדולל לצינור אחד. (B) הדנ"א מטוהר באמצעות שלב טיהור שני. הוסף את Binding Buffer 2 לצינור של הדנ"א המצטבר, ולאחר מכן פיפטה על עמודת סיבוב. לשטוף את הממברנה ולאחר מכן lute את ה- DNA במים מזוקקים. (C) להגיש את הדנ"א המטוהר לליבת הריצוף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
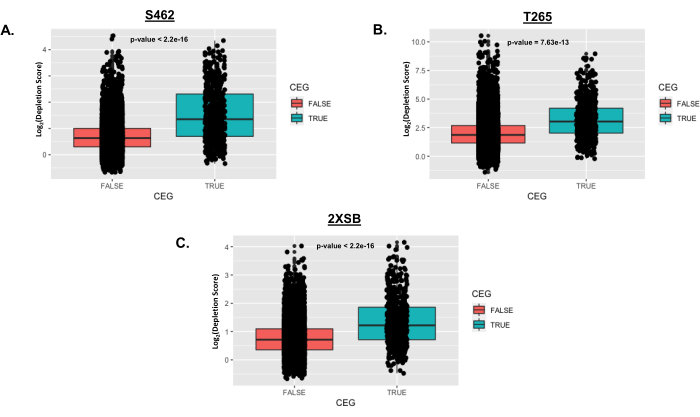
איור 5: דוגמאות מייצגות להתפלגות הגנים החיוניים לאחר ניתוח כמתואר בפרוטוקול. בדוגמה זו, שלושה תאי MPNST אנושיים (S462, T265 ו-2XSB) נבדקו באמצעות ספריות shRNA של Cellecta DECIPHER. עבור כל קו תאי MPNST אנושי, נוצרה קופסה כדי להשוות ציוני דלדול ברמת הגן עבור גנים ברשימת הגנים החיוניים (CEG; תרשים תיבה אמיתי)25 לזה של גנים שאינם נמצאים ברשימת CEGs (תרשים תיבה שקרית). נקודות נתונים נפרדות מסודרות בשכבות מעל כל התוויית תיבה. ערכי P הם ממבחן t סטנדרטי המשווה ציוני דלדול ברמת הגן של CEGs ללא CEGs. קיצורים: CEG = גן חיוני הליבה; MPNST = גידול ממאיר במעטפת העצבים ההיקפית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
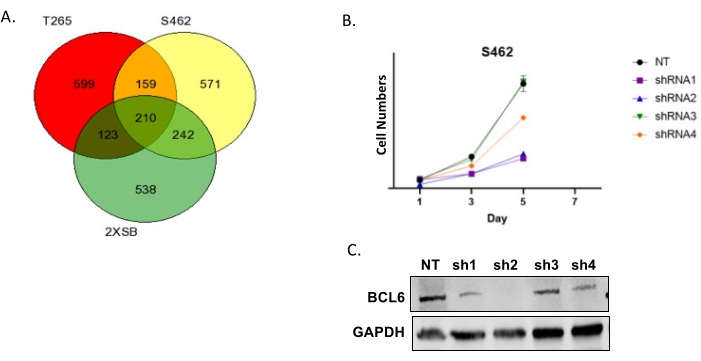
איור 6: אימות תוצאות המסך . (A) דיאגרמת חיתוך קבוצות (Venn) מייצגת של פגיעות חופפות בשלושה קווי תאי MPNST אנושיים. (B) תאי MPNST אנושיים S462 שהותמרו עם וקטור לנטיויראלי ללא מטרה (NT) ולנטיוירוס המבטאים ארבעה shRNA BCL6 שונים (shRNA1, shRNA2, shRNA3 ו-shRNA4). התאים הומרו עם lentivirus ולאחר מכן טופלו עם סוכן בחירה (puromycin) במשך 3 ימים. לאחר מכן הוערכו מספרי התאים במהלך שבעת הימים הבאים. (C) ניתוח כתמים מערביים המראה רמות חלבון של BCL6 לאחר התמרה עם NT,shRNA1, shRNA2, shRNA3 ו-shRNA4 lentivirus. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פריסת לוחות עבור titering lentiviral. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: הגדרה ראשונית של תגובות PCR ראשונות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: הכנת תערובת אב לתגובת PCR ראשונה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 4: פרמטרי PCR ראשונים של סלקטה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 5: הגדרה ראשונית של תגובת PCR שנייה. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 6: פרמטרים של PCR שני של סלקטה. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
השיטות המפורטות המוצגות כאן פותחו כדי לחקור neoplasia מערכת העצבים ההיקפית ופתוגנזה MPNST. למרות שמצאנו שיטות אלה כיעילות, יש להכיר בכך שיש כמה מגבלות פוטנציאליות לשיטות שאנו מתארים כאן. להלן, נדון בכמה ממגבלות אלה ובאסטרטגיות אפשריות להתגבר עליהן במערכות מודל אחרות.
מצאנו כי ריצוף אקסומי שלם מזהה ביעילות מוטציות מעניינות בעכברי P 0-GGFβ3. עם זאת, יש להכיר בכך שלכל ריצוף האקזום עצמו יש מגבלות. ראשית, ריצוף אקסומי שלם אינו גישה יעילה לזיהוי תוצרי גן היתוך. הסיבה לכך היא שרוב השברים הכרומוזומליים והאיחוי שבא בעקבותיהם כוללים בעיקר אזורים אינטרוגניים ואינטרונים, שכן אזורים אלה מייצגים את רוב הגנום. במקום זאת מצאנו כי RNA-Seq עם קריאות קצה מזווג מזהה בצורה הרבה יותר יעילה גנים היתוך. קיימת גם השאלה באיזו יעילות ריצוף אקסומי שלם מזהה אזורים גדולים יחסית של אובדן כרומוזומלי.
למרות שפותחו מספר אלגוריתמים לזיהוי הפסדים כאלה, המונח "ריצוף אקסומי שלם" הוא כשלעצמו מטעה מכיוון שלכידת האקזומה אפילו בריצות טובות מפספסת לעתים קרובות עד 5-10% מהאזורים האקסוניים. מסיבה זו, אנו משלימים באופן שגרתי ריצוף אקסומי שלם עם גישות אחרות כגון הכלאה גנומית השוואתית מערך (aCGH). לאחר זיהוי רווחים והפסדים, אנו בוחנים את הגנים בתוך מרווחי זמן אלה ומשווים אותם למוטציות המניעות הידועות הקשורות לעמיתיהם האנושיים. עם זאת, גנום העכבר יציב יותר מהגנום האנושי27. כתוצאה מכך, גידולים בעכבר בדרך כלל אינם מראים chromothripsis מקביל למה שנראה neoplasms אנושי. במקום זאת, הדפוס בגידולים בעכברים הוא הרבה יותר פשוט, נוטה לרווחים או הפסדים של כרומוזום שלם עם מחיקות מוקדיות מעטות יחסית שנוטות להתרחש תחת לחץ סלקטיבי חזק22,23.
ישנן כמה מלכודות פוטנציאליות שנתקלנו בהן בעת ביצוע מסכי shRNA בקנה מידה גנומי. אחת הבעיות הנפוצות ביותר שאנו נתקלים בהן היא התמרה דלה יחסית של הווקטורים הלנטי-ויראליים לתאי המטרה. לרוב אנו מוצאים כי הבעיה נבעה מטירינג לא נכון של הבריכות הלנטיוויראליות הארוזות. מכיוון שתרביות תאי גידול בעכברים במעבר מוקדם הן משאב מגביל, חוקרים רבים ינסו במקום זאת לקשור את נגיף הלנטי שלהם באמצעות קו תאים מבוסס אחר הזמין יותר. הבעיה עם גישה זו, עם זאת, היא כי היעילות של התמרה lentiviral יכול להשתנות במידה ניכרת מסוג התא לסוג התא. מסיבה זו אנו ממליצים על טיטרינג לנטיוירוס על התאים האמיתיים שישמשו בניסוי. נתקלנו גם בבעיות עם טיטרים ויראליים נמוכים יחסית. בעיה זו משקפת לרוב טרנספקציה ירודה של תאי 293T בעת ייצור הנגיף הארוז.
ניתן להשיג פגיעות חיוביות כוזבות בעת ביצוע מסכי shRNA בקנה מידה גנומי. מסיבה זו, ברגע שזיהינו את המטרות הפוטנציאליות הניתנות לסמים שמעניינות אותנו ביותר, אנו תמיד מאמתים את התוצאות של מסכי ה-shRNA שלנו. בדרך כלל, נשתמש בשתי גישות שונות כדי לאמת יעדים בעלי ריבית גבוהה. ראשית, אנו מפילים את ביטוי הגנים באמצעות שני shRNA או יותר הנבדלים מאלה המשמשים במסך הראשוני וקובעים את ההשפעה שיש לכך על התרבות תאי הגידול והישרדותם. שנית, אנו משיגים את התרופות המזוהות במסד הנתונים של אינטראקציה גנטית של תרופות וקובעים את ההשפעה שיש לכך על התרבות תאי הגידול והישרדותם. אנחנו משתמשים בשתי הגישות במקביל כי נתקלנו בנסיבות שבהן ה-shRNA עובד והתרופה לא. לפחות בחלק מהמקרים הללו, בחינה של כל מערך הנתונים של רצף האקזומה הראתה כי חלבון המטרה מיוצר על ידי גן שיש לו מוטציה שעלולה להשפיע על אינטראקציות בין תרופות לחלבונים.
הגישות המתוארות לעיל יספקו לחוקר אמצעי ישים לזיהוי מוטציות מניעות פוטנציאליות המתרחשות בגידולים נדירים, זיהוי פונקציונלי של מסלולי האיתות הדרושים להתרבות והישרדות, ותעדוף מטרות לפיתוח טיפולי. אנו מקווים שחוקרים אחרים ימצאו גישות אלה שימושיות לזיהוי מטרות טיפוליות מרכזיות בסוגי סרטן אנושיים אחרים. הקורא צריך להיות מודע, עם זאת, כי ישנן גישות גנומיות פונקציונליות אחרות שניתן להשתמש בהן כדי לזהות גנים המעורבים בפתוגנזה של הגידול וגנים המקודדים מטרות טיפוליות פוטנציאליות. לדוגמה, קיימות ספריות קריספר שניתן להשתמש בהן באופן מקביל לזה שאנו מתארים עבור ספריות shRNA. ניתן לבצע גם מסכים פונקציונליים in vivo כדי לזהות גנים המקדמים גידולים. כדוגמה לכך, מערכת מוטגנזה סומטית מבוססת טרנספוזון של היפהפייה הנרדמת שימשה בעבר למיקוד תאי Schwann ומבשריהם, וכתוצאה מכך זוהו כמה מאות גנים המעורבים בפתוגנזה MPNST28. מכיוון שמערכות אלה ניגשות לגנומיקה פונקציונלית בדרכים שונות, אנו ממליצים לחוקר לשקול בקפידה את מטרות הניסויים המתוכננים שלו ולבסס את בחירתו במתודולוגיית גנומיקה פונקציונלית על מטרות אלה.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהמכון הלאומי למחלות נוירולוגיות ושבץ (R01 NS048353 ו- R01 NS109655 ל- S.L.C.; R01 NS109655-03S1 ל- D.P.J.), המכון הלאומי לסרטן (R01 CA122804 ל- S.L.C.), ומשרד ההגנה (X81XWH-09-1-0086 ו- W81XWH-12-1-0164 ל- S.L.C).
Materials
| Name | Company | Catalog Number | Comments |
| Bioruptor Sonication System | Diagenode | UCD-600 | |
| CASAVA 1.8.2 | |||
| Cbot | Illumina, San Diego, CA | N/A | |
| Celigo Image Cytometer | Nexcelom | N/A | |
| Cellecta Barcode Analyzer and Deconvoluter software | |||
| Citrisolve Hybrid | Decon Laboratories | 5989-27-5 | |
| Corning 96-well Black Microplate | Millipore Sigma | CLS3603 | |
| Diagenode Bioruptor 15ml conical tubes | Diagenode | C30010009 | |
| dNTP mix | Clontech | 639210 | |
| Eosin Y | Thermo Scientific | 7111 | |
| Elution buffer | Qiagen | 19086 | |
| Ethanol (200 Proof) | Decon Laboratories | 2716 | |
| Excel | Microsoft | ||
| FWDGEX 5’-CAAGCAGAAGACGGCATACGAGA-3’ | |||
| FWDHTS 5’-TTCTCTGGCAAGCAAAAGACGGCATA-3’ | |||
| GexSeqS (5’ AGAGGTTCAGAGTTCTACAGTCCGAA-3’ | HPLC purified | ||
| GraphPad Prism | Dotmatics | ||
| Harris Hematoxylin | Fisherbrand | 245-677 | |
| Illumina HiScanSQ | Illumina, San Diego, CA | N/A | |
| Paraformaldehyde (4%) | Thermo Scientific | J19943-K2 | |
| PLUS Transfection Reagent | Thermo Scientific | 11514015 | |
| Polybrene Transfection Reagent | Millipore Sigma | TR1003G | |
| PureLink Quick PCR Purification Kit | Invitrogen | K310001 | |
| Qiagen Buffer P1 | Qiagen | 19051 | |
| Qiagen Gel Extraction Kit | Qiagen | 28704 | |
| RevGEX 5’-AATGATACGGCGACCACCGAGA-3’ | |||
| RevHTS1 5’-TAGCCAACGCATCGCACAAGCCA-3’ | |||
| Titanium Taq polymerase | Clontech | 639210 | |
| Trimmomatic software | www.usadellab.org |
References
- Carroll, S. L. Molecular mechanisms promoting the pathogenesis of Schwann cell neoplasms. Acta Neuropathol. 123 (3), 321-348 (2012).
- Longo, J. F., Weber, S. M., Turner-Ivey, B. P., Carroll, S. L. Recent Advances in the Diagnosis and Pathogenesis of Neurofibromatosis Type 1 (NF1)-associated Peripheral Nervous System Neoplasms. Adv Anat Pathol. 25 (5), 353-368 (2018).
- Longo, J. F., Carroll, S. L. The RASopathies: Biology, genetics and therapeutic options. Adv Cancer Res. 153, 305-341 (2022).
- Birindelli, S., et al. Rb and TP53 pathway alterations in sporadic and NF1-related malignant peripheral nerve sheath tumors. Lab Invest. 81 (6), 833-844 (2001).
- Legius, E., et al. TP53 mutations are frequent in malignant NF1 tumors. Genes Chromosomes Cancer. 10 (4), 250-255 (1994).
- Menon, A. G., et al. Chromosome 17p deletions and p53 gene mutations associated with the formation of malignant neurofibrosarcomas in von Recklinghausen neurofibromatosis. Proc Natl Acad Sci U S A. 87 (14), 5435-5439 (1990).
- Upadhyaya, M., et al. Germline and somatic NF1 gene mutation spectrum in NF1-associated malignant peripheral nerve sheath tumors (MPNSTs). Hum Mutat. 29 (1), 74-82 (2008).
- Kourea, H. P., Orlow, I., Scheithauer, B. W., Cordon-Cardo, C., Woodruff, J. M. Deletions of the INK4A gene occur in malignant peripheral nerve sheath tumors but not in neurofibromas. Am J Pathol. 155 (6), 1855-1860 (1999).
- Nielsen, G. P., et al. Malignant transformation of neurofibromas in neurofibromatosis 1 is associated with CDKN2A/p16 inactivation. Am J Pathol. 155 (6), 1879-1884 (1999).
- Gregorian, C., et al. PTEN dosage is essential for neurofibroma development and malignant transformation. Proc Natl Acad Sci U S A. 106 (46), 19479-19484 (2009).
- Lee, W., et al. PRC2 is recurrently inactivated through EED or SUZ12 loss in malignant peripheral nerve sheath tumors. Nat Genet. 46 (11), 1227-1232 (2014).
- Zhang, M., et al. Somatic mutations of SUZ12 in malignant peripheral nerve sheath tumors. Nat Genet. 46 (11), 1170-1172 (2014).
- Varela, I., et al. Somatic structural rearrangements in genetically engineered mouse mammary tumors. Genome Biol. 11 (10), 100 (2010).
- Johnson, R. A., et al. Cross-species genomics matches driver mutations and cell compartments to model ependymoma. Nature. 466 (7306), 632-636 (2010).
- Kim, M., et al. Comparative oncogenomics identifies NEDD9 as a melanoma metastasis gene. Cell. 125 (7), 1269-1281 (2006).
- Zender, L., et al. Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach. Cell. 125 (7), 1253-1267 (2006).
- Uren, A. G., et al. Large-scale mutagenesis in p19(ARF)- and p53-deficient mice identifies cancer genes and their collaborative networks. Cell. 133 (4), 727-741 (2008).
- Starr, T. K., et al. A transposon-based genetic screen in mice identifies genes altered in colorectal cancer. Science. 323 (5922), 1747-1750 (2009).
- Dupuy, A. J., et al. A modified sleeping beauty transposon system that can be used to model a wide variety of human cancers in mice. Cancer Res. 69 (20), 8150-8156 (2009).
- Carroll, S. L. The Challenge of Cancer Genomics in Rare Nervous System Neoplasms: Malignant Peripheral Nerve Sheath Tumors as a Paradigm for Cross-Species Comparative Oncogenomics. Am J Pathol. 186 (3), 464-477 (2016).
- Huijbregts, R. P., Roth, K. A., Schmidt, R. E., Carroll, S. L. Hypertrophic neuropathies and malignant peripheral nerve sheath tumors in transgenic mice overexpressing glial growth factor beta3 in myelinating Schwann cells. J Neurosci. 23 (19), 7269-7280 (2003).
- Kazmi, S. J., et al. Transgenic mice overexpressing neuregulin-1 model neurofibroma-malignant peripheral nerve sheath tumor progression and implicate specific chromosomal copy number variations in tumorigenesis. Am J Pathol. 182 (3), 646-667 (2013).
- Brosius, S. N., et al. Neuregulin-1 overexpression and Trp53 haploinsufficiency cooperatively promote de novo malignant peripheral nerve sheath tumor pathogenesis. Acta Neuropathol. 127 (4), 573-591 (2014).
- Hart, T., Brown, K. R., Sircoulomb, F., Rottapel, R., Moffat, J. Measuring error rates in genomic perturbation screens: gold standards for human functional genomics. Mol Syst Biol. 10 (7), 733 (2014).
- Hart, T., et al. Evaluation and Design of Genome-Wide CRISPR/SpCas9 Knockout Screens. G3. 7 (8), 2719-2727 (2017).
- Longo, J. F., et al. Establishment and genomic characterization of a sporadic malignant peripheral nerve sheath tumor cell line. Sci Rep. 11 (1), 5690 (2021).
- Maser, R. S., et al. Chromosomally unstable mouse tumours have genomic alterations similar to diverse human cancers. Nature. 447 (7147), 966-971 (2007).
- Rahrmann, E. P., et al. Forward genetic screen for malignant peripheral nerve sheath tumor formation identifies new genes and pathways driving tumorigenesis. Nat Genet. 45 (7), 756-766 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved