Ozonolyse des alcènes
Vue d'ensemble
Source : Vy M. Dong et Zhiwei Chen, Department of Chemistry, University of California, Irvine, CA
Cette expérience montrera un exemple d’une réaction d’ozonolyse de synthétiser la vanilline d’isoeugenol (Figure 1). Ozonolyse des alcènes, une réaction d’oxydation entre l’ozone et un alcène, est une méthode commune pour préparer les aldéhydes, cétones et acides carboxyliques. Cette expérience montre également l’utilisation d’un générateur d’ozone et une réaction de basse température (−78 ° C).

La figure 1. Schéma montrant l’ozonolyse d’isoeugénol de vanilline.
Principles
Le clivage oxydant des alcènes à deux composés contenant du carbonyle-groupe s’appelle une réaction d’ozonolyse (Figure 2). Le mécanisme proposé (Figure 3) commence par une cycloaddition [3 + 2] entre alcène 1 avec l’ozone pour générer l' intermédiaire molozonide A. A est instable et se transpose dans l’ozonide plus stable C via le zwitterion B. C se décompose en présence d’un agent réducteur tel que le sulfure de diméthyle à remettre les deux produits de carbonyle (2, 3) et le diméthylsulfoxyde. Quand un solvant nucléophile est utilisé (par exemple, méthanol), le nucléophile attaque intermédiaire B pour former un hydroperoxyde E, qui se décompose en produit 3 lorsqu’il est ajouté, le sulfure de diméthyle (Figure 4). La réaction est généralement effectuée à −78 ° C afin d’éviter les réactions secondaires et en présence d’un indicateur pour déterminer quand la réaction est terminée. Sudan III est un indicateur couramment utilisé. Au début, le mélange réactionnel est rouge et se tourne vers bleu/violet quand tous l’alcène est consommée. Quand tous l’alcène a réagi, l’indicateur, qui a un double de liaison N-N, réagit avec l’ozone, donnant ainsi le changement de couleur.

La figure 2. Schéma montrant la réaction d’ozonolyse générales d’un alcène avec un bilan réductrice.
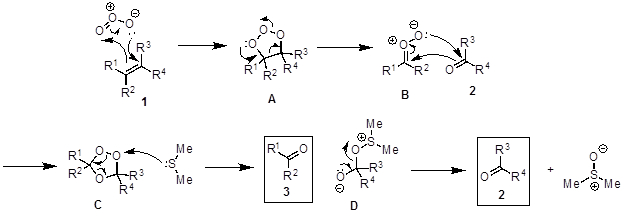
La figure 3. Schéma montrant le mécanisme général d’ozonolyse des alcènes.

La figure 4. Schéma montrant la formation d’un hydroperoxyde d’intermédiaire B.
Procédure
- Ajouter 200 mg d’isoeugénol, 15 mL de MeOH, et ~ 2 mg de Soudan III à un ballon à fond rond de 50 mL à col 3 équipé d’un bar d’agitation magnétique.
- Raccorder le ballon de réaction à un réservoir d’oxygène et un barboteur.
- Allumez le débit d’oxygène.
- Laissez refroidir le mélange réactionnel avec un bain de glace carbonique et d’acétone.
- Mettre en marche le générateur d’ozone, qui convertit l’oxygène du réservoir à l’ozone qui va dans le ballon à réaction. Le générateur se situera entre le réservoir d’oxygène et le ballon à réaction. Laissez le mélange réactionnel à remuer jusqu'à ce que les changements de couleur rouge à violet/bleu.
- Désactiver le générateur d’ozone et permettre à oxygène purger le mélange de la réaction de l’ozone pendant 5 min.
- Retirer le bain de refroidissement et ajouter 0,2 mL de sulfure de diméthyle.
- Remuer le mélange réactionnel tout en réchauffant à température ambiante pendant 1 h.
- Éliminer le solvant par évaporateur rotatif. Faire une silice prise en plaçant le gel de silice dans un entonnoir Büchner. Dissoudre le résidu dans l’acétate d’éthyle 10 % dans hexanes et passer la solution à travers le bouchon de silice sous vide pour éliminer les impuretés. Laver le bouchon de silice 2 fois plus avec 10 % d’acétate d’éthyle dans hexanes. Recueillir le filtrat et enlever le solvant évaporateur rotatif pour obtenir de la vanilline sous forme de solide blanc.
- Calculer le rendement en pourcentage de la vanilline obtenue et d’établir son identité par le point de fusion (m.p) et 1H RMN et la pureté.
Résultats
La vanilline a été obtenue sous forme de solide blanc (150 mg, rendement 76 %) ; m.p. 76-79 ° C ; 1 H RMN (400 MHz, CDCl3) δ 9,82 (br s, 1 H), 7.43-7.41 (m, 2 H), 7.04 (d, J = 8,8 Hz, 1 H), 6 h 30 (s, 1 H), 3,96 (s, 3 H).
Applications et Résumé
Dans cette expérience, nous avons démontré la synthèse de la vanilline d’isoeugénol en utilisant la réaction d’ozonolyse. En outre, en utilisant un générateur d’ozone tout en effectuant une réaction basse température a été montré.
Ozonolyse est une réaction utile pour préparer des aldéhydes, cétones et acides carboxyliques partir d’alcènes. Il a été appliqué dans la synthèse de produits naturels et de la préparation industrielle de produits pharmaceutiques. L’artémisinine est un puissant agent antipaludéen et fut l’un des produits naturels reconnus dans le 2015 prix Nobel en médecine. Dans une synthèse de 10 étapes de (R)-(+) - pulégone, ozonolyse a été utilisé dans la dernière étape pour rendre le produit naturel (Figure 5). Ceftibuten et cefaclor sont antibiotiques céphalosporines produits à échelle industrielle. Une route commerciale utilise ozonolyse pour accéder à un intermédiaire clé commun, qui peut être élaboré à deux composés (Figure 6).

Figure 5 . Schéma montrant l’ozonolyse comme la dernière étape dans une synthèse de l’artémisinine.
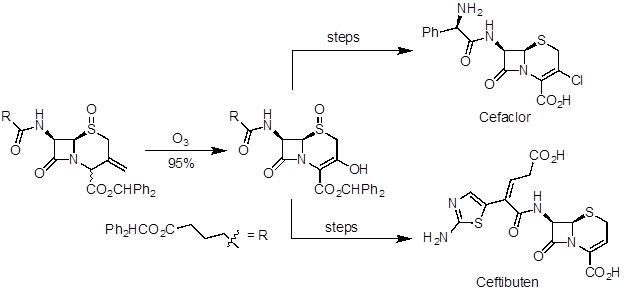
Figure 6 . Schéma montrant l’ozonolyse pour préparer une clé intermédiaire dans la synthèse divergente du cefaclor et ceftibuten.
Passer à...
Vidéos de cette collection:

Now Playing
Ozonolyse des alcènes
Organic Chemistry II
67.1K Vues

Nettoyage de la verrerie
Organic Chemistry II
123.9K Vues

Substitution nucléophile
Organic Chemistry II
99.6K Vues

Agents reducteurs
Organic Chemistry II
43.2K Vues

Réaction de Grignard
Organic Chemistry II
149.2K Vues

Titrage du n-butyllithium
Organic Chemistry II
48.1K Vues

Appareil de Dean-Stark
Organic Chemistry II
100.6K Vues

Organocatalyse
Organic Chemistry II
16.9K Vues

Réaction de couplage catalysé au palladium
Organic Chemistry II
34.6K Vues

Synthèse en phase solide
Organic Chemistry II
41.2K Vues

Hydrogénation
Organic Chemistry II
49.7K Vues

Polymérisation
Organic Chemistry II
94.6K Vues

Point de fusion
Organic Chemistry II
150.0K Vues

Spectroscopie infrarouge
Organic Chemistry II
215.9K Vues

Polarimètre
Organic Chemistry II
100.2K Vues