Détermination des règles de solubilité des composés ioniques
Vue d'ensemble
Source : Laboratoire du Dr Neal Abrams — SUNY College of Environmental Science and Forestry
Solubilité d’un composé ionique peut être déterminée par une analyse qualitative. L’approche qualitative est une branche de la chimie analytique qui utilise les propriétés chimiques et réactions afin d’identifier les cations ou anions présent dans un composé chimique. Alors que les réactions chimiques s’appuient sur les règles de solubilité connue, ces mêmes règles peuvent être déterminés en identifiant les produits qui se forment. Analyse qualitative n’est pas généralement effectuée dans les laboratoires de chimie industrielle moderne, mais il peut être facilement utilisé dans le domaine sans recourir à des instruments sophistiqués. Analyse qualitative se concentre également sur la compréhension des réactions ioniques ioniques et nettes comme organisation des données dans un diagramme pour expliquer les observations et faire des conclusions définitives.
Nombreux cations ont des propriétés chimiques semblables, ainsi que les homologues de l’anion. Identification correcte nécessite attention séparation et analyse systématiquement identifier les ions présents dans une solution. Il est important de comprendre les propriétés acide/base, équilibres ioniques, réactions rédox et pH propriétés pour identifier les ions avec succès.
Bien qu’il y a un test qualitatif pour pratiquement chaque ion polyatomique élémentaire, le processus d’identification commence généralement par connaître une « classe » d’ions analysés ; les cations ou anions, élémentaires ou polyatomiques, groupes ou périodes, transition ou groupe principal. Dans cette expérience, les deux types d’ions, cations et anions sont identifiés. Les cations comprennent aussi bien des ions polyatomiques.
Principles
Identification des cations et des anions est issu des réactions chimiques connues entre l’ion inconnue et réactif. Parfois, il peut être l’absence d’une réaction qui identifie formellement l’ion ainsi. Tous les composés ioniques sont composées d’un cation et un anion, et lorsqu’une réaction se produit entre deux différents composés ioniques, le cation d’un composé est électrostatiquement attirées par l’anion de l’autre, formant un composé ionique nouvel. (Remarque : certains composés ioniques uniques ont un ou plusieurs cations, ou ions. Un exemple serait le KNaC4H4O6 ou (NH4)2Fe (SO4)2. La charge globale du composé ionique doit toujours la somme à zéro) Ce type de réaction est connu comme une réaction de métathèse ou double déplacement et il est indiqué ci-dessous :
w AB(aq) + xCD(aq)→yannonce(s) + zCB(aq)
réaction moléculaire
où A et C sont réactifs cation, B et D sont des réactifs de l’anion, et les composés sont dans des proportions molaires w et x, respectivement. La même suit pour les produits AD(s) et CB(aq) avec des rapports molaires de y et z. Lorsqu’une réaction a lieu en solution aqueuse, la réaction moléculaire peut être écrit comme une combinaison d’ions libres et insolubles produits connus comme une réaction ionique :
A + (aq) + B–(aq) +(aq) de la C++ D–(aq) →AD(s) + B–(aq) + C+(aq)
réaction ionique
Une réaction ionique montre les deux ions impliqués dans la réaction ainsi que ceux qui ne participent pas, appelées ions spectateur. La formation du produit insoluble annonce(s) identifie les ions qui réagissent ou pourrait être utilisée pour déterminer une règle de solubilité de ces ions. Dans tous les cas, une réaction ionique nette sous-tend toutes les observations, ce qui est une forme simplifiée de la réaction ionique et montre seulement les ions impliqués dans la réaction.
Un+(aq) + D–(aq)→ annonce(s)
réaction ionique nette
Observant une réaction chimique produisant un produit insoluble, ou précipité, est un marqueur pour les participants d’une nette réaction ionique.
Les réactions peuvent être propres à un certain cations ou anions, ou commune à tous les ions au sein d’un groupe ou une classe de réactifs. Par exemple, tous les ions de métaux de transition réagit avec l’ion sulfure, S2 -, à forme insoluble précipite. Beaucoup de métaux alcalino-terreux forme des précipités blanches en présence d’ions carbonate et phosphate. Des analyses d’identification plus sélectifs peuvent être effectuées avec des solutions mixtes grâce à une combinaison de règles de solubilité et de la réactivité chimique. Par exemple, une solution contenant du zinc, argent, nickel et fer puisse être séparée selon l’organigramme de la Figure 1. Le chlorure est tout d’abord ajouté à la solution, précipitant dehors, chlorure d’argent AgCl. Les autres métaux sont hydroxyde précipités dans tous les, avec excès d’hydroxyde de re-dissoudre le zinc. Le zinc est confirmé en présence de potassium hexacyanoferrate, formant un précipité vert. Les précipités de fer et de nickel restantes sont collectées et excès d’ammoniac est ajouté pour dissoudre le nickel et le fer massif complex est recueilli. Le fer est re-dissous en présence d’acide et confirmé avec l’ion thiocyanate. Nickel est formellement identifié en ajoutant la diméthylglyoxime, formant un précipité rougeâtre solide.
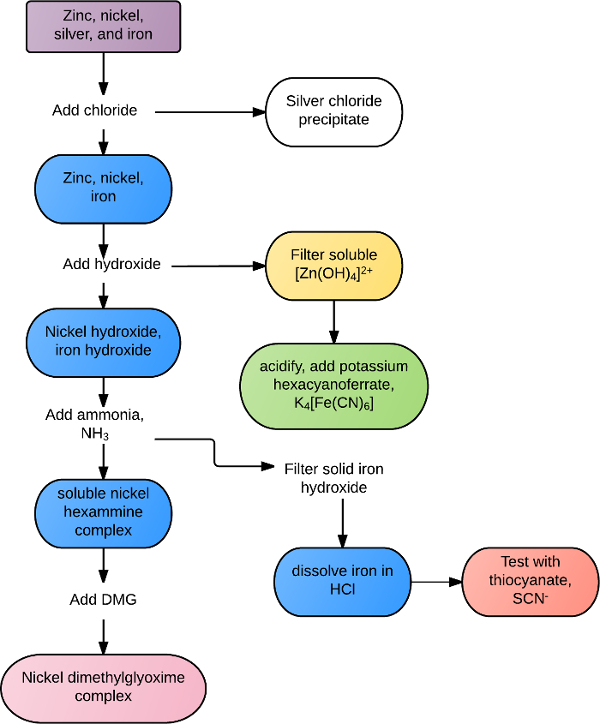
La figure 1. Organigramme d’exemple de la séparation de la solution.
Procédure
1. méthodes générales
- Préparation pour l’analyse Qualitative
- Les réactions se font généralement dans des petites éprouvettes avec volume de 5 mL ou moins.
- Les solutions doivent être entièrement soluble et devraient être relativement diluer, typiquement ~0.1 M.
- Réactifs doivent être lentement ajoutés goutte-à-goutte et observés attentivement.
- Plusieurs communes « des solutions de test » est nécessaires pour établir des règles de solubilité ou identifier un ion inconnu. Ces documents contiennent des ions qui réagissent spécifiquement avec certaines espèces chimiques (cations ou anions).
- Des solutions communes incluent CaNO3, BaCl2, (NH4)2MoO4, HCl, AgNO3et NaOH et autres solutions comme nécessaire.
- Mélange
- Mélanger les solutions en touchant ou en agitant le tube à essai dans le sens vertical. Utilisez un bouchon ou un bouchon pour éviter les éclaboussures de la solution.
- Enlever le bouchon ou le bouchon, puis chauffer doucement les solutions avec un bain d’eau ou la flamme cool pour induire une réaction. Point le tube à essai loin de tout individu dans le laboratoire.
- Observation et récupération
- Séparer le surnageant (solution non réactif) et précipiter par centrifugation. Si plus précipitent des formes quand ion essai supplémentaire est ajoutée, la réaction est incomplète. Continuez à ajouter ion de test jusqu'à ce qu’aucuns plus ne précipitent les formes.
- Laver le précipité à l’aide de centrifugation et de coulée ou de décantation hors le surnageant. Ajouter de l’eau et répétez l’opération pour un total de trois lavages.
- Laver de grandes quantités de précipité de filtration sous vide et récupérer le précipité séché le papier filtre.
- Remarque la formation d’un précipité ainsi que les propriétés du précipité comme la couleur, l’épaisseur (gélatineux, nuageux, fine) et formation de cristaux.
- Sécurité et déchets
- Portez toujours des lunettes de sécurité lors de l’exécution d’une analyse qualitative des expériences. Gants peuvent également être nécessaires basée sur les réactifs et les produits formés.
- Méthodes d’élimination des déchets appropriée doivent être suivies de près. Produits nocifs peuvent se former lorsque plusieurs réactifs sont combinés dans un récipient.
2. analyse de l’anion
- Identifier le phosphate, le carbonate, chlorure et des ions sulfure ; PO43 -, CO32 -, Cl-, S2-
- Phosphate
- Ajouter une solution contenant du phosphate, PO43 -, une autre solution contenant des ions de calcium, Ca2 +. La formation d’un précipité blanc indique la formation de phosphate de calcium, Ca3(PO4)2.
- Puisque de nombreux cations forment des produits insolubles avec calcium, une réaction plus précise est possible. Ajouter H+ (acide) à Ca3(PO4)2 pour dissoudre le solide et former HPO42 -. Combinez alors le HPO42 - avec molybdate d’ammonium (NH4)2MoO4. Un test positif donne l’ammonium précipité jaune de phosphomolybdate, NH4)3PO4(MoO3)12(s). Les réactions ioniques nettes sont comme suit :
3 Ca2 +(aq) + 2 PO43 -(aq) → Ca3PO4(s)
Ca3PO4(s) + 2 H+(aq) → 3 Ca2 + + 2 HPO42–(aq)
HPO4 2- (aq) + 12 (NH4)2MoO4(aq) + 23 H+(aq) → (NH4)3PO4 (MoO3)12(s) + 21 NH4+(aq) + 12 H2O(l)
- Carbonate de
- Sels de carbonate sont généralement insolubles sauf en présence de cations de groupe 1 et de l’ammonium. Ajoutez quelques gouttes de chlorure de calcium CaCl2, à la solution contenant du carbonate. Dans les solutions avec des concentrations élevées de carbonate, un blanc précipitent formes et indique une possible formation de phosphate de calcium CaCO3. La réaction a de nombreuses interférences, y compris les autres anions comme phosphate.
Ca2 +(aq) + CO32 -(aq) → CaCO3(s) - Ajoutez H+ (acide) à une solution contenant du carbonate, CO3-2. La formation de bulles indique la présence de CO2, ce qui signifie3CO2 - comme réactifs. Ion carbonate se comporte comme une base en présence d’un acide fort à l’eau et de gaz carbonique de forme.
3CO2-(aq) + H+(aq) → CO2(g) + H2O(l)
- Sels de carbonate sont généralement insolubles sauf en présence de cations de groupe 1 et de l’ammonium. Ajoutez quelques gouttes de chlorure de calcium CaCl2, à la solution contenant du carbonate. Dans les solutions avec des concentrations élevées de carbonate, un blanc précipitent formes et indique une possible formation de phosphate de calcium CaCO3. La réaction a de nombreuses interférences, y compris les autres anions comme phosphate.
- Chlorure de
- Nitrate d’argent s’ajoute une solution contenant du chlorure. La formation d’un précipité blanc indique la formation de AgCl(s):
AG+(aq) + Cl–(aq) → AgCl(s)
- Nitrate d’argent s’ajoute une solution contenant du chlorure. La formation d’un précipité blanc indique la formation de AgCl(s):
- Sulfure de
- Ajouter une solution de chlorure de cuivre à une solution contenant du sulfure. La formation d’un précipité noir indique la formation de sulfure de cuivre, CuS. En général, les solutions contenant des ions sulfure, S2 -, réagissent avec des ions métalliques pour donner un sulfures métalliques insolubles.
S2 - + Cu2 + → CuS(s).
La valeur du produit de solubilité, Ksp = 6,3 x 10-36, indique le haut degré d’insolubilité du produit.
- Ajouter une solution de chlorure de cuivre à une solution contenant du sulfure. La formation d’un précipité noir indique la formation de sulfure de cuivre, CuS. En général, les solutions contenant des ions sulfure, S2 -, réagissent avec des ions métalliques pour donner un sulfures métalliques insolubles.
- Phosphate
3. analyse de cations
- Alcali tous les métaux (groupe 1) et certains métaux alcalino-terreux (groupe 2) est solubles, sauf dans des conditions spécifiques.
- Groupe de presque tous les 3 – 13 métaux sont considérés comme insolubles en présence de sulfure, carbonate, phosphate et hydroxyde. La couleur et le type du précipité variera.
- Place une solution dans une solution d’hydroxyde de chrome. On observe un précipité vert. La réaction générale d’un métal + 2 avec un hydroxyde est illustrée ci-dessous :
M2 + + OH– → M(OH)2(s) - Il n’est pas possible de différencier des ions métalliques plus basées sur la solubilité seule avec quelques exceptions notables :
- L’ajout d’argent, Ag+, mercure, Hg2+ 2ou plomb, Pb2 + au chlorure, bromure ou iodure conduit à la formation précipitée.
- L’addition de strontium, Sr2 +, baryum, Ba2 +, mercure, Hg22 +ou plomb, Pb2 + entraîne un précipité en présence de sulfate.
- BA2 + forme un solide jaune en présence de CrO4-2, BaCrO4(s). Il s’agit du pigment utilisé dans la peinture à base d’huile, communément appelé « baryum jaune ».
- Place une solution dans une solution d’hydroxyde de chrome. On observe un précipité vert. La réaction générale d’un métal + 2 avec un hydroxyde est illustrée ci-dessous :
- Limité l' insolubilité des ions métalliques permettant d’autres tests qualitatifs d’identifier avec certitude de chaque métal. Tandis que certaine forme de précipités, d’autres subissent des changements de couleur unique en présence de chélation des ions ou des molécules. Identifications de cation comprennent nickel, fer, aluminium et zinc ; Ni2 +, Fe3 +, Al3 +, Zn2 +.
- Ajouter nickel (II) en présence de la diméthylglyoxime (H2dmg) pour former la rose-rouge précipité Ni (dmg de2H) :
Ni2 +(aq) + 2 H2dmg(aq) → Ni(Hdmg)2(s) + 2 H+(aq) - Fer (III) s’ajoute l’ion thiocyanate, RCS– pour former le rouge sang [FeNCS]2 +] complexe :
Fe3 +(aq) + RCS–(aq) → [FeNCS]2 +(aq) - Ion aluminium
- Combiner en aluminium (III) avec pyrocatéchol violet dans une solution pH du tampon d’acétate d’ammonium 6 pour former une solution bleue.
- Aluminium (III) est également précipité en présence d’une base faible pour former le blanc gélatineux Al(OH)3(s) composé. L’addition de plus base provoque le composé pour former la limpide et incolore [Al(OH)4]–(aq) complexe soluble.
- Ions de zinc
- Ajoute une petite quantité de base pour former un précipité blanc de zinc (II). Ajoutez ensuite une base plus pour re-dissoudre le précipité et former le soluble [Zn(OH)4]2 - complexe.
- Ajouter zinc (II) de potassium hexacyanoferrate, K4[Fe(CN)6] pour former la lumière verte précipitée K2Zn3[Fe(CN)6]2(s) :
3 Zn2 +(aq) + 2 K4[Fe(CN)6](aq) → K2Zn3[Fe(CN)6]2(s) + 6 K+(aq)
- Ajouter nickel (II) en présence de la diméthylglyoxime (H2dmg) pour former la rose-rouge précipité Ni (dmg de2H) :
Applications et Résumé
Les réactions ci-dessous peuvent être utilisées pour identifier la présence d’une classe de cations ou anions ou être utilisé très spécifiquement pour un certain ion. Parce que les deux réactifs sont utilisés dans les analyses, soit réactif est généralement détectable à l’aide de l’autre. Par exemple, au lieu d’analyser la présence de chlorure à l’aide d’ions d’argent, les ions d’argent peuvent être identifiées en utilisant du chlorure. Une combinaison de règles communes des précipitations suivie de tests colorimétriques ou précipitations spécifiques permet d’identifier avec certitude presque chaque ion, atomique ou polyatomique, disponible. Dans le même temps, la plupart de ces mêmes règles peut être établie par réaction entre anions et cations ensemble systématiquement pour générer un ensemble de règles pour le cation et l’anion solubilité.
Analyse qualitative et la règle relies à la solubilité est des expériences communes dans le laboratoire de chimie générale. Cela est dû, en partie, à la facilité, la vitesse et la nature peu coûteux des tests. C’est pour toutes ces raisons que les tests qualitatifs sont également utilisées dans les analyses sur le terrain et de laboratoire de confirmation des tests. Par exemple, un cabinet de géologie souhaitera savoir si des quantités importantes de nickel existent dans le ruissellement des cours d’eau d’une mine. Un test simple en ajoutant de l’eau à dimethylgloxime est sélectif pour l’ion nickel. De même, les autorités de la qualité de l’eau peuvent utiliser baryum (ou certains autres métaux du groupe 2) pour détecter les carbonates dans l’eau, donc de détecter le niveau de dureté de l’eau. Instrumentation avancée est utilisée, cependant, lorsque quantitative des résultats sont nécessaires ou plusieurs ions doivent être identifiés à des niveaux très bas. Cela inclut diverses formes de spectroscopie de masse ainsi que la chromatographie ionique et spectroscopie lumineuse.
References
- Eaton, A. Standard Methods for the Examination of Water & Wastewater. Centennial ed. Washington, DC: American Public Health Association (2005).
Passer à...
Vidéos de cette collection:

Now Playing
Détermination des règles de solubilité des composés ioniques
General Chemistry
141.3K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
655.5K Vues

Solutions et Concentrations
General Chemistry
273.8K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
555.7K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.3K Vues

Déterminer la formule empirique
General Chemistry
180.8K Vues

Utiliser un pH-mètre
General Chemistry
345.2K Vues

Introduction au titrage
General Chemistry
424.0K Vues

Loi des gaz parfaits
General Chemistry
78.3K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.3K Vues

Principe de Le Châtelier
General Chemistry
264.9K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.6K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
195.9K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.4K Vues

Complexes de coordination
General Chemistry
91.3K Vues