קביעת כללי המסיסות של תרכובות יוניות
Overview
מקור: המעבדה של ד"ר ניל אברמס — מכללת SUNY למדעי הסביבה ויערנות
מסיסות של תרכובת יונית ניתן לקבוע באמצעות ניתוח איכותי. ניתוח איכותי הוא ענף של כימיה אנליטית המשתמשת בתכונות כימיות ותגובות כדי לזהות את הקטיון או האניון הקיימים בתרכובת כימית. בעוד התגובות הכימיות מסתמכות על כללי מסיסות ידועים, אותם כללים יכולים להיקבע על ידי זיהוי המוצרים שנוצרים. ניתוח איכותי אינו נעשה בדרך כלל במעבדות כימיה תעשייתיות מודרניות, אך ניתן להשתמש בו בקלות בתחום ללא צורך במכשור מתוחכם. ניתוח איכותי מתמקד גם בהבנת תגובות יוניות ויוניות נטו, כמו גם בארגון נתונים לתרשים זרימה כדי להסביר תצפיות ולהסיק מסקנות סופיות.
לציטוטים רבים יש תכונות כימיות דומות, כמו גם עמיתיו אניון. זיהוי נכון דורש הפרדה וניתוח זהירים כדי לזהות באופן שיטתי את היונים הקיימים בפתרון. חשוב להבין תכונות חומצה/בסיס, שיווי משקל יוני, תגובות redox, תכונות pH כדי לזהות יונים בהצלחה.
אמנם יש מבחן איכותי כמעט לכל יונים אלמנטריים ופוליאטומיים, אך תהליך הזיהוי מתחיל בדרך כלל בהכרת "מחלקה" של יונים מנותחים; cations או אניונים, אלמנטים או פוליאטומיים, קבוצות או תקופות, מעבר או קבוצה ראשית. בניסוי זה, שני סוגי היונים, הסיוציות והאניונים מזוהים. הציטוטים כוללים גם יונים פוליאטומיים.
Principles
זיהוי ציטוטים ואניונים מבוסס על תגובות כימיות ידועות בין היון הלא ידוע לבין המגיב הנתון. לפעמים, זה יכול להיות חוסר תגובה המזהה באופן חיובי את היון גם כן. כל התרכובות היוניות מורכבות קטיון ואניון, וכאשר מתרחשת תגובה בין שתי תרכובות יוניות שונות, הקציה של תרכובת אחת נמשכת אלקטרוסטטית לאניון של אחר, ויוצרת תרכובת יונית חדשה. (הערה: כמה תרכובות יוניות ייחודיות יש אחד או יותר cations או יונים. דוגמה לכך היא KNaC4H4O6 או (NH4)2Fe (SO4)2. החיוב הכולל של המתחם היוני עדיין חייב להסתכם לאפס.) סוג זה של תגובה ידוע בשם metathesis, או תזוזה כפולה, תגובה והוא מוצג להלן:
w AB(aq) + xCD(aq)→yAD(s) + zCB(aq)
תגובה מולקולרית
כאשר A ו- C הם מגיבים cation, B ו- D הם מגיבים אניון, ואת התרכובות הם בפרופורציות טוחנות w ו- x, בהתאמה. כך גם לגבי מוצרים AD(ים) ו- CB(aq) עם יחסי ים ו- z. כאשר מתרחשת תגובה בתמיסה מימית, התגובה המולקולרית יכולה להיכתב כשילוב של יונים חופשיים ומוצרים בלתי מסיסים המכונים תגובה יונית:
A+(aq) + B-(aq) + C+(aq) + D-(aq) →AD(s) + B-(aq) + C+(aq)
תגובה יונית
תגובה יונית מראה הן את היונים המעורבים בתגובה והן את אלה שאינם משתתפים, המכונים יונים צופים. היווצרות המוצר הבלתי מסיס AD(ים) מזהה את היונים מגיבים או יכול לשמש כדי לקבוע כלל מסיסות עבור יונים אלה. בכל המקרים, תגובה יונית נטו עומדת בבסיס כל התצפיות, שהיא צורה פשוטה יותר של התגובה היונית ומראה רק את היונים המעורבים בתגובה.
A+(aq) + D-(aq)→ לספירה(ים)
תגובה יונית נטו
התבוננות בתגובה כימית המייצרת מוצר בלתי מסיס, או מזרז, היא סמן עבור המשתתפים של תגובה יונית נטו.
תגובות עשויות להיות ייחודיות לקיבוץ או אניון מסוים, או משותפות לכל היונים בתוך קבוצה או סוג של ריאגנטים. לדוגמה, כל יונים מתכת המעבר להגיב עם יון גופרתי, S2-, כדי ליצור משקעים מסיסים. מתכות אדמה אלקליין רבות יוצרות משקעים לבנים בנוכחות יונים פחמתיים או פוספטים. ניתוחי זיהוי סלקטיביים יותר יכולים להתבצע עם פתרונות מעורבים באמצעות שילוב של כללי מסיסות ותגובה כימית. לדוגמה, ניתן להפריד בין פתרון המכיל אבץ, כסף, ניקל וברזל לפי תרשים הזרימה באיור 1. כלוריד מתווסף תחילה לפתרון, ומזרז כלוריד כסף, AgCl. כל המתכות הנותרות מזורזות בהידרוקסידי, עם עודף הידרוקסיד הממיס מחדש את האבץ. האבץ מאושר בנוכחות אשלגן hexacyanoferrate, יצירת משקעים ירוקים. משקעים ברזל וניקל הנותרים נאספים אמוניה עודפת מתווספת כדי להמיס את ניקל ואת קומפלקס ברזל מוצק נאסף. הברזל מומס מחדש בנוכחות חומצה ואושר עם יון תיוצינאט. ניקל מזוהה באופן חיובי על ידי הוספת דימתילגליוקסים, יצירת משקעים אדמדמים מוצקים.
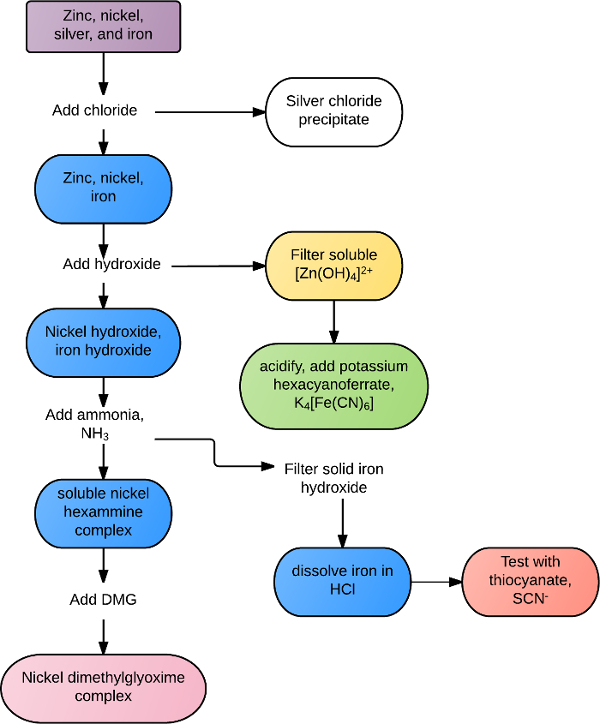
איור 1. תרשים זרימה לדוגמה של הפרדת פתרונות.
Procedure
1. שיטות כלליות
- הכנה לניתוח איכותי
- תגובות נעשות בדרך כלל במבחנות קטנות עם נפח של 5 מ"ל או פחות.
- פתרונות צריכים להיות מסיסים לחלוטין צריך להיות מדלל יחסית, בדרך כלל ~ 0.1 M.
- ריאגנטים צריכים להיות מתווספים לאט טיפה חכם ונצפו בקפידה.
- נדרשים מספר "פתרונות בדיקה" נפוצים כדי לקבוע כללי מסיסות או לזהות יון לא ידוע. אלה מכילים יונים ידוע להגיב במיוחד עם מינים כימיים מסוימים (cations או אניונים).
- פתרונות נפוצים כוללים CaNO3, BaCl2, (NH4)2MoO4, HCl, AgNO3ו- NaOH, ופתרונות אחרים לפי הצורך.
- ערבוב
- ערבבו פתרונות על ידי הקשה או מערבולת של המבחנה בכיוון אנכי. השתמש פקק או פקק כדי למנוע התזת הפתרון.
- הסר את הפקק או פקק, ולאחר מכן לחמם בעדינות את הפתרונות עם אמבט מים או להבה קרירה כדי לגרום לתגובה. כוון את המבחנה הרחק מכל אדם במעבדה.
- תצפית והתאוששות
- הפרד את הסופר-טבעי (פתרון שאינו מגיב) והיכוו באמצעות צנטריפוגה. אם טפסים נוספים של משקעים בעת הוספת יון בדיקה נוסף, התגובה אינה שלמה. המשך להוסיף יון בדיקה עד שלא ייווצרו עוד טפסים מזרזים.
- לשטוף את המשקעים באמצעות צנטריפוגה ושופך או decanting את supernatant. מוסיפים עוד מים וחוזרים על התהליך בסך הכל שלוש כביסות.
- לשטוף כמויות גדולות של משקעים על ידי סינון ואקום לשחזר את המשקעים היבשים מנייר המסנן.
- שים לב להיווצרות של משקעים, כמו גם את המאפיינים של המשקעים כגון צבע, עובי (ג'לטיני, מעונן, עדין), היווצרות קריסטל.
- בטיחות ופסולת
- תמיד ללבוש משקפי בטיחות בעת ביצוע ניסויי ניתוח איכותי. כפפות עשויות להיות נחוצות גם על סמך ריאגנטים בשימוש ומוצרים שנוצרו.
- יש לעקוב מקרוב אחר שיטות פינוי פסולת נאותות. ניתן ליצור מוצרים מזיקים כאשר מגיבים מרובים משולבים במיכל אחד.
2. ניתוח אניון
- זיהוי יונים פוספט, קרבונט, כלוריד וגופרית; PO43-, CO32-, Cl-, S2-
- פוספט
- הוסף פתרון המכיל פוספט, PO43-, לפתרון אחר המכיל יוני סידן, Ca2 +. היווצרות של משקעים לבנים מצביעה על היווצרות של סידן פוספט, Ca3(PO4)2.
- מאז cations רבים ליצור מוצרים מסיסים עם סידן, תגובה ספציפית יותר אפשרית. הוסף H+ (חומצה) ל Ca3(PO4)2 כדי להמיס את מוצק וליצור HPO42-. לאחר מכן שלב את HPO42- עם אמוניום מוליבאדאט, (NH4)2MoO4. בדיקה חיובית מניבה את אמוניום פוספומוליבטט משקעים צהוב, NH4)3PO4(MoO3)12(ים). התגובות היוניות נטו הן כדלקמן:
3 Ca2+(aq) + 2 PO43-(aq) → Ca 3PO4(ים)
Ca3PO4(ים) + 2 H+(aq) → 3 Ca2 + + 2 HPO42- (aq)
HPO4 2-(aq) + 12 (NH4)2MoO4(aq) + 23 H+(aq) → (NH4)3PO4 (MoO3)12(ים) + 21 NH4+(aq) + 12 H2O(l)
- פחמתי
- מלחי קרבונט הם בדרך כלל מסיסים למעט בנוכחות קבוצה 1 ו cations אמוניום. הוסף כמה טיפות של סידן כלוריד, CaCl2, לפתרון המכיל פחמתי. בפתרונות עם ריכוזי פחמתיים גבוהים, נוצר משקעים לבנים ומציין היווצרות אפשרית של סידן פוספט, CaCO3. לתגובה יש הפרעות רבות, כולל אניונים אחרים כמו פוספט.
Ca2+(aq) + CO3 2-(aq) → CaCO3(ים) - הוסף H+ (חומצה) לפתרון המכיל קרבונט, CO32-. היווצרות של בועות מצביעה על נוכחות של CO2, המסמל CO32- כמגיב. יון פחמתי מתנהג כבסיס בנוכחות חומצה חזקה ליצירת גז ומים דו תחמוצת הפחמן.
CO32-(aq) + H+(aq) → CO2(ז) + H2O(l)
- מלחי קרבונט הם בדרך כלל מסיסים למעט בנוכחות קבוצה 1 ו cations אמוניום. הוסף כמה טיפות של סידן כלוריד, CaCl2, לפתרון המכיל פחמתי. בפתרונות עם ריכוזי פחמתיים גבוהים, נוצר משקעים לבנים ומציין היווצרות אפשרית של סידן פוספט, CaCO3. לתגובה יש הפרעות רבות, כולל אניונים אחרים כמו פוספט.
- כלוריד
- הוסף כסף חנקתי לתמיסה המכילה כלוריד. היווצרות של משקעים לבנים מצביעה על היווצרות של AgCl(ים):
Ag+(aq) + Cl-(aq) → AgCl(ים)
- הוסף כסף חנקתי לתמיסה המכילה כלוריד. היווצרות של משקעים לבנים מצביעה על היווצרות של AgCl(ים):
- גופרתי
- הוסף תמיסה נחושת כלורית לפתרון המכיל גופרתי. היווצרות של משקעים שחורים מצביעה על היווצרות של גופרית נחושת, CuS. באופן כללי, פתרונות המכילים יונים גופרתיים, S2-, מגיבים עם יונים מתכת להניב גופרית מתכת מסיס.
S2- + Cu2 + → CuS(ים).
הערך של מוצר המסיסות, Ksp = 6.3 x 10-36, מציין את המידה הגבוהה של אי-יכולת האצילות של המוצר.
- הוסף תמיסה נחושת כלורית לפתרון המכיל גופרתי. היווצרות של משקעים שחורים מצביעה על היווצרות של גופרית נחושת, CuS. באופן כללי, פתרונות המכילים יונים גופרתיים, S2-, מגיבים עם יונים מתכת להניב גופרית מתכת מסיס.
- פוספט
3. ניתוח Cation
- כל המתכות האלקליות (קבוצה 1) וכמה מתכות אדמה אלקליין (קבוצה 2) מסיסות למעט בתנאים ספציפיים.
- כמעט כל מתכות קבוצה 3-13 נחשבים מסיסים בנוכחות גופרתי, קרבונט, פוספט, הידרוקסיד. הצבע וסוג המשקעים ישתנו.
- מניחים תמיסת כרום בתמיסת הידרוקסיד. משקעים ירוקים יצפו. התגובה הכללית של מתכת +2 עם הידרוקסיד מוצגת להלן:
M2+ + OH- → M(OH)2(ים) - לא ניתן להבדיל בין רוב יונים מתכת מבוסס על מסיסות לבד עם כמה יוצאים מן הכלל בולטים:
- התוספת של כסף, Ag+, כספית, Hg22 +, או עופרת, Pb2 + לכלוריד, ברומיד או יודיד תוצאות היווצרות משקעים.
- התוספת של סטרונציום, האב2+, בריום, Ba2 +, כספית, Hg2+, או עופרת, Pb2 + גורמת למזרז בנוכחות סולפט.
- Ba2+ יוצר מוצק צהוב בנוכחות CrO42-, BaCrO4(s). זהו פיגמנט המשמש צבע על בסיס שמן הידוע בכינויו "צהוב בריום".
- מניחים תמיסת כרום בתמיסת הידרוקסיד. משקעים ירוקים יצפו. התגובה הכללית של מתכת +2 עם הידרוקסיד מוצגת להלן:
- אי-מסיסות מוגבלת של יונים ממתכת מאפשרת בדיקות איכותיות אחרות לזהות באופן חיובי כל מתכת. בעוד כמה טופס משקעים, אחרים עוברים שינויי צבע ייחודיים בנוכחות יונים או מולקולות כלאט. זיהויי Cation כוללים ניקל, ברזל, אלומיניום ואבץ; Ni2+, Fe3 +, Al3 +, Zn2 +.
- הוסף ניקל (II) בנוכחות דימתילגליוקסים (H2dmg) כדי ליצור את מ המשקעים ורד אדום Ni(H2dmg):
Ni2+(aq) + 2 H2dmg(aq) → Ni(Hdmg)2(s) + 2 H+(aq) - הוסף ברזל (III) כדי יון thiocyanate, SCN- כדי ליצור את הדם אדום [FeNCS]2 +] קומפלקס:
Fe3+(aq) + SCN-(aq) → [FeNCS]2+(aq) - אלומיניום יון
- שלבו אלומיניום (III) עם סיגלית פירוקטקול בתמיסת חיץ אצטט אמוניום pH 6 ליצירת פתרון כחול.
- אלומיניום (III) הוא גם זידר בנוכחות בסיס חלש כדי ליצור את אל(OH)3(s) תרכובת ג'לטינית-לבן. תוספת של בסיס נוסף גורמת לתרכובת ליצור את המתחם ברור וחסר צבע [Al(OH)4]-(aq) מסיס.
- אבץ יון
- הוסיפו אבץ (II) לכמות קטנה של בסיס כדי ליצור משקעים לבנים. לאחר מכן להוסיף בסיס נוסף כדי להמיס מחדש את המשקעים וליצור את מסיס [Zn(OH)4]2- מורכב.
- הוסף אבץ (II) אשלגן hexacyanoferrate, K4[Fe(CN)6] כדי ליצור את המשקעים הירוקים בהירים K2Zn3[Fe(CN)6]2(s):
3 Zn2+(aq) + 2 K4[Fe(CN)6](aq) → K2Zn3[Fe(CN)6]2(ים) + 6 K+(aq)
- הוסף ניקל (II) בנוכחות דימתילגליוקסים (H2dmg) כדי ליצור את מ המשקעים ורד אדום Ni(H2dmg):
Application and Summary
התגובות המוצגות כאן יכולות לשמש כדי לזהות את נוכחותו של סוג של cations או אניונים או לשמש באופן ספציפי מאוד עבור יון מסוים. מכיוון ששני ריאגנטים משמשים בניתח, ניתן לזהות ריאגנט בדרך כלל באמצעות השני. לדוגמה, במקום לנתח את נוכחותו של כלוריד באמצעות יון כסף, ניתן לזהות יון כסף באמצעות כלוריד. שילוב של כללים נפוצים של משקעים ואחריו בדיקות צבע או משקעים ספציפיות יכול לשמש כדי לזהות באופן חיובי כמעט כל יון, אטומי או פוליאטומי, זמין. יחד עם זאת, ניתן לקבוע את רוב אותם כללים על ידי תגובה אניונים ו cations יחד באופן שיטתי כדי ליצור קבוצה של כללים עבור cation ו מסיסות אניון.
ניתוח איכותי וכללים הקשורים למסיסות הם ניסויים נפוצים במעבדת הכימיה הכללית. זאת, בין היתר, בשל הקלות, המהירות והאופי הזול של הבדיקות. מסיבות אלה משמשים גם בדיקות איכותניות ניתוחים מבוססי שדה ובדיקות מעבדה מאשרות. לדוגמה, חברת גיאולוגיה עשויה לרצות לדעת אם קיימות כמויות משמעותיות של ניקל בזרמה ממכרה. בדיקה פשוטה על ידי הוספת המים דימתילגלוקסימה היא סלקטיבית עבור יון ניקל. באופן דומה, רשויות איכות המים יכולות להשתמש בבריום (או במתכות אחרות בקבוצה 2) כדי לזהות קרבונט במים, ובכך לזהות את רמת קשיות המים. מכשור מתקדם משמש, עם זאת, שבו תוצאות כמותיות נדרשות או יונים מרובים צריך להיות מזוהה ברמות נמוכות מאוד. זה כולל צורות שונות של ספקטרוסקופיית מסה, כמו גם כרומטוגרפיה יון וספקטרוסקופיה קלה.
References
- Eaton, A. Standard Methods for the Examination of Water & Wastewater. Centennial ed. Washington, DC: American Public Health Association (2005).
Skip to...
Videos from this collection:

Now Playing
קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.3K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
655.5K Views

פתרונות וריכוזים
General Chemistry
273.8K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
555.7K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.3K Views

קביעת הנוסחה האמפירית
General Chemistry
180.8K Views

שימוש במד pH
General Chemistry
345.2K Views

מבוא לתמצית
General Chemistry
424.0K Views

חוק הגז האידיאלי
General Chemistry
78.3K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.3K Views

עקרון לה שאטלייה
General Chemistry
264.9K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.6K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
195.9K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.4K Views

מתחמי כימיה של תיאום
General Chemistry
91.3K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved