Determinação das Regras de Solubilidade de Compostos Iônicos
Visão Geral
Fonte: Laboratório do Dr. Neal Abrams — SUNY College of Environmental Science and Forestry
A solubilidade de um composto iônico pode ser determinada através de análise qualitativa. A análise qualitativa é um ramo da química analítica que utiliza propriedades químicas e reações para identificar o cátion ou ânion presente em um composto químico. Embora as reações químicas dependam de regras conhecidas de solubilidade, essas mesmas regras podem ser determinadas identificando os produtos que formam. A análise qualitativa não é tipicamente feita em laboratórios modernos de química industrial, mas pode ser usada facilmente no campo sem a necessidade de instrumentação sofisticada. A análise qualitativa também se concentra na compreensão das reações iônicas e líquidas, bem como na organização de dados em um fluxograma para explicar observações e tirar conclusões definitivas.
Muitos ceations têm propriedades químicas semelhantes, assim como as contrapartes de ânion. A identificação correta requer uma separação e análise cuidadosas para identificar sistematicamente os íons presentes em uma solução. É importante entender as propriedades ácido/base, equilíbrio iônico, reações redox e propriedades de pH para identificar íons com sucesso.
Embora exista um teste qualitativo para praticamente todos os íons elementares e poliatômicos, o processo de identificação geralmente começa com o conhecimento de uma "classe" de íons sendo analisados; cations ou ânions, elementar ou poliatômico, grupos ou períodos, transição ou grupo principal. Neste experimento, são identificados os dois tipos de íons, cáations e ânions. Os ceações incluem íons poliatômicos também.
Princípios
Identificar cáations e ânions baseia-se em reações químicas conhecidas entre o íon desconhecido e dado reagente. Às vezes, pode ser a falta de uma reação que identifica positivamente o íon também. Todos os compostos iônicos são compostos de um cáção e um ânion, e quando ocorre uma reação entre dois compostos iônicos diferentes, a cáção de um composto é eletroesticamente atraída pelo ânion de outro, formando um novo composto iônico. (NOTA: Alguns compostos iônicos únicos têm um ou mais fusões ou íons. Um exemplo seria KNaC4H4O6 ou (NH4)2Fe(SO4)2. A carga global do composto iônico ainda deve somar a zero.) Este tipo de reação é conhecida como uma metatese, ou deslocamento duplo, reação e é mostrado abaixo:
w AB(aq) + xCD(aq)→yAD(s) + zCB(aq)
reação molecular
onde A e C são reagentes de cáção, B e D são reagentes de ânion, e os compostos estão em proporções molar w e x, respectivamente. O mesmo segue para os produtos AD(s) e CB(aq) com relações molar de y e z. Quando uma reação ocorre em solução aquosa, a reação molecular pode ser escrita como uma combinação de íons livres e produtos insolúveis conhecidos como uma reação iônica:
A+(aq) + B-(aq) + C+(aq) + D-(aq) →AD(s) + B-(aq) + C+(aq)
reação iônica
Uma reação iônica mostra tanto os íons envolvidos na reação quanto aqueles que não participam, conhecidos como íons espectadores. A formação do produto insolúvel AD(s) identifica os íons de reação ou pode ser usada para determinar uma regra de solubilidade para esses íons. Em todos os casos, uma reação iônica líquida está por trás de todas as observações, que é uma forma simplificada da reação iônica e mostra apenas os íons envolvidos na reação.
A+(aq) + D-(aq)→ AD(s)
reação iônica líquida
Observar uma reação química produzindo um produto insolúvel, ou precipitado, é um marcador para os participantes de uma reação iônica líquida.
As reações podem ser únicas a um certo cation ou ânion, ou comuns a todos os íons dentro de um grupo ou classe de reagentes. Por exemplo, todos os íons metálicos de transição reagem com o íon sulfeto, S2-, para formar precipitados insolúveis. Muitos metais alcalinos formam precipitados brancos na presença de íons de carbonato ou fosfato. Análises de identificação mais seletivas podem ser realizadas com soluções mistas através de uma combinação de regras de solubilidade e reatividade química. Por exemplo, uma solução contendo zinco, prata, níquel e ferro poderia ser separada de acordo com o fluxograma na Figura 1. Cloreto é adicionado pela primeira vez à solução, precipitando cloreto de prata, C.I.C.. Os metais restantes são todos precipitados em hidróxido, com o excesso de hidróxido se dissolvendo o zinco. O zinco é confirmado na presença de hexacitanoferato de potássio, formando um precipitado verde. Os precipitados restantes de ferro e níquel são coletados e o excesso de amônia é adicionado para dissolver o níquel e o complexo de ferro sólido é coletado. O ferro é re-dissolvido na presença de ácido e confirmado com íon tiocianato. O níquel é identificado positivamente adicionando dimetilglyoxime, formando um precipitado avermelhado sólido.
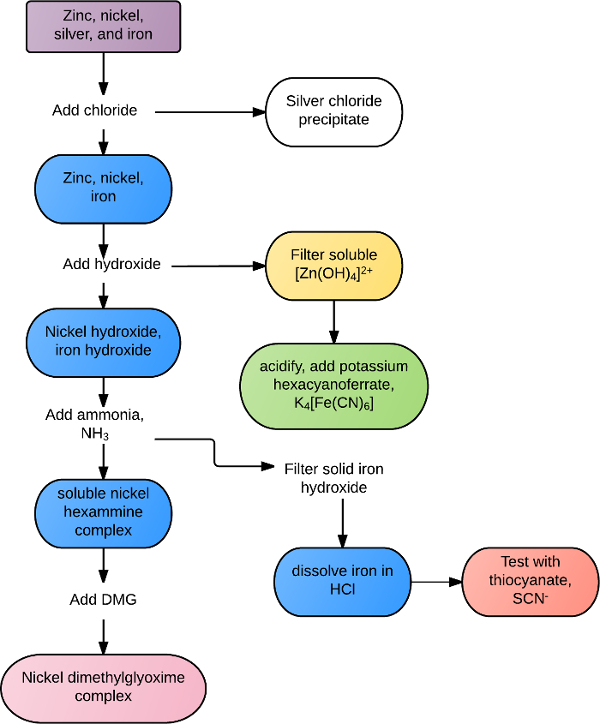
Figura 1. Fluxograma de exemplo de separação de soluções.
Procedimento
1. Métodos Gerais
- Preparação para análise qualitativa
- As reações são geralmente feitas em pequenos tubos de ensaio com volume de 5 mL ou menos.
- As soluções precisam ser totalmente solúveis e devem ser relativamente diluídas, tipicamente ~0,1 M.
- Os reagentes devem ser adicionados lentamente em termos de gota e observados cuidadosamente.
- Várias "soluções de teste" comuns são necessárias para estabelecer regras de solubilidade ou identificar um íon desconhecido. Estes contêm íons conhecidos por reagir especificamente com determinadas espécies químicas (álções ou ânions).
- As soluções comuns incluem CaNO3, BaCl2, (NH4)2MoO4, HCl, AgNO3e NaOH, e outras soluções conforme necessário.
- Mistura
- Misture as soluções tocando ou rodando o tubo de ensaio em uma direção vertical. Use uma rolha ou rolha para evitar espirrar a solução.
- Remova a rolha ou rolha, em seguida, aqueça suavemente as soluções com um banho de água ou chama fria para induzir uma reação. Aponte o tubo de ensaio para longe de qualquer indivíduo no laboratório.
- Observação e Recuperação
- Separe a supernasce (solução não reagidora) e precipitar usando centrífugação. Se mais formas precipitadas quando o íon de teste adicional for adicionado, a reação será incompleta. Continue adicionando íon de teste até que não haja mais forma precipitada.
- Lave o precipitado usando centrífugas e derramando ou decantando o supernatante. Adicione mais água e repita o processo para um total de três lavagens.
- Lave grandes quantidades de precipitação por filtragem a vácuo e recupere o precipitado seco do papel filtro.
- Note a formação de um precipitado, bem como as propriedades do precipitado, como cor, espessura (gelatinosa, nublado, fina) e formação de cristais.
- Segurança e Desperdício
- Use sempre óculos de segurança durante a realização de experimentos de análise qualitativa. Luvas também podem ser necessárias com base nos reagentes utilizados e produtos formados.
- Os métodos adequados de eliminação de resíduos devem ser acompanhados de perto. Produtos nocivos podem ser formados quando vários reagentes são combinados em um recipiente.
2. Análise de Ânion
- Identificação de íons fosfato, carbonato, cloreto e sulfeto; PO43-,CO32-, Cl-, S2-
- Fosfato
- Adicione uma solução contendo fosfato, PO43-, a outra solução contendo íons de cálcio, Ca2+. A formação de um precipitado branco indica a formação de fosfato de cálcio, Ca3(PO4)2.
- Como muitos ceações formam produtos insolúveis com cálcio, uma reação mais específica é possível. Adicione H+ (ácido) ao Ca3(PO4)2 para dissolver o sólido e formar HPO42-. Em seguida, combine o HPO42- com molis de amônio, (NH4)2MoO4. Um teste positivo produz o fosfomobdate de amônio precipitado amarelo, NH4)3PO4(MoO3)12(s). As reações iônicas líquidas são as seguintes:
3 Ca2+(aq) + 2 PO43-(aq) → Ca 3PO4(s)
Ca3PO4(s) + 2 H+(aq) → 3 Ca2+ + 2 HPO42- (aq)
HPO42-(aq) + 12 (NH4)2MoO4(aq) + 23 H+(aq) → (NH4)3PO4 (MoO3)12(s) + 21 NH4+(aq) + 12 H2O(l)
- Carbonato
- Os sais carbonato são geralmente insolúveis, exceto na presença do Grupo 1 e dos cátions de amônio. Adicione algumas gotas de cloreto de cálcio, CaCl2,à solução que contém carbonato. Em soluções com altas concentrações de carbonato, um precipitado branco forma e indica a possível formação de fosfato de cálcio, CaCO3. A reação tem muitas interferências, incluindo outros ânions como fosfato.
Ca2+(aq) + CO32-(aq) → CaCO3(s) - Adicione H+ (ácido) a uma solução que contenha carbonato, CO32-. A formação de bolhas indica presença de CO2, significando CO32 - como um reagente. O íon carbonato comporta-se como uma base na presença de ácido forte para formar gás e água de dióxido de carbono.
CO32-(aq) + H+(aq) → CO2(g) + H2O(l)
- Os sais carbonato são geralmente insolúveis, exceto na presença do Grupo 1 e dos cátions de amônio. Adicione algumas gotas de cloreto de cálcio, CaCl2,à solução que contém carbonato. Em soluções com altas concentrações de carbonato, um precipitado branco forma e indica a possível formação de fosfato de cálcio, CaCO3. A reação tem muitas interferências, incluindo outros ânions como fosfato.
- Cloreto
- Adicione nitrato de prata a uma solução que contenha cloreto. A formação de um precipitado branco indica a formação de AgCl(s):
Ag+(aq) + Cl-(aq) → AgCl(s)
- Adicione nitrato de prata a uma solução que contenha cloreto. A formação de um precipitado branco indica a formação de AgCl(s):
- Sulfeto
- Adicione uma solução de cloreto de cobre a uma solução que contenha sulfeto. A formação de um precipitado preto indica a formação de sulfeto de cobre, CuS. Em geral, soluções contendo íons de sulfeto, S2-, reagem com íons metálicos para produzir um sulfeto metálico insolúvel.
S2- +2+ → CuS(s).
O valor do produto solubilidade, Ksp = 6,3 x 10-36, indica o alto grau de insolubilidade do produto.
- Adicione uma solução de cloreto de cobre a uma solução que contenha sulfeto. A formação de um precipitado preto indica a formação de sulfeto de cobre, CuS. Em geral, soluções contendo íons de sulfeto, S2-, reagem com íons metálicos para produzir um sulfeto metálico insolúvel.
- Fosfato
3. Análise de Cation
- Todos os metais alcalinos (grupo 1) e alguns metais alcalinos terrestres (grupo 2) são solúveis, exceto em condições específicas.
- Quase todos os metais do Grupo 3-13 são considerados insolúveis na presença de sulfeto, carbonato, fosfato e hidróxido. A cor e o tipo de precipitado variam.
- Coloque uma solução de cromo em uma solução de hidróxido. Um precipitado verde será observado. A reação geral de um metal +2 com hidróxido é mostrada abaixo:
M2+ + OH- → M(OH)2(s) - Não é possível diferenciar a maioria dos íons metálicos com base apenas na solubilidade com algumas exceções notáveis:
- A adição de prata, Ag+, mercúrio, Hg22+, ou chumbo, Pb2+ ao cloreto, brometo ou iodeto resulta em formação precipitada.
- A adição de estrôncio, Sr2+, bário, Ba2+, mercúrio, Hg22+, ou chumbo, Pb2+ resulta em um precipitado na presença de sulfato.
- O Ba2+ forma um sólido amarelo na presença de CrO42-, BaCrO4(s). Este é o pigmento usado na tinta à base de óleo comumente conhecida como "amarelo bário".
- Coloque uma solução de cromo em uma solução de hidróxido. Um precipitado verde será observado. A reação geral de um metal +2 com hidróxido é mostrada abaixo:
- A insolubilidade limitada dos íons metálicos permite que outros testes qualitativos identifiquem positivamente cada metal. Enquanto alguns forma precipitam, outros sofrem mudanças de cor únicas na presença de íons ou moléculas quelantes. As identificações de cáção incluem níquel, ferro, alumínio e zinco; Ni2+, Fe3+, Al3+, Zn2+.
- Adicione níquel (II) na presença de dimetilglyoxime (H2dmg) para formar o precipitado vermelho-rosa Ni(H2dmg):
Ni2+(aq) + 2 H2dmg(aq) → Ni(Hdmg)2(s) + 2 H+(aq) - Adicione ferro (III) ao íon tiocianato, SCN- para formar o complexo vermelho-sangue [FeNCS]2+):
Fe3+(aq) + SCN-(aq) → [FeNCS]2+(aq) - Íon de alumínio
- Combine alumínio (III) com pirócatecol violeta em uma solução tampão de acetato de amônio pH 6 para formar uma solução azul.
- O alumínio (III) também é precipitado na presença de base fraca para formar o composto gelatinoso-branco Al(OH)3(s). A adição de mais base faz com que o composto forme o complexo solúvel claro e incolor [Al(OH)4]-(aq).
- Íon de zinco
- Adicione zinco (II) a uma pequena quantidade de base para formar um precipitado branco. Em seguida, adicione mais base para re dissolver o precipitado e formar o solúvel [Zn(OH)4]2- complexo.
- Adicione zinco (II) ao hexacianoferato de potássio, K4[Fe(CN)6] para formar o precipitado verde claro K2Zn3[Fe(CN)6]2(s):
3 Zn2+(aq) + 2 K4[Fe(CN)6](aq) → K2Zn3[Fe(CN)6]2(s) + 6 K+(aq)
- Adicione níquel (II) na presença de dimetilglyoxime (H2dmg) para formar o precipitado vermelho-rosa Ni(H2dmg):
Aplicação e Resumo
As reações aqui mostradas podem ser usadas para identificar a presença de uma classe de cáations ou ânions ou ser usados muito especificamente para um determinado íon. Como dois reagentes são usados nas análises, qualquer reagente pode ser normalmente detectado usando o outro. Por exemplo, em vez de analisar a presença de cloreto usando íon prateado, íon prateado pode ser identificado usando cloreto. Uma combinação de regras comuns de precipitação seguidas de testes coloridos ou de precipitação específicos pode ser usada para identificar positivamente quase todos os íons, atômicos ou poliatômicos, disponíveis. Ao mesmo tempo, a maioria dessas mesmas regras pode ser estabelecida reagindo ânions e cáations sistematicamente para gerar um conjunto de regras para cáção e solubilidade de anion.
Análises qualitativas e regras relacionadas à solubilidade são experimentos comuns no laboratório de química geral. Isso se deve, em parte, à facilidade, velocidade e natureza barata dos testes. É por essas razões que os testes qualitativos também são utilizados em análises de campo e testes de laboratório confirmatórios. Por exemplo, uma empresa de geologia pode querer saber se existem quantidades significativas de níquel no escoamento de córregos de uma mina. Um teste simples adicionando a água ao dimetilgloxime é seletivo para íon de níquel. Da mesma forma, as autoridades de qualidade da água podem usar o bário (ou alguns outros metais do grupo 2) para detectar carbonato na água, detectando assim o nível de dureza da água. No entanto, é utilizada instrumentação avançada, quando são necessários resultados quantitativos ou múltiplos íons precisam ser identificados em níveis muito baixos. Isso inclui várias formas de espectroscopia de massa, bem como cromatografia de íons e espectroscopia de luz.
Referências
- Eaton, A. Standard Methods for the Examination of Water & Wastewater. Centennial ed. Washington, DC: American Public Health Association (2005).
Pular para...
Vídeos desta coleção:

Now Playing
Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.3K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
655.5K Visualizações

Soluções e Concentrações
General Chemistry
273.8K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
555.7K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.3K Visualizações

Determinação da Fórmula Empírica
General Chemistry
180.8K Visualizações

Usando um medidor de pH
General Chemistry
345.2K Visualizações

Introdução à Titulação
General Chemistry
424.0K Visualizações

Lei dos gases ideais
General Chemistry
78.3K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.3K Visualizações

Princípio de Le Châtelier
General Chemistry
264.9K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.6K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
195.9K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.4K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados