Loi des gaz parfaits
Vue d'ensemble
Source : Laboratoire de Dr. Andreas Züttel - Swiss Federal Laboratories for Materials Science and Technology
La Loi des gaz parfaits décrit le comportement des gaz plus communs dans des conditions proches de l’air ambiant et la tendance de toute matière chimique dans la limite de la diluer. Il existe une relation fondamentale entre trois variables système macroscopique mesurable (pression, température et le volume) et le nombre de molécules de gaz dans le système et est donc un lien essentiel entre l’univers macroscopiques et microscopique.
L’histoire de la Loi des gaz parfaits remonte jusqu’au milieu du 17ème siècle lorsque la relation entre la pression et le volume d’air s’est avérée pour être inversement proportionnelle, une expression confirmée par Robert Boyle et que nous appelons maintenant Loi de Boyle (équation 1).
P  V-1 (équation 1)
V-1 (équation 1)
Œuvre non publiée par Jacques Charles dans les années 1780, qui a été étendu à de nombreux gaz et vapeurs de Joseph Louis Gay-Lussac et signalés en 1802, établi la relation proportionnelle entre la température absolue et le volume d’un gaz. Cette relation est appelée Loi de Charles (équation 2).
V  T (équation 2)
T (équation 2)
Guillaume Amontons est généralement crédité sur la première découverte de la relation entre la température et la pression d’air dans un volume déterminé au début du 18ème siècle. Cette loi a été étendue aussi aux nombreux autres gaz par Joseph Louis Gay-Lussac au début du 19ème siècle et est donc que soit dénommée loi de Amontons ou loi de Gay-Lussac, a déclaré comme le montre l’équation 3.
P  T (équation 3)
T (équation 3)
Ensemble, ces trois relations peuvent être combinées pour donner la relation dans l’équation 4.
V  T (équation 4)
T (équation 4)
Enfin, en 1811, il a été proposé par Amedeo Avogadro que tout deux gaz, qui s’est tenue dans le même volume et à la même température et pression, contiennent le même nombre de molécules. Cela a conduit à la conclusion que tous les gaz peuvent être décrite par une constante commune, la constante des gaz parfaits R, qui est indépendant de la nature du gaz. Ceci est connu comme la Loi des gaz parfaits (équation 5). 1, 2
PV  T (équation 5)
T (équation 5)
Principles
La Loi des gaz parfaits et donc son R constante caractéristique, peuvent aussi être avec éloquence dérivés de la théorie des premiers principes de diverses façons, où les hypothèses simplificatrices importants sont que les molécules n’ont aucun volume inhérente et n’interagissent pas. Ces hypothèses sont valides dans la limite de la matière diluée, où le volume d’espace occupé par chaque molécule (p. ex. ~ 10-23 L aux conditions ambiantes) est beaucoup plus grand que la molécule elle-même (~ 10-26 L), et où les interactions sont improbables. Il peut donc facilement être démontrée dans un certain nombre de manières en utilisant des équipements communs de laboratoire à température ambiante et peut être mesurée avec exactitude à l’aide de divers gaz à des pressions atteignant même 10 bar (Figure 1). Toutefois, la Loi des gaz parfaits ne peut expliquer avec précision pour les propriétés des gaz plus denses dans des conditions quasi ambiantes (p. ex., propane) ou pour la condensation, les phénomènes qui surviennent à la suite des interactions intermoléculaires. Pour cette raison, nombreuses équations plus détaillées de l’État ont réussi la Loi des gaz parfaits dans les années depuis sa découverte, qui réduit à la Loi des gaz parfaits dans la limite de la matière diluée. 1, 2

La figure 1. Comparaison de la densité de loi des gaz parfaits à divers autres gaz commune à 25 ° C et entre 0 et 100 bar.
Dans ce tutoriel, nous allons soigneusement mesurer la densité d’hydrogène gazeux à une augmentation des pressions et des températures dans un volume déterminé par pesée d’un échantillon solide suspendu de volume connu : un bloc en aluminium usiné avec précision. Le changement dans le poids de l’échantillon est directement lié aux changements dans la densité du fluide, dans lequel il est flottant, par principe d’Archimède. Nous allons également démontrer les lacunes d’utilisation moins un idéal de gaz (comme le dioxyde de carbone) à des pressions élevées. Enfin, nous démontrer visuellement et qualitativement confirmer la Loi des gaz parfaits en effectuant une expérience simple paillasse où le changement de volume du système en raison de la libération d’hydrogène par un matériau de stockage de l’hydrogène est mesuré. À l’aide de l’une de ces expériences, nous pouvons déterminer la constante universelle qui décrit la relation entre la pression, la température et le volume pour une quantité donnée de gaz – la constante des gaz parfaits, R.
Procédure
1. mesure du Volume de l’échantillon
- Nettoyer l’échantillon soigneusement et sécher.
- Remplir un cylindre gradué haute résolution avec assez d’eau pour couvrir l’échantillon distillée. Noter le volume initial
- Déposer l’échantillon dans l’eau et noter le changement de volume. C’est le volume de l’échantillon, V.
- Retirer l’échantillon et séchez-le. Remarque : vous pouvez également mesuré la longueur du côté de l’échantillon et calculer son volume à l’aide de la géométrie.
2. Placer l’échantillon dans la Balance
- Accrocher l’échantillon dans la balance de suspension magnétique.
- Installer la chambre de pression/température autour de l’échantillon.
- Évacuer l’environnement de l’échantillon et remplir avec de l’hydrogène gazeux, à 1 bar.
- Mesurer le poids de l’échantillon à 1 bar et la température ambiante, w00.
3. mesure poids de l’échantillon en fonction de la pression à la température ambiante
- Augmenter ou diminuer la pression au sein de l’échantillon de Pi0.
- Permettre à l’environnement de l’échantillon s’équilibrer.
- Mesurer le poids de l' échantillon, wi0.
- 3.1 à 3.3 le répète plusieurs fois.
4. mesure poids de l’échantillon en fonction de la pression à différentes températures
- Régler la température à Tj et permettez-lui de s’équilibrer.
- Régler la pression d’hydrogène gazeux à 1 bar.
- Mesurer le poids de l’échantillon à 1 bar et Tj, w0j.
- Augmenter ou diminuer la pression Pij et laissez-le s’équilibrer.
- Mesurer le poids de l' échantillon, wij.
- 4.4-4.5 le répète plusieurs fois.
- Répétez 4.1 à 4.6, comme vous le souhaitez.
5. calculer la constante des gaz parfaits
- Totaliser les valeurs mesurées {TjPijet wij} où P0j est toujours 1 bar et T0 est la température ambiante mesurée.
- Calculer et tabuler les différences Δwij et ΔPij à chaque température Tj en utilisant l’équation 6 et 7 de l’équation.
Δwij = wij - w0j (équation 6)
Δwij = Pij - P0j = Pij - 1 bar (équation 7) - Calculer Rij pour chaque mesure, et moyenne sur toutes les valeurs pour déterminer la constante des gaz parfaits, R. alternativement, tracer le produit de ΔPij et V en fonction du produit de Δwij (divisée par le poids moléculaire, MW) et Tjet effectuer une analyse de régression linéaire pour déterminer la pente, R. (équations 8 et 9) pour l’hydrogène , MW = 2.016 g/mol.
ΔP V = Δn RT (équation 8)
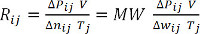 (Équation 9)
(Équation 9)
Résultats
La Loi des gaz parfaits est une description valide des propriétés des gaz réels de nombreux gaz communs aux conditions près ambiant (encart de laFigure 1 ) et est donc utile dans le cadre de nombreuses applications. Les limites de la Loi des gaz parfaits dans la description de systèmes dans des conditions de pression haute ou basse température peuvent s’expliquer par l’importance croissante des interactions moléculaires et/ou la taille finie des molécules de gaz qui contribuent aux propriétés du système. Par conséquent, gaz dont les interactions intermoléculaires fortes, attractifs (découlant des interactions dipôle-dipôle, y compris les liaisons hydrogène, interactions ion-dipôle ou des interactions de van der Waals) exposera des densités plus élevées que le gaz parfaits. Tous les gaz aura également une composante répulsive à densité élevée due au fait que plus d’une molécule ne peut occuper le même emplacement, une diminution de densité de prêt sur le gaz parfaits. Des gaz comme l’hydrogène et l’hélium montrent une contribution plus importante de la répulsion forcer en raison de la taille finie de la molécule et donc légèrement plus faibles densités à haute pression. Le méthane et le dioxyde de carbone montrent une contribution beaucoup plus importante de leurs propriétés d’interactions attractives, prêt leur densité plus élevée que le gaz parfait jusqu'à ce que très haute pressions, où domine le terme répulsif (à beaucoup plus élevé que 100 bar à 25 ° C).

La figure 2. Isotherme de captation d’adsorption équilibre de CO2 sur grande surface, caractérisée carbone MSC-30, 25 ° c.
Applications et Résumé
La Loi des gaz parfaits est telle une équation fondamentale des sciences chimiques qu’il a une multitude d’utilisations tant dans les activités quotidiennes de laboratoire, ainsi que dans les calculs et modélisation de systèmes très complexes, au moins en première approximation. Son application est limitée uniquement par les approximations inhérentes à la Loi elle-même ; à l’air ambiant près de pressions et des températures, où la Loi des gaz parfaits est bien valable pour nombreux gaz communs, il est largement employé dans l’interprétation des processus et systèmes à base de gaz. Deux exemples d’appareils qui fonctionnent selon des principes, qui peuvent être conciliées par utilisation de la Loi des gaz parfaits, sont le thermomètre de gaz et le moteur Stirling.
Une application spécifique est en mesurant la quantité d’adsorption de gaz (adsorption) sur la surface d’un matériau solide. L’adsorption est le phénomène physique par lequel les molécules de gaz laissent la phase gazeuse et entrer dans une phase densifiée près de la surface d’un solide (ou peut-être un liquide) en raison des interactions intermoléculaires attractives (forces de dispersion) entre le solide et le gaz. Le rôle de l’adsorption peut être négligé pour en vrac de nombreux matériaux (tels que le verre et l’acier inoxydable) acier aux conditions ambiantes, mais devient très important pour les matériaux poreux avec une grande surface surface accessible, surtout à basse température. 3 méthode de la Sieverts volumétrique et quantifier l’adsorption physique par la méthode gravimétrique dépendent sachant l’équation d’État du gaz dans le système. La Loi des gaz parfaits est valable pour nombreux gaz à basse pression et température ambiante et peut être utilisée pour déterminer avec précision la quantité adsorbée de gaz d’une manière similaire, tel que décrit dans le protocole de détermination R ci-dessus. Par exemple, dans les mesures gravimétriques de la flottabilité d’une adsorbant dans des conditions où le gaz parfait droit vaut en fait, la différence entre les Δwréelles mesurées haute-surface-zone et la Δwidéale calculée par l’équation idéale d’État peut être attribuée au changement dans le poids de la phase adsorbée. (Équation 10) Isothermes d’adsorption de gaz équilibre peuvent ainsi être mesurées par tabulating cette déviation, Δwannonces, en fonction de la pression à une température fixe (voir Figure 2), une procédure standard dans la caractérisation de matériaux poreux.
Δwannonces = Δwréels - Δwidéal (équation 10)
References
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
Passer à...
Vidéos de cette collection:

Now Playing
Loi des gaz parfaits
General Chemistry
78.5K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
656.9K Vues

Solutions et Concentrations
General Chemistry
274.5K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.4K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.6K Vues

Déterminer la formule empirique
General Chemistry
182.4K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.5K Vues

Utiliser un pH-mètre
General Chemistry
346.3K Vues

Introduction au titrage
General Chemistry
424.8K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.6K Vues

Principe de Le Châtelier
General Chemistry
265.6K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.7K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.2K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.5K Vues

Complexes de coordination
General Chemistry
91.6K Vues