Bestimmung der Löslichkeit von ionischen Verbindungen
Überblick
Quelle: Labor von Dr. Neal Abrams – SUNY College of Environmental Science and Forestry
Eine ionische Verbindung Löslichkeit kann über Qualitative Analyse ermittelt werden. Qualitative Analyse ist ein Zweig der analytischen Chemie, der chemischen Eigenschaften verwendet und Reaktionen auf die kation oder Anion identifizieren in einer chemischen Verbindung. Während die chemischen Reaktionen auf bekannten Löslichkeit Regeln beruhen, können die gleichen Regeln ermittelt werden, durch die Identifizierung der Produkte, die sich bilden. Qualitative Analyse erfolgt in der Regel nicht in modernen industriellen Chemie-Labors, aber es kann leicht im Feld ohne ausgefeilte Instrumentierung verwendet werden. Qualitative Analyse konzentriert sich auch auf ionische und net ionische Reaktionen zu verstehen sowie die Organisation von Daten in ein Flussdiagramm, Beobachtungen zu erklären und endgültige Schlussfolgerungen zu ziehen.
Viele kationen haben ähnliche chemische Eigenschaften wie die Anion-Pendants. Korrekte Identifizierung erfordert sorgfältige Trennung und Analyse, systematisch zu identifizieren, die Ionen in einer Lösung vorhanden. Es ist wichtig zu verstehen, Säure/Base-Eigenschaften, ionische Gleichgewichte, Redox-Reaktionen und pH Eigenschaften, Ionen erfolgreich zu identifizieren.
Zwar gibt es ein Qualitätstest für praktisch alle elementaren und polyatomaren Ion, beginnt der Identifikationsprozess in der Regel mit dem wissen, einer "Klasse" von Ionen analysiert; kationen und Anionen, elementare oder polyatomaren, Gruppen oder Zeiträume, Übergang oder Hauptgruppe. In diesem Experiment werden beide Arten von Ionen, kationen und Anionen, identifiziert. Die Kationen gehören polyatomaren Ionen sowie.
Grundsätze
Identifizierung von kationen und Anionen basiert auf bekannten chemischen Reaktionen zwischen dem unbekannten Ion und Reaktionspartner. Manchmal kann es sein, das Fehlen einer Reaktion, die das Ion sowie positiv identifiziert. Alle ionische Verbindungen bestehen aus einem kation und ein Anion, und tritt eine Reaktion zwischen zwei verschiedenen ionische Verbindungen, das kation eine Verbindung ist elektrostatisch Anion eines anderen, bilden eine neue ionische Verbindung angezogen. (Hinweis: einige einzigartige Ionischen Verbindungen haben eine oder mehrere kationen oder Ionen. Ein Beispiel wäre KNaC4H4O6 oder (NH4)2Fe (SO4)2. Der Gesamtbelastung die ionische Verbindung muss noch auf Null sum.) Diese Art von Reaktion ist bekannt als eine Metathese oder doppelten Hubraum, Reaktion und ist unten dargestellt:
w AB(Aq) + XCD(Aq)→yAD(s) + ZCB(Aq)
molekulare Reaktion
wo A und C sind kation Reaktanden, B und D sind Anion Reaktanden und die Verbindungen sind in molare Verhältnis w und X, beziehungsweise. Das gleiche folgt für Produkte AD(s) und CB(Aq) mit molaren Verhältnissen von y und Z. Wenn eine Reaktion in wässriger Lösung stattfindet, kann die molekulare Reaktion als eine Kombination von freien Ionen und unlöslichen Produkte bekannt als ionische Reaktion geschrieben werden:
A + (Aq) + B–(Aq) + C+(Aq) + D–(Aq) →AD(s) + B–(Aq) + C+(Aq)
Ionischen Reaktion
Eine ionische Reaktion zeigt sowohl die Ionen in der Reaktion als auch diejenigen, die nicht mitmachen, bekannt als Zuschauer Ionen. Die Bildung von unlöslichen Produkt AD(s) identifiziert die reagierenden Ionen oder könnte verwendet werden, um die Löslichkeit in der Regel für diese Ionen zu bestimmen. In allen Fällen zugrunde liegt eine Netto ionische Reaktion aller Beobachtungen, die eine vereinfachte Form der Ionischen Reaktion und zeigt nur die Ionen an der Reaktion beteiligte.
+(Aq) + D–(Aq)→ AD(s)
NET ionische Reaktion
Beobachtung einer chemischen Reaktion produziert ein unlösliches Produkt oder Niederschlag, ist ein Marker für die Teilnehmer einer net ionische Reaktion.
Reaktionen möglicherweise nur für einen bestimmten kation oder Anion oder üblich, alle Ionen innerhalb einer Gruppe oder Klasse von Reagenzien. Zum Beispiel alle Übergangsmetall-Ionen reagieren mit Sulfid-Ionen, S2 -, zu bilden unlösliche Niederschläge. Viele alkalische Erden bilden weiße Ausscheidungen in Gegenwart von Carbonat oder Phosphat-Ionen. Selektivere Identifikation Untersuchungen können mit gemischten Lösungen durch eine Kombination von Löslichkeit Regeln und chemische Reaktivität durchgeführt werden. Beispielsweise könnte eine Lösung, enthält Zink, Silber, Nickel und Eisen nach dem Flussdiagramm in Abbildung 1getrennt werden. Chlorid ist zuerst die Lösung Ausfällen von Silberchlorid AgCl hinzugefügt. Die restlichen Metalle sind alle ausgefällten in Hydroxid mit überschüssigen Hydroxid Zink wieder auflösen. Das Zink wird in Anwesenheit von Kalium Hexacyanoferrate, bilden einen grünen Niederschlag bestätigt. Die restlichen Eisen und Nickel Ausscheidungen werden gesammelt und überschüssiges Ammoniak aufzulösen die Nickel hinzugefügt und das solide Eisen komplexe gesammelt. Das Eisen ist neu in Gegenwart von Säure aufgelöst und bestätigt mit Thiocyanat-Ionen. Nickel wird durch Hinzufügen von Dimethylglyoxime, bilden einen solide rötlichen Niederschlag positiv identifiziert.
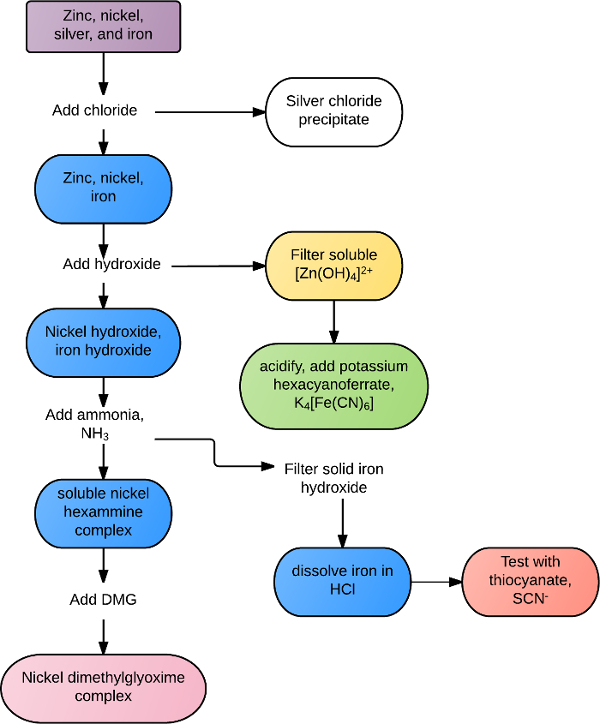
Abbildung 1. Beispiel-Flussdiagramm der Lösung Trennung.
Verfahren
1. allgemeine Methoden
- Vorbereitung für die Qualitative Analyse
- Reaktionen erfolgen in der Regel in kleine Reagenzgläser mit Volumen von 5 mL oder weniger.
- Lösungen sollte müssen vollständig löslich sein und relativ zu verdünnen, in der Regel ~0.1 M.
- Reagenzien sollten langsam tropfenweise hinzugefügt und sorgfältig beobachtet werden.
- Mehrere gemeinsame "test Lösungen" sind erforderlich, um Löslichkeit Regeln oder ein unbekannter Ion zu identifizieren. Diese enthalten Ionen reagieren spezifisch mit bestimmten chemischen Spezies (kationen und Anionen) bekannt.
- Gemeinsame Lösungen beinhalten CaNO3, BaCl2(NH4)2MoO4, HCl, AgNO3und NaOH und andere Lösungen als erforderlich.
- Mischen
- Mischen Sie Lösungen durch Antippen oder das Reagenzglas in vertikaler Richtung schwenken. Verwenden Sie ein Korken oder Stopper um zu verhindern, die Lösung Platschen.
- Entfernen Sie der Kork oder Stopfen, dann erhitzen Sie die Lösungen mit einem Wasserbad oder coole Flamme um eine Reaktion hervorzurufen. Zeigen Sie das Reagenzglas von Personen im Labor.
- Beobachtung und Erholung
- Den überstand (nicht reagierende Lösung) zu trennen und Niederschlag mittels Zentrifugation. Wenn mehr Formen Niederschlag, wenn zusätzlicher Test Ionen hinzugefügt wird, ist die Reaktion unvollständig. Weitere Test Ion hinzu, bis nicht mehr Formen auszufällen.
- Waschen Sie den Niederschlag mittels Zentrifugation und Gießen oder Umfüllen von überstand. Fügen Sie mehr Wasser hinzu und wiederholen Sie den Vorgang für eine Gesamtmenge von drei Wäschen.
- Waschen Sie große Mengen an Niederschlag von Vakuumfiltration und erholen Sie den getrocknete Niederschlag aus dem Filterpapier zu.
- Beachten Sie die Bildung von einen Niederschlag sowie die Eigenschaften des Niederschlags wie Farbe, Dicke (gallertartig, bewölkt, fein) und Kristallbildung.
- Sicherheit und Abfall
- Tragen Sie immer Schutzbrille während der Durchführung der qualitativen Analyse Experimente. Handschuhe können auch notwendig sein, abhängig vom verwendeten Reagenzien und Produkte gebildet.
- Ordnungsgemäße Entsorgungsmethoden müssen engmaschig überwacht werden. Schädliche Produkte können gebildet werden, wenn mehrere Reaktanden in einem Container kombiniert werden.
(2) Anion Analyse
- Ermittlung von Karbonat, Phosphat, Chlorid und Sulfid-Ionen; PO43 -, CO32 -, Cl-, S2-
- Phosphat
- Fügen Sie eine Lösung, enthält Phosphat, PO43 -, zu einer anderen Lösung, enthält Kalzium-Ionen, Ca2 +. Die Bildung von einen weißen Niederschlag zeigt die Bildung von Calcium-Phosphat, Ca3(PO4)2.
- Da viele kationen unlösliche Produkte mit Kalzium bilden, ist eine spezifische Reaktion möglich. Fügen Sie Ca3(PO4)2 festen aufzulösen und bilden HPO42 hinzu-H+ (Säure). Dann kombinieren Sie das HPO42 - mit Ammonium Molybdat, (NH4)2MoO4. Ein positiver Test liefert die gelbe Niederschlag Ammonium Phosphomolybdate, NH4)3PO4(MoO3)12(s). Die net Ionischen Reaktionen sind wie folgt:
3 Ca2 +(Aq) + 2 PO43 -(Aq) → Ca3PO4(s)
Ca3PO4(s) + 2 H+(Aq) → 3 Ca2 + + 2 HPO42–(Aq)
HPO4 2- (Aq) + 12 (NH4)2MoO4(Aq) + 23 H+(Aq) → (NH4)3PO4 (MoO3)12(s) + 21 NH4+(Aq) + 12 H2O(l)
- Carbonat
- Carbonat-Salze sind in der Regel unlöslich außer in Anwesenheit von Gruppe 1 und Ammonium kationen. Ein paar Tropfen von Kalzium-Chlorid, CaCl2, auf die Karbonat-haltige Lösung. In Lösungen mit hoher Carbonat-Konzentrationen ein weißen Niederschlag Formen und zeigt die mögliche Bildung von Calciumphosphat, CaCO3. Die Reaktion hat viele Störungen, einschließlich andere Anionen wie Phosphat.
Ca2 +(Aq) + CO32 -(Aq) → CaCO3(s) - Eine Lösung mit Carbonat, CO32 -fügen Sie H+ (Säure hinzu). Blasenbildung zeigt Anwesenheit von CO2, was bedeutet CO32 - als Reaktionspartner. Carbonat-Ionen verhält sich wie eine Base in Gegenwart von starken Säure in Form von Kohlendioxid und Wasser.
CO32-(Aq) + H+(Aq) → CO2(g) + H2O(l)
- Carbonat-Salze sind in der Regel unlöslich außer in Anwesenheit von Gruppe 1 und Ammonium kationen. Ein paar Tropfen von Kalzium-Chlorid, CaCl2, auf die Karbonat-haltige Lösung. In Lösungen mit hoher Carbonat-Konzentrationen ein weißen Niederschlag Formen und zeigt die mögliche Bildung von Calciumphosphat, CaCO3. Die Reaktion hat viele Störungen, einschließlich andere Anionen wie Phosphat.
- Chlorid
- Chlorid-haltige Lösung Silbernitrat hinzufügen. Die Bildung von einen weißen Niederschlag zeigt die Bildung von AgCl(s):
AG+(Aq) + Cl–(Aq) → AgCl(s)
- Chlorid-haltige Lösung Silbernitrat hinzufügen. Die Bildung von einen weißen Niederschlag zeigt die Bildung von AgCl(s):
- Sulfid
- Fügen Sie eine Kupferchlorid-Lösung zu einer Lösung mit Schwefelwasserstoff. Die Bildung von einen schwarzen Niederschlag zeigt die Bildung von Kupfer-Sulfide, CuS. Im allgemeinen reagieren mit Sulfid-Ionen, S2 -Lösungen mit Metall-Ionen zu einer unlöslichen Metall Sulfid führen.
S2- + Cu2 + → CuS(s).
Der Wert von der Löslichkeit Produkt Ksp = 6,3 x 10-36, gibt den hohen Grad der Unlöslichkeit des Produkts.
- Fügen Sie eine Kupferchlorid-Lösung zu einer Lösung mit Schwefelwasserstoff. Die Bildung von einen schwarzen Niederschlag zeigt die Bildung von Kupfer-Sulfide, CuS. Im allgemeinen reagieren mit Sulfid-Ionen, S2 -Lösungen mit Metall-Ionen zu einer unlöslichen Metall Sulfid führen.
- Phosphat
(3) kation Analyse
- Alle Alkalimetalle (Gruppe 1) und einige alkalische Erden (Gruppe 2) außer unter besonderen Bedingungen löslich sind.
- Gruppe "fast alle" 3 – 13 Metalle gelten unlöslich in Anwesenheit von Sulfid, Karbonat, Phosphat und Hydroxid. Die Farbe und Art des Niederschlags variieren.
- Legen Sie eine Chrom-Lösung in einer Natronlauge. Ein grünen Niederschlag wird beobachtet. Die allgemeine Reaktion eines Metalls + 2 mit einem Hydroxid wird unten gezeigt:
M2 + + OH– → M(OH)2(s) - Es ist nicht möglich, die Metall-Ionen basierend auf Löslichkeit allein mit einigen bemerkenswerten Ausnahmen zu unterscheiden:
- Die Zugabe von Silber, Ag+, Quecksilber, Hg22 +, oder Blei, Pb2 + , Chlorid, Bromid und Iodid entsteht Niederschlag.
- Die Zugabe von Strontium, Sr2 +, Barium, Ba2 +, Quecksilber, Hg22 +oder Blei, Pb2 + Ergebnisse in einen Niederschlag in Anwesenheit von Sulfat.
- BA2 + bildet eine gelbliche Lösung in Gegenwart von CrO42-, BaCrO4(s). Dies ist Pigment in Ölfarben, allgemein bekannt als "Barium gelb" verwendet.
- Legen Sie eine Chrom-Lösung in einer Natronlauge. Ein grünen Niederschlag wird beobachtet. Die allgemeine Reaktion eines Metalls + 2 mit einem Hydroxid wird unten gezeigt:
- Begrenzte Unlöslichkeit von Metall-Ionen können für andere qualitative Tests für jedes Metall eindeutig identifizieren. Während irgendeiner Form ausfällt, unterzogen andere einzigartige Farbenänderungen in Anwesenheit von Ionen oder Moleküle chelatisierenden. Kation Identifikationen gehören Nickel, Eisen, Aluminium und Zink; NI2 +, Fe3 +, Al3 +, Zn2 +.
- Hinzufügen von Nickel (II) in Anwesenheit von Dimethylglyoxime (H2Dmg), rosa-rot überstürzten Ni (H2Dmg) zu bilden:
NI2 +(Aq) + 2 H2Dmg(Aq) → Ni(Hdmg)2(s) + 2 H+(Aq) - Thiocyanat-Ion, SCN– zu den blutroten [FeNCS]2 +Eisen (III) hinzufügen] komplexe:
Fe3 +(Aq) + SCN–(Aq) → [FeNCS]2 +(Aq) - Aluminium-Ionen
- Kombinieren Sie Aluminium (III) mit Pyrocatechol violett in einer Pufferlösung von pH 6 Ammonium Acetat zu einer blauen Lösung.
- Aluminium (III) wird auch in Anwesenheit von schwache Basis bilden die gallertartige weiß Al(OH)3(s) zusammengesetzte ausgefällt. Zugabe von mehr base führt die Masse Form klar und farblos [Al(OH)4]-(Aq) löslich Complex.
- Zink-Ionen
- Eine kleine Menge an Base, einen weißen Niederschlag bilden fügen Sie Zink (II hinzu). Fügen Sie dann weitere Basis den Niederschlag wieder auflösen und bilden die löslichen [Zn(OH)4]2 - Komplex.
- Fügen Sie Zink (II) Kalium Hexacyanoferrate, K4[Fe(CN)6] um das Licht grün überstürzten K2Zn3[Fe(CN)6]2(s) zu bilden:
3 Zn2 +(Aq) + 2 K4[Fe(CN)6](Aq) → K2Zn3[Fe(CN)6]2(s) + 6 K+(Aq)
- Hinzufügen von Nickel (II) in Anwesenheit von Dimethylglyoxime (H2Dmg), rosa-rot überstürzten Ni (H2Dmg) zu bilden:
Anwendung und Zusammenfassung
Die hier gezeigten Reaktionen lässt sich das Vorhandensein einer Klasse von kationen oder Anionen zu identifizieren oder sehr spezifisch für eine bestimmte Ionen verwendet werden. Da zwei Reagenzien in den Analysen verwendet werden, kann entweder Reagenz in der Regel mit anderen erkannt werden. Zum Beispiel, anstatt durch die Analyse auf das Vorhandensein von Chlorid mit Silberionen, Silberionen erkennbar mit Chlorid. Eine Kombination von gemeinsamen Regeln des Niederschlags gefolgt von spezifischen farbmetrischen oder Ausfällung Tests lässt sich eindeutig identifizieren fast jedes Ion, Atom- oder polyatomaren, zur Verfügung. Zur gleichen Zeit können die meisten die gleichen Regeln reagierenden Anionen und kationen systematisch auf einen Satz von Regeln für kation und Anion Löslichkeit generieren gemeinsam festzulegen.
Qualitative Analyse und Bestimmungen zur Löslichkeit sind gemeinsame Experimente in die allgemeine Chemie-Labor. Dies liegt teilweise an der Leichtigkeit, Geschwindigkeit und kostengünstige Art der Tests. Es ist für diese Gründe, die auch qualitative Tests sind im Feld-basierte Analysen und bestätigende Lab Tests verwendet. Beispielsweise kann eine Geologie-Firma wissen wollen, ob erhebliche Mengen an Nickel in Stream Abfluss aus einer Mine vorhanden sind. Ein einfacher Test durch Zugabe von Wasser zu Dimethylgloxime ist selektiv für Nickel-Ionen. Ebenso können die Wasserqualität Behörden Barium (oder einige andere Metalle der Gruppe 2) zur Erkennung von Calciumcarbonat in Wasser, so erkennen die Höhe der Wasserhärte. Erweiterte Instrumentierung dient jedoch wo quantitative Ergebnisse erforderlich sind oder mehrere Ionen auf sehr niedrigem Niveau identifiziert werden müssen. Dazu gehören verschiedene Formen der Massenspektroskopie und Ionenchromatographie sowie leichte Spektroskopie.
Referenzen
- Eaton, A. Standard Methods for the Examination of Water & Wastewater. Centennial ed. Washington, DC: American Public Health Association (2005).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.3K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
655.5K Ansichten

Lösungen und Konzentrationen
General Chemistry
273.8K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
555.7K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.3K Ansichten

Ermittlung der Summenformel
General Chemistry
180.8K Ansichten

Verwendung eines pH-Meters
General Chemistry
345.2K Ansichten

Einführung in die Titration
General Chemistry
424.0K Ansichten

Ideale Gasgleichung
General Chemistry
78.3K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.3K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
264.9K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.6K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
195.9K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.4K Ansichten

Komplexchemie
General Chemistry
91.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten