Utiliser un pH-mètre
Vue d'ensemble
Source : Laboratoire du Dr Zhongqi He - United States Department of Agriculture
Acides et bases sont des substances capables de faire un don de protons (H+) et les ions hydroxydes (OH–), respectivement. Ils sont deux extrêmes qui décrivent les produits chimiques. Mélange d’acides et les bases peut s’annulent ou neutraliser leurs effets extrêmes. Une substance qui n’est ni acide ni base est neutre. Les valeurs de concentration de protons ([H+]) pour la plupart des solutions sont malencontreusement petites et difficiles à comparer pour qu’une quantité plus pratique, le pH, a été introduite. pH a été initialement définie comme le logarithme décimal de l’inverse de la concentration molaire de protons  , mais a été mis à jour pour le logarithme décimal de l’inverse de l’activité en ions hydrogène
, mais a été mis à jour pour le logarithme décimal de l’inverse de l’activité en ions hydrogène 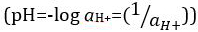 . L’ancienne définition est maintenant parfois exprimée en p [H]. La différence entre p [H] et le pH est assez petite. Il a été indiqué que le pH = p [H] + 0,04. Il est pratique courante d’utiliser le terme « pH » pour les deux types de mesures.
. L’ancienne définition est maintenant parfois exprimée en p [H]. La différence entre p [H] et le pH est assez petite. Il a été indiqué que le pH = p [H] + 0,04. Il est pratique courante d’utiliser le terme « pH » pour les deux types de mesures.
Le pH à l’échelle en général varie entre 0 et 14. Pour une solution 1 M d’un acide fort, pH = 0 et d’une solution 1 M d’un fort base, pH = 14. Ainsi, les valeurs de pH mesuré résidera principalement dans la gamme 0 à 14, bien que les valeurs en dehors de cette plage sont tout à fait possibles. L’eau pure est neutre pH = 7. Un pH inférieur à 7 est acide, et un pH supérieur à 7 est basique. Comme l’échelle du pH est logarithmique, pH est une grandeur sans dimension. Chaque ensemble de pH inférieur à 7 est 10 x plus acide que l’entier suivant. Par exemple, un pH de 4 est 10 x plus acide qu’un pH de 5 et 100 x (10 x 10) plus acide qu’un pH de 6. Va de même pour les valeurs de pH supérieures à 7, dont chacun est 10 x plus basic (ou alcaline) que la prochaine valeur entiθre infιrieure. Par exemple, un pH de 10 est 10 x plus basic à un pH de 9.
Principles
Le pH d’une solution peut être facilement et précisément déterminé par mesures électrochimiques avec un dispositif appelé un pH-mètre avec un pH (proton)-électrode sensible (généralement en verre) et une électrode de référence (habituellement chlorure d’argent ou calomel). Idéalement, le potentiel de l’électrode, E, pour le proton peut être écrite comme

où E est un potentiel mesuré, E0 est le potentiel à unH +de l’électrode standard = 1 mol/L, R est la constante des gaz, T est la température en kelvin, F est la constante de Faraday.
L’électrode pH utilise un verre spécialement formulé, sensibles au pH en contact avec la solution, qui développe le potentiel (E) proportionnel au pH de la solution. L’électrode de référence est destiné à maintenir un potentiel constant à une température donnée et sert à compléter le circuit dans la solution de mesure du pH. Il fournit un potentiel de référence connu pour l’électrode de pH. La différence dans le potentiel des électrodes pH et référence fournit un signal de millivolts (mV) proportionnel au pH. En pratique, une électrode de verre combinée a une électrode de référence intégrée. Il est calibré en solutions tampons d’activité connue des ions hydrogène. La plupart des capteurs pH sont conçus pour produire un signal 0-mV à pH 7,0, avec une pente (théoriquement idéal), ou la sensibilité de-59.16 mV / pH à 25 ° C. Deux ou plusieurs solutions tampons sont utilisées afin de tenir compte du fait que la « pente » peut différer légèrement du idéal. Solutions tampons standards commerciaux viennent habituellement avec les informations sur la valeur du pH à 25 ° C et un facteur de correction à appliquer aux autres températures.
Procédure
1. pH Calibration
- Allumez la puissance du compteur en appuyant sur le bouton « power ».
- Fixer la sonde automatique de compensation (CAT) si elle est disponible ou n’est pas avec l’électrode.
- Vérifiez que le mode de mesure est pH. Si ce n’est pas le cas, appuyez sur la touche « MODE » jusqu'à ce que le mode « pH » apparaît sur l’écran LCD.
- Consulter le guide de référence rapide en bas du compteur ou à proximité de l’aide si nécessaire.
- Toujours utiliser des tampons pH frais, non utilisé, non périmé pour l’étalonnage. Tampons devraient être à la même température que les solutions de tests.
- Rincer l’électrode à l’eau distillée, puis avec la mémoire tampon utilisée pour l’étalonnage (c.-à-d., pH 7.00).
- Plongez l’électrode pH dans un tampon de pH neutre (c.-à-d., pH 7.00). Remuer le tampon avec un barreau magnétique (à un rythme modéré pour ~ 30 s) pour de meilleurs résultats.
- Appuyez sur les « CAL/AME » (étalonnage [ou la normalisation] / easurement) pour sélectionner la fonction « calibration (normalisation) ». Définissez la valeur de pH tampon sur l’écran du lecteur à 7,00.
- Lorsque la « lecture » est stable, appuyez sur le bouton « Entrer » pour accepter. La lecture primaire doit clignoter brièvement avant que l’affichage secondaire commence à défiler les tampons disponibles restantes.
- Rincer l’électrode à l’eau distillée, puis avec la mémoire tampon à utiliser pour le prochain étalonnage (c.-à-d., pH 4.01).
- Plongez l’électrode pH dans le prochain tampon de pH 4.01. L’écran du compteur doit être verrouillé sur la valeur du tampon.
- Lorsque la « lecture » est stable, appuyez sur « ENTER » pour accepter. La lecture primaire va clignoter brièvement, puis afficher l’efficacité pour cent (pente) avant le début de l’affichage secondaire défilement via le restant des tampons disponibles.
- Répétez les étapes 2,2 et 2,7 pour calibrer le tampon pH 10.01.
- Le compteur reviendra automatiquement au mode de mesure après l’accomplissement de l’étalonnage 3 points.
Notes : (1) les norme tampons pH 4.01 et 10.01 peut-être remplacées par autres tampons appropriés par le test des pH dans la gamme. (2) pour un seul (neutre)-, ou 2 points d’étalonnage, appuyez sur la touche « CAL/MEAS » pour revenir à des mesures à l’issue de l’étalonnage. (3) l’étalonnage avec plus de 3 points peut être utilisé pour des mesures plus précises. (4) il est recommandé d’effectuer l’étalonnage au début de chaque journée. Pour un travail très précis du pH-mètre doit être étalonné avant chaque mesure. (5) manuellement ajuster les valeurs de pH des tampons si la température diffère de la température ambiante normale et aucune sonde ATC n’est associée.
2. pH mesures
- Confirmer que le compteur est sur le mode de mesure de pH.
- Rincer soigneusement l’électrode de pH entre les différentes mesures d’eau distillée pour éviter la contamination de transfert des solutions testées. Éponger doucement l’électrode sur un laboratoire de nettoyage de tissu pour enlever l’eau excédentaire. Ne pas frotter l’ampoule puisque cela peut causer une accumulation de charge statique. Sinon, rincez l’électrode avec la solution d’essai.
- Plongez l’électrode pH dans une solution ou en suspension test. Agiter la solution avec un barreau magnétique (~ 30 s) avec le même taux d’agitation en ce qui concerne l’étalonnage pour de meilleurs résultats.
- Le pH est terminé lorsque le pH est stable.
- Si nécessaire et disponible, appuyez sur le bouton « HOLD » pour geler la lecture mesurée. Appuyer à nouveau pour reprendre la lecture direct.
- Enregistrer la valeur du pH (et la température si nécessaire) en écrivant ou en appuyant sur la touche « MEMORY » (le cas échéant) pour stocker la valeur dans la mémoire.
- Répétez les étapes 3,2 à 3,6 pour plusieurs mesures.
- Rincez et conserver l’électrode dans une solution de stockage une fois que toutes les mesures sont effectuées.
Notes : (1) le temps de réponse de sonde pH dans chaque mémoire tampon doit être pas plu de 60 s, mais peut être plus long pour certaines solutions/coulis de tests. (2) la sonde de l’électrode doit être nettoyée à l’aide de solution de nettoyage électrode pH une fois par mois, ou chaque fois qu’il est sale. Une solution de HCl 0,1 M peut être utilisée pour le nettoyage général. Détergent liquid dilué et eau de Javel domestique peuvent être utilisés pour le nettoyage des contaminations bactériennes et de graisse. Toutefois, pour éviter des problèmes inattendus, la meilleure pratique consiste à toujours se référer aux recommandations du fabricant de l’électrode. (3) l’ampoule d’électrode de pH doit être humide en permanence. Gardez-le dans la solution de stockage d’électrode qui vient avec l’électrode. Utiliser la solution tampon pH 4 Si aucune solution de stockage est disponible. Utiliser la solution tampon pH 7 pendant une courte période si celui-ci n’est pas disponible.
Résultats
La figure 1 illustre le pH des sols agricoles touchés par la gestion des culture et d’irrigation des eaux souterraines. Ces échantillons de sol ont été prélevés de 5 champs de pommes de terre sous différentes pratiques culturales de rotation avec ou sans irrigation souterraine. Le pH le plus bas est observé dans champ 4 sols en culture pluviale et des eaux souterraines série irriguées. Irrigation souterraine a augmenté constamment le pH du sol dans tous les 5 domaines. Les informations de pH sont essentielles pour la recommandation du chaulage les champs de pommes de terre de façon appropriée promouvoir une croissance optimale.
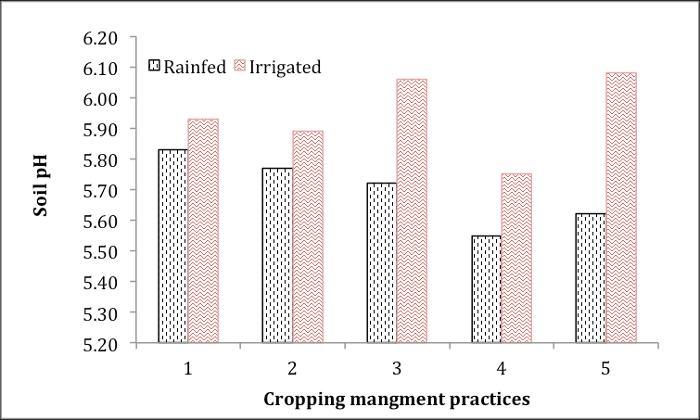
La figure 1. PH du sol des champs de pommes de terre sous différentes pratiques culturales de gestion avec ou sans sous l’eau d’irrigation.
Applications et Résumé
pH est l’un des paramètres chimiques couramment mesurés des solutions aqueuses. C’est un paramètre essentiel dans le traitement de l’eau et des eaux usées pour les applications municipales et industrielles, production de produits chimiques, recherche sur l’agriculture et la production. Il est également essentiel dans la recherche environnementale surveillance, chimie et sciences de la vie, recherche biochimique et pharmaceutique, production électronique et bien d’autres applications. La figure 2 répertorie des valeurs de pH de quelques substances courantes.
L’eau pure est neutre, avec un pH de 7,00. Lorsque les produits chimiques sont mélangés avec de l’eau, le mélange peut devenir soit acide ou basique. Jus de citron et le vinaigre sont des substances acides, tandis que l’ammoniaque et les détergents à lessive sont à la base. Produits chimiques qui sont très acides ou très basique sont considérés comme « réactives ». Ces produits chimiques peuvent causer des brûlures graves. L’acide de batterie automobile est un produit chimique acide qui est réactif. Batteries d’automobiles contiennent une forme plus forte d’un les acides dans les pluies acides. Débouchage domestique contiennent souvent de la lessive, un produit chimique très alcalin qui est aussi réactif.
Dans les systèmes vivants, le pH des compartiments cellulaires différents, fluides corporels et des organes est généralement étroitement contrôlée dans un processus appelé homéostasie d’acide-base. Le pH du sang est généralement légèrement basique avec une valeur de pH 7,365. Cette valeur est souvent dénommée pH physiologique en biologie et en médecine. Plaque peut créer un environnement acide local qui peut se traduire par la carie par déminéralisation. Enzymes et autres protéines ont une gamme de pH optimum et peuvent devenir inactivés ou dénaturés en dehors de cette plage.

La figure 2. L’échelle de pH et les valeurs de pH de certains éléments communs.
Passer à...
Vidéos de cette collection:

Now Playing
Utiliser un pH-mètre
General Chemistry
346.6K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
657.4K Vues

Solutions et Concentrations
General Chemistry
274.7K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.5K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.7K Vues

Déterminer la formule empirique
General Chemistry
183.0K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.5K Vues

Introduction au titrage
General Chemistry
425.1K Vues

Loi des gaz parfaits
General Chemistry
78.6K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.6K Vues

Principe de Le Châtelier
General Chemistry
265.7K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.7K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.2K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.5K Vues

Complexes de coordination
General Chemistry
91.6K Vues