Principe de Le Châtelier
Vue d'ensemble
Source : Laboratoire de Dr. Lynne o ' Connell, Boston College
Lorsque les conditions d’un système à l’équilibre sont modifiées, le système répond de manière à maintenir l’équilibre. En 1888, Henri-Lewis Le Châtelier décrit ce phénomène dans un principe qui énonce, « Lorsqu’un changement de température, de pression ou concentration perturbe un système en équilibre chimique, le changement sera compensée par une altération dans la composition de l’équilibre. »
Cette expérience illustre le principe de Le Châtelier à le œuvre dans une réaction réversible entre les ions fer (III) et l’ion thiocyanate, qui produit des ions de thiocyante de fer (III) :
Fe3 +(aq) + (aq) du SCN–  FeSCN2 + (aq)
FeSCN2 + (aq)
La concentration de l’un des ions est modifiée en ajoutant directement une quantité d’un ion à la solution ou en supprimant sélectivement un ion de la solution par le biais de la formation d’un sel insoluble. Observations des changements de couleur indique si l’équilibre s’est déplacé à favoriser la formation de ces produits ou réactifs. En outre, l’effet d’un changement de la température sur la solution à l’équilibre peuvent être observés, ce qui conduit à la capacité de conclure si la réaction est exothermique ou endothermique.
Principles
Pour bien comprendre le principe de Le Châtelier, est considérée une réaction réversible de la sorte exprimée par l’équation chimique suivante :
aA + bB  cC + dD
cC + dD
Cette réaction se compose en réalité de deux processus opposés : la réaction vers l’avant, dans lequel les produits C et D sont formés à partir de réactifs, et la réaction inverse, dans lesquels les réactifs A et B sont formés à partir des produits. Lorsque les taux de ces deux processus sont égales entre eux, il n’y a aucun changement net dans la concentration de produits ou réactifs, et la réaction est censée être à l’équilibre. Le rapport des concentrations à l’équilibre des produits à des concentrations à l’équilibre des réactifs est une constante, comme le montre l’équation suivante :

où Kc est la constante d’équilibre. Les parenthèses signifient les concentrations des différentes espèces et les lettres minuscules représentent le nombre de moles de chaque substance impliquée dans l’équation équilibrée. Dans le cas de la réaction entre les ions fer (III) et thiocyanate montré précédemment, la constante d’équilibre est :
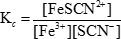
Lorsque la concentration du réactif ou un produit dans une solution d’équilibre est altérée, les concentrations des autres espèces doivent changer afin de maintenir le rapport constant de produits aux réactifs. Ces changements sont appelés « changements » dans l’équilibre. L’équilibre peut déplacer vers la gauche, ce qui signifie qu'il se déroule en sens inverse et les concentrations de l’augmentation de réactifs, ou déplacer vers la droite, ce qui signifie qu'il procède dans vers l’avant et les concentrations de l’augmentation des produits. Dans la réaction entre les ions fer (III) et thiocyanate, un virage vers la gauche signifierait la formation de plus d’ions fer (III) et thiocyanate, alors qu’un déplacement vers la droite signifierait la formation de fer (III) plus ions thiocyanates.
La constante d’équilibre dépend de la température ; ainsi, un changement dans la température de la solution d’équilibre peut également entraîner un déplacement vers la droite ou la gauche, selon que la réaction est exothermique ou endothermique. Pour une réaction exothermique, la chaleur produite par la réaction peut être représentée comme résidant sur le côté du produit de l’équation, car la chaleur est produite avec les produits :
aA + bB  cC + dD + chaleur
cC + dD + chaleur
Si la chaleur est ajouté au système en augmentant la température, l’équilibre se déplace vers la gauche, et augmenteront les concentrations des réactifs. Pour une réaction endothermique, l’ajout de chaleur se traduirait par un déplacement vers la droite.
aA + bB + chaleur  cC + dD
cC + dD
Dans ce cas, les concentrations des réactifs augmenterait avec une augmentation de température.
Procédure
1. préparation des Solutions équilibre Thiocyanate de fer (III)
- Placez 1 goutte de la solution3 Fe (NO3) de 1 M dans un tube à essai et diluer avec 2 mL d’eau. Placez 1 goutte de 1 M KSCN dans un autre tube à essai et diluer avec 2 mL d’eau. Ces deux tubes à essai servent de commandes à comparer avec les autres tubes à essai.
- Placer 1 goutte de solution de3 M Fe (NO3) dans un tube à essai.
- Ajouter 1 goutte de 1 M KSCN dans l’éprouvette.
- Ajouter 16 mL d’eau dans l’éprouvette et bien mélanger le contenu.
- Enregistrer des observations éventuelles.
- Diviser le mélange en portions de 2 mL à 8 tubes à essai. Un des tubes de test reste intact et sert un FeSCN2 + contrôle. Numéroter les autres tubes à essai 1 – 7.
2. Ajout de fer (III) et les Ions thiocyanates à la Solution d’équilibre
- Pour tube à essai 1, ajouter 1 goutte de la solution 1 M Fe (NO3)3 .
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Pour tube à essai 2, ajouter 1 goutte de solution KSCN 1.
- Agiter pour mélanger et enregistrer des observations éventuelles.
3. Ajout de Nitrate d’argent à la Solution d’équilibre
- Pour tube à essai 3, ajouter 3 gouttes d’une solution 0,1 M AgNO3 .
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Ajouter 3 gouttes de Fe (NO3) 1 M3 à l’éprouvette.
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Pour tube à essai 4, ajouter 3 gouttes d’une solution 0,1 M AgNO3 .
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Ajouter 3 gouttes de 1 M KSCN dans l’éprouvette.
- Agiter pour mélanger et enregistrer des observations éventuelles.
4. Ajout de Phosphate de Potassium de la Solution d’équilibre
- Pour tube à essai 5, ajouter 3 gouttes de solution de 0,5 M K3PO4 .
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Ajouter 3 gouttes de Fe (NO3) 1 M3 à l’éprouvette.
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Pour tube à essai 6, ajouter 3 gouttes de solution de 0,5 M K3PO4 .
- Agiter pour mélanger et enregistrer des observations éventuelles.
- Ajouter 3 gouttes de 1 M KSCN dans l’éprouvette.
- Agiter pour mélanger et enregistrer des observations éventuelles.
5. changer la température de la Solution d’équilibre
- Placer le tube à essai 7 dans un bain d’eau de 70 à 80 ° C pendant 1 à 2 min.
- Comparer la solution chaude de la solution dans l’éprouvette non chauffé (FeSCN2 + contrôle) et d’enregistrer des observations éventuelles.
- Recueillir le contenu des tubes à essai 3 et 4 dans les déchets de laboratoire jar étiquetée « Silver ». Versez le contenu de tous les autres tubes à essai dans l’évier.
Résultats
Observations des solutions initiales et le mélange des deux solutions sont visibles dans le tableau 1.
Observations des mélanges équilibre lors de l’addition de réactifs différents peuvent être vu dans le tableau 2.
Observation, lorsque la température est modifiée : en tube à essai 7, la solution devient plus orange en couleur (moins rouge, plus jaune) lorsqu’il est chauffé.
Éprouvettes 1 et 2, lorsque le nitrate de fer (III), qui contient un réactif, a été ajouté à la solution de l’équilibre, la couleur rouge de la solution intensifié. Cette observation indique que l’équilibre déplacé vers la droite comme la concentration du produit, ion thiocyanate de fer (III), a augmenté. De même, lorsque le thiocyanate de potassium, qui contient l’autre substance réactive, a été ajouté à la solution de l’équilibre, la couleur rouge de la solution intensifié. Cette observation indique également que l’équilibre déplacé vers la droite comme la concentration du produit a augmenté.
Dans des tubes à essai 3 et 4, lorsque le nitrate d’argent (AgNO3) a été ajouté à la solution de l’équilibre, a disparu à la couleur rouge du produit et la solution devenue incolore. Cette observation indique que l’équilibre décalé vers la gauche comme la concentration des réactifs a augmenté. En outre, un précipité a été observé. La couleur rouge est réapparu lors de l’addition de l’ion thiocyanate (SCN–). Cette observation indique que l’équilibre déplacé vers la droite comme la concentration du produit a augmenté. La couleur rouge ne reparut pas lorsqu’on ajoute des ions fer (III) (Fe3 +).
De ces observations, on peut conclure que thiocyanate d’argent (AgSCN) a été le précipité formé lorsque le nitrate d’argent a été ajouté à la solution d’équilibre. La formation de ce massif est responsable de la turbidité observée dans les deux tubes à essai. Lorsque l’ion thiocyanate a été retirée de la solution par précipitation, l’équilibre décalé vers la gauche, parce que la concentration de l’un des réactifs a été réduite. Quand on ajoutait ensuite plus ion thiocyanate, l’équilibre déplacé vers la droite pour rétablir le rapport des concentrations à l’équilibre de reformer le thiocyanate de fer (III). L’ajout de plusieurs ions fer (III) a fait pas à déplacer l’équilibre vers la droite, car l’ion thiocyanate avait été retirée de la solution sous forme d’argent thiocyanate précipiter et qu’il n’était plus disponible pour réagir avec le fer (III) pour former l’ion thiocyanate de fer (III).
Dans des tubes à essai 5 et 6, lorsque l’ion de phosphate de potassium (K3PO4) a été ajoutée à la solution de l’équilibre, a disparu à la couleur rouge des produits et la solution devenue jaune. Cette observation indique que l’équilibre décalé vers la gauche comme la concentration des réactifs a augmenté. La couleur rouge est réapparu lors de l’addition d’ions fer (III) (Fe3 +). Cette observation indique que l’équilibre déplacé vers la droite comme la concentration du produit a augmenté. En outre, un précipité a été observé. La couleur rouge ne reparut pas lorsque l’ion thiocyanate (SCN–) a été ajouté.
De ces observations, on peut conclure que le sel de fer (III) phosphate (FePO4) a été formé quand phosphate de potassium a été ajouté à la solution d’équilibre. Lorsque l’ion fer (III) a été retirée de la solution par la formation de ce sel, l’équilibre décalé vers la gauche, parce que la concentration de l’un des réactifs a été réduite. Lorsque plusieurs ions fer (III) a été ajoutée ensuite, l’équilibre décalé vers la droite pour rétablir le rapport des concentrations à l’équilibre en re-formant des thiocyante de fer (III). Bien qu’aucun trouble a été détectée par la vue lorsque l’ion phosphate a été ajoutée au départ, une couverture nuageuse apparaissait lorsque l’ion fer (III) a été ajoutée par la suite, qui est le sel de phosphate de fer (III) solide. L’addition de l’ion thiocyanate plus ne pas déplacer l’équilibre vers la droite, car l’ion fer (III) avait été enlevée de la solution sous forme de sel de phosphate de fer (III) et n’était plus disponible réagit avec l’ion thiocyanate pour former l’ion thiocyanate de fer (III).
En tube à essai 7, tant que la température augmentée, la couleur rouge des produits fanée, indiquant un déplacement de l’équilibre vers la gauche comme plus réactifs ont été formés. Cette observation conduit à la conclusion que la réaction est exothermique. Pour une réaction exothermique, la chaleur produite par la réaction se trouve sur le côté du produit de l’équation :
Fe3 + + SCN–  FeSCN2 + + chaleur
FeSCN2 + + chaleur
Quelle chaleur a été ajouté au système (en augmentant la température), l’équilibre décalé vers la gauche.
| Solution | Observation |
| Fe (pas3)3 | Jaune, claire |
| KSCN | Incolore, clair |
| Fe(SCN)2 + | Clair, rouge-orange |
Le tableau 1. Observations des solutions initiales et le mélange des deux solutions.
| Tube à essai # | Premier réactif | Observation de la Solution d’équilibre | Deuxième réactif | Observation de la Solution d’équilibre |
| 1 | Fe (pas3)3
|
Rouge, clair | — | — |
| 2 | KSCN
|
Rouge, clair | — | — |
| 3 | AgNO3 (incolore, transparent) | Incolore (blanc), nuageux | Fe (pas3)3 | Jaune, encore trouble |
| 4 | AgNO3 | Incolore (blanc), nuageux | KSCN | Rouge-orange, encore trouble |
| 5 | K3PO4 (incolore, transparent) | Jaune, claire | Fe (pas3)3 | Rouge-orange, nuageux |
| 6 | K3PO4 | Jaune, claire | KSCN | Toujours clair, jaune |
Le tableau 2. Observations des mélanges équilibre lors de l’addition de réactifs différents.
Applications et Résumé
Principe de le Châtelier est à l’oeuvre dans des corps humains. L’oxygène est transporté des poumons aux muscles et autres tissus par une protéine appelée hémoglobine (Hb) qui se trouve dans le sang. La molécule d’oxygène se lie à cette protéine dans une réaction réversible qui peut être décrite par une équation d’équilibre :
HB + 4 O2  Hb (O2)4
Hb (O2)4
Dans les poumons, la pression partielle d’oxygène-gaz est élevée (de l’ordre 100 torr). L’équilibre se déplace vers la droite dans cet environnement, et les molécules d’oxygène se lient aux molécules d’hémoglobine jusqu'à ce que la protéine est saturée en oxygène. Lorsque ce saturé hémoglobine atteint les cellules du tissu musculaire, où la pression d’oxygène est beaucoup plus faible, l’équilibre se déplace vers la gauche, et l’oxygène est libéré. Si le muscle est au repos, la pression d’oxygène est environ 30 torr, et environ 40 % de l’oxygène est libéré. Lorsque le muscle est actif, les intervalles de pression d’oxygène de 3 à 18 torr et environ 85 % de l’oxygène est libéré pour satisfaire la demande métabolique accrue.
Un autre exemple physiologique d’un système d’équilibre implique la régulation du pH sanguin. Dioxyde de carbone dans le sang réagit réversiblement avec de l’eau pour produire de l’acide carbonique, qui se dissocie pour produire des ions hydronium et bicarbonate :
CO2 (aq) + H2O (l)  H2CO3 (aq)
H2CO3 (aq)  H3O+ (aq) + HCO3–(aq)
H3O+ (aq) + HCO3–(aq)
Au cours d’un exercice intense, la quantité de dioxyde de carbone produite par les cellules augmente en raison de la forte activité métabolique. L’augmentation de la concentration de dioxyde de carbone dans le sang provoque un déplacement vers la droite dans cet équilibre pour produire plus d’acide carbonique. Lorsque cela se produit, le niveau de pH du sang décroît lorsque ion hydronium concentration augmente. Une des réponses du corps à ce déséquilibre du pH du sang est d’augmenter le taux de respiration donc plus de gaz carbonique est expiré des poumons, déplaçant ainsi l’équilibre vers la gauche et l’élévation du pH de retour à la normale.
Principe de le Châtelier doit également prendre en compte dans de nombreux procédés industriels. L’ammoniac est un important produit chimique utilisé dans les engrais, agents de nettoyage et comme un bloc de construction dans les réactions organiques synthétiques. La production industrielle d’ammoniac est réalisée selon le procédé Haber, qui repose sur la réaction réversible entre l’hydrogène et l’azote :
3 H2 (g) + N2 (g)  2 NH3 (g)
2 NH3 (g)
Afin d’optimiser la production d’ammoniac, la réaction est exécutée à haute pression, généralement autour de 200 atm. Il y a 4 moles de gaz sur le côté gauche de l’équation et 2 moles de gaz sur le côté droit. Principe de le Châtelier dicte qu’une augmentation de la pression sur le système déplace l’équilibre vers la droite, parce que le volume de 2 moles de gaz est plus petit que le volume de 4 moles de gaz. Étant donné que le volume et la pression sont directement proportionnels, une Maj pour réduire le volume réduit également la pression et le système retourne à l’équilibre. En outre, le processus consiste à liquéfier le gaz ammoniac dans un condensateur, donc il est retiré de la chambre de réaction. Cette diminution de l’ammoniac aussi déplace l’équilibre vers la droite, en maximisant la quantité d’ammoniac produit.
Passer à...
Vidéos de cette collection:

Now Playing
Principe de Le Châtelier
General Chemistry
265.8K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
658.3K Vues

Solutions et Concentrations
General Chemistry
275.1K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.8K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.8K Vues

Déterminer la formule empirique
General Chemistry
183.7K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.6K Vues

Utiliser un pH-mètre
General Chemistry
346.7K Vues

Introduction au titrage
General Chemistry
425.4K Vues

Loi des gaz parfaits
General Chemistry
79.0K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.7K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.8K Vues

Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.3K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.7K Vues

Complexes de coordination
General Chemistry
91.7K Vues