Method Article
Comparaison directe de la diffusion Raman stimulée hyperspectrale et de la microscopie à diffusion Raman anti-Stokes cohérente pour l’imagerie chimique
Dans cet article
Résumé
Cet article compare directement la résolution, la sensibilité et les contrastes d’imagerie de la diffusion Raman stimulée (SRS) et de la diffusion Raman anti-Stokes cohérente (CARS) intégrées dans la même plate-forme de microscope. Les résultats montrent que CARS a une meilleure résolution spatiale, SRS donne de meilleurs contrastes et une meilleure résolution spectrale, et les deux méthodes ont une sensibilité similaire.
Résumé
La diffusion Raman stimulée (SRS) et la microscopie cohérente anti-diffusion Raman (CARS) sont les technologies d’imagerie par diffusion Raman cohérente les plus largement utilisées. L’imagerie hyperspectrale SRS et CARS offre des informations spectrales Raman à chaque pixel, ce qui permet une meilleure séparation des différentes compositions chimiques. Bien que les deux techniques nécessitent deux lasers d’excitation, leurs schémas de détection de signal et leurs propriétés spectrales sont très différents. L’objectif de ce protocole est d’effectuer à la fois l’imagerie hyperspectrale SRS et CARS sur une seule plate-forme et de comparer les deux techniques de microscopie pour l’imagerie de différents échantillons biologiques. La méthode de focalisation spectrale est utilisée pour acquérir des informations spectrales à l’aide de lasers femtosecondes. En utilisant des échantillons chimiques standard, la sensibilité, la résolution spatiale et la résolution spectrale de SRS et CARS dans les mêmes conditions d’excitation (c.-à-d. puissance à l’échantillon, temps de séjour en pixels, lentille d’objectif, énergie d’impulsion) sont comparées. Les contrastes d’imagerie de CARS et SRS pour les échantillons biologiques sont juxtaposés et comparés. La comparaison directe des performances CARS et SRS permettrait une sélection optimale de la modalité d’imagerie chimique.
Introduction
Le phénomène de diffusion Raman a été observé pour la première fois en 1928 par C. V. Raman1. Lorsqu’un photon incident interagit avec un échantillon, un événement de diffusion inélastique peut se produire spontanément, dans lequel le changement d’énergie du photon correspond à une transition vibratoire des espèces chimiques analysées. Ce processus ne nécessite pas l’utilisation d’une étiquette chimique, ce qui en fait un outil polyvalent et sans étiquette pour l’analyse chimique tout en minimisant la perturbation des échantillons. Malgré ses avantages, la diffusion Raman spontanée souffre d’une faible section de diffusion (généralement 10à 11 inférieure à la section transversale d’absorption infrarouge [IR]), ce qui nécessite de longs temps d’acquisition pour l’analyse2. Ainsi, la recherche d’une augmentation de la sensibilité du processus de diffusion Raman est essentielle pour pousser les technologies Raman à l’imagerie en temps réel.
Un moyen efficace d’améliorer considérablement la sensibilité de la diffusion Raman consiste à utiliser des processus de diffusion Raman cohérents (CRS), pour lesquels deux impulsions laser sont généralement utilisées pour exciter les transitions vibratoires moléculaires 3,4. Lorsque la différence d’énergie des photons entre les deux lasers correspond aux modes vibratoires des molécules de l’échantillon, de forts signaux Raman seront générés. Les deux procédés CRS les plus couramment utilisés pour l’imagerie sont la diffusion Raman anti-Stokes cohérente (CARS) et la diffusion Raman stimulée (SRS)5. Au cours des deux dernières décennies, les développements technologiques ont fait progresser les techniques de microscopie CARS et SRS pour devenir des outils puissants pour la quantification sans étiquette et l’élucidation des changements chimiques dans les échantillons biologiques.
L’imagerie chimique par microscopie CARS peut être datée de 1982, lorsque le balayage laser a été appliqué pour la première fois pour acquérir des images CARS, démontré par Duncan et al6. La modernisation de la microscopie CARS a été considérablement accélérée après les vastes applications de la microscopie à fluorescence multiphotonique à balayage laser7. Les premiers travaux du groupe Xie utilisant des lasers à haut taux de répétition ont permis à CARS de devenir une plate-forme d’imagerie chimique à grande vitesse, sans étiquette, pour la caractérisation de molécules dans des échantillons biologiques 8,9,10. L’un des principaux problèmes de l’imagerie CARS est la présence d’un arrière-plan non résonant, ce qui réduit le contraste de l’image et déforme le spectre Raman. De nombreux efforts ont été faits pour réduire le fond non résonant 11,12,13,14,15 ou pour extraire les signaux Raman résonnants des spectres CARS 16,17. Une autre avancée qui a considérablement fait progresser le domaine est l’imagerie hyperspectrale CARS, qui permet une cartographie spectrale à chaque pixel d’image avec une sélectivité chimique améliorée 18,19,20,21.
La diffusion Raman stimulée (SRS) est une technologie d’imagerie plus jeune que CARS, bien qu’elle ait été découverte plus tôt22. En 2007, la microscopie SRS a été rapportée en utilisant une source laser à faible taux de répétition23. Bientôt, plusieurs groupes ont démontré l’imagerie SRS à grande vitesse en utilisant des lasers à haut taux de répétition 24,25,26. L’un des principaux avantages de la microscopie SRS par rapport à CARS est l’absence du fond non résonant27, bien que d’autres arrière-plans tels que la modulation de phase croisée (XPM), l’absorption transitoire (TA), l’absorption à deux photons (TPA) et l’effet photothermique (PT) puissent se produire avec SRS28. De plus, le signal SRS et la concentration de l’échantillon ont des relations linéaires, contrairement à CARS, qui a une dépendance quadratique signal-concentration29. Cela simplifie la quantification chimique et le démélange spectral. Le SRS multicolore et hyperspectral a évolué sous différentes formes 30,31,32,33,34,35,36, la focalisation spectrale étant l’une des approches les plus populaires pour l’imagerie chimique 37,38.
Cars et SRS nécessitent la focalisation de la pompe et des faisceaux laser Stokes sur l’échantillon pour correspondre à la transition vibratoire des molécules pour l’excitation du signal. Les microscopes CARS et SRS ont également beaucoup en commun. Cependant, la physique sous-jacente à ces deux processus et les détections de signaux impliquées dans ces technologies de microscopie présentent des disparités 3,39. CARS est un processus paramétrique qui n’a pas de couplage d’énergie photon-molécule net3. Le SRS, cependant, est un processus non paramétrique et contribue au transfert d’énergie entre les photons et les systèmes moléculaires27. Dans CARS, un nouveau signal à la fréquence anti-Stokes est généré, tandis que SRS se manifeste par le transfert d’énergie entre la pompe et les faisceaux laser Stokes.
Le signal CARS satisfait Eq (1)28.
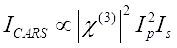 (1)
(1)
Pendant ce temps, le signal SRS peut être écrit comme Eq (2) 28.
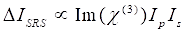 (2)
(2)
Ici, Ip, Is, ICARS et ΔISRS sont les intensités du faisceau de pompe, du faisceau de Stokes, du signal CARS et des signaux SRS, respectivement. χ(3) est la susceptibilité optique non linéaire de troisième ordre de l’échantillon et est une valeur complexe composée de parties réelles et imaginaires.
Ces équations expriment les profils spectraux et la dépendance signal-concentration de CARS et SRS. Les différences physiques se traduisent par des schémas de détection disparates pour ces deux technologies de microscopie. La détection du signal dans CARS implique généralement la séparation spectrale des photons nouvellement générés et la détection à l’aide d’un tube photomultiplicateur (PMT) ou d’un dispositif à couplage de charge (CCD); pour srS, l’échange d’énergie entre la pompe et les faisceaux de Stokes est généralement mesuré par modulation d’intensité à grande vitesse à l’aide d’un modulateur optique et démodulation à l’aide d’une photodiode () associée à un amplificateur de verrouillage.
Bien que de nombreux développements et applications technologiques aient été publiés ces dernières années dans les domaines CARS et SRS, aucune comparaison systématique des deux techniques CRS n’a été effectuée sur la même plate-forme, en particulier pour la microscopie hyperspectrale CARS et SRS. Des comparaisons directes de la sensibilité, de la résolution spatiale, de la résolution spectrale et des capacités de séparation chimique permettraient aux biologistes de choisir la meilleure modalité pour la quantification chimique. Dans ce protocole, des étapes détaillées pour construire une plate-forme d’imagerie multimodale avec des modalités hyperspectrales CARS et SRS basées sur un système laser femtoseconde et une focalisation spectrale sont fournies. Les deux techniques ont été comparées dans le sens avant pour la résolution spectrale, la sensibilité de détection, la résolution spatiale et les contrastes d’imagerie des cellules.
Protocole
1. Configuration instrumentale pour l’imagerie CRS hyperspectrale
REMARQUE: La génération de signal CRS nécessite l’utilisation de lasers de haute puissance (c.-à-d. classe 3B ou classe 4). Les protocoles de sécurité doivent être respectés et l’équipement de protection individuelle (EPI) approprié doit être porté en tout temps lorsque vous travaillez à des puissances de pointe aussi élevées. Consultez la documentation appropriée avant l’expérimentation. Ce protocole se concentre sur la conception du trajet du faisceau, le gazouillis des impulsions femtosecondes et l’optimisation des conditions d’imagerie. Une disposition optique générale de ce microscope CRS hyperspectral est illustrée à la figure 1. La configuration présentée ici est l’une des nombreuses configurations existantes pour la microscopie CRS. Le système de microscopie CRS utilisé dans ce protocole est construit sur une source laser femtoseconde à double sortie et un microscope à balayage laser.
- Assurez-vous que la source laser fournit deux trains d’impulsions femtosecondes (largeur 120 fs) avec un taux de répétition de 80 MHz, y compris une longueur d’onde fixe à 1 045 nm utilisée comme faisceau de Stokes et une longueur d’onde accordable de 680 à 1 300 nm utilisée comme faisceau de pompe. Synchronisez les impulsions de sortie avec une différence de délai optique. Utilisez un cadre de microscope pour construire la plate-forme d’imagerie.
- Conception du trajet du faisceau
- Pour contrôler la puissance laser de l’échantillon, utilisez une combinaison de plaque demi-onde et de séparateur de faisceau de polarisation (PBS) pour chaque faisceau laser.
- Installez un modulateur acousto-optique (AOM) dans le trajet du faisceau laser Stokes. Focalisez le faisceau avec un objectif à focale de 150 mm dans l’AOM et collasiez la sortie de 0ème ordre avec un objectif à distance focale de 400 mm.
- Utilisez la même paire d’objectifs (distances focales de 150 mm et 400 mm) pour étendre le faisceau de la pompe afin de correspondre à la taille du faisceau laser avec le Stokes.
- Placez les objectifs à distance focale de 400 mm dans les chemins de la pompe et du faisceau Stokes sur des étapes de traduction unidimensionnelles séparées pour affiner la divergence du faisceau et optimiser la taille du faisceau avant d’entrer dans le microscope.
- Dirigez le faisceau de la pompe avec un miroir réfléchissant à angle droit monté sur un étage de translation motorisé pour un réglage optique du retard. Si le faisceau de Stokes a besoin d’un retard optique, placez plutôt ces composants dans son trajet de faisceau.
- Permettre aux deux faisceaux d’être combinés à un miroir dichroïque avec une longueur d’onde de coupure à ~ 1 000 nm (entre les longueurs d’onde de la pompe et de Stokes), de sorte que le faisceau de Stokes transmettra à travers le miroir dichroïque pendant que le faisceau de la pompe est réfléchi par le miroir dichroïque. Envoyez les faisceaux laser combinés collinéaires au microscope.
- Pour gazouiller la pompe et les poutres stokes, placez des tiges de verre dans leurs chemins de poutre. Voir l’étape 1.5 pour plus de détails.
- Pour confirmer le bon alignement et la taille du faisceau, utilisez des diaphragmes d’iris après le miroir dichroïque et avant le microscope. Plus précisément, installez l’un à une position proche et l’autre à une distance du miroir dichroïque pour confirmer un bon alignement et un bon chevauchement de faisceau. Utilisez une carte de visualisation IR ou une visionneuse IR pour visualiser le faisceau pendant l’alignement.
- Utilisez un rapide et un oscilloscope pour mesurer approximativement le délai optique entre la pompe et les impulsions de Stokes. Déclenchez l’oscilloscope en échantillonnant le train d’impulsions laser.
- Bloquez le faisceau de la pompe et échantillonnez le faisceau de Stokes. Zoomez sur l’une des impulsions et placez un curseur vertical dessus pour marquer son emplacement temporel sur l’oscilloscope.
- Débloquez le faisceau de la pompe et bloquez le faisceau de Stokes. Traduisez l’étape de retard jusqu’à ce que les impulsions de la pompe d’échantillonnage s’alignent temporellement sur la position marquée.
- Le microscope à balayage laser
- Pour une configuration de microscope vertical, envoyez les faisceaux laser combinés à travers un périscope pour monter à un niveau approprié avant d’atteindre les miroirs de balayage 2D galvo.
- Mesurez la taille du faisceau laser avant le microscope et configurez la paire de lentilles appropriée après les miroirs galvo pour étendre le faisceau laser afin de correspondre au mieux à la taille de la pupille d’entrée de la lentille de l’objectif.
- Construisez un système 4-f en utilisant les deux lentilles, avec l’ouverture arrière de l’objectif et le centre des deux miroirs galvo étant des plans conjugués. Alternativement, utilisez deux miroirs galvo 1D séparés avec deux systèmes de lentilles 4-f pour le balayage laser.
- Après le condenseur, concevez un miroir rabattable de 2 pouces pour refléter les faisceaux laser pour la collecte du signal. Positionnez une lentille de 2 de diamètre dans la trajectoire du faisceau transmis pour collecter et focaliser complètement les signaux de transmission vers les détecteurs.
- Dirigez les signaux CARS vers le PMT avec un miroir dichroïque ayant une coupure à 776 nm, et laissez les signaux SRS transmis être détectés par le. Utilisez un filtre passe-bande (655/30 nm) avant le PMT pour rejeter les impulsions laser d’excitation résiduelles. Utilisez un filtre passe-court (passe courte de 980 nm) avant le pour empêcher le faisceau Stokes d’entrer dans le détecteur.
- Pour la détection du signal CARS, connectez un préamplificateur et un convertisseur courant-tension après le PMT et avant d’envoyer le signal au système d’acquisition de données. Ajustez la tension PMT pour optimiser le contraste du signal et de l’image.
- Utilisez un générateur de fonctions pour moduler l’AOM à 1-10 MHz et utilisez la même fréquence que la référence pour la démodulation de verrouillage. Utilisez un amplificateur à verrouillage pour extraire les signaux SRS avant l’acquisition des données.
- Acquisition et affichage des données
- Effectuez l’acquisition de données à l’aide d’une carte d’acquisition de données numériques (DAQ) associée à un bornier.
- Utilisez les sorties analogiques du DAQ pour contrôler les miroirs galvo et les entrées analogiques pour l’acquisition du signal.
- Utilisez un logiciel écrit en laboratoire basé sur LabVIEW avec un affichage multicanal simultané pour visualiser et enregistrer des images en temps réel (voir Fichier supplémentaire).
- Gazouillir la source femtoseconde et mesurer la résolution spectrale
REMARQUE: Pour obtenir une bonne résolution spectrale en utilisant la focalisation spectrale, des tiges de verre sont utilisées pour introduire des dispersions et des impulsions laser chirp de la femtoseconde à la picoseconde. Pour obtenir la meilleure résolution spectrale, le taux de gazouillis du faisceau de pompe doit être égal à celui du faisceau de Stokes. Pour ce système laser, la meilleure résolution spectrale peut être obtenue en gazouillant les impulsions laser de sortie ~120 fs à 3,4 ps pour la pompe et 1,8 ps pour les Stokes. Ce gazouillis est obtenu en utilisant une combinaison 4+ 1 (quatre dans le faisceau combiné, un seul dans le faisceau de Stokes) d’une combinaison de tige de verre de 150 mm (SF-57), comme décrit ci-dessous, et devrait atteindre une résolution spectrale de 15 cm-1 . La durée de l’impulsion peut être mesurée à l’aide d’un autocorrélateur.- Insérez une tige de verre de 150 mm dans le seul chemin de faisceau Stokes.
- Insérez deux tiges de verre de 150 mm dans le trajet combiné pompe/faisceau Stokes après le séparateur de faisceau dichroïque. Pour augmenter le gazouillis, laissez les faisceaux laser combinés passer deux fois les deux tiges de verre en plaçant un miroir diélectrique à une extrémité des tiges.
- Pour mesurer la résolution spectrale, préparez un échantillon chimique standard (p. ex. sulfoxyde de diméthyle [DMSO]) pressé entre deux couvercles en verre et scannez l’étage de retard jusqu’à ce que le signal maximal soit atteint.
- Déplacez le retard optique de 1 000 μm dans la direction du décalage vers le rouge. Ensuite, exécutez 200 images à 10 μm/pas vers la direction blueshift pour collecter la pile d’images hyperspectrales.
- Pour convertir les nombres d’images en numéros d’onde, effectuez une régression linéaire à l’aide du C-H symétrique (2 913 cm-1) et asymétrique (2 994 cm-1) s’étendant du DMSO et de leurs numéros d’image correspondants40.
- Utilisez le signal XPM pour mesurer le profil d’intensité de focalisation spectrale. Fermez à moitié le diaphragme du condenseur et déplacez la mise au point vers un couvercle vierge. Collectez le même nombre d’étapes que pour le SRS hyperspectral. Pour mesurer le fond non résonant CARS, concentrez-vous sur le couvercle en verre et collectez le même nombre d’étapes pour les mesures hyperspectrales CARS.
- Optimisation du rapport signal/bruit (SNR) des images
- Préparez un échantillon chimique pour l’alignement du système. Suivez la procédure décrite à l’étape 3.1 pour la préparation des échantillons.
REMARQUE: Le DMSO est un bon choix car il s’agit d’un produit chimique de laboratoire commun avec de forts signaux Raman et des pics symétriques et asymétriques C-H bien séparés. - Placez l’échantillon sur la scène du microscope et ajoutez de l’eau ou de l’huile d’immersion si nécessaire pour la lentille de l’objectif ou le condenseur. Déplacez correctement le bord de la gouttelette DMSO dans le champ de vision et ajustez l’objectif pour une mise au point optimale. Centrez le condenseur à l’aide de la méthode d’éclairage Köhler41. Ouvrez complètement le diaphragme du condenseur.
- Réglez la longueur d’onde du faisceau de la pompe à 800 nm (1 045 nm Stokes) pour cibler le pic de 2 913 cm-1 CH3 . Réglez la puissance de la pompe et du faisceau de Stokes à ~30 mW avant le microscope en ajustant la plaque demi-onde (~10 mW de puissance au plan d’échantillonnage).
- Pour SRS, réglez le gain de l’amplificateur de verrouillage sur ~10 avec une constante de temps de 7 μs (lorsque vous utilisez un temps de séjour de 10 μs en pixels). Assurez-vous que la constante de temps est inférieure au temps de séjour en pixels. Utilisez Demod R pour la sortie AUX pour les signaux SRS.
- Pour CARS, envoyez la sortie PMT au préamplificateur et au convertisseur courant-tension. Utilisez le DAQ pour acquérir la sortie du convertisseur.
- Définissez les paramètres d’acquisition d’image dans le logiciel d’acquisition. Utilisez un nombre de pixels de 200 x 200 avec une taille de numérisation d’environ 100 x 100 μm2. Assurez-vous que l’image contient à la fois la gouttelette DMSO et une zone vide.
- Scannez l’échantillon et vérifiez l’image sur l’écran de l’ordinateur. Scannez l’étage de retard motorisé dans le faisceau Stokes/pompe tout en surveillant les images en temps réel. Balayez le délai jusqu’à ce que le signal soit maximisé.
- Déplacez la gouttelette DMSO pour couvrir tout le champ de vision et vérifiez si le signal CC maximal est centré dans l’image (le signal dépend du faisceau de la pompe). Ajustez soit la position du faisceau de la pompe via un miroir, soit le décalage de tension dans le logiciel d’imagerie.
- Après l’optimisation CC, ajustez les miroirs de faisceau Stokes jusqu’à ce que le signal CA soit maximisé en ajustant la valeur de seuil pour afficher une saturation d’environ 50 %. Vérifiez si la saturation est centrée dans l’image. Sinon, affinez les miroirs uniquement dans le faisceau de Stokes. Surveillez le signal pendant l’alignement en tant que rétroaction en temps réel sur la qualité de l’alignement.
- Pour déterminer le SNR, sélectionnez une petite région de l’image DMSO et mesurez la valeur moyenne. Pour le bruit, sélectionnez une petite zone dans la zone vide de l’image et déterminez à la fois la valeur moyenne et l’écart type. Soustrayez la valeur moyenne du bruit de la valeur moyenne du signal et divisez les résultats par l’écart type de la région vide.
- Si le SNR calculé n’est pas assez élevé (généralement 800-1 000 pour SRS et >10 000 pour CARS à une tension PMT de 0,4 V avec cette combinaison de puissance), vérifiez et réoptimisez le chevauchement du faisceau, la taille du faisceau et la position de l’étage de retard, affinez l’AOM et modifiez la fréquence de modulation du générateur de fonction jusqu’à ce que le SNR attendu soit obtenu.
- Préparez un échantillon chimique pour l’alignement du système. Suivez la procédure décrite à l’étape 3.1 pour la préparation des échantillons.
2. Analyse d’images et traitement des données
- Analyse SNR
- Ouvrez le logiciel ImageJ. Pour importer l’exemple de fichier .txt DMSO enregistré, cliquez sur Fichier | Importer | | d’image textuelle Ouvrir.
- Une fois l’image importée, appuyez sur CTRL + Maj + C pour afficher la fonction de luminosité et de contraste (B & C). Pour trouver le signal d’échantillonnage maximal, appuyez sur le bouton automatique du B&C jusqu’à ce qu’une région de l’échantillon DMSO apparaisse saturée.
- Cliquez sur l’outil de sélection ovale de l’interface ImageJ et mettez en surbrillance une petite zone de la région DMSO saturée. Une fois la mise en surbrillance, appuyez sur M pour mesurer la moyenne et l’écart-type de la zone sélectionnée.
- Pour mesurer l’arrière-plan, ajustez les barres dans la fonction B & C jusqu’à ce que le signal de la région vide puisse être observé. Cliquez sur la sélection ovale et mettez en surbrillance une région de l’arrière-plan de la même taille que pour l’étape 2.1.3. Assurez-vous que la région sélectionnée ne contient pas de DMSO. Appuyez sur M pour mesurer les statistiques de la zone sélectionnée.
- Calculez le SNR conformément à l’étape 1.6.10.
- Traitement d’images CRS hyperspectrales
- Importez le fichier .txt conformément à l’étape 2.1.1. Une fois importé, cliquez sur Image | Piles | Outils | Montage à Stack... pour convertir le fichier en pile d’images.
- Faites défiler le montage jusqu’à ce que le premier pic DMSO soit visible. Sélectionnez une région sur le DMSO et cliquez sur Image | | de pile Tracez le profil de l’axe Z pour tracer le spectre de l’intensité par rapport au nombre d’images. Pour extraire les données spectrales brutes, cliquez sur la liste et copiez les données de profil.
- Pour convertir le spectre récupéré en unités de nombre d’onde, effectuez une régression linéaire comme indiqué à l’étape 1.5.5.
- Raccord pour mesurer la résolution spectrale
REMARQUE: Les fonctions lorentziennes sont utilisées pour s’adapter aux spectres SRS et CARS28.- Ouvrez le logiciel d’ajustement, puis copiez et collez les données de régression linéaire dans le programme. Pour ajuster les données SRS, mettez-les en surbrillance, puis tracez les données sous forme de nuage de points.
- Tirez vers le haut le nuage de points. Cliquez sur Analyse | Pics et | de référence | Peak Fit multiple Ouvrez la boîte de dialogue pour afficher l’analyseur de crête. Lorsque vous tirez vers le haut, vérifiez que l’entrée est le tracé actuel et remplacez la fonction de pic par Lorentzian (Lorentz).
- Double-cliquez sur chacun des deux pics DMSO du graphique pour mettre en surbrillance les régions à ajuster. Ensuite, cliquez sur Ouvrir NLfit pour afficher la fenêtre de raccord . Cliquez sur le bouton Ajuster jusqu’à la convergence , puis sur OK, pour afficher un résumé tabulaire des coefficients de raccord (voir Eq (3)).
REMARQUE: L’équation ci-dessous montre le format de fonction Lorentzian dans le logiciel. A1/2 sont les amplitudes des pics d’ajustement, w1/2 sont les largeurs des pics ajustés et les valeurs x01/02 sont les centres des pics ajustés. La variable indépendante est x et la variable dépendante est y.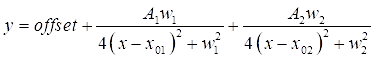 (3)
(3) - Pour l’ajustement spectral CARS, cliquez sur Analyse | | de montage Ajustement de courbe non linéaire | Ouvrir la boîte de dialogue. Sélectionnez la catégorie : nouveau pour définir une nouvelle fonction pour CARS. Utilisez une fonction d’ajustement CARS à deux pics définie ci-dessous (voir Eq (4)) pour l’ajustement spectral CARS.
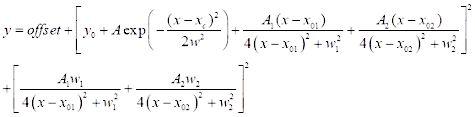 (4)
(4)
- Détermination de la résolution spatiale
REMARQUE: Avant cette étape, il est important de connaître la conversion entre la taille de pixel à un grossissement spécifique, le nombre de pixels et la taille de pas en μm. Cela peut être effectué en utilisant un échantillon d’un diamètre connu qui est plus grand que la résolution d’imagerie attendue, en mesurant son profil de ligne et en ajustant une fonction gaussienne pour déterminer la pleine largeur à la valeur FWHM (FWHM). Des cibles de résolution ou des échantillons uniformes tels que des billes polymères peuvent être utilisés.- Acquérir une image de cellules ou de particules de polymère de moins de 200 nm de diamètre.
- Utilisez ImageJ pour tracer une ligne sur la plus petite particule de l’image.
- Appuyez sur K pour tracer le profil d’intensité.
- Cliquez sur liste dans la fenêtre contextuelle et copiez les informations dans le logiciel d’ajustement.
- Tracez le profil dans le logiciel d’ajustement et utilisez l’ajustement gaussien (cliquez sur Analyse | | de montage Ajustement de courbe non linéaire | Ouvrir la boîte de dialogue | Catégorie: Fonctions de base; Fonction: Gauss).
- Lisez la largeur du pic après l’ajustement. Utilisez la conversion pixel en taille pour obtenir la résolution réelle du microscope.
3. Préparation des échantillons pour l’imagerie CRS hyperspectrale
- Préparation de lames d’imagerie et d’échantillons chimiques
- Placez un morceau de ruban adhésif double face sur un couvercle et découpez une petite forme rectangulaire du ruban adhésif au milieu du ruban adhésif placé pour créer une zone ouverte pour que l’échantillon soit placé.
- Pipette 1-2 μL de DMSO pur et distribuer la gouttelette au centre de la vacance.
- Placez soigneusement le couvercle supérieur et appuyez doucement sur les bords des couvercles pour sceller la chambre tout en vous assurant que l’échantillon de DMSO n’entre pas en contact avec les bords du ruban.
- Pour les expériences de sensibilité, préparer des dilutions en série de DMSO dans de l’oxyde de deutérium (D2O) pour donner une plage de concentration de 50% à 0%. Prélever 1 à 2 μL de chaque solution et préparer les échantillons pressés comme décrit ci-dessus.
- Préparation cellulaire
- Ensemencez les cellules dans un plat à fond de verre de 35 mm (ou plus) dans le milieu d’aigle modifié (DMEM) de Dulbecco avec 10% de sérum bovin fœtal (FBS) et 1% de pénicilline / streptomycine.
- Incuber les cellules dans une chambre d’incubation à 37 °C avec une atmosphère de CO2 de 5 % pendant la nuit ou plus jusqu’à ce que la confluence soit de ~50 % à 80 %.
- Imagez les cellules vivantes directement ou fixez les cellules avec une solution de formol à 10% pour l’imagerie.
Résultats
Comparaisons de la résolution spectrale
La figure 2 compare la résolution spectrale de la microscopie hyperspectrale SRS (Figure 2A) et CARS (Figure 2B) à l’aide d’un échantillon de DMSO. Pour le spectre SRS, deux fonctions lorentziennes (voir l’étape 2.3 du protocole) ont été appliquées pour s’adapter au spectre, et une résolution de 14,6 cm-1 a été obtenue en utilisant le pic de 2 913 cm-1 . Pour CARS, une fonction d’ajustement à deux pics avec un fond gaussien (voir l’étape 2.3 du protocole) a été utilisée pour le raccord, ce qui a donné la résolution spectrale de 17,1 cm-1. Ces résultats montrent que, dans les mêmes conditions de mesure, SRS a une meilleure résolution spectrale que CARS. La résolution spectrale réduite dans CARS est principalement contribuée par l’implication du fond non résonant. En outre, il a été constaté que les rapports de crête symétriques (2 913 cm-1) et asymétriques (2 995 cm-1) étaient très différents pour srs et cars. Cela est dû aux différentes corrélations de signal avec la susceptibilité optique non linéaire du troisième ordre, comme décrit dans les équations (1) et (2). Avec la dépendance quadratique de CARS, la différence d’intensité entre les deux pics est amplifiée. Les formes de lignes symétriques des pics SRS et les formes de lignes asymétriques des pics CARS peuvent être observées dans le spectre. L’asymétrie du signal CARS est principalement due à la présence de l’interférence de fond non résonante. Les pics spectraux CARS apparaissent légèrement décalés vers le rouge (1-2 cm-1) par rapport aux pics SRS. Cela provient également de l’interférence de fond non résonante avec les pics de résonance.
Comparaisons de la sensibilité de détection
La figure 3 compare la sensibilité de détection de la microscopie hyperspectrale SRS et CARS. Le SNR des signaux SRS du DMSO (2 913 cm-1) en fonction de la concentration de DMSO dans D2O à des concentrations élevées est tracé en premier (1%-50%, Figure 3A). Les résultats montrent une relation linéaire, équation satisfaisante (2). La figure 3B représente les spectres de DMSO à des concentrations de 0,1 % et 0,01 %, dans lesquelles le pic de 2 913 cm-1 peut être résolu dans le premier mais pas dans le second, indiquant que la limite de détection se situe entre 0,1 % et 0,01 % de DMSO. En utilisant la limite de critères vides, nous avons estimé que la limite de détection SRS est de 0,021% DMSO. La figure 3C représente le SNR CARS en fonction de la concentration de DMSO (1%-50%), montrant une dépendance quadratique en accord avec l’équation (1). Les spectres CARS récupérés en phase sont représentés à la figure 3D pour le DMSO de 0,1 % et 0,01 %. Pour obtenir ces spectres, une méthode de récupération de phase spectrale basée sur les relations kramers-Kronig a été utilisée et une suppression supplémentaire de l’arrière-plan a été effectuée16. Semblable aux spectres SRS, le pic de DMSO 2 913 cm-1 peut être clairement résolu pour le DMSO de 0,1 % mais pas pour le 0,01 %, ce qui indique une limite de détection entre ces deux concentrations. En utilisant la limite de critères vides, nous avons estimé que la limite de détection SRS est de 0,015% DMSO. Le DMSO de 0,02 % correspond à 2,8 mM. Par conséquent, la limite de détection du microscope CRS hyperspectral utilisé ici est d’environ 2,1 à 2,8 mM de DMSO.
Comparaisons de la résolution spatiale
La figure 4 compare la résolution d’une petite caractéristique cellulaire détectée dans les images SRS (Figure 4A) et CARS (Figure 4B). Les profils d’intensité de la même ligne sont affichés et ajustés à l’aide d’une fonction gaussienne pour déterminer les valeurs FWHM pour la comparaison de résolution. Le signal SRS donnait une résolution de 398,6 nm (Figure 4C), tandis que le signal CARS donnait une résolution de 330,3 nm (Figure 4D). La résolution de CARS était ~ 1,2 fois meilleure que celle du SRS. La raison de la différence de résolution réside également dans les équations (1) et (2). Les faisceaux de pompe et de Stokes ont tous deux une fonction d’étalement de points gaussiens au foyer. Le signal de CARS est alors proportionnel à la multiplication de trois fonctions gaussiennes, ce qui réduit grosso modo la largeur d’un facteur de √3. De même, pour SRS, la largeur est réduite d’un facteur de √2. Par conséquent, la résolution de CARS était de √3/√2 = 1,2 fois meilleure que celle du SRS.
Comparaisons des images de cellules
La figure 5 compare les images SRS et CARS des cellules MIA PaCa-2 à différentes positions de retard optique. La figure 5A montre les images SRS au retard optique qui a donné le signal le plus fort. Dans cette image, des gouttelettes lipidiques (LD), du réticulum endoplasmique (ER) et du noyau (NU) peuvent être détectés, les LD ayant les signaux les plus forts montrés sous forme de points lumineux. La figure 5B montre l’image du canal CARS avec le même retard optique, avec des contrastes très réduits pour les LD. Les principales raisons de cette différence de contraste sont la présence du fond non résonant et le décalage vers le rouge du même pic Raman dans les spectres CARS. À ce retard optique, le signal généré a une grande contribution du fond non résonant de l’eau. Pour améliorer le contraste lipidique dans CARS, le retard optique a été réglé sur une valeur décalée vers le rouge. Le décalage vers le rouge a amélioré les contrastes lipidiques en concentrant plus d’énergie sur les 2 850 cm-1 pour le SRS (Figure 5C) et le CARS (Figure 5D), bien que le niveau global du signal ait été réduit. Pour CARS, un contraste similaire de LDs à srS a été obtenu par un décalage vers le rouge d’environ 98 cm-1 dans la mise au point spectrale (figure 5D), bien qu’un arrière-plan supérieur à celui de l’image SRS ait encore été observé. À ce retard optique, l’image SRS montre beaucoup moins de teneurs en protéines et en acides nucléiques, mais de fortes teneurs en lipides dans les LD, les RE et les membranes cellulaires (Figure 5C).
CARS est un processus paramétrique tandis que SRS est non paramétrique. Une telle différence contribue également à des différences de contraste dans les deux modalités. Les signaux CARS paramétriques sont déterminés par l’interférence des signaux CARS provenant de différentes couches proches de la mise au point laser, qui peuvent montrer des contrastes négatifs comme l’indiquent les flèches de la figure 5B et de la figure 5D (également à la figure 4B). De tels contrastes négatifs induits par les interférences de signal sont absents des images SRS. Le contraste négatif dans CARS peut fournir des informations sur la position axiale de la cible d’intérêt.
Les signaux SRS ont une relation linéaire avec la concentration moléculaire, tandis que les signaux CARS satisfont une dépendance de concentration quasi quadratique. Par conséquent, les LD riches en CH2 montrent un signal beaucoup plus fort que l’ER et les membranes cellulaires dans l’image CARS que dans l’image SRS (Figure 5E,F). Les spectres SRS peuvent être extraits d’images hyperspectrales. La figure 5G montre les spectres SRS typiques des LD, ER, cytosol (CY) et NU. L’intensité et la forme spectrale sont différentes selon les compartiments cellulaires. LD montre un signal beaucoup plus fort à 2 850 cm-1 que les autres organites. En ce qui concerne les CARS, des spectres similaires, bien que de formes différentes, peuvent être obtenus. Les spectres CARS bruts montrent un petit décalage vers le rouge par rapport aux spectres SRS correspondants. La récupération de phase spectrale peut également être utilisée pour extraire les réponses Raman à l’aide des spectres CARS.
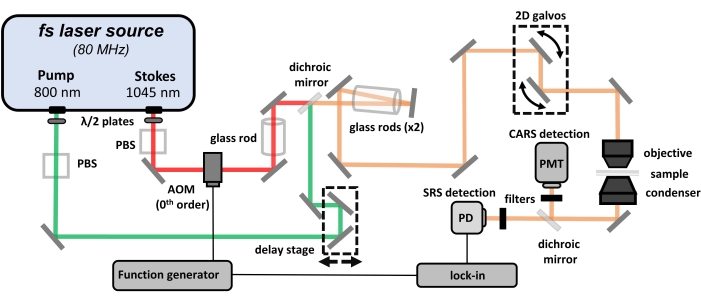
Figure 1 : Schéma du microscope hyperspectral CARS/SRS. Abréviations : CARS = diffusion Raman anti-Stokes cohérente ; SRS = diffusion Raman stimulée; PBS = séparateur de faisceau de polarisation; = photodiode; PMT = tube photomultiplicateur; AOM = modulateur acousto-optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
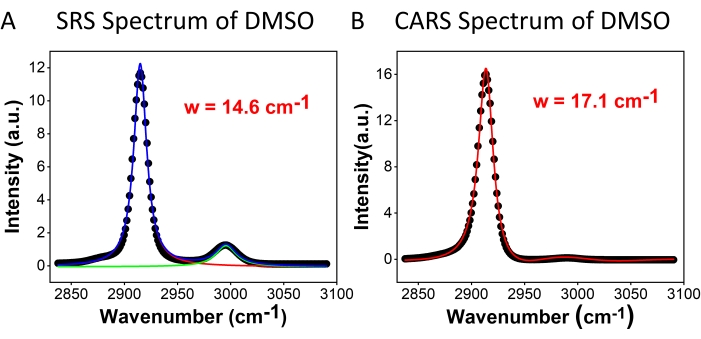
Figure 2: Spectres DMSO. (A) SRS et (B) Spectres CARS de DMSO. Les points sont des données expérimentales; les courbes sont des résultats d’ajustement spectral. Abréviations : CARS = diffusion Raman anti-Stokes cohérente ; SRS = diffusion Raman stimulée; DMSO = diméthylsulfoxyde; w = résolution spectrale. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Rapports signal/bruit et spectres du DMSO. (A) Rapport signal/bruit du pic symétrique du DMSO à 2 913 cm-1 en fonction de la concentration dans D2O mesurée par SRS. Les points sont des données expérimentales; la ligne est le résultat de l’ajustement linéaire. (B) Les spectres SRS de 0,1 % et 0,01 % de DMSO dans D2O. (C) Rapport signal/bruit du pic symétrique DMSO à 2 913 cm-1 en fonction de la concentration dans D2O mesuré par CARS. Les points sont des données expérimentales; la courbe est le résultat de l’ajustement polynomial du deuxième degré. (D) Les spectres CARS de 0,1% et 0,01% de DMSO dans D2O. Abréviations: CARS = diffusion Raman anti-Stokes cohérente; SRS = diffusion Raman stimulée; DMSO = diméthylsulfoxyde; SNR = rapport signal/bruit; D2O = oxyde de deutérium. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Images SRS et CARS et profils d’intensité d’une cellule MIA PaCa-2. (A) Image SRS d’une cellule MIA PaCa-2. (B) Une image CARS d’une cellule MIA PaCa-2 dans le même champ de vision que le panneau A. (C) Profil d’intensité du SRS le long de la ligne jaune dans le panneau A. (D) Profil d’intensité des CARS le long de la ligne jaune du panneau B. Les points sont des données expérimentales; les courbes sont des résultats d’ajustement de fonction gaussienne. Barres d’échelle = 5 μm. Abréviations : CARS = diffusion Raman anti-Stokes cohérente ; SRS = diffusion Raman stimulée; w = résolution. Veuillez cliquer ici pour voir une version agrandie de cette figure.
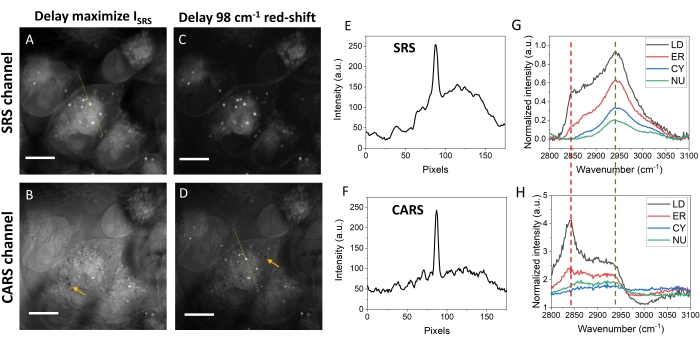
Figure 5 : Images et profil d’intensité des cellules MIA PaCa-2. (A) Une image SRS des cellules MIA PaCa-2 au délai optimisé pour l’intensité SRS. (B) Une image CARS au même délai que dans le panneau A. (C) Une image SRS aux retards décalés vers le rouge de 98 cm-1 comme dans le panneau A. D) Une image CARS avec le même retard optique que dans le panneau C. (E,F) Les profils d’intensité SRS et CARS tracés le long des lignes pointillées dans les panneaux A et D. (G) Spectres SRS typiques des gouttelettes lipidiques, du réticulum endoplasmique, du cytosol et du noyau. (H) Spectres CARS typiques des quatre compositions cellulaires. Les lignes pointillées vertes et rouges sont des positions de retard pour les panneaux A/B et C/D, respectivement. Barres d’échelle = 10 μm. Abréviations : CARS = diffusion Raman anti-Stokes cohérente ; SRS = diffusion Raman stimulée; LD = gouttelettes lipidiques; ER = réticulum endoplasmique; CY = cytosol; NU = noyau. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire : Logiciel écrit en laboratoire basé sur LabVIEW ayant un affichage multicanal simultané pour la visualisation et l’enregistrement d’images en temps réel. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole présenté ici décrit la construction d’un microscope CRS multimodal et la comparaison directe entre CARS et l’imagerie SRS. Pour la construction du microscope, les étapes critiques sont le chevauchement spatial et temporel des faisceaux et l’optimisation de la taille des faisceaux. Il est recommandé d’utiliser un échantillon standard tel que le DMSO avant l’imagerie biologique pour optimiser le SNR et calibrer les décalages Raman. La comparaison directe entre les images CARS et SRS révèle que CARS a une meilleure résolution spatiale, tandis que SRS donne une meilleure résolution spectrale et des contrastes chimiques moins alambiqués. CARS et SRS ont des limites de détection similaires.
L’imagerie CARS et SRS utilise des lasers à impulsions à haute énergie pour l’excitation. Cela permet à la plate-forme d’intégrer d’autres modalités d’imagerie optique non linéaire telles que la fluorescence d’excitation multiphotonique, la génération d’harmoniques et l’absorption transitoire pour des contrastes chimiques supplémentaires28,39.
CARS et SRS ont été largement utilisés pour étudier la composition lipidique avec une sélectivité chimique élevée. Cependant, les technologies ne se limitent pas à quantifier les lipides. Le SRS a été appliqué pour cartographier la distributiondes médicaments 42, la synthèse des protéines43 et l’ADN44. CARS et SRS ont également été appliqués pour imager les ingrédients pharmaceutiques et les excipients dans les comprimés 45,46,47,48. Hyperspectral CARS et SRS ont trouvé des applications dans le diagnostic du cancer49, l’évaluationdes maladies cardiovasculaires 50 et l’imagerie neuronale51. Ils peuvent également être appliqués pour les études COVID-1952. Les CARS à large bande, qui peuvent couvrir des fenêtres spectrales aussi larges que 3 000 cm-1, peuvent élucider de riches structures chimiques dans des échantillons biologiques53. Cependant, en raison de la lenteur du taux de lecture du CCD, le temps de séjour des pixels est de l’ordre de quelques millisecondes, beaucoup plus lent que le temps de séjour des pixels de la microseconde pour la microscopie SRS34. La microscopie SRS hyperspectrale a actuellement une bande passante typique de 200-300 cm-1, limitée par la bande passante laser et l’absence de détecteurs à réseau intégrés34. La microscopie SRS à transformée de Fourier est un moyen alternatif d’élargir potentiellement la couverture spectrale SRS35.
Bien que CARS et SRS fournissent des informations chimiques riches sans avoir besoin de marquage, la sélectivité chimique réside dans les liaisons chimiques, ce qui rend difficile la distinction de protéines spécifiques. Les étiquettes Raman ont montré le potentiel d’améliorer la sélectivité chimique de CARS et SRS54,55. Cependant, l’imagerie Raman cohérente a encore une sensibilité beaucoup plus faible par rapport à la détection par fluorescence. L’amélioration de surface a été utilisée pour la spectroscopie de diffusion Raman spontanée afin d’améliorer les niveaux de signal56. Il a également été appliqué à CARS et SRS pour l’amplification du signal 57,58,59. Bien que le facteur d’amélioration ne soit pas aussi élevé que la diffusion Raman spontanée, la microscopie CARS et SRS améliorée en surface montre toujours le potentiel de détection de molécules uniques59,60. Néanmoins, l’utilisation de particules ou de surfaces métalliques prive l’avantage de l’approche sans étiquette. Améliorer la sensibilité de la microscopie Raman cohérente sans utiliser de surfaces métalliques élargirait considérablement l’application de la technologie en sciences biologiques.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a été soutenue par le fonds de démarrage du département de chimie de l’Université Purdue.
matériels
| Name | Company | Catalog Number | Comments |
| 2D galvo scanner set | Thorlabs | GVS002 | |
| Acousto-optic modulator | Isomet | M1205-P80L-0.5 | |
| AOM driver | Isomet | 532B-2 | |
| Data acquisition card | National Instruments | PCle 6363 | Custom ordered filter (980 sp) |
| Delay stage | Zaber | X-LSM050A | |
| Deuterium oxide | Millipore Sigma | 151882-100G | |
| Dichroic mirror for beam combination | Thorlabs | DMLP1000 | |
| Dichroic mirror for signal separation | Semrock | FF776-Di01-25x36 | |
| DMSO | MiliporeSigma | 200-664-3 | |
| MIA PaCa 2 Cells | ATCC | CRL-1420 | |
| Femtosecond laser system | Spectral Physics | InSightX3+ | |
| Filter for CARS | Chroma | AT655/30m | |
| Filter for SRS | Chroma | ET980sp | |
| Function generator | Rigol | DG1022Z | |
| Glass rods | Lattice Electro Optics | SF-57 | |
| Half-wave plate | Newport | 10RP02-51; 10RP02-46 | |
| LabVIEW 2020 | National Instruments | This is the image acquisition software | |
| Lock-in amplifier | Zurich Instrument | HF2LI | |
| Microscope housing | Olympus | BX51W1 | |
| Objective lens | Olympus | UPLSAPO60XW | |
| Origin Pro 2019b | OriginLab Corporation | This is the spectral fitting software | |
| Oscilloscope | Tektronix | TBS2204B | |
| Photodiode | Hamamatsu | S3994-01 | |
| PMT detector | Hamamatsu | H7422P-40 | |
| PMT voltage amplifier | Advanced Research Instrument Corp. | PMT4V3 | |
| Polarizing beamsplitter cube | Thorlabs | PBS255 | |
| Terminal block | National Instruments | BNC-2110 |
Références
- Raman, C. V. A change of wave-length in light scattering. Nature. 121 (3051), 619(1928).
- Li, S., Li, Y., Yi, R., Liu, L., Qu, J. Coherent anti-Stokes Raman scattering microscopy and its applications. Frontiers in Physics. 8, 515(2020).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annual Review of Analytical Chemistry. 1 (1), 883-909 (2008).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62, 507-530 (2011).
- Suhalim, J. L., Boik, J. C., Tromberg, B. J., Potma, E. O. The need for speed. Journal of Biophotonics. 5 (5-6), 387-395 (2012).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Optics Letters. 7 (8), 350-352 (1982).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Physical Review Letters. 82 (20), 4142-4145 (1999).
- Cheng, J. -X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: instrumentation, theory, and applications. The Journal of Physical Chemistry B. 108 (3), 827-840 (2004).
- Evans, C. L., et al. Chemical imaging of tissue in vivo with video-rate coherent anti-Stokes Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 102 (46), 16807(2005).
- Cheng, J. -X., Volkmer, A., Book, L. D., Xie, X. S. An epi-detected coherent anti-Stokes Raman scattering (E-CARS) microscope with high spectral resolution and high sensitivity. The Journal of Physical Chemistry B. 105 (7), 1277-1280 (2001).
- Volkmer, A., Book, L. D., Xie, X. S. Time-resolved coherent anti-Stokes Raman scattering microscopy: Imaging based on Raman free induction decay. Applied Physics Letters. 80 (9), 1505-1507 (2002).
- Marks, D. L., Boppart, S. A. Nonlinear interferometric vibrational imaging. Physical Review Letters. 92 (12), 123905(2004).
- Ganikhanov, F., Evans, C. L., Saar, B. G., Xie, X. S. High-sensitivity vibrational imaging with frequency modulation coherent anti-Stokes Raman scattering (FM CARS) microscopy. Optics Letters. 31 (12), 1872-1874 (2006).
- Potma, E. O., Evans, C. L., Xie, X. S. Heterodyne coherent anti-Stokes Raman scattering (CARS) imaging. Optics Letters. 31 (2), 241-243 (2006).
- Liu, Y., Lee, Y. J., Cicerone, M. T. Broadband CARS spectral phase retrieval using a time-domain Kramers-Kronig transform. Optics Letters. 34 (9), 1363-1365 (2009).
- Masia, F., Karuna, A., Borri, P., Langbein, W. Hyperspectral image analysis for CARS, SRS, and Raman data. Journal of Raman Spectroscopy. 46 (8), 727-734 (2015).
- Knutsen, K. P., Johnson, J. C., Miller, A. E., Petersen, P. B., Saykally, R. J. High spectral resolution multiplex CARS spectroscopy using chirped pulses. Chemical Physics Letters. 387 (4-6), 436-441 (2004).
- Okuno, M., Kano, H., Leproux, P., Couderc, V., Hamaguchi, H. -o Ultrabroadband multiplex CARS microspectroscopy and imaging using a subnanosecond supercontinuum light source in the deep near infrared. Optics Letters. 33 (9), 923-925 (2008).
- Masia, F., Glen, A., Stephens, P., Borri, P., Langbein, W. Quantitative chemical imaging and unsupervised analysis using hyperspectral coherent anti-Stokes Raman scattering microscopy. Analytical Chemistry. 85 (22), 10820-10828 (2013).
- Pegoraro, A. F., Slepkov, A. D., Ridsdale, A., Moffatt, D. J., Stolow, A. Hyperspectral multimodal CARS microscopy in the fingerprint region. Journal of Biophotonics. 7 (1-2), 49-58 (2014).
- Eckhardt, G., et al. Stimulated Raman scattering from organic liquids. Physical Review Letters. 9 (11), 455-457 (1962).
- Ploetz, E., Laimgruber, S., Berner, S., Zinth, W., Gilch, P. Femtosecond stimulated Raman microscopy. Applied Physics B. 87 (3), 389-393 (2007).
- Freudiger, C. W., et al. Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy. Science. 322 (5909), 1857-1861 (2008).
- Nandakumar, P., Kovalev, A., Volkmer, A. Vibrational imaging based on stimulated Raman scattering microscopy. New Journal of Physics. 11 (3), 033026(2009).
- Slipchenko, M. N., Le, T. T., Chen, H., Cheng, J. -X. High-speed vibrational imaging and spectral analysis of lipid bodies by compound Raman microscopy. The Journal of Physical Chemistry B. 113 (21), 7681-7686 (2009).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annual Review of Physical Chemistry. 62 (1), 507-530 (2011).
- Zhang, C., Zhang, D., Cheng, J. -X. Coherent Raman scattering microscopy in biology and medicine. Annual Review of Biomedical Engineering. 17 (1), 415-445 (2015).
- Prince, R. C., Frontiera, R. R., Potma, E. O. Stimulated Raman scattering: from bulk to nano. Chemical Reviews. 117 (7), 5070-5094 (2017).
- Lu, F. -K., et al. Multicolor stimulated Raman scattering microscopy. Molecular Physics. 110 (15-16), 1927-1932 (2012).
- Ozeki, Y., et al. High-speed molecular spectral imaging of tissue with stimulated Raman scattering. Nature Photonics. 6 (12), 845-851 (2012).
- Wang, P., et al. Label-free quantitative imaging of cholesterol in intact tissues by hyperspectral stimulated raman scattering microscopy. Angewandte Chemie International Edition. 125 (49), 13280-13284 (2013).
- Freudiger, C. W., et al. Stimulated Raman scattering microscopy with a robust fibre laser source. Nature Photonics. 8 (2), 153-159 (2014).
- Liao, C. -S., et al. Microsecond scale vibrational spectroscopic imaging by multiplex stimulated Raman scattering microscopy. Light: Science & Applications. 4 (3), 265(2015).
- Liao, C. -S., et al. Spectrometer-free vibrational imaging by retrieving stimulated Raman signal from highly scattered photons. Science Advances. 1 (9), 1500738(2015).
- He, R., et al. Dual-phase stimulated Raman scattering microscopy for real-time two-color imaging. Optica. 4 (1), 44-47 (2017).
- Andresen, E. R., Berto, P., Rigneault, H. Stimulated Raman scattering microscopy by spectral focusing and fiber-generated soliton as Stokes pulse. Optics Letters. 36 (13), 2387-2389 (2011).
- Fu, D., Holtom, G., Freudiger, C., Zhang, X., Xie, X. S. Hyperspectral imaging with stimulated Raman scattering by chirped femtosecond lasers. The Journal of Physical Chemistry B. 117 (16), 4634-4640 (2013).
- Zhang, C., Aldana-Mendoza, J. A. Coherent Raman scattering microscopy for chemical imaging of biological systems. Journal of Physics: Photonics. , (2021).
- Martens, W. N., Frost, R. L., Kristof, J., Theo Kloprogge, J. Raman spectroscopy of dimethyl sulphoxide and deuterated dimethyl sulphoxide at 298 and 77 k. Journal of Raman Spectroscopy. 33 (2), 84-91 (2002).
- Gill, G. W. Cytopreparation: Principles & Practice. Gill, G. W. , Springer. New York. 309-323 (2013).
- Fu, D., et al. Imaging the intracellular distribution of tyrosine kinase inhibitors in living cells with quantitative hyperspectral stimulated Raman scattering. Nature Chemistry. 6 (7), 614-622 (2014).
- Wei, L., Yu, Y., Shen, Y., Wang, M. C., Min, W. Vibrational imaging of newly synthesized proteins in live cells by stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 110 (28), 11226-11231 (2013).
- Lu, F. -K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences. 112 (37), 11624-11629 (2015).
- Slipchenko, M. N., et al. Vibrational imaging of tablets by epi-detected stimulated Raman scattering microscopy. Analyst. 135 (10), 2613-2619 (2010).
- Slipchenko, M. N., Zhou, B., Pinal, R., Teresa Carvajal, M., Cheng, J. -X. RAMAN-chemical imaging of solid dosage forms based on stimulated Raman scattering. American Pharmaceutical Review. 15 (3), 66(2012).
- Sarri, B., et al. Discriminating polymorph distributions in pharmaceutical tablets using stimulated Raman scattering microscopy. Journal of Raman Spectroscopy. 50 (12), 1896-1904 (2019).
- Fussell, A. L., Kleinebudde, P., Herek, J., Strachan, C. J., Offerhaus, H. L. Coherent anti-Stokes Raman scattering (CARS) microscopy visualizes pharmaceutical tablets during dissolution. JoVE (Journal of Visualized Experiments). (89), e51847(2014).
- Freudiger, C. W., et al. Multicolored stain-free histopathology with coherent Raman imaging). Laboratory Investigation. 92 (10), 1492-1502 (2012).
- Lim, R. S., et al. Multimodal CARS microscopy determination of the impact of diet on macrophage infiltration and lipid accumulation on plaque formation in ApoE-deficient mice [S]. Journal of Lipid Research. 51 (7), 1729-1737 (2010).
- Ji, M., et al. label-free detection of brain tumors with stimulated Raman scattering microscopy. Science Translational Medicine. 5 (201), (2013).
- Tabish, T. A., Narayan, R. J., Edirisinghe, M. Rapid and label-free detection of COVID-19 using coherent anti-Stokes Raman scattering microscopy. Mrs Communications. 10 (4), 566-572 (2020).
- Camp, C. H., et al. High-speed coherent Raman fingerprint imaging of biological tissues. Nature Photonics. 8 (8), 627-634 (2014).
- Wei, L., et al. Live-cell bioorthogonal chemical imaging: stimulated Raman scattering microscopy of vibrational probes. Accounts of Chemical Research. 49 (8), 1494-1502 (2016).
- Hu, F., Shi, L., Min, W. Biological imaging of chemical bonds by stimulated Raman scattering microscopy. Nature Methods. 16 (9), 830-842 (2019).
- Nie, S., Emory, S. R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering. Science. 275 (5303), 1102-1106 (1997).
- Steuwe, C., Kaminski, C. F., Baumberg, J. J., Mahajan, S. Surface enhanced coherent anti-Stokes Raman scattering on nanostructured gold surfaces. Nano Letters. 11 (12), 5339-5343 (2011).
- Fast, A., Kenison, J. P., Syme, C. D., Potma, E. O. Surface-enhanced coherent anti-Stokes Raman imaging of lipids. Applied Optics. 55 (22), 5994-6000 (2016).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Yampolsky, S., et al. Seeing a single molecule vibrate through time-resolved coherent anti-Stokes Raman scattering. Nature Photonics. 8 (8), 650-656 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon