Method Article
Excision mésorectale totale assistée par robot et curage ganglionnaire pelvien latéral pour le cancer du rectum localement avancé de moyenne à basse température
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La technique robotique décrite ici vise à détailler une approche par étapes de l’excision mésorectale totale assistée par robot et du curage ganglionnaire pelvien latéral pour le cancer du rectum localement avancé (T3 / T4) situé sous la réflexion péritonéale.
Résumé
Depuis leur approbation pour une utilisation clinique, les robots chirurgicaux da Vinci ont montré de grands avantages dans les opérations chirurgicales gastro-intestinales, en particulier dans les procédures complexes. Le visuel 3D de haute qualité, le bras multijoint et la filtration naturelle des tremblements permettent au chirurgien d’exposer et de disséquer plus précisément avec une invasion minimale. L’excision mésorectale totale est la technique chirurgicale standard pour le traitement du cancer du rectum résécable. Pour réduire le taux de récidive latérale, un curage ganglionnaire pelvien latéral peut être effectué, car il s’agit d’une procédure sûre et réalisable pour le cancer du rectum localement avancé de milieu à bas avec une forte possibilité de métastases aux ganglions lymphatiques latéraux. Cependant, la complexité des structures anatomiques et le taux élevé de complications postopératoires limitent son application. Récemment, plusieurs chirurgiens ont de plus en plus utilisé des techniques robotiques pour l’excision mésorectale totale et le curage latéral des ganglions lymphatiques pelviens. Par rapport à la chirurgie ouverte et laparoscopique, la technique robotique présente plusieurs avantages, tels que moins de perte de sang, moins de transfusions sanguines, un traumatisme minimal, une hospitalisation postopératoire plus courte et une récupération plus rapide. Une approche robotique est généralement considérée comme une alternative raisonnable pour les procédures compliquées telles que le curage latéral des ganglions lymphatiques pelviens, bien qu’il existe un nombre limité d’études contrôlées randomisées prospectives de haute qualité rapportant des preuves directes. Ici, nous fournissons les étapes détaillées de l’excision mésorectale totale assistée par robot et du curage ganglionnaire pelvien latéral effectué au premier hôpital affilié de l’Université Xi’an Jiaotong.
Introduction
Depuis leur approbation pour une utilisation clinique par la Food and Drug Administration des États-Unis en 2000, les robots chirurgicaux da Vinci ont été de plus en plus utilisés dans différentes spécialités chirurgicales1. Le système chirurgical robotique présente l’avantage d’utiliser des bras multijoints flexibles, une caméra tridimensionnelle de haute qualité, une filtration des tremblements et une ergonomie considérablement améliorée, ce qui peut minimiser le caractère invasif de l’opération et le rendre ainsi idéal pour les procédures complexes.
Pendant des décennies, l’excision mésorectale totale (EMT) a été la norme pour le traitement du cancer du rectum résécable. Cependant, pour le cancer du rectum avancé (T3/T4) situé sous la réflexion péritonéale, les métastases des ganglions lymphatiques pelviens latéraux (LPLN) sont une cause majeure de récidive locale après la chirurgie2. Les preuves cliniques montrent clairement que le curage ganglionnaire pelvien latéral (LPLND) pourrait réduire considérablement le taux de récidive locale3. Par rapport à la procédure ouverte, le TME assisté par robot et le LPLND ont été associés à moins de pertes de sang, moins de transfusions sanguines et moins de complications postopératoires4. De plus, les résultats à long terme ne sont pas significativement différents entre les deux procédures5. Les résultats de ces rapports indiquent que le LPLND assisté par robot peut être une modalité réalisable pour le cancer du rectum localement avancé. Cependant, il convient de noter que le TME assisté par robot et le LPLND sont des procédures complexes et doivent être effectuées par un chirurgien expérimenté.
Ici, une approche systématique standard du TME assisté par robot et du LPLND est décrite étape par étape. Cette procédure a été développée au centre avec de l’expérience dans l’exécution de plus de trois mille procédures robotiques6. De plus, cette approche était basée sur des caractéristiques anatomiques normales; des variations anatomiques rares doivent être notées.
Nous présentons le cas d’un patient de 64 ans qui a eu une hématochézie intermittente pendant environ 3 mois. L’examen rectal numérique a révélé qu’une masse était située sur la paroi latérale antérieure et droite du rectum, à 5 cm de l’anus. Une tomodensitométrie (TDM) améliorée et une échographie endoscopique (EUS) ont révélé un cancer du rectum inférieur avec métastases des ganglions lymphatiques iliaques internes. La biopsie coloscopique a confirmé la présence d’un adénocarcinome modérément différencié. L’évaluation préopératoire a suggéré que le stade clinique était cT3N + M0. En conséquence, nous avons décidé d’effectuer des TME et LPLND assistés par robot. Le consentement du patient a été obtenu avant d’effectuer ces procédures.
Protocole
Ce protocole est conforme aux directives du Comité d’éthique du premier hôpital affilié de l’Université Xi 'an Jiaotong (n ° 2019ZD04).
1. Préparation préopératoire, position du patient et anesthésie
- Assurer une gestion diététique appropriée avant l’opération.
- Prescrire une boisson glucidique orale préopératoire à consommer au coucher et 4 h avant la chirurgie.
REMARQUE: Cela a été autorisé en fonction du protocole de récupération améliorée après la chirurgie (ERAS). - Ne prescrivez pas d’antibiotiques oraux supplémentaires.
NOTE: La mise en œuvre de ces mesures doit être soigneusement examinée en fonction de l’expérience de chaque centre.
- Prescrire une boisson glucidique orale préopératoire à consommer au coucher et 4 h avant la chirurgie.
- Administrer des antibiotiques préopératoires et une prophylaxie de la thromboembolie veineuse.
- Injecter des antibiotiques préventifs (2 g de cefmétazole, 4,5 g de pipéracilline/tazobactam ou 300 mg de clindamycine selon le test d’allergie médicamenteuse) dans les 1 h précédant l’incision.
- Administrer une prophylaxie de la thrombose veineuse profonde sous la forme d’une injection sous-cutanée d’héparine de bas poids moléculaire (nadroparin calcium, 2850 UI) 2 à 4 h avant l’anesthésie.
- Induire une anesthésie générale.
REMARQUE: Cela doit être effectué en fonction de l’expérience de chaque centre.- Administrer l’analgésie multimodale pour minimiser l’administration de narcotiques, y compris le blocage nerveux régional et l’analgésie non stéroïdienne.
- Effectuer une gestion peropératoire restrictive appropriée du liquide en fonction des besoins de base, de la perte de sang et des résultats de la surveillance hémodynamique.
- De plus, pendant l’opération, surveiller dynamiquement l’électrocardiogramme du patient, la pression artérielle radiale, l’oxymétrie de pouls, la capnographie, les volumes urinaires, la température et l’analyse des gaz sanguins 7.
- Placez un cathéter urétral stérile 16-18 Fr.
- Placez le patient dans une position Lloyd Davis et fixez-le soigneusement à la table d’opération. Assurez-vous que les jambes sont soigneusement rembourrées dans des étriers et que les deux bras sont repliés sur le côté.
2. Paramètres de fonctionnement et placement du port
NOTE: Ces mesures peuvent être adaptées de manière appropriée en fonction de l’expérience de chaque chirurgien.
- Assurez-vous que le chirurgien principal opère à partir de la console robotique et personnalise ses paramètres (Figure 1).
- Demandez à un chirurgien laparoscopique assistant de se tenir sur le côté droit du patient (Figure 1).
- Demandez à une infirmière de se tenir debout sur le côté gauche du patient (figure 1).
- Avant l’opération, confirmez la balance des blancs, réglez la mise au point et l’étalonnage 3D de l’objectif du robot da Vinci Si en suivant les directives du système d’exploitation et chauffez l’objectif dans de l’eau tiède (pas plus de 55 ° C) pour éviter le brouillard.
- Établir le pneumopéritoine et l’emplacement du port.
- Faites une incision de 12 mm à 2-3 cm au-dessus de l’ombilic et légèrement à gauche.
- Élevez l’ombilic et la paroi abdominale avec une pince à serviette et percez dans la cavité abdominale à l’aide d’une aiguille Veress.
- Fixez une seringue jetable remplie de 5 mL de solution saline normale à l’aiguille Veress avec le robinet d’écoulement ouvert. Aspirez la seringue et assurez-vous qu’aucun sang ou matière fécale n’a été aspiré. Injecter 5 mL de solution saline.
- Retirez la seringue de l’aiguille Veress avec le robinet d’écoulement laissé ouvert. Observez le mouvement de la colonne de fluide au sommet de l’aiguille Veress pour confirmer que l’aiguille Veress a percé l’emplacement approprié.
REMARQUE: Le mouvement libre sans aucune résistance du liquide de l’aiguille dans l’abdomen indique un résultat positif pour le test de chute saline et l’aiguille Veress a percé la cavité abdominale. - Connectez le tube d’insufflation à l’aiguille Veress. Ensuite, démarrez l’appareil d’insufflation de CO2 à un réglage de pression de 12 mmHg.
REMARQUE: La pression doit être réglée entre 8 et 15 mmHg. Vérifiez que l’aiguille Veress est à l’endroit approprié en notant la pression. Si la pression augmente rapidement par rapport à la pression réglée, cela indique généralement que l’aiguille Veress n’a pas percé la cavité abdominale. - Une fois que la pression mesurée a atteint la pression de réglage, retirez l’aiguille Veress et réglez un trocart de 12 mm comme port visuel (Figure 2).
- Insérez l’objectif de la caméra robotique et inspectez complètement la cavité abdominale. Rechercher et biopsier les nodules métastatiques suspects et les envoyer pour une histologie de section congelée8.
- Si les adhérences perturbent le réglage du trocart, relâchez-les d’abord à l’aide de l’instrument laparoscopique.
- Réglez les trois ports de bras robotiques. Placez le trocart après avoir fait des incisions cutanées transversales de 8 mm pour chaque trocart. Placez le bras 1 (R1) dans le point droit de McBurney (Figure 2). Placez le bras 2 (R2) dans la ligne médiane gauche au niveau de l’orifice visuel (Figure 2). Placez le bras 3 (R3) dans la ligne axillaire antérieure gauche au niveau du port visuel (Figure 2).
REMARQUE: Assurez-vous que la distance entre les ports adjacents est de 8 à 10 cm. - Placez un port d’assistant 1 (A1) de 12 mm dans la ligne médiane droite au niveau du port visuel (Figure 2).
- Placez un port d’assistant 2 (A2) de 8 mm à environ 1-2 cm au-dessus de la symphyse pubienne (Figure 2).
- Placez le patient dans une position Trendelenburg à 30° avec une position de 15° vers le bas.
- Après avoir réglé ces ports, placez le robot da Vinci entre les jambes du patient et fixez le bras de la caméra et trois bras d’opération au trocart à l’aide du guidage du système.
- Placez les instruments robotiques. Placez les ciseaux monopolaires dans R1, la pince bipolaire dans R2 et les pinces de préhension Cadiere dans R3.
REMARQUE: L’instrument dans R1 peut être remplacé en fonction des actions du chirurgien principal. Les instruments les plus couramment utilisés sont les ciseaux monopolaires et les scalpels harmoniques.
3. Excision mésorectale totale
- Mobilisez le côlon gauche.
- Rétracter le côlon descendant et sigmoïde médialement par pince de préhension cadière dans R3 pour exposer le sulci paracolique gauche.
- Libérez les adhérences physiologiques du côlon descendant et sigmoïde le long du sulci paracolique avec des ciseaux monopolaires dans R1. Inciser le péritoine le long des sulci paracoliques et disséquer le côlon descendant de supérieur à inférieur avec des ciseaux monopolaires dans R1 jusqu’à ce que l’uretère soit exposé pour mobiliser le côté latéral du côlon de flexion descendant et splénique. Placez un morceau de gaze stérile près de l’uretère comme indicateur.
- Après avoir mobilisé le côté latéral du côlon descendant et de flexion splénique, saisissez et continuez à élever le côlon sigmoïde avec son mésentère vers l’avant à l’aide de pinces de préhension Cadiere en R3. Créez une tension dans le mésentère avec une pince bipolaire dans R2 et des pinces dans la main de l’assistant. Ensuite, reconnaissez la « ligne blanche » du fascia de Toldt, un plan avasculaire. Inciser le péritoine le long de la « ligne blanche ».
- Séparez le long de ce plan vers le sulci paracolique latéral avec des ciseaux monopolaires dans R1 pour mobiliser le côlon sigmoïde. Ensuite, créez un tunnel entre les compartiments médial et latéral sous la direction de la gaze indicatrice qui a été réglée précédemment. Continuer à développer ce plan vers le bas jusqu’au promontoire sacré en utilisant l’électrocautérisation et combiner l’étalement aigu et émoussé. Effectuez la dissection rapidement pour mobiliser complètement le côlon descendant et sigmoïde.
- Transectez l’artère mésentérique inférieure (IMA) et la veine mésentérique inférieure (IMV).
- Après avoir mobilisé le côlon sigmoïde, saisissez et continuez à élever le côlon sigmoïde avec une pince dans R3 pour exposer l’aorte. Disséquer le long de l’aorte de manière supérieure avec des ciseaux monopolaires dans R1 pour exposer l’IMA.
- Changez l’instrument dans R1 de ciseaux monopolaires à un scalpel harmonique.
- À partir de la racine de l’IMA, séparez le tissu lymphatique des vaisseaux avec un scalpel à ultrasons dans R1 jusqu’à l’apparition de l’artère colique gauche. Demandez au chirurgien assistant de clipser l’IMA sous l’origine de l’artère colique gauche avec un grand clip de verrouillage. Ensuite, transectez avec le scalpel harmonique pour minimiser les saignements.
- Continuer à séparer le tissu lymphatique de l’artère colique gauche avec un scalpel harmonique dans R1. Reconnaître la veine mésentérique inférieure (IMV) et la branche descendante de l’artère colique gauche. Demandez à l’assistant chirurgien de clipser et de transecter ces 2 vaisseaux.
- Effectuer une dissection pelvienne du rectum.
- Utilisez un rétracteur à ruban pour soulever le rectum. Placez les pinces de préhension en A2 par le chirurgien assistant et contrôlez le mouvement du rectum en saisissant l’enrouleur à ruban. Remplacez l’instrument dans R1 par des ciseaux monopolaires.
- Soulevez le rectum vers l’avant avec la pince de préhension Cadiere insérée à travers la marge postérieure du côlon sigmoïde pour exposer le promontoire sacré. Ensuite, disséquer dans le plan rétrorectal entre le fascia mésorectien et le fascia du nerf préhypogastrique avec des ciseaux monopolaires dans R1. Se développer le long de ce plan et séparer le fascia mésorectien du fascia nerveux préhypogastrique à l’aide de ciseaux monopolaires dans R1 jusqu’à ce que le niveau du muscle releveur ani soit atteint (Figure 3A).
REMARQUE: L’intégrité du fascia mésorectal doit être conservée. - Inciser le péritoine et ouvrir le plan mésorectal latéral près du rectum avec des ciseaux monopolaires en R1. Demandez au chirurgien assistant de déplacer le rectum de l’autre côté.
- Changez l’instrument dans R1 en scalpel harmonique. Disséquez et développez soigneusement ce plan jusqu’à ce que le niveau du muscle releveur ani soit atteint. Répétez cette étape pour le côté controlatéral.
REMARQUE: En fait, comme la dissection antérieure n’a toujours pas été effectuée, le plan mésorectical latéral est difficile à développer complètement. S’il semble difficile à utiliser, envisagez de traiter d’abord le plan antérieur. - Inciser le péritoine à 1 cm au-dessus de la réflexion du péritoine viscéral avec le scalpel harmonique en R1. Après avoir incisé la réflexion du péritoine viscéral, identifiez les vésicules séminales et le fascia de Denonvilliers qui recouvrent la paroi postérieure de la vésicule séminale.
REMARQUE: Chez les femmes, la dissection doit être effectuée entre la paroi postérieure vaginale et le fascia mésorectal. Les chirurgiens doivent éviter d’endommager la fine paroi postérieure vaginale. - Continuer à développer le plan entre le fascia de Denonvilliers et le fascia mésorectal jusqu’à ce que le niveau du muscle releveur ani soit atteint avec le scalpel harmonique en R3.
- À ce stade, effectuez un examen rectal numérique par voie transanale pour confirmer que la dissection a dépassé la marge distale de la tumeur et qu’il existe des marges appropriées pour la résection.
- Séparer le tissu adipeux entourant le rectum à ce niveau. Transectez le rectum à l’aide d’une agrafeuse de coupe linéaire laparoscopique.
REMARQUE: Assurez-vous que le rectum est transecté sous la bordure distale de la tumeur avec une marge distale de 2 cm ou plus dans la mesure du possible. - Sortez le rectum de la cavité pelvienne et irriguez abondamment la cavité pelvienne avec de l’eau distillée. Effectuer une hémostase à l’aide de l’électrocautérisation avec des pinces bipolaires dans R2.
4. Curage ganglionnaire pelvien latéral
REMARQUE: Le LPLND bilatéral peut commencer sur le côté gauche ou droit. La ligne directrice technique actuelle suggère de commencer par la gauche. Après avoir libéré et mobilisé le côlon sigmoïde et le rectum, l’artère iliaque commune / externe gauche et l’uretère gauche peuvent être clairement identifiés, ce qui facilite le début de la lymphadénectomie de ce côté. Les ganglions lymphatiques pelviens latéraux comprennent la région iliaque commune (n° 273), la région iliaque externe (n° 293), la zone obturatrice (n° 283) et la zone iliaque interne (n° 263). Cependant, des études antérieures indiquent que les métastases fréquentes des ganglions lymphatiques iliaques et externes sont rares9. Par conséquent, les lignes directrices de traitement du cancer colorectal recommandent de se concentrer principalement sur la zone obturatrice (n° 283) et la zone iliaque interne (n° 263) pour la dissection9.
- En commençant par la gauche, inciser le péritoine juste latéralement à l’uretère avec le scalpel harmonique en R1. Étendez l’incision jusqu’au canal déférent.
REMARQUE: Chez les femmes, l’incision doit être étendue jusqu’au ligament rond. Utilisez un scalpel harmonique pour minimiser les lésions vasculaires. - Identifier l’uretère gauche au niveau de sa traversée avec les navires iliaques. Mobilisez ensuite l’uretère et déplacez-le du côté médian avec des pinces en R3. Laissez l’uretère et le fascia du nerf préhypogastrique devenir le plan médian de la dissection du nœud latéral.
REMARQUE: La squelettisation complète de l’uretère peut endommager l’apport sanguin de l’uretère, ce qui doit être évité si possible. De plus, gardez la dissection latérale à l’uretère et au fascia du nerf préhypogastrique pour éviter d’endommager le nerf autonome pelvien situé dans le fascia. - De l’artère iliaque latérale à l’artère iliaque externe, séparer le tissu lymphatique entourant l’artère iliaque externe et la veine avec le scalpel harmonique dans R1.
- Rétractez la veine iliaque externe latéralement avec l’aspirateur dans la main de l’assistant. À la bifurcation de l’artère iliaque interne et externe, séparer le tissu lymphatique avec un scalpel harmonique dans R1 et identifier le nerf obturateur et l’artère ombilicale. Au niveau de la paroi latérale, libérer complètement le tissu lymphatique de la surface du psoas et des muscles obturateurs internes (Figure 3C).
REMARQUE: La bifurcation des artères iliaques internes et externes se trouve à l’extrémité proximale de la dissection du nœud latéral. - Rétracter l’artère ombilicale et le fascia vésicohypogastrique médialement avec l’aspirateur dans la main de l’assistant et séparer le tissu lymphatique du fascia vésicohypogastrique. Laissez l’artère ombilicale et le fascia vésicohypogastrique devenir la paroi médiale de dissection des nœuds obturateurs (#283). Séparez soigneusement le tissu lymphatique du fascia et du nerf le long du nerf obturateur avec le scalpel harmonique dans R1 et identifiez l’artère obturatrice et la veine, qui sont les branches de l’artère et de la veine iliaques internes. Isolez soigneusement l’artère obturatrice et la veine pour éviter toute blessure.
REMARQUE: Certains patients peuvent avoir deux branches nerveuses obturatrices ou plus selon notre expérience. La blessure ou la transsection de l’une de ces branches peut ne pas entraîner de dysfonctionnement grave. Cependant, la transsection complète de toutes les branches d’un côté du nerf obturateur doit être évitée autant que possible. - Rétracter l’uretère et le fascia nerveux préhypogastrique avec l’aspirateur dans la main de l’assistant (Figure 3D). Libérez complètement le tissu lymphatique du fascia avec un scalpel harmonique en R1. Identifiez et isolez les 2-3 artères vésicales supérieures - ce sont les branches de l’artère ombilicale.
REMARQUE: Évitez de ligaturer toutes les branches de l’artère vésicale supérieure pour minimiser le dysfonctionnement urinaire. Au moins une artère vésicale supérieure doit être préservée, en particulier lorsque la LPLND bilatérale est effectuée. Sinon, un dysfonctionnement urinaire grave peut survenir. - Continuer à disséquer le tissu lymphatique et adipeux distalement avec le scalpel harmonique dans R1 jusqu’à ce que le canal déférent.
REMARQUE: Chez les femmes, la dissection doit être effectuée jusqu’à ce que le ligament rond soit atteint. - Prélever le tissu adipeux lymphatique en un seul échantillon de la fosse à l’aide d’un sac d’échantillon stérile (Figure 3E,F). Vérifiez et assurez-vous qu’il n’y a pas de tissu lymphatique résiduel et pas de saignement.
- Si nécessaire, répétez les étapes énumérées dans cette section à droite pour compléter la lymphadénectomie du côté droit.
5. Reconstruction du tube digestif
REMARQUE: Ici, selon l’expérience et les préférences du chirurgien principal, une anastomose colorectale agrafée ou cousue à la main peut être choisie par des méthodes laparoscopiques ouvertes ou robotiques. Les méthodes d’anastomose comprennent l’anastomose droite de bout en bout, l’anastomose colorectale de bout en bout à petit réservoir ou l’anastomose de la poche en J du côlon10. Ici, nous fournissons une technique d’anastomose colorectale agrafée de bout en bout de base, ouverte et droite.
- Faites une incision verticale de la ligne médiane sous l’ombilical. Placez un protecteur de plaie.
REMARQUE: On peut également sélectionner une incision de Pfannenstiel ou un autre type d’incision en fonction de l’expérience et des préférences du chirurgien principal. - Déterminez le niveau de transsection en fonction de la position de la tumeur et de la longueur du côlon. Le niveau de transsection doit être d’au moins 10 cm proximal à la bordure proximale de la tumeur. Essayez d’attacher le côlon proximal vers le moignon rectal et assurez-vous qu’il n’y a pas de tension indue.
- Séparer le mésentère proximal et distal. Ligaturez l’arc vasculaire du côlon. Libérez le tissu adipeux entourant le niveau de transsection du côlon.
- Serrez le côlon à l’aide d’une pince à cordon de la bourse au niveau déterminé précédemment. Faites un cordon de sac à main à l’aide d’une aiguille de cordon de cordon de bourse. Transectez le côlon.
- Insérez l’enclume dans la lumière du côlon et fixez le cordon de la bourse sur la tige de l’enclume avec 0 sutures en soie. Renvoyer le côlon proximal dans la cavité abdominale. Maintenant, le spécimen a été complètement retiré.
- Introduisez une agrafeuse circulaire par voie transanique sous guidage laparoscopique, en faisant pivoter doucement le bouton de réglage dans le sens inverse des aiguilles d’une montre. Étendez complètement le trocart et percez le tissu.
- Faites glisser l’arbre de l’enclume sur le trocart jusqu’à ce que l’enclume s’enclenche dans une position entièrement assise. Fermez en tournant en réglant le bouton dans le sens des aiguilles d’une montre. Démarrez l’agrafeuse pour compléter l’anastomose.
6. Iléostomie de la boucle de dérivation
REMARQUE: La question de savoir si une iléostomie de la boucle de dérivation est effectuée dépend de la hauteur et de la qualité de l’anastomose et si le patient a été traité par radiothérapie avant l’opération. Si l’iléostomie n’est pas choisie, veuillez sauter les étapes 6.1.1 à 6.1.7.
- Faites une incision dans le quadrant inférieur droit loin des plis de la peau, des protubérances osseuses et d’autres incisions.
REMARQUE: Si une iléostomie de la boucle de dérivation est prévue avant l’opération, essayez de placer R1 à travers l’aspect latéral de la zone marquée pour minimiser le nombre d’incisions. - Evert une longueur de boucle de l’intestin grêle mobilisée, bien fournie par la vascularisation à travers la paroi abdominale tout en évitant toute torsion du mésentère.
- Faites un défaut mésentérique au niveau de la zone avasculaire. Placez un drain dans le mésentère pour aider à l’extériorisation de la boucle pour la maturation en tant que stomie.
- Divisez la paroi antimesentérique de l’iléon près du membre distal au niveau du pont de stomie à l’aide de l’électrocautérisation.
REMARQUE: Cette ouverture doit être créée d’un bord mésentérique à l’autre. - Effectuer une suture interrompue au bord de la stomie et au tiers distal de l’incision abdominale.
- Fixez le bord de la stomie à la sérophiluscularité de la paroi proximale de l’iléon en inversant la paroi de l’iléon. Suture interrompue du bord de la stomie, de la séromycularité de l’iléon proximal et de la couche sous-cuticulaire proximale de l’ouverture abdominale. Créez un bourgeon éventré.
- Compléter la jonction muco-cutanée.
- Fermez le fascia et l’incision.
- Irriguez abondamment toutes les plaies avec une solution saline.
- Placez un drain à canal rond 19-Fr à côté de la stomie anastomotique à travers l’incision R3.
- Suture interrompue du péritoine et de la couche sous-cutanée. Suture intradermique de la couche cutanée.
Résultats
Les informations périopératoires détaillées du cas présentées dans la vidéo sont présentées dans le tableau 1 et la figure 3. La procédure a été effectuée en avril 2019 par l’auteur correspondant à l’aide du système da Vinci Si Robot. La perte de sang estimée pendant l’opération était de 90 ml et aucune transfusion n’a été nécessaire. La gestion postopératoire a adhéré aux principes de l’ERAS. Après la première défécation le 6ème jour après l’opération, nous avons administré un lavement au diatrizoate de méglumine et effectué une radiographie aux rayons X pour déterminer si une fuite anastomotique s’était produite. Nous avons ensuite retiré le drain après avoir confirmé l’absence de preuve de fuite. Le patient n’a signalé aucun dysfonctionnement urinaire ou sexuel pendant le suivi.
L’examen pathologique de l’échantillon a indiqué un adénocarcinome à différenciation modérée (Figure 4). Aucun ganglion lymphatique positif n’a été détecté dans l’un des 19 ganglions mésorectés ou 18 ganglions lymphatiques latéraux. Le stade pathologique final était T3N0M0. Il n’y avait aucune preuve d’invasion lymphatique, veineuse ou périneurale. Nous avons recommandé que le patient reçoive une chimiothérapie adjuvante avec FOLFOX. Jusqu’en janvier 2021, le patient restait sans aucune preuve de récidive ou de métastase.
Dans notre centre, le TME assisté par robot et le LPLND ont été réalisés chez 89 patients. Toutes les procédures ont été effectuées avec succès sous assistance robotique sans conversion en chirurgie ouverte. Les informations détaillées sont présentées dans le tableau 2. Le temps de fonctionnement moyen était de 173,5 min. Des complications postopératoires se sont développées chez 14,6% des patients. Le nombre médian de ganglions lymphatiques détectés était de 32. Le taux total de métastases des ganglions lymphatiques pelviens latéraux a atteint 22,5%. En avril 2021, 3 patients présentaient une récidive locale de la paroi latérale pelvienne et une stomie anastomotique, avec un temps de suivi médian de 1,9 an. Un dysfonctionnement urinaire a été défini comme ≥50 mL d’urine résiduelle survenant au 3ème mois après l’opération. Au total, 74 patients ont accepté l’évaluation et 5 patients ont satisfait au critère. La dysfonction sexuelle chez les hommes a été mesurée à l’aide de l’Indice international de la fonction érectile, d’un questionnaire en version 5 éléments (IIEF-5) et du questionnaire de l’Indice de la fonction sexuelle féminine (FSFI) a été utilisé pour les femmes. Au total, 49 patients ont accepté l’évaluation postopératoire. Un score inférieur à 17 sur le questionnaire IIEF-5 ou inférieur à 28 sur le questionnaire FSFI a été considéré comme révélateur d’un dysfonctionnement sexuel. Deux patients ont signalé un dysfonctionnement sexuel.
Tableau 1 : Résultats représentatifs. Ce tableau montre les caractéristiques cliniques de base détaillées, les résultats peropératoires et postopératoires et les résultats pathologiques du cas représentatif. IMC: indice de masse corporelle; ASA: Société américaine des anesthésiologistes; LPLND: curage latéral des ganglions lymphatiques pelviens; TME: excision mésorectale totale. *Ici, nous n’avons compté que les complications nécessitant une intervention thérapeutique supplémentaire. Veuillez cliquer ici pour télécharger ce tableau.

Figure 1 : paramètre de fonctionnement. Cette figure a été adaptée de Napoli, N., Kauffmann, E. F., Menonna, F., Iacopi, S., Cacace, C., Boggi, U. Robot-Assisted Radical Antegrade Modular Pancreatosplenectomy Including Resection and Reconstruction of the Spleno-Mesenteric Junction. J. Vis. Exp. (155), e60370, doi:10.3791/60370 (2020)11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
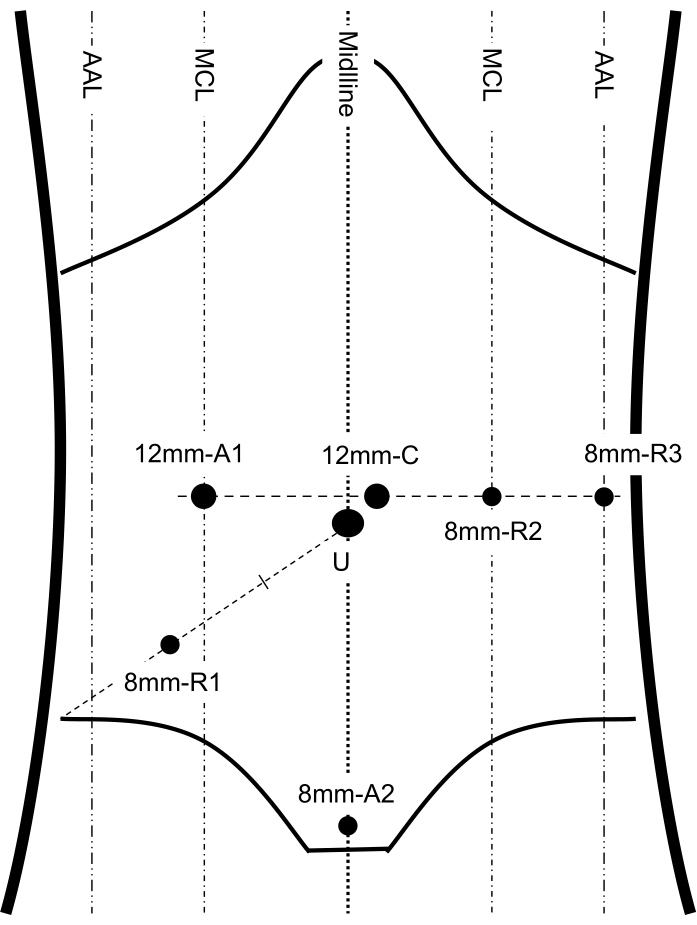
Figure 2 : Placement du port. Cette figure montre les repères anatomiques importants de l’abdomen et du placement du port, y compris 3 bras robotiques, 1 caméra et 2 ports d’assistant. LCM: ligne midclaviculaire; AAL: ligne axillaire antérieure; C: port de la caméra; U: ombilic; R1, 2, 3: bras robotique 1, 2, 3; A1, 2: port assistant 1, 2. Ce chiffre a été modifié à partir de Shi F, Li Y, Pan Y, et al. Faisabilité clinique et sécurité de la chirurgie coopérative robotique et endoscopique du troisième espace pour la dissection des tumeurs stromales gastro-intestinales gastriques: une nouvelle technique chirurgicale pour le traitement des TRG gastriques. Surg Endosc. 2019;33(12):4192-4200. doi:10.1007/s00464-019-07223-w12. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : TME robotique et LPLND. (A) Une dissection du plan rétrorectal a été réalisée entre le fascia mésorectal et le fascia nerveux préhypogastrique. La ligne pointillée jaune indique le promontoire sacré. (B) Incision le long de la ligne pointillée jaune pour ouvrir le plan antérieur entre le fascia de Denonvilliers et le fascia mésorectal. (C) Dissection des nœuds obturateurs. La ligne pointillée jaune indique la plage de nœuds obturateurs (#283). La ligne pointillée bleue indique l’artère ombilicale. (D) Curage du ganglion lymphatique iliaque interne. La ligne pointillée jaune indique la gamme des ganglions lymphatiques iliaques internes (#263). (E) Le LPLND a été achevé. (F) Échantillon entier de tissu lymphatique et adipeux latéral réséqué. MRF: fascia mésorectien; PHNF: fascia nerveux préhypogastrique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
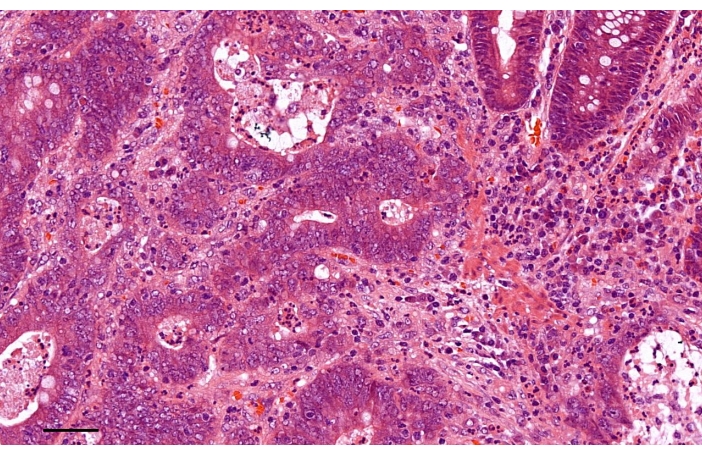
Figure 4 : L’examen pathologique de l’échantillon a révélé un adénocarcinome à différenciation modérée (coloration à l’hématoxyline-éosine). Barre d’échelle, 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 2 : Résultats de 89 TME et LPLND consécutifs assistés par robot. Ce tableau présente les caractéristiques cliniques de base détaillées, les résultats peropératoires et postopératoires et les résultats de pathologie. IMC: indice de masse corporelle; ASA: Société américaine des anesthésiologistes; LPLND: curage latéral des ganglions lymphatiques pelviens; TME: excision mésorectale totale. *Ici, nous n’avons compté que les complications nécessitant une intervention thérapeutique supplémentaire. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le cancer colorectal (CCR) est l’un des cancers les plus courants dans le monde13. Parmi eux, plus d’un tiers sont des cancers du rectum. En raison de l’exigence fonctionnelle postopératoire plus élevée et de l’anatomie neurologique et fasciale sophistiquée du bassin et du périnée, la meilleure approche chirurgicale pour le cancer du rectum, en particulier le cancer du rectum faible ou ultra-faible, fait toujours l’objet d’un grand débat. Depuis son premier rapport en 1979, l’excision mésorectale totale (EMT) est la technique chirurgicale standard pour le traitement du cancer du rectum résécable14. Avec l’excision complète du mésorecte, le taux de récidive locale diminue considérablement. Cependant, cette approche est encore difficile à réaliser chez les patients atteints d’un cancer du rectum faible, et un taux de conversion élevé et des marges de résection positives restent préoccupants15,16. Sylla et coll. ont mis au point la stratégie d’excision mésorectale totale transanale (TaTME) comme une nouvelle approche du traitement chirurgical du cancer du rectum17. En effet, il a été proposé que le TaTME présente les avantages de moins d’incisions abdominales, d’une meilleure visualisation du plan mésorectical et de la marge de résection distale et d’une meilleure faisabilité dans l’espace étroit du bassin15. Cependant, une certaine controverse sur les résultats oncologiques à long terme et la qualité de vie postopératoire demeure. Les données nationales montrent que TaTME a un taux de récurrence locale plus élevé que le TME18 laparoscopique. De plus, en raison d’une longue période de traction anale peropératoire, les patients qui subissent taTME peuvent endurer des douleurs anales à long terme (plus de 6 mois)19. Cette technique émergente peut nécessiter des améliorations à la procédure elle-même, des lignes directrices normalisées et des programmes de formation structurés à appliquer largement.
Une autre technique a émergé et a été de plus en plus acceptée par les chirurgiens colorectaux comme une option populaire. Un hôpital de Séoul a réalisé et signalé le premier TME assisté par robot da Vinci en 200720. Les interventions chirurgicales assistées par robot surmontent les limites des approches ouvertes (champ visuel limité et espace opératoire étroit) et laparoscopiques (réduction de la dextérité manuelle, mode de mouvement contre-intuitif, tremblements naturels amplifiés de la main et visuels plats). Par rapport aux procédures laparoscopiques, le système de robot chirurgical da Vinci échange un visuel plat, égaré en 2 dimensions qui doit être obtenu par le biais de personnel supplémentaire pour un champ visuel de haute qualité en 3 dimensions qui peut afficher des structures anatomiques plus détaillées. De plus, le système da Vinci adopte un bras multijoint avec 7 degrés de liberté pour copier parfaitement le mouvement d’une main humaine naturelle au lieu de mouvements « baguettes » droits gênants. De plus, plusieurs inventions ergonomiques ont considérablement réduit les tremblements naturels pour assurer la stabilité des instruments chirurgicaux et minimiser les blessures imprévues. Cependant, la perte de sens tactile et de retour de force n’a toujours pas été abordée. Des revues systématiques et des méta-analyses récentes ont montré que le TME robotique a un taux de conversion en chirurgie ouverte significativement plus faible que les procédures laparoscopiques, bien qu’ils incluent des patients ayant un indice de masse corporelle plus élevé et une localisation tumorale plus faible, ainsi qu’une proportion plus élevée de brevets recevant un traitement néoadjuvant, qui sont tous des facteurs indésirables pour les procédures chirurgicales21, 22. Les résultats oncologiques à long terme des procédures robotiques et laparoscopiques sont équivalents23. Une approche robotique est généralement considérée comme une alternative raisonnable pour les procédures complexes telles que TME et LPLND. Cependant, il convient de reconnaître que le TME robotique présente encore plusieurs limites, telles qu’un coût plus élevé pour les patients et les services et des exigences de formation supplémentaires16.
La procédure TME standard n’inclut pas la curation des ganglions lymphatiques pelviens latéraux (LPN). Cependant, selon les résultats d’études antérieures de la Société japonaise pour le cancer du côlon et du rectum (JSCCR), le taux total de métastases de LPLN chez les patients dont la bordure tumorale inférieure était distale à la réflexion péritonéale et dont le cancer a envahi au-delà de la muscularis propria était de 20,1%9. Un essai contrôlé randomisé (ECR) multicentrique pour le cancer du rectum inférieur de stade II/III (JCOG0212) a montré qu’une procédure TME de haute qualité avec dissection LPLN (LPLND) peut réduire le taux de récidive locale après la chirurgie (12,6 % dans le TME seul contre 7,4 % dans le TME avec LPLND, P = 0,024)3. Dans les pays occidentaux, la radiothérapie néoadjuvante/chimioradiothérapie (NART/CRT) est devenue un traitement standard pour le cancer du rectum de stade clinique II/III plutôt que LPLND24. Cependant, une étude multicentrique récente a montré que le NART / CRT suivi d’un TME seul n’est pas suffisant pour prévenir la récidive locale chez les patients atteints de cancer du rectum présentant des LLPN élargis. L’ajout de LPLND peut réduire considérablement le taux de récidive (19,5 % dans le TME seul contre 5,7 % dans le TME avec LPLND, P = 0,042)25. Par conséquent, une procédure TME standard combinée sélectivement avec LPLND en fonction des caractéristiques cliniques et d’imagerie du patient devrait être un traitement chirurgical standard pour le cancer du rectum localement avancé moyen-bas. Cependant, le principal facteur limitant le développement et l’utilisation généralisée de LPLND est le taux d’incidence élevé de la dysfonction urinaire et sexuelle postopératoire. Deux méta-analyses ont rapporté que par rapport au TME seul, le LPLND supplémentaire augmentait nettement l’incidence de la dysfonction urinaire, tandis qu’une seule méta-analyse rapportait une incidence plus élevée de dysfonction sexuelle26,27.
Actuellement, nous utilisons le système chirurgical robotique pour effectuer TME et LPLND supplémentaire. Selon nos résultats préliminaires, l’utilisation de TME robotique et de LPLND conduit à des résultats périopératoires favorables et à des résultats oncologiques équivalents à moyen terme. Comme le système de robot da Vinci présente plusieurs caractéristiques, comme nous l’avons décrit précédemment, le système présente des avantages inhérents à l’identification et à la dissection de nerfs et de vaisseaux importants afin de réduire éventuellement le risque de complications postopératoires. Cependant, il convient de noter que la décision de combiner LPLND devrait dépendre des caractéristiques cliniques et des facteurs du patient. Jusqu’à présent, la LPLND largement préventive n’a pas été recommandée pour les patients sans aucune preuve de métastases ganglionnaires latérales en raison de son risque élevé de blessure, du faible taux de métastases et des taux élevés de dysfonction urinaire et sexuelle postopératoire28. En outre, certains facteurs liés au patient doivent être pris en compte. Une question se pose: pour les patients âgés atteints d’un cancer du rectum, vont-ils mourir d’un cancer ou d’un cancer? 29 Pour les patients âgés atteints d’un cancer du rectum, les interventions chirurgicales devraient être décidées avec plus circonspection. En général, les patients âgés présentent diverses comorbidités et fragilités, ce qui entraîne des taux plus élevés de complications intra et postopératoires. En outre, contrairement aux patients plus jeunes, le maintien de la fonction et de la qualité de vie est plus important pour les patients plus âgés plutôt que d’obtenir des avantages oncologiques optimaux. Ainsi, une évaluation préopératoire complète des avantages et des risques de préjudice est absolument nécessaire.
Sur la base de notre expérience, plusieurs points clés de cette technique doivent être soulignés pour assurer une procédure réussie. Le plus important est une familiarité adéquate avec les structures anatomiques. Pendant la phase TME, la principale considération est de savoir comment protéger efficacement les nerfs pelviens autonomes. Il convient de noter que la dissection a été effectuée par un scalpel harmonique au lieu de l’électrocautérisation, ce qui pourrait réduire le risque de blessure thermique. En outre, une compréhension radicale du fascia et des plans entourant le rectum est nécessaire30. Il y a trois plans à considérer lors de la dissection et de la mobilisation du rectum. Le premier est le plan TME classique entre le fascia mésorectèque et le fascia nerveux préhypogastrique (postérieur et latéral au rectum) ou le fascia de Denonvilliers (antérieur au rectum). En développant ce plan, les nerfs autonomes environnants peuvent être sauvegardés. En dehors du plan TME, il existe un deuxième plan entre le fascia nerveux préhypogastrique et le fascia présacral (postérieur) ou le fascia vésicohypogastrique (latéral) et antérieur au fascia de Denonvilliers, ce qui comporte un risque plus élevé de lésion du plexus pelvien. Le troisième plan est proche du fascia endopelvien et est rarement adopté. De plus, pendant la phase LPLND, la structure anatomique de la région pelvienne latérale est complexe, en particulier les régions de l’obturateur et de l’artère iliaque interne. Nous devons clairement identifier trois plans: le plan de la paroi latérale, composé du psoas et des muscles obturateurs internes; le plan médian, composé de l’uretère et du fascia du nerf hypogastrique et du plexus pelvien; et le plan dorsal, composé des vaisseaux iliaques internes et du nerf sciatique. Ces trois plans définissent les limites de la dissection. En outre, le fascia vésicohypogastrique divise la zone en l’obturateur et les compartiments iliaques internes, avec l’artère ombilicale facilement identifiable comme bordure supérieure. La ligature sélective des vaisseaux peut contrôler les saignements et exposer les structures anatomiques. Cependant, il convient de noter que le nerf obturateur et l’artère vésicale supérieure doivent être conservés avec soin. Si le saignement n’est pas contrôlé, une conversion ouverte rapide et sûre doit être effectuée pendant que l’assistant applique temporairement une pression. De plus, le bras R3 joue un rôle important dans la rétraction de l’organe et des tissus pour permettre une exposition optimale. Un chirurgien expérimenté peut placer correctement le bras R3 pour exposer plus clairement les structures cibles et assurer une dissection précise.
En conclusion, la technique robotique TME et LPLND est sûre et réalisable pour les patients atteints d’un cancer du rectum localement avancé de moyenne à basse température. Cette technique permet une meilleure exposition des structures anatomiques complexes et peut réduire les blessures imprévues, suivant la tendance de développement de la chirurgie mini-invasive. Une sélection appropriée des indications chirurgicales et une compréhension radicale des structures anatomiques sont des facteurs critiques de procédures réussies. En outre, nous suggérons des ajustements individualisés appropriés en fonction des préférences et des expériences des chirurgiens individuels.
Déclarations de divulgation
Rien à divulguer.
Remerciements
Ce projet a été soutenu par la Fondation nationale des sciences naturelles de Chine (n° 81870380) et la Fondation des sciences de la province du Shaanxi (2020ZDLSF01-03 et 2020KWZ-020).
matériels
| Name | Company | Catalog Number | Comments |
| 0 Silk suture | N/A | N/A | Secure the anvil |
| 12mm Trocar | Medtronic (Minneapolis, MN) | NONB12STF | Assistant port 1 |
| 19 Fr drain | N/A | N/A | Pelvic drain |
| 2-0 Silk suture | N/A | N/A | Close skin incisions |
| 2-0 V-Loc sutures | Covidien (Dublin, Ireland) | VLOCL0315 | Barbed Absorable Suture |
| 4-0 PDS | Ethicon (Somerville, NJ) | SXPP1A400 | Synthetic Absorbable Suture |
| 8mm Trocar | Medtronic (Minneapolis, MN) | NONB8STF | Assistant port 2 |
| Bipolar forceps | Intuitive (Sunnyvale, CA) | 470172 | Operation |
| Cadiere grasping forceps | Intuitive (Sunnyvale, CA) | 470049 | Operation |
| Circular stapler | EzisurgMed (Shanghai, China) | CS2535 | Laparoscopic Surgical Stapler |
| Da Vinci Si | Intuitive (Sunnyvale, CA) | N/A | Surgical Robot |
| Da Vinci Xi | Intuitive (Sunnyvale, CA) | N/A | Surgical Robot |
| Hem-o-lok ligation clip | Weck (Morrisville, NC) | 544995 | Ligation of vessel |
| Laparoscopic single use linear cutting stapler | EzisurgMed (Shanghai, China) | U12M45 | Laparoscopic Surgical Stapler |
| Large needle driver | Intuitive (Sunnyvale, CA) | 470006 | Operation |
| Monopolar scissors | Intuitive (Sunnyvale, CA) | 470179 | Operation |
| Ribbon retractor | N/A | N/A | Control movement of rectum |
| Specimen Bags | N/A | N/A | Extract specimen |
| Veress needle | N/A | N/A | Saline drop test |
Références
- Fantus, R. J., et al. Facility-level analysis of robot utilization across disciplines in the National Cancer Database. Journal of Robotic Surgery. 13 (2), 293-299 (2019).
- Akiyoshi, T., et al. Results of a japanese nationwide multi-institutional study on lateral pelvic lymph node metastasis in low rectal cancer is it regional or distant disease. Annals of Surgery. 255 (6), 1129-1134 (2012).
- Fujita, S., et al. Mesorectal excision with or without lateral lymph node dissection for clinical stage II/III lower rectal cancer (JCOG0212): A multicenter, randomized controlled, noninferiority trial. Annals of Surgery. 266 (2), 201-207 (2017).
- Yamaguchi, T., Kinugasa, Y., Shiomi, A., Tomioka, H., Kagawa, H. Robotic-assisted laparoscopic versus open lateral lymph node dissection for advanced lower rectal cancer (vol 30, pg 721). Surgical Endoscopy and Other Interventional Techniques. 30 (2), 729 (2016).
- Yamaguchi, T., et al. Oncological outcomes of robotic-assisted laparoscopic versus open lateral lymph node dissection for locally advanced low rectal cancer. Surgical Endoscopy and Other Interventional Techniques. 32 (11), 4498-4505 (2018).
- Gustafsson, U. O., et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS((R))) society recommendations: 2018. World Journal of Surgery. 43 (3), 659-695 (2019).
- Brind'Amour, A., et al. Canadian guidelines on the management of colorectal peritoneal metastases. Current Oncology. 27 (6), 621-631 (2020).
- Watanabe, T., et al. Japanese society for cancer of the colon and rectum (JSCCR) guidelines 2016 for the treatment of colorectal cancer. International Journal of Clinical Oncology. 23 (1), 1-34 (2018).
- Professional Committee of Robotic Surgery, C.C.C.o.C.M.D.A. Robotic and Laparoscopic Surgery Committee of Chinese Research Hospital, A. [Chinese expert consensus on robotic surgery for colorectal cancer (2020 edition)]. Zhonghua Wei Chang Wai Ke Za Zhi. 24 (1), 14-22 (2021).
- Napoli, N., et al. Robot-Assisted Radical Antegrade Modular Pancreatosplenectomy Including Resection and Reconstruction of the Spleno-Mesenteric Junction. Journal of Visualized Experiments. (155), e60370 (2020).
- Shi, F., et al. Clinical feasibility and safety of third space robotic and endoscopic cooperative surgery for gastric gastrointestinal stromal tumors dissection : A new surgical technique for treating gastric GISTs. Surgical Endoscopy and Other Interventional Techniques. 33 (12), 4192-4200 (2019).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Heald, R. J. A new approach to rectal cancer. British Journal of Hospital Medication. 22 (3), 277-281 (1979).
- Jiang, T. Y., Ma, J. J., Zheng, M. H. Controversies and consensus in transanal total mesorectal excision (taTME): Is it a valid choice for rectal cancer. Journal of Surgical Oncology. 123, 59-64 (2021).
- Di Saverio, S., Stupalkowska, W., Hussein, A., Fearnhead, N., Wheeler, J. Laparoscopic ultralow anterior resection with intracorporeal coloanal stapled anastomosis for low rectal cancer - is robotic surgery or transanal total mesorectal excision always needed to achieve a good oncological and sphincter-sparing dissection - a video vignette. Colorectal Diseases. 21 (7), 848-849 (2019).
- Sylla, P., Rattner, D. W., Delgado, S., Lacy, A. M. NOTES transanal rectal cancer resection using transanal endoscopic microsurgery and laparoscopic assistance. Surgical Endoscopy and Other Interventional Techniques. 24 (5), 1205-1210 (2010).
- Larsen, S. G., Pfeffer, F., Korner, H. Norwegian moratorium on transanal total mesorectal excision. British Journal of Surgery. 106 (9), 1120-1121 (2019).
- Koedam, T. W., et al. Transanal total mesorectal excision (TaTME) for rectal cancer: effects on patient-reported quality of life and functional outcome. Techniques in Coloproctology. 21 (1), 25-33 (2017).
- Baik, S. H., et al. Robotic total mesorectal excision for the treatment of rectal cancer. Journal of Robotic Surgery. 1 (1), 99-102 (2007).
- Gavriilidis, P., et al. Robotic vs laparoscopic total mesorectal excision for rectal cancers: has a paradigm change occurred? A systematic review by updated meta-analysis. Colorectal Diseases. 22 (11), 1506-1517 (2020).
- Prete, F. P., et al. Robotic versus laparoscopic minimally invasive surgery for rectal cancer: A Systematic review and meta-analysis of randomized controlled trials. Annals of Surgery. 267 (6), 1034-1046 (2018).
- Qiu, H., et al. Long-term oncological outcomes in robotic versus laparoscopic approach for rectal cancer: A systematic review and meta-analysis. International Journal of Surgery. 80, 225-230 (2020).
- Kapiteijn, E., et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. New England Journal of Medicine. 345 (9), 638-646 (2001).
- Ogura, A., et al. Neoadjuvant (Chemo)radiotherapy with total mesorectal excision only is not sufficient to prevent lateral local recurrence in enlarged nodes: Results of the multicenter lateral node study of patients with low cT3/4 rectal cancer. Journal of Clinical Oncology. 37 (1), 33-43 (2019).
- Emile, S. H., Elfeki, H., Shalaby, M., Sakr, A., Kim, N. K. Outcome of lateral pelvic lymph node dissection with total mesorectal excision in treatment of rectal cancer: A systematic review and meta-analysis. Surgery. 169 (5), 1005-1015 (2021).
- Hajibandeh, S., Hajibandeh, S., Matthews, J., Palmer, L., Maw, A. Meta-analysis of survival and functional outcomes after total mesorectal excision with or without lateral pelvic lymph node dissection in rectal cancer surgery. Surgery. 168 (3), 486-496 (2020).
- Laparoscopic surgery committee of the endoscopist branch in the chinese medical doctor, A. Laparoscopic surgery committee of colorectal cancer committee of chinese medical doctor, A. and Colorectal surgery group of the surgery branch in the chinese medical, A. [Chinese expert consensus on the diagnosis and treatment for lateral lymph node metastasis of rectal cancer (2019 edition)]. Zhonghua Wei Chang Wai Ke Za Zhi. 22 (10), 901-912 (2019).
- Podda, M., et al. Multidisciplinary management of elderly patients with rectal cancer: recommendations from the SICG (Italian Society of Geriatric Surgery), SIFIPAC (Italian Society of Surgical Pathophysiology), SICE (Italian Society of Endoscopic Surgery and new technologies), and the WSES (World Society of Emergency Surgery) International Consensus Project. World Journal of Emergency Surgery. 16 (1), 35 (2021).
- Fung, T. L. D., Tsukada, Y., Ito, M. Essential anatomy for total mesorectal excision and lateral lymph node dissection, in both trans-abdominal and trans-anal perspective. Surgeon. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon