Method Article
Robotergestützte totale mesorektale Exzision und laterale Beckenlymphknotendissektion bei lokal fortgeschrittenem mittel-niedrigem Rektumkarzinom
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die hier beschriebene Robotertechnik zielt darauf ab, einen schrittweisen Ansatz zur robotergestützten totalen mesorektalen Exzision und lateralen Beckenlymphknotendissektion für lokal fortgeschrittenen (T3/T4) Rektumkarzinom unterhalb der Peritonealreflexion zu beschreiben.
Zusammenfassung
Seit ihrer Zulassung für den klinischen Einsatz haben da Vinci Operationsroboter große Vorteile bei gastrointestinalen chirurgischen Eingriffen, insbesondere bei komplexen Eingriffen, gezeigt. Die hochwertige visuelle 3D-, Multijoint-Arm- und natürliche Tremorfiltration ermöglichen es dem Chirurgen, mit minimaler Invasion genauer zu belichten und zu sezieren. Die totale mesorektale Exzision ist die Standard-Operationstechnik zur Behandlung von resezierbarem Rektumkarzinom. Um die laterale Rezidivrate zu reduzieren, kann eine laterale Beckenlymphknotendissektion durchgeführt werden, da dies ein sicheres und praktikables Verfahren für lokal fortgeschrittenen mittel-niedrigen Rektumkarzinom mit einer hohen Wahrscheinlichkeit von Metastasen in den lateralen Lymphknoten ist. Die Komplexität der anatomischen Strukturen und die hohe postoperative Komplikationsrate schränken jedoch die Anwendung ein. In jüngster Zeit haben mehrere Chirurgen zunehmend Robotertechniken für die totale mesorektale Exzision und die laterale Beckenlymphknotendissektion eingesetzt. Im Vergleich zur offenen und laparoskopischen Chirurgie hat die Robotertechnik mehrere Vorteile, wie weniger Blutverlust, weniger Bluttransfusionen, minimales Trauma, kürzerer postoperativer Krankenhausaufenthalt und schnellere Genesung. Ein Roboteransatz wird im Allgemeinen als eine vernünftige Alternative für komplizierte Verfahren wie die laterale Beckenlymphknotendissektion angesehen, obwohl es eine begrenzte Anzahl von qualitativ hochwertigen prospektiven randomisierten kontrollierten Studien gibt, die direkte Beweise liefern. Hier stellen wir die detaillierten Schritte der robotergestützten totalen mesorektalen Exzision und der lateralen Beckenlymphknotendissektion vor, die am First Affiliated Hospital der Xi'an Jiaotong University durchgeführt werden.
Einleitung
Seit ihrer Zulassung für den klinischen Einsatz durch die US-amerikanische Food and Drug Administration im Jahr 2000 werden da Vinci-Operationsroboter zunehmend in verschiedenen chirurgischen Fachgebieten eingesetzt1. Das robotergestützte chirurgische System hat die Vorteile der Verwendung flexibler Mehrgelenkarme, einer hochwertigen dreidimensionalen Kamera, tremorfiltration und einer stark verbesserten Ergonomie, die die Invasivität der Operation minimieren und somit ideal für komplexe Eingriffe machen kann.
Seit Jahrzehnten ist die totale mesorektale Exzision (TME) der Standard für die Behandlung von resezierbarem Rektumkarzinom. Bei fortgeschrittenem (T3/T4) Rektumkarzinom, der sich unterhalb der Peritonealreflexion befindet, ist die Metastasierung des lateralen Beckenlymphknotens (LPLN) jedoch eine Hauptursache für ein lokales Rezidiv nach der Operation2. Klinische Evidenz zeigt deutlich, dass die laterale Beckenlymphknotendissektion (LPLND) die lokale Rezidivrate signifikant senken könnte3. Im Vergleich zum offenen Verfahren wurden robotergestützte TME und LPLND mit weniger Blutverlust, weniger Bluttransfusionen und weniger postoperativen Komplikationen in Verbindung gebracht4. Darüber hinaus unterscheiden sich die langfristigen Ergebnisse zwischen den beiden Verfahren nicht signifikant5. Die Ergebnisse dieser Berichte deuten darauf hin, dass robotergestützte LPLND eine praktikable Modalität für lokal fortgeschrittenen Rektumkarzinom sein könnte. Es sollte jedoch beachtet werden, dass robotergestützte TME und LPLND komplexe Verfahren sind und von einem erfahrenen Chirurgen durchgeführt werden sollten.
Hierin wird ein systematischer Standardansatz für robotergestützte TME und LPLND Schritt für Schritt beschrieben. Dieses Verfahren wurde im Zentrum entwickelt und verfügt über Erfahrung in der Durchführung von mehr als dreitausend Roboterverfahren6. Darüber hinaus basierte dieser Ansatz auf normalen anatomischen Eigenschaften; seltene anatomische Variationen sollten beachtet werden.
Wir präsentieren den Fall eines 64-jährigen männlichen Patienten, der seit etwa 3 Monaten eine intermittierende Hämatocheziose hatte. Die digitale rektale Untersuchung ergab, dass sich eine Masse an der vorderen und rechten Seitenwand des Rektums befand, 5 cm vom Anus entfernt. Ein verbesserter Computertomographie -Scan (CT) und endoskopischer Ultraschall (EUS) zeigten einen niedrigeren Rektumkarzinom mit internistischer Lymphknotenmetastasierung. Die koloskopische Biopsie bestätigte das Vorhandensein eines mäßig differenzierten Adenokarzinoms. Die präoperative Bewertung ergab, dass das klinische Stadium cT3N+M0 war. Dementsprechend haben wir uns entschieden, robotergestützte TME und LPLND durchzuführen. Die Zustimmung des Patienten wurde vor der Durchführung dieser Verfahren eingeholt.
Protokoll
Dieses Protokoll entspricht den Richtlinien der Ethikkommission des Ersten Angeschlossenen Krankenhauses der Xi 'an Jiaotong Universität (Nr. 2019ZD04).
1. Präoperative Vorbereitung, Patientenposition und Anästhesie
- Stellen Sie vor der Operation ein angemessenes Ernährungsmanagement sicher.
- Verschreiben Sie ein präoperatives orales Kohlenhydratgetränk, das vor dem Schlafengehen und 4 Stunden vor der Operation eingenommen wird.
HINWEIS: Dies wurde auf der Grundlage des ERAS-Protokolls (Enhanced Recovery after Surgery) erlaubt. - Verschreiben Sie keine zusätzlichen oralen Antibiotika.
HINWEIS: Die Umsetzung dieser Maßnahmen sollte entsprechend den Erfahrungen jedes Zentrums sorgfältig abgewogen werden.
- Verschreiben Sie ein präoperatives orales Kohlenhydratgetränk, das vor dem Schlafengehen und 4 Stunden vor der Operation eingenommen wird.
- Verabreichen Sie präoperative Antibiotika und venöse Thromboembolieprophylaxe.
- Injizieren Sie vorbeugende Antibiotika (2 g Cefmetazol, 4,5 g Piperacillin / Tazobactam oder 300 mg Clindamycin basierend auf dem Arzneimittelallergietest) innerhalb von 1 h vor der Inzision.
- Verabreichen Sie eine tiefe venöse Thromboseprophylaxe in Form einer subkutanen niedermolekularen Heparin-Injektion (Nadroparin Calcium, 2850 IE) 2-4 h vor der Anästhesie.
- Induzieren Sie eine Vollnarkose.
HINWEIS: Dies sollte auf der Grundlage der Erfahrung jedes Zentrums durchgeführt werden.- Verabreichen Sie multimodale Analgesie, um die narkotische Verabreichung zu minimieren, einschließlich regionaler Nervenblockade und nichtsteroidaler Analgesie.
- Führen Sie ein angemessenes restriktives intraoperatives Flüssigkeitsmanagement gemäß den Grundanforderungen, dem Blutverlust und den ergebnissen der hämodynamischen Überwachung durch.
- Darüber hinaus überwachen Sie während der Operation dynamisch das Elektrokardiogramm, den radialen arteriellen Druck, die Pulsoximetrie, die Kapnographie, das Harnvolumen, die Temperatur und die Blutgasanalyse des Patienten 7.
- Legen Sie einen sterilen Harnröhrenkatheter 16-18 Fr ein.
- Bringen Sie den Patienten in eine Lloyd Davis-Position und befestigen Sie ihn vorsichtig am Operationstisch. Stellen Sie sicher, dass die Beine sorgfältig in Steigbügeln gepolstert sind und dass beide Arme an der Seite verstaut sind.
2. Betriebseinstellungen und Portplatzierung
HINWEIS: Diese Maßnahmen können entsprechend den Erfahrungen jedes Chirurgen angepasst werden.
- Stellen Sie sicher, dass der Hauptchirurg von der Roboterkonsole aus operiert und seine Einstellungen anpasst (Abbildung 1).
- Lassen Sie einen laparoskopischen Assistenten auf der rechten Seite des Patienten stehen (Abbildung 1).
- Lassen Sie eine Krankenschwester auf der linken Seite des Patienten stehen (Abbildung 1).
- Bestätigen Sie vor der Operation den Weißabgleich, stellen Sie den Fokus und die 3D-Kalibrierung des da Vinci Si-Roboterobjektivs gemäß der Anleitung des Betriebssystems ein und erhitzen Sie das Objektiv in warmem Wasser (nicht mehr als 55 ° C), um Nebel zu vermeiden.
- Legen Sie das Pneumoperitoneum und die Portplatzierung fest.
- Machen Sie einen 12-mm-Schnitt 2-3 cm über dem Nabel und leicht nach links.
- Heben Sie den Nabel und die Bauchdecke mit einer Handtuchklemme an und stechen Sie mit einer Veress-Nadel in die Bauchhöhle.
- Befestigen Sie eine mit 5 ml normaler Kochsalzlösung gefüllte Einwegspritze bei geöffnetem Durchflusshahn an der Veress-Nadel. Aspirieren Sie die Spritze und stellen Sie sicher, dass kein Blut oder Kot abgesaugt wurde. Injizieren Sie 5 ml Kochsalzlösung.
- Entfernen Sie die Spritze von der Veress-Nadel mit offenem Flow-Tap. Beobachten Sie die Bewegung der Flüssigkeitssäule an der Oberseite der Veress-Nadel, um zu bestätigen, dass die Veress-Nadel die entsprechende Stelle durchbohrt hat.
HINWEIS: Freie Bewegung ohne Widerstand der Flüssigkeit von der Nadel in den Bauch zeigt ein positives Ergebnis für den Kochsalzlösungstropfentest an und die Veress-Nadel hat die Bauchhöhle durchbohrt. - Verbinden Sie das Insufflationsrohr mit der Veress-Nadel. Starten Sie dann die CO2-Insufflationsvorrichtung mit einer Druckeinstellung von 12 mmHg.
HINWEIS: Der Druck sollte zwischen 8 und 15 mmHg eingestellt werden. Bestätigen Sie, dass sich die Veress-Nadel an der richtigen Stelle befindet, indem Sie den Druck notieren. Steigt der Druck über den eingestellten Druck schnell an, deutet dies meist darauf hin, dass die Veress-Nadel die Bauchhöhle nicht durchbohrt hat. - Nachdem der gemessene Druck den Solldruck erreicht hat, entfernen Sie die Veress-Nadel und stellen Sie einen 12-mm-Trokar als Sichtanschluss ein (Abbildung 2).
- Setzen Sie das Objektiv der Roboterkamera ein und untersuchen Sie die Bauchhöhle vollständig. Suchen und biopsieren Sie verdächtige metastasierende Knötchen und senden Sie sie für die Histologie des gefrorenen Abschnitts8.
- Wenn die Adhäsionen die Trokareinstellung stören, lassen Sie sie zuerst mit dem laparoskopischen Instrument los.
- Stellen Sie die drei Roboterarmanschlüsse ein. Platzieren Sie den Trokar, nachdem Sie für jeden Trokar quer 8 mm Hautschnitte vorgenommen haben. Platzieren Sie Arm 1 (R1) in der rechten McBurney-Spitze (Abbildung 2). Platzieren Sie Arm 2 (R2) in der linken Mittelklavikularlinie auf Höhe des Sichtports (Abbildung 2). Platzieren Sie Arm 3 (R3) in der linken vorderen Achsellinie auf Höhe der Sichtöffnung (Abbildung 2).
HINWEIS: Stellen Sie sicher, dass der Abstand zwischen benachbarten Anschlüssen 8-10 cm beträgt. - Platzieren Sie einen 12-mm-Assistentenport 1 (A1) in der rechten Mittelklavikularlinie auf Höhe des Sichtports (Abbildung 2).
- Platzieren Sie einen 8 mm Hilfsport 2 (A2) ca. 1-2 cm über der Schamsymphyse (Abbildung 2).
- Platzieren Sie den Patienten in einer 30° Trendelenburg Position mit einem 15° nach unten.
- Nachdem Sie diese Ports gesetzt haben, platzieren Sie den da Vinci-Roboter zwischen den Beinen des Patienten und befestigen Sie den Kameraarm und drei Operationsarme mittels Systemführung am Trokar.
- Platzieren Sie die Roboterinstrumente. Platzieren Sie eine monopolare Schere in R1, einen bipolaren Greifer in R2 und eine Cadiere-Greifzange in R3.
HINWEIS: Das Instrument in R1 kann abhängig von den Aktionen des Primärchirurgen ausgetauscht werden. Die am häufigsten verwendeten Instrumente sind monopolare Scheren und harmonische Skalpelle.
3. Totale mesorektale Exzision
- Mobilisieren Sie den linken Dickdarm.
- Ziehen Sie den absteigenden und sigmoiden Dickdarm medial mit einer Cadiere-Greifzange in R3 ein, um die linken parakolischen Sulci freizulegen.
- Setzen Sie die physiologischen Adhäsionen des absteigenden und sigmoiden Dickdarms entlang der parakolischen Sulci mit einer monopolaren Schere in R1 frei. Schneiden Sie das Peritoneum entlang parakolischer Sulci ein und sezieren Sie den absteigenden Dickdarm von superior nach inferior mit einer monopolaren Schere in R1, bis der Harnleiter freigelegt ist, um die laterale Seite des absteigenden und milzförmigen Beugungskolons zu mobilisieren. Legen Sie ein Stück sterile Gaze als Indikator in die Nähe des Harnleiters.
- Nachdem Sie die seitliche Seite des absteigenden und milzförmigen Dickdarms mobilisiert haben, greifen Sie das Sigma mit seinem Mesenterium mit einer Cadiere-Greifzange in R3 nach vorne und heben Sie es weiter an. Erzeugen Sie Spannung im Mesenterium mit einem bipolaren Greifer in R2 und einer Pinzette in der Hand des Assistenten. Erkenne dann die "weiße Linie" von Toldts Faszie, einer avaskulären Ebene. Schneiden Sie das Peritoneum entlang der "weißen Linie" ein.
- Trennen Sie sich entlang dieser Ebene in Richtung der lateralen parakolischen Sulci mit einer Monopolschere in R1, um das Sigma zu mobilisieren. Erstellen Sie anschließend einen Tunnel zwischen den medialen und seitlichen Kompartimenten unter der Führung der zuvor eingestellten Indikatorgaze. Entwickeln Sie diese Ebene mit Elektrokauterisation weiter nach unten zum Sakralvorgebirge und kombinieren Sie scharfe und stumpfe Spreizung. Führen Sie die Dissektion schnell durch, um das absteigende und sigmoide Dickdarm vollständig zu mobilisieren.
- Transektieren Sie die Arteria mesenterica inferior (IMA) und die Vena mesentericus inferior (IMV).
- Nachdem Sie das Sigma mobilisiert haben, greifen Sie das Sigma und heben Sie es mit einer Pinzette in R3 an, um die Aorta freizulegen. Sezieren Sie entlang der Aorta überlegen mit einer monopolaren Schere in R1, um die IMA freizulegen.
- Ändern Sie das Instrument in R1 von einer monopolaren Schere zu einem harmonischen Skalpell.
- Von der Wurzel der IMA trennen Sie das Lymphgewebe von den Gefäßen mit einem Ultraschallskalpell in R1, bis die linke Kolikarterie erscheint. Lassen Sie den Assistenzchirurgen die IMA unter dem Ursprung der linken Kolikarterie mit einem großen Verriegelungsclip befestigen. Dann mit dem harmonischen Skalpell transektieren, um Blutungen zu minimieren.
- Trennen Sie weiterhin das Lymphgewebe von der linken Kolikarterie mit einem harmonischen Skalpell in R1. Erkennen Sie die Vena mesenterica inferior (IMV) und den absteigenden Ast der linken Kolikarterie. Lassen Sie den Assistenzchirurgen diese 2 Gefäße beschneiden und transektieren.
- Führen Sie eine Beckendissektion des Rektums durch.
- Verwenden Sie einen Bandretraktor, um das Rektum anzuheben. Legen Sie die Greifzange vom Assistenzchirurgen in A2 und steuern Sie die Bewegung des Rektums, indem Sie den Bandretraktor greifen. Ändern Sie das Gerät in R1 in eine monopolare Schere.
- Heben Sie das Rektum mit einer Cadiere-Greifzange nach vorne, die durch den hinteren Rand des Sigmas eingeführt wird, um das sakrale Vorgebirge freizulegen. Dann sezieren Sie in die retrorektale Ebene zwischen mesorektaler Faszie und prähypogastrischer Nervenfaszie mit einer monopolaren Schere in R1. Entwickeln Sie sich entlang dieser Ebene und trennen Sie die mesorektale Faszie von der prähypogastrischen Nervenfaszie mit einer monopolaren Schere in R1, bis das Niveau des Musculus levator ani erreicht ist (Abbildung 3A).
HINWEIS: Die Integrität der mesorektalen Faszie sollte erhalten bleiben. - Das Peritoneum einschneiden und die laterale mesorektale Ebene in der Nähe des Rektums mit einer monopolaren Schere in R1 öffnen. Lassen Sie den Assistenzchirurgen das Rektum auf die andere Seite bewegen.
- Ändern Sie das Instrument in R1 in ein harmonisches Skalpell. Sezieren und entwickeln Sie diese Ebene sorgfältig, bis das Niveau des Musculus levator ani erreicht ist. Wiederholen Sie diesen Schritt für die kontralaterale Seite.
HINWEIS: Da die vordere Dissektion noch nicht durchgeführt wurde, ist es schwierig, die laterale mesorektale Ebene vollständig zu entwickeln. Wenn es schwierig zu bedienen erscheint, sollten Sie zuerst mit der Vorderebene in Betracht ziehen. - Das Peritoneum 1 cm über der Reflexion des viszeralen Peritoneums mit dem harmonischen Skalpell in R1 einschneiden. Nachdem Sie die Reflexion des viszeralen Peritoneums eingeschnitten haben, identifizieren Sie die Samenbläschen und die Faszie der Denonvilliers, die die hintere Wand des Samenbläschens bedecken.
HINWEIS: Bei Frauen sollte eine Dissektion zwischen der vaginalen hinteren Wand und der mesorektalen Faszie durchgeführt werden. Chirurgen sollten es vermeiden, die dünne vaginale Hinterwand zu beschädigen. - Entwickeln Sie die Ebene zwischen der Faszie von Denonvilliers und der mesorektalen Faszie weiter, bis das Niveau des Musculus levator ani mit dem harmonischen Skalpell in R3 erreicht ist.
- Führen Sie zu diesem Zeitpunkt eine digitale rektale Untersuchung transanal durch, um zu bestätigen, dass die Dissektion über den distalen Rand des Tumors hinausgegangen ist und dass geeignete Ränder für die Resektion vorhanden sind.
- Trennen Sie das Fettgewebe, das das Rektum auf dieser Ebene umgibt. Transektieren Sie das Rektum mit einem laparoskopischen linearen Schneidhefter.
HINWEIS: Stellen Sie sicher, dass das Rektum unterhalb der distalen Grenze des Tumors mit einem distalen Rand von 2 cm oder mehr durchtrennt wird, wann immer dies möglich ist. - Nehmen Sie das Rektum aus der Beckenhöhle und bewässern Sie die Beckenhöhle reichlich mit destilliertem Wasser. Führen Sie die Hämostase mit Elektrokauterisation mit bipolarer Pinzette in R2 durch.
4. Laterale Beckenlymphknotendissektion
HINWEIS: Bilaterale LPLND kann entweder auf der linken oder rechten Seite beginnen. Die aktuelle Technikrichtlinie schlägt vor, links zu beginnen. Nach der Freisetzung und Mobilisierung des Sigmas und des Rektums können die linke gemeinsame /äußere Beckenarterie und der linke Harnleiter eindeutig identifiziert werden, was den Beginn der Lymphadenektomie auf dieser Seite erleichtert. Die lateralen Beckenlymphknoten umfassen den gemeinsamen Beckenbereich (Nr. 273), den äußeren Beckenbereich (Nr. 293), den Obturatorbereich (Nr. 283) und den inneren Beckenbereich (Nr. 263). Frühere Studien deuten jedoch darauf hin, dass häufige Becken- und externe Beckenlymphknotenmetastasen selten sind9. Daher empfehlen die Behandlungsrichtlinien für Darmkrebs, sich bei der Dissektion in erster Linie auf den Obturatorbereich (Nr. 283) und den inneren Beckenbereich (Nr. 263) zu konzentrieren9.
- Beginnend auf der linken Seite, schneiden Sie das Peritoneum direkt seitlich zum Harnleiter mit dem harmonischen Skalpell in R1 ein. Verlängern Sie den Schnitt bis zum Vas deferens.
HINWEIS: Bei Frauen sollte der Schnitt bis zum Rundband verlängert werden. Verwenden Sie ein harmonisches Skalpell, um Gefäßverletzungen zu minimieren. - Identifizieren Sie den linken Harnleiter auf Höhe seiner Kreuzung mit den Beckengefäßen. Dann mobilisieren Sie den Harnleiter und bewegen Sie ihn mit einer Pinzette in R3 auf die mediale Seite. Lassen Sie den Harnleiter und die prähypogastrische Nervenfaszie zur medialen Ebene der lateralen Knotendissektion werden.
HINWEIS: Eine vollständige Skelettierung des Harnleiters kann die Blutversorgung des Harnleiters schädigen, was nach Möglichkeit vermieden werden sollte. Halten Sie die Dissektion außerdem lateral zum Harnleiter und zur prähypogastrischen Nervenfaszie, um eine Schädigung des autonomen Beckennervs zu vermeiden, der sich medial zu dieser Faszie befindet. - Von der lateralen zur äußeren Beckenarterie trennen Sie das Lymphgewebe, das die Arteria iliaca externa und die Vene umgibt, mit dem harmonischen Skalpell in R1.
- Ziehen Sie die äußere Beckenvene seitlich mit dem Aspirator in der Hand des Assistenten zurück. Trennen Sie bei der Verzweigung der Arteria iliaca interna und extern das Lymphgewebe mit einem harmonischen Skalpell in R1 und identifizieren Sie den Nervus obturatoralis und die Arteria Nabel. An der Seitenwand das Lymphgewebe vollständig von der Oberfläche des Psoas und der inneren Obturatormuskulatur lösen (Abbildung 3C).
HINWEIS: Die Verzweigung der inneren und äußeren Beckenarterien befindet sich am proximalen Ende der lateralen Knotendissektion. - Ziehen Sie die Nabelarterie und die vesicohypogastrische Faszie medial mit dem Aspirator in der Hand des Assistenten zurück und trennen Sie das Lymphgewebe von der vesicohypogastrischen Faszie. Lassen Sie die Nabelarterie und die vesicohypogastrische Faszie zur medialen Wand der Dissektion von Obturatorknoten werden (#283). Trennen Sie vorsichtig das Lymphgewebe von Faszien und Nerven entlang des Obturatornervs mit dem harmonischen Skalpell in R1 und identifizieren Sie die Arteria obturator und die Vene, die die Äste der Arteria iliaca interna und der Vene sind. Isolieren Sie sorgfältig die Arteria obturator und die Vene, um Verletzungen zu vermeiden.
HINWEIS: Einige Patienten können nach unserer Erfahrung zwei oder mehr Obturatornervenäste haben. Eine Verletzung oder Durchtrennung eines dieser Zweige kann nicht zu einer schweren Funktionsstörung führen. Eine vollständige Durchtrennung aller Äste einer Seite des Obturatornervs sollte jedoch so weit wie möglich vermieden werden. - Ziehen Sie den Harnleiter und die Faszie des prähypogastrischen Nervs medial mit dem Aspirator in der Hand des Assistenten ein (Abbildung 3D). Befreien Sie das Lymphgewebe vollständig von der Faszie mit einem harmonischen Skalpell in R1. Identifizieren und isolieren Sie die 2-3 oberen vesikalen Arterien - das sind die Zweige der Nabelschnurarterie.
HINWEIS: Vermeiden Sie es, alle oberen vesikalen Arterienäste zu ligieren, um Harnfunktionsstörungen zu minimieren. Mindestens eine Arteria vesica superior sollte erhalten bleiben, insbesondere wenn eine bilaterale LPLND durchgeführt wird. Andernfalls kann eine schwere Harnfunktionsstörung auftreten. - Fahren Sie fort, das Lymph- und Fettgewebe distal mit dem harmonischen Skalpell in R1 zu sezieren, bis sie den Vas deferens treffen.
HINWEIS: Bei Frauen sollte die Dissektion durchgeführt werden, bis das Rundeband erreicht ist. - Entnehmen Sie das lymphatische Fettgewebe als Einzelprobe mit einem sterilen Probenbeutel aus der Fossa (Abbildung 3E,F). Überprüfen und stellen Sie sicher, dass kein Restlymphgewebe und keine Blutungen vorhanden sind.
- Wiederholen Sie bei Bedarf die in diesem Abschnitt auf der rechten Seite aufgeführten Schritte, um die rechtsseitige Lymphadenektomie abzuschließen.
5. Rekonstruktion des Verdauungstraktes
HINWEIS: Hier kann je nach Erfahrung und Vorliebe des Primärchirurgen entweder eine geheftete kolorektale oder handgenähte Anastomose über offene oder robotische laparoskopische Methoden gewählt werden. Methoden der Anastomose umfassen gerade End-to-End-Anastomose, kleine Reservoir-End-to-Side-kolorektale Anastomose oder Kolon-J-Pouch-Anastomose10. Hier bieten wir eine grundlegende, offene, gerade End-to-End-geheftete kolorektale Anastomose-Technik.
- Machen Sie einen vertikalen Mittellinienschnitt unter der Nabelschnur. Legen Sie einen Wundschutz auf.
HINWEIS: Man kann auch einen Pfannenstiel-Schnitt oder eine andere Art von Schnitt wählen, abhängig von der Erfahrung und Präferenz des Primärchirurgen. - Bestimmen Sie das Transektionsniveau entsprechend der Position des Tumors und der Länge des Dickdarms. Das Transektionsniveau sollte mindestens 10 cm proximal zum proximalen Rand des Tumors betragen. Versuchen Sie, den proximalen Dickdarm in Richtung des rektalen Stumpfes zu befestigen und sicherzustellen, dass keine übermäßige Spannung vorliegt.
- Trennen Sie das proximale und distale Mesenterium. Ligat den Gefäßbogen des Dickdarms. Setzen Sie das Fettgewebe frei, das den Dickdarm auf Transfektionsebene umgibt.
- Klemmen Sie den Doppelpunkt mit einer Handtaschenzange auf dem zuvor festgelegten Niveau ein. Machen Sie eine Geldbörsenschnur mit einer Geldbörsenschnurnadel. Transektieren Sie den Doppelpunkt.
- Stecken Sie den Amboss in das Dickdarmlumen und befestigen Sie die Geldbeutelschnur mit 0 Seidennähten am Ambossschaft. Bringen Sie den proximalen Dickdarm in die Bauchhöhle zurück. Nun wurde das Exemplar vollständig entfernt.
- Führen Sie einen kreisförmigen Hefter transanal unter laparoskopischer Führung ein und drehen Sie den Einstellknopf vorsichtig gegen den Uhrzeigersinn. Strecken Sie den Trokar vollständig aus und durchbohren Sie das Gewebe.
- Schieben Sie den Ambossschaft über den Trokar, bis der Amboss in eine voll sitzende Position einrastet. Schließen Sie, indem Sie den Knopf im Uhrzeigersinn drehen. Beginnen Sie mit dem Hefter, schließen Sie die Anastomose ab.
6. Umleitungsschleife Ileostomie
HINWEIS: Ob eine Diverting-Loop-Ileostomie durchgeführt wird, hängt von der Höhe und Qualität der Anastomose ab und davon, ob der Patient präoperativ mit Bestrahlung behandelt wurde. Wenn die Ileostomie nicht gewählt wird, überspringen Sie bitte die Schritte 6.1.1-6.1.7.
- Machen Sie einen Schnitt im rechten unteren Quadranten weg von Hautfalten, knöchernen Protuberanzen und anderen Einschnitten.
HINWEIS: Wenn eine umleitende Schleifenileostomie präoperativ erwartet wird, versuchen Sie, R1 durch den lateralen Aspekt des markierten Bereichs zu platzieren, um die Anzahl der Einschnitte zu minimieren. - Jede Länge einer mobilisierten, gut vaskulären Dünndarmschlaufe durch die Bauchdecke, während eine Verdrehung des Mesenteriums vermieden wird.
- Machen Sie einen mesenterialen Defekt im avaskulären Bereich. Legen Sie einen Abfluss in das Mesenterium, um die Externalisierung der Schleife für die Reifung als Stoma zu unterstützen.
- Teilen Sie die Antimesenterialwand des Ileums in der Nähe der distalen Extremität auf Höhe der Stomabrücke mit Elektrokauterisation.
HINWEIS: Diese Öffnung sollte von einer mesenteriellen Kante zur anderen erstellt werden. - Führen Sie eine unterbrochene Naht am Rand des Stomas und dem distalen Drittel des Bauchschnitts durch.
- Befestigen Sie den Rand des Stomas an der Seromuskularität der proximalen Ileumwand, indem Sie die Ileumwand umkehren. Unterbrochene Naht der Kante des Stomas, die Seromuskulularität des proximalen Ileums und die proximale subkutuläre Schicht der Bauchöffnung. Erstellen Sie eine everted Knospe.
- Vervollständigen Sie die mukokutane Verbindung.
- Schließen Sie die Faszie und den Schnitt.
- Bewässern Sie alle Wunden reichlich mit Kochsalzlösung.
- Legen Sie einen 19-Fr runden Kanalablauf neben das anastomotische Stoma durch den R3-Schnitt.
- Unterbrochene Naht des Peritoneums und der subkutanen Schicht. Intradermales Nähen der Hautschicht.
Ergebnisse
Die detaillierten perioperativen Informationen des im Video dargestellten Falls sind in Tabelle 1 und Abbildung 3 dargestellt. Das Verfahren wurde im April 2019 vom korrespondierenden Autor mit dem da Vinci Si Robot System durchgeführt. Der geschätzte Blutverlust während der Operation betrug 90 ml, und es waren keine Transfusionen erforderlich. Das postoperative Management hielt sich an die Prinzipien von ERAS. Nach der ersten Defäkation am 6. Tag nach der Operation verabreichten wir einen Meglumin-Diatrizoat-Einlauf und führten eine Röntgenradiographie durch, um festzustellen, ob eine anastomotische Leckage aufgetreten ist. Wir haben dann den Abfluss entfernt, nachdem wir bestätigt hatten, dass es keine Hinweise auf eine Leckage gab. Der Patient berichtete während der Nachuntersuchung nicht über harnwegs oder sexuelle Funktionsstörungen.
Die pathologische Untersuchung der Probe deutete auf ein Adenokarzinom mit moderater Differenzierung hin (Abbildung 4). In keinem der 19 mesorektalen Knoten oder 18 lateralen Lymphknoten wurden positive Lymphknoten nachgewiesen. Das letzte pathologische Stadium war T3N0M0. Es gab keine Hinweise auf eine lymphatische, venöse oder perineurale Invasion. Wir empfahlen dem Patienten, eine adjuvante Chemotherapie mit FOLFOX zu erhalten. Bis Januar 2021 blieb der Patient noch ohne Anzeichen eines Rezidivs oder einer Metastasierung.
In unserem Zentrum wurden robotergestützte TME und LPLND bei 89 Patienten durchgeführt. Alle Eingriffe wurden unter robotergestützter Assistenz erfolgreich abgeschlossen, ohne in eine offene Operation umgewandelt zu werden. Die detaillierten Informationen sind in Tabelle 2 dargestellt. Die mittlere Einsatzzeit betrug 173,5 min. Postoperative Komplikationen entwickelten sich bei 14,6% der Patienten. Die mediane Anzahl der nachgewiesenen Lymphknoten betrug 32. Die gesamtrate der lateralen Beckenlymphknotenmetastasen erreichte 22,5%. Ab April 2021 gab es 3 Patienten, die ein lokales Rezidiv in der Beckenlateralwand und im anastomotischen Stoma mit einer medianen Nachbeobachtungszeit von 1,9 Jahren aufwiesen. Harndysfunktion wurde definiert als ≥50 ml Resturin, der im 3. Monat nach der Operation auftrat. Insgesamt 74 Patienten akzeptierten die Bewertung, und 5 Patienten erfüllten das Kriterium. Sexuelle Dysfunktion bei Männern wurde mit dem International Index of Erectile Function, einem 5-Item-Version (IIEF-5) Fragebogen, und der Female Sexual Function Index (FSFI) Fragebogen wurde für Frauen verwendet. Insgesamt 49 Patienten akzeptierten die postoperative Bewertung. Eine Punktzahl von weniger als 17 auf dem IIEF-5-Fragebogen oder weniger als 28 auf dem FSFI-Fragebogen wurde als Hinweis auf sexuelle Dysfunktion angesehen. Zwei Patienten berichteten über sexuelle Dysfunktion.
Tabelle 1: Repräsentative Ergebnisse. Diese Tabelle zeigt die detaillierten klinischen Ausgangsmerkmale, intraoperativen und postoperativen Ergebnisse und Pathologieergebnisse des repräsentativen Falls. BMI: Body-Mass-Index; ASA: Amerikanische Gesellschaft der Anästhesisten; LPLND: laterale Beckenlymphknotendissektion; TME: totale mesorektale Exzision. *Hier zählten wir nur Komplikationen, die einen zusätzlichen therapeutischen Eingriff erforderten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.

Abbildung 1: Betriebseinstellung. Diese Figur wurde von Napoli, N., Kauffmann, E. F., Menonna, F., Iacopi, S., Cacace, C., Boggi, U. Robot-Assisted Radical Antegrade Modular Pancreatosplenectomy Including Resection and Reconstruction of the Spleno-Mesenteric Junction adaptiert. (155), e60370, doi:10.3791/60370 (2020)11. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
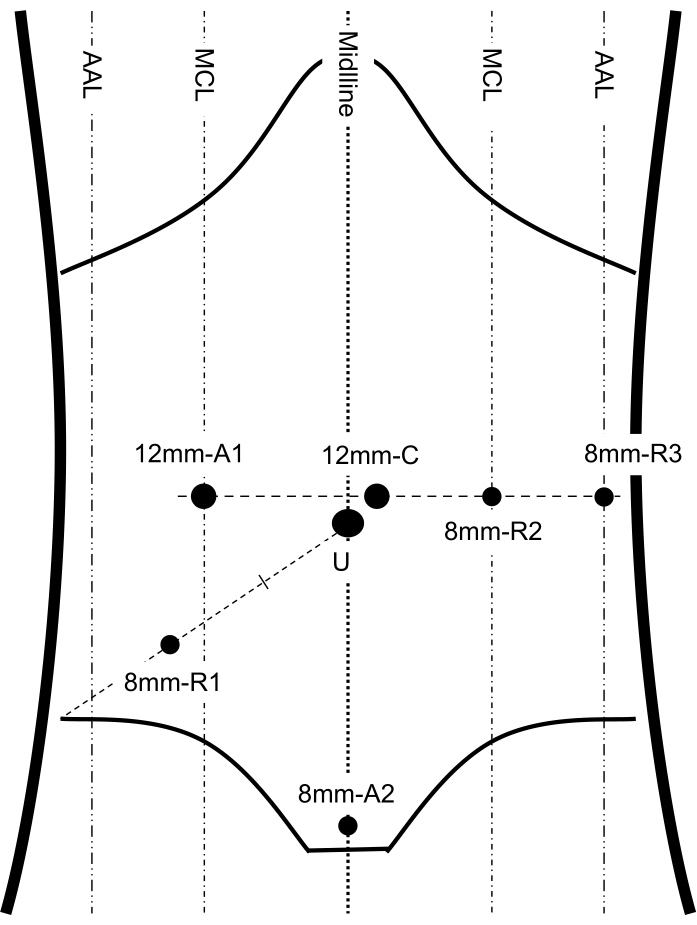
Abbildung 2: Portplatzierung. Diese Abbildung zeigt die wichtigen anatomischen Orientierungspunkte der Abdomen- und Portplatzierung, darunter 3 Roboterarme, 1 Kamera und 2 Assistenzports. MCL: mittelklavikuläre Linie; AAL: vordere Achsellinie; C: Kameraanschluss; U: Nabel; R1, 2, 3: Roboterarm 1, 2, 3; A1, 2: Hilfsport 1, 2. Diese Figur wurde von Shi F, Li Y, Pan Y, et al. modifiziert. Klinische Machbarkeit und Sicherheit der robotischen und endoskopischen kooperativen Chirurgie des dritten Raums für die gastrointestinale Stromatumordissektion im Magen: Eine neue Operationstechnik zur Behandlung von Magen-GISTs. Surg Endosc. 2019;33(12):4192-4200. doi:10.1007/s00464-019-07223-w12. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Roboter-TME und LPLND. (A) Die Dissektion der retrorektalen Ebene wurde zwischen mesorektaler Faszie und prähypogastrischer Nervenfaszie durchgeführt. Die gelb gestrichelte Linie zeigt das sakrale Vorgebirge an. (B) Schnitt entlang der gelb gestrichelten Linie, um die vordere Ebene zwischen der Faszie der Denonvilliers und der mesorektalen Faszie zu öffnen. (C) Dissektion der Obturatorknoten. Die gelb gestrichelte Linie zeigt den Bereich der Obturatorknoten an (#283). Die blau gestrichelte Linie zeigt die Nabelarterie an. (D) Dissektion des inneren Beckenlymphknotens. Die gelb gestrichelte Linie zeigt den Bereich der inneren Beckenlymphknoten an (#263). (E) Die LPLND wurde abgeschlossen. (F) Ganze Probe von reseziertem lateralem Lymph- und Fettgewebe. MRF: mesorektale Faszie; PHNF: Prähypogastrische Nervenfaszie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
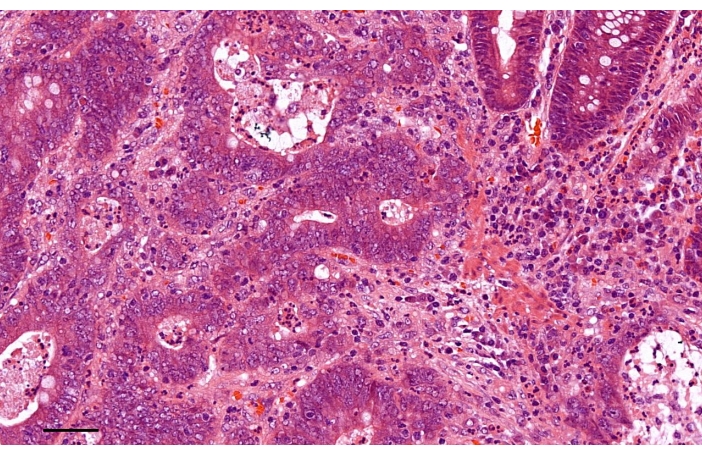
Abbildung 4: Die pathologische Untersuchung der Probe zeigte ein Adenokarzinom mit moderater Differenzierung (Hämatoxylin-Eosin-Färbung). Maßstabsleiste, 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 2: Ergebnisse von 89 aufeinanderfolgenden robotergestützten TME und LPLND. Diese Tabelle zeigt die detaillierten klinischen Ausgangsmerkmale, intraoperativen und postoperativen Ergebnisse und Pathologieergebnisse. BMI: Body-Mass-Index; ASA: Amerikanische Gesellschaft der Anästhesisten; LPLND: laterale Beckenlymphknotendissektion; TME: totale mesorektale Exzision. *Hier zählten wir nur Komplikationen, die einen zusätzlichen therapeutischen Eingriff erforderten. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Darmkrebs (CRC) ist eine der häufigsten Krebsarten weltweit13. Unter ihnen sind mehr als ein Drittel Rektumkarzinom. Aufgrund des höheren postoperativen Funktionsbedarfs und der ausgefeilten neuro- und faszialen Anatomie des Beckens und des Perineums steht der beste chirurgische Ansatz bei Rektumkarzinom, insbesondere bei niedrigem oder ultralowem Rektumkarzinom, noch in großer Diskussion. Seit ihrem ersten Bericht im Jahr 1979 ist die totale mesorektale Exzision (TME) die Standardoperationstechnik zur Behandlung von resezierbarem Rektumkarzinom14. Bei vollständiger Exzision des Mesorektums nimmt die lokale Rezidivrate signifikant ab. Dieser Ansatz ist jedoch bei Patienten mit niedrigem Rektumkarzinom nach wie vor eine Herausforderung, und eine hohe Konversionsrate und positive Resektionsmargen sind nach wie vor besorgniserregend15,16. Sylla et al. entwickelten die Strategie der transanalen totalen mesorektalen Exzision (TaTME) als neuartigen Ansatz zur chirurgischen Behandlung von Rektumkarzinom17. In der Tat wurde vorgeschlagen, dass TaTME die Vorteile von weniger Bauchschnitten, einer besseren Visualisierung der mesorektalen Ebene und des distalen Resektionsrandes und einer besseren Machbarkeit im schmalen Beckenraum hat15. Es bestehen jedoch nach wie vor einige Kontroversen über langfristige onkologische Ergebnisse und postoperative Lebensqualität. Landesweite Daten zeigen, dass TaTME eine höhere lokale Rezidivrate aufweist als laparoskopische TME18. Darüber hinaus können Patienten, die sich einer TaTME unterziehen, aufgrund einer langen Intraoperativen analen Traktion langfristige (über 6 Monate) Analschmerzen ertragen19. Diese aufkommende Technik erfordert möglicherweise Verbesserungen des Verfahrens selbst, standardisierte Richtlinien und strukturierte Schulungsprogramme, um weit verbreitet angewendet zu werden.
Eine andere Technik ist entstanden und wurde zunehmend unter Kolorektalchirurgen als beliebte Option akzeptiert. Ein Krankenhaus in Seoul führte 200720 die erste da Vinci robotergestützte TME durch und berichtete darüber. Robotergestützte chirurgische Eingriffe überwinden die Einschränkungen der offenen (begrenztes Gesichtsfeld und enger Operationsraum) und laparoskopischen Ansätze (Verringerung der manuellen Geschicklichkeit, ein kontraintuitiver Bewegungsmodus, vergrößertes natürliches Zittern der Hand und flache Visuals). Im Vergleich zu laparoskopischen Verfahren tauscht das da Vinci Operationsrobotersystem ein flaches, 2-dimensionales fehlplatziertes Bild, das durch zusätzliches Personal erhalten werden muss, gegen ein 3-dimensionales hochwertiges Gesichtsfeld, das detailliertere anatomische Strukturen darstellen kann. Darüber hinaus verwendet das da Vinci-System einen mehrgelenkigen Arm mit 7 Freiheitsgraden, um die Bewegung einer natürlichen menschlichen Hand anstelle von umständlichen geraden "Essstäbchen" -Bewegungen perfekt zu kopieren. Darüber hinaus haben mehrere ergonomische Erfindungen den natürlichen Tremor stark reduziert, um die Stabilität der chirurgischen Instrumente zu gewährleisten und unvorhergesehene Verletzungen zu minimieren. Der Verlust von Tastsinn und Kraftrückkopplung wurde jedoch immer noch nicht behoben. Jüngste systematische Übersichtsarbeiten und Metaanalysen haben gezeigt, dass die robotergestützte TME eine signifikant geringere Umwandlungsrate in offene Operationen aufweist als laparoskopische Verfahren, obwohl sie Patienten mit einem höheren Body-Mass-Index und einer niedrigeren Tumorlokalisation sowie einen höheren Anteil an Patenten, die eine neoadjuvante Therapie erhalten, umfassten, die alle nachteilige Faktoren für chirurgische Eingriffe sind21. 22. Auflage. Die langfristigen onkologischen Ergebnisse robotischer und laparoskopischer Verfahren sind gleichwertig23. Ein robotergestützter Ansatz gilt allgemein als sinnvolle Alternative für komplizierte Verfahren wie TME und LPLND. Es sollte jedoch anerkannt werden, dass die robotergestützte TME immer noch einige Einschränkungen aufweist, wie z. B. höhere Kosten für Patienten und Abteilungen und zusätzliche Schulungsanforderungen16.
Das Standard-TME-Verfahren beinhaltet keine Dissektion der lateralen Beckenlymphknoten (LPLNs). Nach den Ergebnissen früherer Studien der Japanischen Gesellschaft für Dickdarm- und Rektumkrebs (JSCCR) betrug die Gesamtmetastasierungsrate von LPLN bei Patienten, deren untere Tumorgrenze distal zur Peritonealreflexion war und deren Krebs über die Muscularis propria hinaus eindrang, jedoch 20,1%9. Eine multizentrische, randomisierte kontrollierte Studie (RCT) für den unteren Rektumkarzinom im klinischen Stadium II/III (JCOG0212) zeigte, dass ein hochwertiges TME-Verfahren mit LPLN-Dissektion (LPLND) die lokale Rezidivrate nach der Operation reduzieren kann (12,6% bei TME allein vs. 7,4% bei TME mit LPLND, P=0,024)3. In westlichen Ländern ist die neoadjuvante Strahlentherapie / Chemoradiotherapie (NART / CRT) zur Standardbehandlung für Rektumkarzinom im klinischen Stadium II / III geworden und nicht LPLND24. Eine kürzlich durchgeführte multizentrische Studie zeigte jedoch, dass NART / CRT gefolgt von TME allein nicht ausreicht, um ein lokales Rezidiv bei Rektumkarzinompatienten mit vergrößerten LPLNs zu verhindern. Die Zugabe von LPLND kann die Rezidivrate signifikant reduzieren (19,5% in TME allein gegenüber 5,7% in TME mit LPLND, P = 0,042)25. Daher sollte ein Standard-TME-Verfahren, das selektiv mit LPLND entsprechend den klinischen und bildgebenden Merkmalen des Patienten kombiniert wird, eine chirurgische Standardbehandlung für lokal fortgeschrittenen mittel-niedrigen Rektumkarzinom sein. Der Hauptfaktor, der die Entwicklung und den breiten Einsatz von LPLND einschränkt, sind jedoch die hohen Inzidenzraten postoperativer Harn- und sexueller Dysfunktion. Zwei Meta-Analysen berichteten, dass im Vergleich zu TME allein zusätzliche LPLND die Inzidenz von Harnfunktionsstörungen deutlich erhöhte, während nur eine Meta-Analyse eine höhere Inzidenz sexueller Dysfunktion berichtete26,27.
Derzeit verwenden wir das robotergestützte chirurgische System, um TME und zusätzliche LPLND durchzuführen. Nach unseren vorläufigen Ergebnissen führt der Einsatz von robotischer TME und LPLND zu günstigen perioperativen Ergebnissen und gleichwertigen mittelfristigen onkologischen Ergebnissen. Da das da Vinci-Robotersystem mehrere Eigenschaften aufweist, wie wir bereits beschrieben haben, zeigt das System inhärente Vorteile bei der Identifizierung und Dissektion wichtiger Nerven und Gefäße, um möglicherweise das Risiko postoperativer Komplikationen zu reduzieren. Es sollte jedoch beachtet werden, dass die Entscheidung, LPLND zu kombinieren, von klinischen Merkmalen und Patientenfaktoren abhängen sollte. Bisher wurde eine breit angelegte präventive LPLND für Patienten ohne Hinweise auf laterale Lymphknotenmetastasen aufgrund ihres hohen Verletzungsrisikos, der niedrigen Metastasenrate und der hohen Raten postoperativer Harn- und sexueller Dysfunktion nicht empfohlen28. Darüber hinaus sollten einige Patientenfaktoren berücksichtigt werden. Eine Frage stellt sich: Für ältere Rektumkarzinompatienten, werden sie mit Krebs oder an Krebs sterben? 29 Bei älteren Rektumkarzinompatienten sollten chirurgische Eingriffe vorsichtiger entschieden werden. Im Allgemeinen haben ältere Patienten verschiedene Komorbiditäten und Gebrechlichkeit, was zu höheren Raten von intra- und postoperativen Komplikationen führt. Darüber hinaus sind im Gegensatz zu jüngeren Patienten die Aufrechterhaltung von Funktion und Lebensqualität für ältere Patienten wichtiger als die Erzielung optimaler onkologischer Vorteile. Daher ist eine umfassende präoperative Bewertung des Nutzens und des Schadensrisikos unbedingt erforderlich.
Basierend auf unserer Erfahrung sollten mehrere Schlüsselpunkte dieser Technik hervorgehoben werden, um ein erfolgreiches Verfahren zu gewährleisten. Das Wichtigste ist eine ausreichende Vertrautheit mit anatomischen Strukturen. Während der TME-Phase geht es vor allem darum, wie die autonomen Beckennerven effektiv geschützt werden können. Es sollte beachtet werden, dass die Dissektion durch ein harmonisches Skalpell anstelle von Elektrokauterisation durchgeführt wurde, was das Risiko einer thermischen Verletzung verringern könnte. Darüber hinaus ist ein radikales Verständnis der Faszien und Ebenen, die das Rektum umgeben, erforderlich30. Es gibt drei Ebenen, die bei der Dissektion und Mobilisierung des Rektums zu berücksichtigen sind. Die erste ist die klassische TME-Ebene zwischen der mesorektalen Faszie und der prähypogastrischen Nervenfaszie (posterior und lateral zum Rektum) oder der Denonvilliers-Faszie (anterior zum Rektum). Durch die Entwicklung dieser Ebene können die umgebenden autonomen Nerven geschützt werden. Außerhalb der TME-Ebene befindet sich eine zweite Ebene zwischen der prähypogastrischen Nervenfaszie und der präsakralen Faszie (posterior) oder vesicohypogastrischen Faszie (lateral) und anterior zur Denonvilliers-Faszie, die ein höheres Verletzungsrisiko für den Beckenplexus birgt. Die dritte Ebene befindet sich in der Nähe der endopelvinen Faszie und wird selten angenommen. Darüber hinaus ist während der LPLND-Phase die anatomische Struktur der lateralen Beckenregion komplex, insbesondere die Regionen des Obturators und der Arteria iliaca interna. Wir sollten drei Ebenen klar identifizieren: die seitliche Wandebene, die aus dem Psoas und den inneren Obturatormuskeln besteht; die mediale Ebene, bestehend aus dem Harnleiter und der hypogastrischen Nervenfaszie und dem Beckenplexus; und die Rückenebene, bestehend aus den inneren Beckengefäßen und dem Ischiasnerv. Diese drei Ebenen definieren die Grenzen der Dissektion. Darüber hinaus teilt die vesicohypogastrische Faszie den Bereich in die Kompartimente obturator und das innere Becken, wobei die leicht erkennbare Nabelschnurarterie als obere Grenze gilt. Die selektive Ligatur der Gefäße kann Blutungen kontrollieren und die anatomischen Strukturen freilegen. Es sollte jedoch beachtet werden, dass der Nervus obturatoris und die Arteria vesica superior sorgfältig erhalten werden sollten. Wenn die Blutung nicht kontrolliert wird, sollte eine schnelle und sichere offene Umwandlung durchgeführt werden, während der Assistent vorübergehend Druck ausübt. Darüber hinaus spielt der R3-Arm eine wichtige Rolle beim Rückzug des Organs und des Gewebes, um eine optimale Exposition zu ermöglichen. Ein erfahrener Chirurg kann den R3-Arm richtig platzieren, um die Zielstrukturen klarer freizulegen und eine genaue Dissektion sicherzustellen.
Zusammenfassend lässt sich sagen, dass die robotische TME- und LPLND-Technik für Patienten mit lokal fortgeschrittenem mittel-niedrigem Rektumkarzinom sicher und machbar ist. Diese Technik ermöglicht eine bessere Exposition komplizierter anatomischer Strukturen und kann unvorhergesehene Verletzungen reduzieren, die dem Entwicklungstrend der minimal-invasiven Chirurgie folgen. Eine geeignete Auswahl der chirurgischen Indikationen und ein radikales Verständnis der anatomischen Strukturen sind kritische Faktoren für erfolgreiche Eingriffe. Darüber hinaus schlagen wir entsprechend individualisierte Anpassungen vor, die auf den Präferenzen und Erfahrungen der einzelnen Chirurgen basieren.
Offenlegungen
Nichts zu verraten.
Danksagungen
Dieses Projekt wurde von der National Natural Science Foundation of China (Nr. 81870380) und der Shaanxi Province Science Foundation (2020ZDLSF01-03 und 2020KWZ-020) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0 Silk suture | N/A | N/A | Secure the anvil |
| 12mm Trocar | Medtronic (Minneapolis, MN) | NONB12STF | Assistant port 1 |
| 19 Fr drain | N/A | N/A | Pelvic drain |
| 2-0 Silk suture | N/A | N/A | Close skin incisions |
| 2-0 V-Loc sutures | Covidien (Dublin, Ireland) | VLOCL0315 | Barbed Absorable Suture |
| 4-0 PDS | Ethicon (Somerville, NJ) | SXPP1A400 | Synthetic Absorbable Suture |
| 8mm Trocar | Medtronic (Minneapolis, MN) | NONB8STF | Assistant port 2 |
| Bipolar forceps | Intuitive (Sunnyvale, CA) | 470172 | Operation |
| Cadiere grasping forceps | Intuitive (Sunnyvale, CA) | 470049 | Operation |
| Circular stapler | EzisurgMed (Shanghai, China) | CS2535 | Laparoscopic Surgical Stapler |
| Da Vinci Si | Intuitive (Sunnyvale, CA) | N/A | Surgical Robot |
| Da Vinci Xi | Intuitive (Sunnyvale, CA) | N/A | Surgical Robot |
| Hem-o-lok ligation clip | Weck (Morrisville, NC) | 544995 | Ligation of vessel |
| Laparoscopic single use linear cutting stapler | EzisurgMed (Shanghai, China) | U12M45 | Laparoscopic Surgical Stapler |
| Large needle driver | Intuitive (Sunnyvale, CA) | 470006 | Operation |
| Monopolar scissors | Intuitive (Sunnyvale, CA) | 470179 | Operation |
| Ribbon retractor | N/A | N/A | Control movement of rectum |
| Specimen Bags | N/A | N/A | Extract specimen |
| Veress needle | N/A | N/A | Saline drop test |
Referenzen
- Fantus, R. J., et al. Facility-level analysis of robot utilization across disciplines in the National Cancer Database. Journal of Robotic Surgery. 13 (2), 293-299 (2019).
- Akiyoshi, T., et al. Results of a japanese nationwide multi-institutional study on lateral pelvic lymph node metastasis in low rectal cancer is it regional or distant disease. Annals of Surgery. 255 (6), 1129-1134 (2012).
- Fujita, S., et al. Mesorectal excision with or without lateral lymph node dissection for clinical stage II/III lower rectal cancer (JCOG0212): A multicenter, randomized controlled, noninferiority trial. Annals of Surgery. 266 (2), 201-207 (2017).
- Yamaguchi, T., Kinugasa, Y., Shiomi, A., Tomioka, H., Kagawa, H. Robotic-assisted laparoscopic versus open lateral lymph node dissection for advanced lower rectal cancer (vol 30, pg 721). Surgical Endoscopy and Other Interventional Techniques. 30 (2), 729(2016).
- Yamaguchi, T., et al. Oncological outcomes of robotic-assisted laparoscopic versus open lateral lymph node dissection for locally advanced low rectal cancer. Surgical Endoscopy and Other Interventional Techniques. 32 (11), 4498-4505 (2018).
- The First Affiliated Hospital of Xi 'an Jiaotong University: Department of General Surgery. , Available from: http://www.dyyy.xjtu.edu.cn/jypt/jyzn1/yyks/lcks/ptwk_y_ebq_.htm (2021).
- Gustafsson, U. O., et al. Guidelines for perioperative care in elective colorectal surgery: enhanced recovery after surgery (ERAS((R))) society recommendations: 2018. World Journal of Surgery. 43 (3), 659-695 (2019).
- Brind'Amour, A., et al. Canadian guidelines on the management of colorectal peritoneal metastases. Current Oncology. 27 (6), 621-631 (2020).
- Watanabe, T., et al. Japanese society for cancer of the colon and rectum (JSCCR) guidelines 2016 for the treatment of colorectal cancer. International Journal of Clinical Oncology. 23 (1), 1-34 (2018).
- Professional Committee of Robotic Surgery, C.C.C.o.C.M.D.A. Robotic and Laparoscopic Surgery Committee of Chinese Research Hospital, A. [Chinese expert consensus on robotic surgery for colorectal cancer (2020 edition)]. Zhonghua Wei Chang Wai Ke Za Zhi. 24 (1), 14-22 (2021).
- Napoli, N., et al. Robot-Assisted Radical Antegrade Modular Pancreatosplenectomy Including Resection and Reconstruction of the Spleno-Mesenteric Junction. Journal of Visualized Experiments. (155), e60370(2020).
- Shi, F., et al. Clinical feasibility and safety of third space robotic and endoscopic cooperative surgery for gastric gastrointestinal stromal tumors dissection : A new surgical technique for treating gastric GISTs. Surgical Endoscopy and Other Interventional Techniques. 33 (12), 4192-4200 (2019).
- Sung, H., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer Journal for Clinicians. 71 (3), 209-249 (2021).
- Heald, R. J. A new approach to rectal cancer. British Journal of Hospital Medication. 22 (3), 277-281 (1979).
- Jiang, T. Y., Ma, J. J., Zheng, M. H. Controversies and consensus in transanal total mesorectal excision (taTME): Is it a valid choice for rectal cancer. Journal of Surgical Oncology. 123, Suppl 1 59-64 (2021).
- Di Saverio, S., Stupalkowska, W., Hussein, A., Fearnhead, N., Wheeler, J. Laparoscopic ultralow anterior resection with intracorporeal coloanal stapled anastomosis for low rectal cancer - is robotic surgery or transanal total mesorectal excision always needed to achieve a good oncological and sphincter-sparing dissection - a video vignette. Colorectal Diseases. 21 (7), 848-849 (2019).
- Sylla, P., Rattner, D. W., Delgado, S., Lacy, A. M. NOTES transanal rectal cancer resection using transanal endoscopic microsurgery and laparoscopic assistance. Surgical Endoscopy and Other Interventional Techniques. 24 (5), 1205-1210 (2010).
- Larsen, S. G., Pfeffer, F., Korner, H. Norwegian moratorium on transanal total mesorectal excision. British Journal of Surgery. 106 (9), Norwegian Colorectal Cancer, G 1120-1121 (2019).
- Koedam, T. W., et al. Transanal total mesorectal excision (TaTME) for rectal cancer: effects on patient-reported quality of life and functional outcome. Techniques in Coloproctology. 21 (1), 25-33 (2017).
- Baik, S. H., et al. Robotic total mesorectal excision for the treatment of rectal cancer. Journal of Robotic Surgery. 1 (1), 99-102 (2007).
- Gavriilidis, P., et al. Robotic vs laparoscopic total mesorectal excision for rectal cancers: has a paradigm change occurred? A systematic review by updated meta-analysis. Colorectal Diseases. 22 (11), 1506-1517 (2020).
- Prete, F. P., et al. Robotic versus laparoscopic minimally invasive surgery for rectal cancer: A Systematic review and meta-analysis of randomized controlled trials. Annals of Surgery. 267 (6), 1034-1046 (2018).
- Qiu, H., et al. Long-term oncological outcomes in robotic versus laparoscopic approach for rectal cancer: A systematic review and meta-analysis. International Journal of Surgery. 80, 225-230 (2020).
- Kapiteijn, E., et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. New England Journal of Medicine. 345 (9), 638-646 (2001).
- Ogura, A., et al. Neoadjuvant (Chemo)radiotherapy with total mesorectal excision only is not sufficient to prevent lateral local recurrence in enlarged nodes: Results of the multicenter lateral node study of patients with low cT3/4 rectal cancer. Journal of Clinical Oncology. 37 (1), 33-43 (2019).
- Emile, S. H., Elfeki, H., Shalaby, M., Sakr, A., Kim, N. K. Outcome of lateral pelvic lymph node dissection with total mesorectal excision in treatment of rectal cancer: A systematic review and meta-analysis. Surgery. 169 (5), 1005-1015 (2021).
- Hajibandeh, S., Hajibandeh, S., Matthews, J., Palmer, L., Maw, A. Meta-analysis of survival and functional outcomes after total mesorectal excision with or without lateral pelvic lymph node dissection in rectal cancer surgery. Surgery. 168 (3), 486-496 (2020).
- Laparoscopic surgery committee of the endoscopist branch in the chinese medical doctor, A. Laparoscopic surgery committee of colorectal cancer committee of chinese medical doctor, A. and Colorectal surgery group of the surgery branch in the chinese medical, A. [Chinese expert consensus on the diagnosis and treatment for lateral lymph node metastasis of rectal cancer (2019 edition)]. Zhonghua Wei Chang Wai Ke Za Zhi. 22 (10), 901-912 (2019).
- Podda, M., et al. Multidisciplinary management of elderly patients with rectal cancer: recommendations from the SICG (Italian Society of Geriatric Surgery), SIFIPAC (Italian Society of Surgical Pathophysiology), SICE (Italian Society of Endoscopic Surgery and new technologies), and the WSES (World Society of Emergency Surgery) International Consensus Project. World Journal of Emergency Surgery. 16 (1), 35(2021).
- Fung, T. L. D., Tsukada, Y., Ito, M. Essential anatomy for total mesorectal excision and lateral lymph node dissection, in both trans-abdominal and trans-anal perspective. Surgeon. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten