Method Article
Préparation de base de biomasse mésoporeux carbone avec azote supérieur-/ Adsorption chélateurs de l’oxygène pour cu (ii) par le biais de micro-ondes pyrolyse pré
Dans cet article
Résumé
Nous présentons ici un protocole pour faire la synthèse de carbone mésoporeux dopé au double azote/oxygène provenant de la biomasse par activation chimique en modes différents pyrolyse suivie de modification. Nous démontrons que la pyrolyse du four à micro-ondes profite du processus de modification ultérieure pour introduire simultanément plus d’azote et d’oxygène des groupes fonctionnels sur le carbone.
Résumé
Une technique respectueuse de l’environnement pour la synthèse mésoporeux à base de biomasse charbon actif avec azote haute- / adsorption chélateurs de l’oxygène pour cu (ii) est proposée. Bagasse imprégnée d’acide phosphorique est utilisé comme précurseur. Pour la pyrolyse du précurseur, deux modes de chauffage séparé sont utilisés : micro-ondes pyrolyse et pyrolyse conventionnelle de chauffage électrique. Les échantillons de carbone dérivé de bagasse qui en résultent sont modifiées avec modification de nitrification et de réduction. Azote (N) / groupes fonctionnels de l’oxygène (O) sont introduits simultanément à la surface du charbon actif, améliorant son adsorption du cu (ii) par complexation et échange d’ions. Caractérisation et cuivre adsorption des expériences sont effectuées pour enquêter sur les propriétés physico-chimiques des quatre échantillons de carbone préparés et déterminer quelle méthode de chauffage favorise la modification ultérieure pour dopage des groupes fonctionnels N/O. Dans cette technique, basée sur l’analyse des données de l’adsorption d’azote, spectroscopie infrarouge à transformée de Fourier et des expériences d’adsorption par lots, il est prouvé que micro-ondes-pyrolyse carbone a plusieurs sites de défaut et, par conséquent, gagner du temps en vigueur micro-ondes pyrolyse contribue plus d’espèces N/O au carbone, même si elle conduit à une surface spécifique plus faible. Cette technique offre une piste prometteuse d’adsorbants de synthèse avec l’azote plus élevée et la teneur en oxygène et une plus grande capacité d’adsorption des ions de métaux lourds dans les applications d’assainissement des eaux usées.
Introduction
Charbon actif possède des propriétés d’absorption uniques, comme une structure poreuse développée, une surface spécifique élevée et les divers groupes fonctionnels surfaces ; par conséquent, il est employé comme adsorbant dans eau traitement ou purification1,2,3,4. Outre ses avantages physiques, charbon actif est rentable et sans danger pour l’environnement et ses matières premières (par exemple, la biomasse) est abondante et facilement obtenu5,6. Les propriétés physico-chimiques du charbon actif dépendent les précurseurs utilisés dans la préparation et les conditions expérimentales de l’activation de processus7.
Deux méthodes sont généralement utilisées pour préparer le charbon actif : une seule étape et un en deux étapes approche8. L’approche d’une étape de terme se réfère à précurseurs étant carbonisé et activés simultanément, alors que l’approche en deux étapes qui désigne dans l’ordre. Compte tenu des économies d’énergie et protection de l’environnement, l’approche d’une étape est plus préféré pour sa plus basse température et pression exigeant.
En outre, activation chimique et physique sont utilisées pour améliorer les propriétés texturales de charbon actif. Activation chimique possède des avantages apparents au cours de l’activation physique en raison de sa température de déclenchement inférieur plus court temps d’activation, rendement de carbone plus élevé et plus structure de pores développés et contrôlables dans une certaine mesure9. Il a été testé qu’activation chimique peut être effectuée par imprégnation la biomasse utilisée comme matière première avec H3PO4, ZnCl2ou autres produits chimiques spécifiques, suivis par pyrolyse à augmenter la porosité du charbon actif, parce que des composants de la biomasse ligno-cellulosiques s’éliminent facilement par un traitement de chauffage subséquent, en raison de la capacité de déshydrogénation de ces produits chimiques10,11. Dès lors, activation chimique grandement favorise la formation de pores du charbon actif ou améliore les performances d’adsorption de contaminants12. Un activateur acide est préféré à H3PO4, en raison de sa demande d’énergie relativement faible, un rendement plus élevé et moins d’impact sur l’environnement13.
Four à micro-ondes pyrolyse a la supériorité dans les économies de temps, chauffage intérieur uniforme, l’efficacité énergétique et chauffage sélectif, ce qui en fait une méthode de chauffage alternative carbone activé par synthèse14,15. Par rapport à un chauffage électrique conventionnel, micro-ondes pyrolyse peut améliorer les processus thermochimiques et favoriser certaines réactions chimiques16. Récemment, des études approfondies ont mis l’accent sur la préparation des charbons par activation chimique de la biomasse en utilisant une étape micro-ondes pyrolyse9,17,18,19. Ainsi, il est considérablement instructif et respectueux de l’environnement de synthèse basé sur la biomasse charbon actif en activant l’assistée par micro-ondes H3PO4 .
En outre, pour améliorer les affinités d’adsorption du charbon vers les ions de métaux lourds spécifiques, modification par hétéroatome [N, O, soufre (S), etc.] dopage dans des structures de carbone a été proposée, et cela s’est avéré une méthode souhaitable 20,21,22,23,24,25,26. Les sites défectueux dans ou sur les bords d’une couche de graphite peuvent être remplacés par hétéroatomes pour générer des groupes fonctionnels27. Par conséquent, modification de nitrification et de réduction servent à modifier les échantillons de carbone qui en résulte pour la "dope" Gonzalez N/O des groupes fonctionnels qui jouent un rôle crucial dans la coordination efficace avec métaux lourds pour former complexants et échange d’ions28.
D’après ce qui précède, nous présentons un protocole visant à synthétiser carbone mésoporeux dopé au double N/O de la biomasse par activation chimique et deux méthodes différentes de pyrolyse suivis par modification. Ce protocole détermine également quel méthode de chauffage favorise la modification qui s’ensuivie pour dopage des groupes fonctionnels N/O et, ainsi, améliorer la performance de l’adsorption.
Protocole
1. préparation du charbon actif axée sur la Bagasse
-
Préparation du précurseur pour axée sur la bagasse charbon actif
- Rincer la bagasse (obtenue sur une ferme dans la province de Jiangsu, Chine) avec de l’eau désionisée et placer les échantillons dans une étuve à 100 ° C pendant 10 h.
- Écraser la bagasse sèche avec une meuleuse et tamisez la poudre à travers un tamis de maille 50.
- Place 30 g de poudre de bagasse fine dans une solution de l’acide phosphorique (H3PO4) wt % 15 dans un ratio de 1:1 en poids pendant 24 h. sécher le mélange dans une étuve à 105 ° C pour 6 h. recueillir le produit qui en résulte comme le précurseur de bagasse-basé de charbon actif (cab).
-
Pyrolyse de chauffage électrique conventionnelle du précurseur
- Mettre 15 g du précurseur dans un bateau de quartz, puis insérez le bateau de quartz dans un tube en verre de quartz d’un four électrique.
- Fixer le taux de chauffage du four à 5 ° C min-1 à carboniser l’échantillon. Lorsque la température atteint 500 ° C, maintenir la température pendant 90 min et ensuite laisser l’échantillon de charbon actif qui en résulte se refroidir à température ambiante dans l’azote. Assurer un flux d’azote de 80 mL min-1 avec un débitmètre à rotor pendant l’ensemble du processus.
- Triturer et recueillent le four électrique-pyrolyse axée sur la bagasse charbon (EBAC) dans un bécher et puis chauffer dans un four de séchage sous vide à 105 ° C pendant 24 h.
-
Four à micro-ondes pyrolyse du précurseur
- Mettre 15 g du précurseur dans un four à micro-ondes (avec une fréquence de 2,45 GHz).
- Régler la puissance du four à micro-ondes à 900 W à pyrolyse l’échantillon pendant 22 min et d’assurer le débit d’azote à 20 mL min-1 avec un débitmètre à rotor. L’entrée d’air du débitmètre du rotor est reliée à une bouteille d’azote à l’aide d’un tuyau, alors que la sortie est reliée à l’entrée d’air du four à micro-ondes.
- Permettre le carbone qui en résulte se refroidir à température ambiante dans l’azote. Triturer et recueillir les échantillons de carbone dans un bécher et puis ajouter 300 mL d’acide chlorhydrique (0,1 M). Agiter le mélange avec un agitateur magnétique (à 200 tr/min) pendant plus de 12 h à température ambiante.
- Le carbone par le filtre papier avec filtration sous vide et les rincer l’échantillon avec de l’eau désionisée jusqu'à ce que la valeur du pH de l’eau de lavage est > 6. Sécher le micro-ondes-pyrolyse axée sur la bagasse charbon (NGC) dans un four de séchage sous vide à 105 ° C pendant 24 h.
2. modification du four électrique-pyrolyse-base de Bagasse charbon et micro-ondes-pyrolyse axée sur la Bagasse charbon actif
Note : La modification des deux échantillons a été effectuée selon la littérature29.
-
Nitrification
- Mélanger 50 mL de concentré acide sulfurique et 50 mL d’acides nitrique concentrés dans un Becher à 0 ° C (dans un bain de glace).
Attention : Lorsque le mélange de l’acide sulfurique concentré et acide nitrique concentré est mixte, l’acide sulfurique concentré devrait être lentement ajouté à l’acide nitrique concentré et remué avec une baguette de verre et refroidi dans le temps. - Ajouter 10 g de EBAC/NGC dans la mélange de la solution. Utiliser un agitateur magnétique à remuer le mélange pendant 120 min (à 200 tr/min).
- Filtrer le nettoyages EBAC/NGC en papier filtre avec filtration sous vide. Laver le carbone à l’eau désionisée jusqu'à ce que l’eau atteigne pH 6 et puis sécher dans une étuve à 90 ° C pendant 24 h.
- Mélanger 50 mL de concentré acide sulfurique et 50 mL d’acides nitrique concentrés dans un Becher à 0 ° C (dans un bain de glace).
-
Modification réductrice
- Dans un ballon à col trois, ajoutez les 5,05 g du produit qui en résulte, 50 mL d’eau désionisée et 20 mL de solution d’ammoniaque (15 M). Incorporer ce mélange pendant 15 min avec un agitateur magnétique (à 200 tr/min), puis ajouter 28 g de Na2S2O4et laisser le mélange en remuant à température ambiante pendant 20 h.
- Adapter un réfrigérant à reflux à la fiole et chauffer le mélange jusqu'à 100 ° C à l’aide d’un bain d’huile. Ajouter 120 mL de CH3COOH (2,9 M) dans la fiole et laisser le mélange de remuer pendant 5 h avec un agitateur magnétique (à 200 tr/min) au reflux.
- Retirer le bain d’huile pour permettre à la solution refroidir à température ambiante. Filtrer l’échantillon de carbone et lavez-le à l’eau désionisée jusqu'à la solution pH > 6. Sécher l’EBAC/NGC modifié à 90 ° C et il désigne comme « EBAC-N/NGC-N ».
3. adsorbante caractérisation
-
Structurels c haracterization — Isothermes d’adsorption/désorption azote
- Peser un tube échantillon vide. Ajouter un échantillon de carbone (~0.15 g) dans le tube d’échantillon.
- Une solution contenant l’échantillon à 110 ° C pendant 5 h dans le vide. Peser le tube à essais contenant du carbone. Calculer le poids de l’échantillon de carbone.
- Installer le tube échantillon dans la zone de test de l’analyseur de surface-surface et porosimétrie utilisant de l’azote liquide à mesurer à-196 ° C,30.
-
Caractérisation chimique — Spectroscopie infrarouge à transformée de Fourier
- Vérifier la température et l’hygromètre et observer si l’environnement répond aux exigences : la température doit être 16-25 ° C et l’humidité relative 20 % - 50 %.
- Retirez le déshydratant et le capuchon anti-poussière dans l’entrepôt de l’échantillon.
- Sécher l’échantillon de carbone et le bromure de potassium à 110 ° C pendant 4 h éviter l’effet de l’eau sur le spectre. Mélanger l’échantillon de carbone avec le bromure de potassium, puis utilisez un mécanisme de presse pour préparer l’échantillon de test.
- Placer l’échantillon dans la zone d’essai et réglez les paramètres du logiciel.
- Enregistrer les spectres et retirer l’échantillon. Effectuer un traitement de données requis pour les spectres31.
4. Cu (II)-expériences de l’adsorption
-
Isotherme d’adsorption
- Placer 0,05 g d’adsorbant dans chacune des fioles coniques, qui contiennent 25 mL d’une solution de4 CuSO (pH 5) avec une concentration initiale sélectionnée (10, 20, 30, 40, 50, 60, 80 et 100 mg L-1). Utiliser un 0,1 M HNO3 et la solution de NaOH 0,1 M pour ajuster le pH de chaque solution de cuivre.
Remarque : Une solution dont la concentration initiale sélectionnée est diluée 1 g L-1 CuSO4 solution, qui est composé d’un g 3,90625 dissous du vitriol bleu solide à l’aide de la vase avec un volume de 1 000 mL. - Monter les couvercles sur les fioles coniques et mettez-les dans un agitateur orbital thermostatique (avec un taux d’agitation de 150 tr/min) à 25 ° C/5 ° C/45 ° C à 240 min.
- Utiliser 0,22 μm membranes filtrantes pour séparer les adsorbants de la solution.
- Utilisez une spectrophotométrie d’absorption atomique de flamme pour déterminer la concentration de cuivre du filtrat.
Remarque : Toutes les expériences ont été menées en triple exemplaire, et les données étaient en moyenne. La capacité d’adsorption de CU (ii), qe, a été calculée comme suit :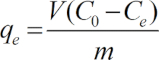 (1)
(1)
Ici,
C0 = la concentration initiale de cuivre (mg L-1),
Ce = la concentration finale (mg L-1),
V = le volume de la solution, et
m = la masse de chaque adsorbant (g).
- Placer 0,05 g d’adsorbant dans chacune des fioles coniques, qui contiennent 25 mL d’une solution de4 CuSO (pH 5) avec une concentration initiale sélectionnée (10, 20, 30, 40, 50, 60, 80 et 100 mg L-1). Utiliser un 0,1 M HNO3 et la solution de NaOH 0,1 M pour ajuster le pH de chaque solution de cuivre.
-
Influence du pH
- Placez 0,05 g d’adsorbant dans chacun des fioles coniques, qui contiennent 25 mL d’une solution de4 CuSO (40 mg L-1) avec un pH initial sélectionné (2, 3, 4, 5, 6 et 7).
- Monter les couvercles sur les fioles coniques et mettez-les dans un agitateur orbital thermostatique (avec un taux d’agitation de 150 tr/min) à 25 ° C pendant 24 h atteindre les conditions de l’équilibre d’adsorption.
- Répétez l’étape 4.1.3-4.1.4.
-
Cinétique d’adsorption
- Place de 0,25 g d’adsorbant dans un bécher contenant 125 mL d’une solution de CuSO4 (30 mg L-1 ou 100 mg L-1, pH 5) dans un bain d’eau de 25 ° C avec magnétique en remuant (à 200 tr/min).
- Utilisez les pipettes dessiner 5 mL de la solution lorsque le temps de contact atteint 0,5, 1, 2.5, 5, 10, 30, 60, 120 et 180 min.
- Répétez l’étape 4.1.3-4.1.4.
Résultats
Isothermes d’adsorption/désorption azote de quatre échantillons sont présentées dans la Figure 1. Toutes les isothermes d’adsorption montrent une augmentation rapide dans la basse région de0 P/P et ces isothermes appartiennent au type IV (classification de l’IUPAC) démontrant leur structure de pores qui se compose de micropores et dominante mesures32.
Les paramètres physiques de surface pour tous les échantillons prélevés dans les isothermes d’adsorption d’azote sont indiquées dans le tableau 1. Four à micro-ondes pyrolyse et modification que contribuent à une plus petite superficie de Brunauer-Emmett-Teller (BET) et total pore volume, changer la morphologie physique des échantillons.
Fourier transform (FTIR) les spectres infrarouges des quatre échantillons sont donnés à la Figure 2. Bandes de NGC à cm 1167-1 [O vibration d’élongation du carbone (C) -], 1620 cm-1 (C = O vibration d’élongation), 3442 cm-1 (O - H cm 2852-1 [N - hydrogène (H) vibration d’élongation] et 2922 cm-1 (C - H vibration d’élongation) vibration d’élongation) sont plus intenses que EBAC. Ceux-ci peuvent être attribuées à la pyrolyse de micro-ondes qui contribuent plus groupes fonctionnels de l’oxygène à la surface du BAC. Pour EBAC-N et NGC-N, bandes autour de 1573 cm-1 et 1 400 cm-1 susceptible de représentent C = N et N - H groupes, respectivement. Il peut être constaté que les matériaux mis à jour le carbone ont obtenu des groupes fonctionnels distincts d’azote/oxygène et le carbone micro-ondes-pyrolyse obtient plus, c'est-à-dire conformément à l’analyse élémentaire, comme indiqué dans le tableau 1. On peut spéculer que micro-ondes la pyrolyse est plus appropriée activer le précurseur et laïc racine pour les autres modifications que la pyrolyse de chauffage électrique conventionnelle. NGC-N possède principalement des groupes fonctionnels hydroxyle, carboxyle, amino et imine.
La figure 3 illustre la capacité d’adsorption des quatre échantillons dans des conditions de pH différent. Les quatre adsorbants atteint la capacité d’adsorption optimale à un pH de 5, pour que les expériences d’adsorption suivants sont effectués à un pH de 5. Les échantillons préparés par pyrolyse micro-ondes exposé meilleure capacité d’adsorption de CU (ii) avant et après la modification, bien qu’ils aient un plus faible volume spécifique de zone et pore surface. En général, l’adsorption d’adsorbants dépend les pore structure et surface des groupes fonctionnels. Donc, la capacité d’adsorption élevée de NGC-N est attribuée à des groupes de surface N/O plus abondantes. Les résultats confirment que la pyrolyse du four à micro-ondes bénéficie de la mise en place suivi de surfaces groupes fonctionnels afin d’améliorer la capacité d’adsorption, plus de chauffage électrique pyrolyse.
Les isothermes d’adsorption de NGC-N sur le cu (ii) à 5 ° C, 25 ° C et 45 ° C sont indiquées dans la Figure 4 a. Les propriétés d’adsorption des échantillons de CU (ii) devient mieux quand la température augmente. En comparant les paramètres isotherme dans le tableau 2, il est clair que le modèle isotherme de Langmuir indique un coefficient de corrélation linéaire supérieur (R2) qui est au-dessus de 0,99 (la ligne de montage dans la Figure 4 b) et l’adsorption mesurée capacité (q0mea) est identique à la calculé un (q0cal). Par conséquent, le modèle convient mieux que les modèles d’isotherme de Freundlich et Temkin, qui indique que l’absorption du cu (ii) est un de processus d’adsorption chimique33.
Comme le montre la Figure 4C, NGC-N peut atteindre environ 75 % de la capacité d’adsorption équilibre de CU (ii) dans les 15 min, et il peut atteindre presque l’équilibre d’adsorption du cu (ii) dans environ 50 min à différentes concentrations initiales. Ces prouver que NGC-N a des propriétés d’adsorption excellent. Comme il ressort du tableau 3, le modèle pseudo second ordre est mieux que les modèles Lagergren et Elovich avec R2 = 0,999 (la ligne raccord d de la Figure 4). Ces résultats confirment que l’adsorption de CU (ii) sur NGC-N chimisorption. Par conséquent, le mécanisme de l’interaction chimique de CU (ii) par le carbone modifié est proposé à la Figure 5. Le tableau 4 compare la capacité d’adsorption du cu (ii) de charbon actif à base de biomasse signalé dans ces dernières références34,35,36,37,38. Il se trouve que NGC-N a une plus grande capacité d’adsorption qu’autres adsorbants rapportées dans la littérature, elle démontre comme un adsorbant prometteur pour l’élimination de CU (ii).

Figure 1 : isothermes d’adsorption/désorption azote des carbones. Le graphique de l’encart dans la Figure 1 montre l’isotherme d’adsorption/désorption azote de NGC-N dans une plus petite gamme ordonnée. Les données ont été extraites du logiciel de prise en charge de l’analyseur de la zone de la surface et porosimétrie. Ce chiffre a été modifié par Wan et Li27. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : spectres FTIR EBAC EBAC-N, NGC et NGC-N. Les spectres peuvent confirmer les compositions chimiques et la surface des groupes fonctionnels des échantillons. Ce chiffre a été modifié par Wan et Li27. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
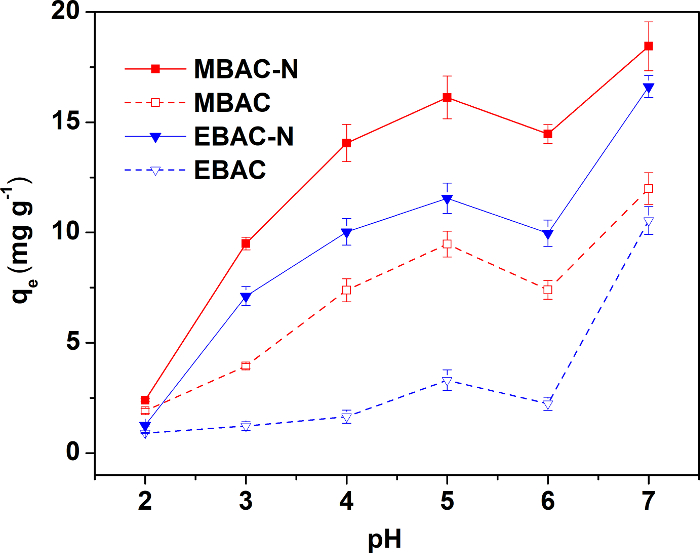
Figure 3 : effet du pH de la solution sur l’adsorption du cu (ii). La concentration de cuivre dans les solutions est de 40 mg L-1. L’essai est effectué à 25 ° C et à 150 tr/min pendant 24 h, pour atteindre l’équilibre d’adsorption. Ce chiffre a été modifié par Wan et Li27. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : analyse de propriété représentatif d’adsorption de NGC-N. (a) ce panneau montre les isothermes d’adsorption de CU (ii) sur NGC-N à 5 ° C, 25 ° C et 45 ° C. (b) ce panneau montre le résultat de raccord cuivre adsorption à l’aide de l’isotherme de Langmuir. (c) ce panneau montre la cinétique du cu (ii) sur NGC-N à la concentration initiale de 30 mg L-1 et 100 mg L-1. (d) ce panneau montre le résultat de raccord cuivre adsorption à 25 ° C en utilisant le modèle Pseudo second ordre. Ce chiffre a été modifié par Wan et Li27. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : mécanisme d’adsorption de CU (ii) proposé par carbone mis à jour le. Dans ce processus de réaction, l’adsorption chimique consiste principalement d’échange d’ions et complexant. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Adsorbants | EBAC | EBAC-N | NGC | NGC-N |
| Paramètres de structure de pores | ||||
| Superficie de pari (m2 g−1) | 978 | 609 | 543 | 61 |
| Volume total de pore (cm3 g−1) | 1.22 | 0,59 | 0,68 | 0,13 |
| Volume mésoporeux (cm3 g−1) | 1.09 | 0,47 | 0,58 | 0,11 |
| Moyenne taille DP (nm) des pores | 4.97 | 3,84 | 5.01 | 8.89 |
| Mésoporeux taux (%) | 89,52 | 80,24 | 85.32 | 84.61 |
| Teneur en éléments (% poids) | ||||
| C | 92.23 | 79,31 | 87.28 | 72.44 |
| H | 1,76 | 1.26 | 1,65 | 1.12 |
| N | 0,08 | 4.01 | 0,58 | 5.52 |
| O | 5.82 | 15 h 15 | 10.33 | 20.54 |
| S | 0,11 | 0,27 | 0,16 | 0,38 |
| Rendement (%) | 53.35 | / | 57,23 | / |
Tableau 1 : caractéristiques structurales et des compositions élémentaires de EBAC EBAC-N, NGC et NGC-N. Les données texturales sont analysées à l’aide de la méthode de pari. Le pourcentage du poids relatif des éléments est calculé sur la base sec exempt de cendres. Cette table a été modifiée du Wan et Li27.
| NGC-N | ||||
| Modèles isotherme | Paramètres | 5 ° C | 25 ° C | 45 ° C |
| Langmuir | q0cal (mg g−1) | 20.82 | 24.09 | 25.97 |
| q0mea (mg g−1) | 20.23 | 23.47 | 25.12 | |
| b (L mg−1) | 0,73 | 0,51 | 0,49 | |
| R2 | 0,999 | 0,996 | 0,995 | |
| Freundlich | KF (L mg−1) | 8.802 | 9,65 | 10,56 |
| n | 3,937 | 3,902 | 4.032 | |
| R2 | 0,907 | 0,967 | 0.987 | |
| Temkin | UnT (mg de L−1) | 29,57 | 32.3 | 49,8 |
| B (L mg−1) | 2,94 | 3.19 | 3.16 | |
| R2 | 0,969 | 0,985 | 0,955 | |
Tableau 2 : paramètres de l’isotherme de CU (ii) sur NGC-N à différentes températures. Les paramètres ajustés sont linéarisées modèles adsorption de Langmuir et Freundlich Temkin. Cette table a été modifiée du Wan et Li27.
| NGC-N | |||
| Modèles cinétiques | Paramètres | 30 mg L−1 | 100 mg L−1 |
| Lagergren | k1 (min−1) | 0,037 | 0,045 |
| R2 | 0,714 | 0,934 | |
| qe, mea (mg g−1) | 13.39 | 22,69 | |
| Pseudo second ordre | qe, cal (mg g−1) | 13.44 | 23.25 |
| k2 (g (mg min)−1) | 0.08676 | 0.03031 | |
| R2 | 0,999 | 0,999 | |
| qe, mea (mg g−1) | 13.39 | 22,69 | |
| Elovich | Αr (g (mg min)−1) | 379.73 | 312.25 |
| ΒE (mg g−1) | 0,738 | 0,411 | |
| R2 | 0,799 | 0,901 | |
Tableau 3 : les paramètres cinétiques à différentes concentrations initiales de CU (ii) sur NGC-N. Les paramètres ajustés sont de linéarisé Lagergren, Pseudo second ordre et les modèles de Elovich. Cette table a été modifiée du Wan et Li27.
| Adsorbants | pH | qe (mg g−1) | Références |
| Charbon actif en grains à base de bois | 5.5 | 6.016 | 34 |
| Fruits de baobab coquille dérivée de charbon actif | 6 | 3.0833 | 35 |
| Pierre olive AC (COSAC) | 5 | 17.08 | 36 |
| Carbonfrom activé date pierres | 5.5 | 18.68 | 37 |
| Charbon actif de noix shell basé | 5 | 9.3 | 38 |
| Modification de plasma charbon actif | 21,4 | ||
| NGC-N | 5 | 25.12 | Cette étude |
Tableau 4 : comparaison de la capacité d’adsorption du cu (ii) sur différents adsorbants. La capacité de charbon actif pour enlever le cu (ii) n’est significativement affectée par le pH de la solution, la capacité d’adsorption des matériaux de carbone biomasse contraste devrait être obtenue près de pH 5.
Discussion
Dans ce protocole, l’une des étapes essentielles est le succès de la préparation du carbone mésoporeux avec mieux les propriétés physicochimiques de la démarche en une seule étape, où les conditions expérimentales optimales doivent être déterminées. Ainsi, dans une précédente étude28nous avons effectué des expériences matrice orthogonale micro-ondes pyrolyse, tenant compte de l’effet du ratio imprégnation de bagasse, acide phosphorique, l’heure de la pyrolyse, four à micro-ondes puissance et temps de séchage. En outre, beaucoup de soin doit être prise en fastidieux Cu (II)-expériences d’adsorption, surtout lorsque la valeur du pH de la solution est ajustée, car la valeur du pH a une grande influence sur l’élimination de CU (ii) de charbon actif (Figure 3). Il est impératif de tester la concentration réelle en cuivre de la CuSO4 solution avec une concentration initiale définie et utiliser cette valeur comme C0 dans l’équation (1).
Une plus grande surface spécifique et le volume plus élevé de pores du charbon à base de biomasse peuvent être obtenus par activation chimique. Toutefois, la surface spécifique et le volume total de pore les deux diminuent au cours de la pyrolyse et la modification processus subséquent, qui est probablement dû à l’effondrement et l’obstruction des pores27, conduisant à une réduction de la capacité d’adsorption. Poursuite des travaux sont donc censé établir carbone mésoporeux à base de biomasse avec une surface importante et abondante des groupes fonctionnels.
Pyrolyse four micro-ondes est vérifiée pour synthétiser plus adéquatement carbone mésoporeux à base de biomasse avec une adsorption d’azote/oxygène-chélation supérieure de CU (ii), qui présente de nombreux avantages par rapport aux méthodes largement utilisé de chauffage conventionnel. Cependant, il n’est pas possible de contrôler la température instantanée avec précision pendant le procédé de pyrolyse du four à micro-ondes. La biomasse est un matériau d’absorption bon micro-ondes, dont la température peut augmenter rapidement sous l’effet d’un micro-ondes. De toute évidence, les travaux futurs doit examiner comment la température de la pyrolyse affecte les propriétés physico-chimiques de la biomasse de carbone.
Une description détaillée du mécanisme de modification est abordée dans cet article, mais il peut être trouvé dans la documentation publiée plus tôt27. L’importance potentielle de nitrification et réduction des modifications qui peuvent introduire efficacement plusieurs groupes fonctionnels de N/O simultanément sur la surface d’échantillons de carbone vaut apprécier. Toutefois, le processus de modification contient de nombreuses mesures expérimentales et l’utilisation d’un acide fort concentré dangereux. Une méthode de modification plus simple et plus efficace d’azote/oxygène peut-être être testée et adoptée dans d’autres études.
Nous ont démontré une méthode économes en énergie respectueuse de l’environnement pour la préparation de carbone mésoporeux à base de biomasse par pyrolyse du four à micro-ondes et dope les groupes N/O simultanément sur le carbone à l’aide d’un itinéraire de nitrification et de réduction. Ces charbons N/O dopée à double possède une plus grande capacité d’adsorption des ions de métaux lourds en solution aqueuse, qui s’applique pour l’assainissement des eaux usées. Nous espérons que ce protocole fournira des idées pour la préparation rapide de haute-adsorption carbone de la biomasse par pyrolyse micro-ondes rapide, efficace et sera optimisé dans l’avenir.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient les fonds de recherche fondamentale pour les universités de la centrale de Chine (No.KYZ201562), China postdoctorales Science Fund (no 2014 M 560429) et le plan de recherche et de développement clé de la Province du Jiangsu (No. BE2018708).
matériels
| Name | Company | Catalog Number | Comments |
| All chemicals and reagents (phosphoric acid, etc.) | Nanjing Chemical Reagent Co., Ltd | Analytical grade | |
| Electric furnace | Luoyang Bolaimaite Experiment Electric Furnace Co., Ltd | ||
| Microwave oven | Nanjing Yudian Automation Technology Co., Ltd | 2.45 GHz frequency | |
| Surface-area and porosimetry analyzer | Beijing Gold APP Instrument Co., Ltd | Vc-Sorb 2800TP | |
| Fourier transform infrared (FTIR) spectrometer | Nicolet | 6700 | |
| Flame atomic absorption spectrophotometry | Beijing Purkinje General Instrument Corporation | A3 | |
| Element Analyzer | Germany Heraeus Co. | CHN-O-RAPID |
Références
- Saleh, T. A., Gupta, V. K. Processing methods, characteristics and adsorption behavior of tire derived carbons: a review. Advances in Colloid & Interface Science. 211, 93 (2014).
- Mohammadi, N., Khani, H., Gupta, V. K., Amereh, E., Agarwal, S. Adsorption process of methyl orange dye onto mesoporous carbon material-kinetic and thermodynamic studies. Journal of Colloid & Interface Science. 362 (2), 457 (2011).
- Saleh, T. A., Gupta, V. K. Column with CNT/magnesium oxide composite for lead(II) removal from water. Environmental Science & Pollution Research. 19 (4), 1224-1228 (2012).
- Asfaram, A., Ghaedi, M., Agarwal, S., Tyagi, I., Kumargupta, V. Removal of basic dye Auramine-O by ZnS:Cu nanoparticles loaded on activated carbon: optimization of parameters using response surface methodology with central composite design. RSC Advances. 5 (24), 18438-18450 (2015).
- Gupta, V. K., Saleh, T. A. Sorption of pollutants by porous carbon, carbon nanotubes and fullerene- an overview. Environmental Science and Pollution Research. 20 (5), 2828-2843 (2013).
- Ahmaruzzaman, M., Gupta, V. K. Rice Husk and Its Ash as Low-Cost Adsorbents in Water and Wastewater Treatment. Industrial & Engineering Chemistry Research. 50 (24), 13589-13613 (2011).
- Ahmed, M. J., Theydan, S. K. Adsorption of cephalexin onto activated carbons from Albizia lebbeck seed pods by microwave-induced KOH and K2CO3 activations. Chemical Engineering Journal. 211 (22), 200-207 (2012).
- Liew, R. K., et al. Production of activated carbon as catalyst support by microwave pyrolysis of palm kernel shell: a comparative study of chemical versus physical activation. Research on Chemical Intermediates. , 1-17 (2018).
- Lam, S. S., et al. Microwave-assisted pyrolysis with chemical activation, an innovative method to convert orange peel into activated carbon with improved properties as dye adsorbent. Journal of Cleaner Production. 162, 1376-1387 (2017).
- Jin, H., Wang, X., Gu, Z., Polin, J. Carbon materials from high ash biochar for supercapacitor and improvement of capacitance with HNO3 surface oxidation. Journal of Power Sources. 236, 285-292 (2013).
- Chen, H. Research Methods for the Biotechnology of Lignocellulose. Biotechnology of Lignocellulose: Theory and Practice. , 403-510 (2014).
- Sayğılı, H., Güzel, F. High surface area mesoporous activated carbon from tomato processing solid waste by zinc chloride activation: process optimization, characterization and dyes adsorption. Journal of Cleaner Production. 113, 995-1004 (2016).
- Cao, Q., Xie, K. C., Lv, Y. K., Bao, W. R. Process effects on activated carbon with large specific surface area from corn cob. Bioresource Technology. 97 (1), 110-115 (2006).
- Xiao, X., et al. Adsorption behavior of phenanthrene onto coal-based activated carbon prepared by microwave activation. Korean Journal of Chemical Engineering. 32 (6), 1129-1136 (2015).
- Ge, X., et al. Adsorption of naphthalene from aqueous solution on coal-based activated carbon modified by microwave induction: Microwave power effects. Chemical Engineering & Processing Process Intensification. 91, 67-77 (2015).
- Yao, S., et al. Removal of Pb(II) from water by the activated carbon modified by nitric acid under microwave heating. Journal of Colloid and Interface Science. 463, 118-127 (2016).
- Ali, A., Idris, R. Utilization Of Low-cost Activated Carbon From Rapid Synthesis Of Microwave Pyrolysis For WC Nanoparticles Preparation. Advanced Materials Letters. 08 (1), 70-76 (2016).
- Puchana-Rosero, M. J., et al. Microwave-assisted activated carbon obtained from the sludge of tannery-treatment effluent plant for removal of leather dyes. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 504, 105-115 (2016).
- Du, Z. L., Zheng, T., Wang, P., Hao, L. L., Wang, Y. X. Fast microwave-assisted preparation of a low-cost and recyclable carboxyl modified lignocellulose-biomass jute fiber for enhanced heavy metal removal from water. Bioresource Technology. 201, 41-49 (2016).
- Ge, X., et al. Microwave-assisted modification of activated carbon with ammonia for efficient pyrene adsorption. Journal of Industrial & Engineering Chemistry. 39, 27-36 (2016).
- Ghaedi, M., et al. Modeling of competitive ultrasonic assisted removal of the dyes - Methylene blue and Safranin-O using Fe3O4 nanoparticles. Chemical Engineering Journal. 268, 28-37 (2015).
- Gupta, V. K., Nayak, A. Cadmium removal and recovery from aqueous solutions by novel adsorbents prepared from orange peel and Fe2O3 nanoparticles. Chemical Engineering Journal. 180 (3), 81-90 (2012).
- Robati, D., et al. Removal of hazardous dyes-BR 12 and methyl orange using graphene oxide as an adsorbent from aqueous phase. Chemical Engineering Journal. 284 (7), 687-697 (2016).
- Ali, I., Alothman, Z. A., Sanagi, M. M. Green Synthesis of Iron Nano-Impregnated Adsorbent for Fast Removal of Fluoride from Water. Journal of Molecular Liquids. 211, 457-465 (2015).
- Gupta, V. K., Kumar, R., Nayak, A., Saleh, T. A., Barakat, M. A. Adsorptive removal of dyes from aqueous solution onto carbon nanotubes: A review. Advances in Colloid & Interface Science. 193 (6), 24 (2013).
- Mittal, A., Mittal, J., Malviya, A., Gupta, V. K. Adsorptive removal of hazardous anionic dye "Congo red" from wastewater using waste materials and recovery by desorption. Journal of Colloid and Interface Science. 340 (1), 16-26 (2009).
- Wan, Z., Li, K. Effect of pre-pyrolysis mode on simultaneous introduction of nitrogen/oxygen-containing functional groups into the structure of bagasse-based mesoporous carbon and its influence on Cu(II) adsorption. Chemosphere. 194, 370-380 (2018).
- Li, K., Li, J., Lu, M., Li, H., Wang, X. Preparation and amino modification of mesoporous carbon from bagasse via microwave activation and ethylenediamine polymerization for Pb(II) adsorption. Desalination and Water Treatment. 57 (50), 24004-24018 (2016).
- Yantasee, W., et al. Electrophilic Aromatic Substitutions of Amine and Sulfonate onto Fine-Grained Activated Carbon for Aqueous-Phase Metal Ion Removal. Separation Science and Technology. 39 (14), 3263-3279 (2004).
- Li, Y. B., Li, K. Q., Wang, X. H., Li, J. Ethylenediamine Modification of Hierarchical Mesoporous Carbon for the Effective Removal of Pb (II) and Related Influencing Factors. International Journal of Material Science. 6 (1), 58-65 (2016).
- Georgakopoulos, E., Santos, R. M., Chiang, Y. W., Manovic, V. Two-way Valorization of Blast Furnace Slag: Synthesis of Precipitated Calcium Carbonate and Zeolitic Heavy Metal Adsorbent. Journal of Visualized Experiments. (120), e55062 (2017).
- Loganathan, P., et al. Modelling equilibrium adsorption of single, binary, and ternary combinations of Cu, Pb, and Zn onto granular activated carbon. Environmental Science & Pollution Research. (15), 1-12 (2018).
- Vunain, E., Kenneth, D., Biswick, T. Synthesis and characterization of low-cost activated carbon prepared from Malawian baobab fruit shells by H3PO4 activation for removal of Cu(II) ions: equilibrium and kinetics studies. Applied Water Science. 7 (8), 4301-4319 (2017).
- Bohli, T., Ouederni, A., Villaescusa, I. Simultaneous adsorption behavior of heavy metals onto microporous olive stones activated carbon: analysis of metal interactions. Euro-Mediterranean Journal for Environmental Integration. 2 (1), 19 (2017).
- Bouhamed, F., Elouear, Z., Bouzid, J., Ouddane, B. Multi-component adsorption of copper, nickel and zinc from aqueous solutions onto activated carbon prepared from date stones. Environmental Science & Pollution Research. 23 (16), 1-6 (2016).
- Wu, L., et al. Surface modification of phosphoric acid activated carbon by using non-thermal plasma for enhancement of Cu(II) adsorption from aqueous solutions. Separation & Purification Technology. 197, (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon