Method Article
Preparación de biomasa carbono mesoporoso con mayor nitrógeno-/ adsorción quelantes de oxígeno para Cu(II) a través de microondas pre-pirolisis
En este artículo
Resumen
Aquí, presentamos un protocolo para sintetizar nitrógeno/oxígeno mesoporosos dopada con el doble de carbón de biomasa por activación química en modos diferentes de la pirolisis seguido por modificación. Demostramos que la pirolisis de microondas beneficia el proceso de modificación posterior al mismo tiempo introducir más grupos funcionales de nitrógeno y oxígeno en el carbono.
Resumen
Una técnica de medio ambiente para sintetizar biomasa mesoporosos activó el carbón con alto nitrógeno- / adsorción quelantes del oxígeno para el Cu(II) se propone. Bagazo impregnado con ácido fosfórico se utiliza como el precursor. Para pyrolyze el precursor, se utilizan dos modos de calefacción independiente: microondas pirolisis y pirolisis convencional de calefacción eléctrica. Las muestras de carbono derivados del bagazo resultante se modifican con la nitrificación y la reducción de modificación. Nitrógeno (N) / al mismo tiempo se introducen grupos funcionales de oxígeno (O) a la superficie del carbón activado, realzando su adsorción de Cu(II) por formación de complejos e intercambio de ion. Caracterización y los experimentos de adsorción de cobre se realizan para investigar las propiedades fisicoquímicas de las muestras de carbón preparado cuatro y determinar qué método de calentamiento favorece la posterior modificación por dopaje de grupos funcionales de N/O. En esta técnica, basada en el análisis de datos de adsorción de nitrógeno, espectroscopia infrarroja de transformada de Fourier transforman y los experimentos de adsorción por lotes, está comprobado que carbono microondas pyrolyzed tiene más sitios de defecto y, por lo tanto, ahorro de tiempo efectivo de microondas pirolisis contribuye más especies N/O al carbono, aunque conduce a una menor superficie específica. Esta técnica ofrece una ruta prometedora para adsorbentes de síntesis con mayor nitrógeno y contenido de oxígeno y una mayor capacidad de adsorción de iones de metales pesados en aplicaciones de remediación de aguas residuales.
Introducción
El carbón activado tiene propiedades de adsorción único, como una estructura porosa desarrollada, una alta superficie específica y varios grupos funcionales superficiales; por lo tanto, se emplea como un adsorbente de agua tratamiento o purificación1,2,3,4. Además de sus ventajas físicas, el carbón activado es inofensivo para el medio ambiente y rentable, y su materia prima (por ejemplo, biomasa) es abundante y fácilmente obtuvo5,6. Las propiedades fisicoquímicas del carbón activado dependen de los precursores que se utilizan en su preparación y en las condiciones experimentales de la activación de proceso7.
Dos métodos se emplean para preparar carbón activado: enfoque de un paso y un proceso de dos pasos8. El enfoque de un solo paso de término se refiere a los precursores está carbonizado y activado al mismo tiempo mientras que el enfoque de dos pasos se refiere a secuencialmente. En vista de la conservación de energía y protección del medio ambiente, el enfoque de un paso es más preferido por su baja temperatura y presión exigiendo.
Además, la activación química y física son utilizados para mejorar las características texturales de carbón activado. Activación química posee ventajas evidentes sobre activación física debido a su baja temperatura de activación, menor tiempo de activación, mayor rendimiento de carbono y más estructura de poro desarrollada y controlable en un cierto grado9. Se ha probado que la activación química se puede realizar por impregnación biomasa utilizada como materia prima con H3PO4, vivencias2u otros productos químicos específicos, seguidas de la pirolisis para aumentar la porosidad del carbón activado, porque componentes lignocelulósicos de la biomasa pueden eliminarse fácilmente por un tratamiento de calefacción posterior, debido a la capacidad de la deshidrogenación de estos productos químicos10,11. Por lo tanto, la activación química grandemente mejora la formación de poros de carbón activado o mejora el rendimiento adsorbente contaminantes12. Un activador ácido es preferido a H3PO4, debido a su relativamente baja demanda de energía, mayor rendimiento y menor impacto sobre el medio ambiente13.
Pirólisis de microondas tiene la superioridad en ahorro de tiempo, uniforme calefacción interior, eficiencia energética y calefacción selectiva, lo que es un método alternativo de calefacción a carbón activado síntesis14,15. En comparación con la calefacción eléctrica convencional, microondas pirolisis puede mejorar los procesos termoquímicos y promover ciertas reacciones químicas16. Recientemente, estudios extensos se han centrado en la preparación de carbón activado por activación química de la biomasa con un solo paso microondas pirolisis9,17,18,19. Por lo tanto, es informativo y respetuoso del medio ambiente a síntesis biomasa carbón por asistida por microondas H3PO4 activación considerablemente.
Además, para mejorar las afinidades de adsorción del carbón activado hacia determinados iones de metales pesados, se ha propuesto modificación dopando heteroatom [N, O, azufre (S), etc.] dentro de las estructuras de carbono, y esto ha demostrado para ser un método deseable 20,21,22,23,24,25,26. Sitios defectuosos o en los bordes de una capa de grafito pueden sustituirse por heteroátomos generar grupos funcionales27. Por lo tanto, modificación de nitrificación y reducción se utilizan para modificar las muestras de carbono resultante para droga N/O grupos funcionales que desempeñan un papel crucial en la coordinación eficiente con metales pesados para formar secuestrantes e intercambio iónico28.
Basado en los resultados anteriores, presentamos un protocolo para sintetizar N/O mesoporosos dopados doble carbono de la biomasa por activación química y dos métodos diferentes de la pirolisis seguidos por modificación. Este protocolo también determina qué método de calentamiento favorece la modificación consiguiente de dopaje de los grupos funcionales de N/O y, así, mejorar el desempeño de adsorción.
Protocolo
1. preparación de carbón activado basada en bagazo
-
Preparación del precursor del carbón activado basada en bagazo
- Enjuague el bagazo (Obtenido de una granja en Jiangsu, China) con agua desionizada y poner las muestras en un horno de secado a 100 ° C durante 10 horas.
- Aplastar el bagazo seco con una amoladora y tamizar el polvo por un tamiz de malla 50.
- Lugar 30 g de polvo de bagazo fino en una solución de ácido fosfórico (H3PO4) de % wt 15 en una proporción de 1:1 para 24 h. secar la mezcla en un horno a 105 ° C por 6 h. recoger el producto resultante como el precursor para el carbón activado base de bagazo (BAC).
-
Convencional pirolisis de la eléctrico-calefacción del precursor del
- Ponga 15 g del precursor en un barco de cuarzo y luego inserte el barco de cuarzo en un tubo de cristal de cuarzo de un horno eléctrico.
- Ajustar la velocidad de calentamiento del horno en 5 ° C min-1 para carbonizar la muestra. Cuando la temperatura alcanza 500 ° C, mantener la temperatura durante 90 minutos y luego deje que la muestra de carbón activado resultante se enfríe a temperatura ambiente en nitrógeno. Asegurar un flujo de nitrógeno de 80 mL min-1 con un caudalímetro de rotor durante todo el proceso.
- Triturate y recoger el pyrolyzed de horno eléctrico basado en bagazo carbón activado (EBAC) en un vaso de precipitados y luego calentarlo en un horno de secado al vacío a 105 ° C durante 24 h.
-
Microondas pirolisis del precursor del
- Ponga 15 g del precursor en un horno de microondas (con una frecuencia de 2,45 GHz).
- Ajustar la potencia del horno microondas a 900 W a pyrolyze la muestra de 22 min y asegurar el flujo de nitrógeno en 20 mL min-1 con un caudalímetro de rotor. La entrada de aire del rotor caudalímetro está conectada a un cilindro de nitrógeno utilizando una manguera, mientras que la salida está conectada a la entrada de aire del horno microondas.
- Permitir que el carbono resultante se enfríe a temperatura ambiente en nitrógeno. Triturate y recolectar la muestra de carbón en un vaso y luego añadir 300 mL de ácido clorhídrico (0.1m). Revolver la mezcla con un agitador magnético (a 200 rpm) por más de 12 h a temperatura ambiente.
- El carbón del filtro de papel de filtro con la filtración de vacío y lavar la muestra con agua desionizada hasta que el pH del agua de lavado es > 6. Seque el microondas pyrolyzed basado en bagazo carbón activado (MBAC) en un horno de secado al vacío a 105 ° C durante 24 h.
2. modificación de carbón de activado basado en bagazo pyrolyzed de horno eléctrico y microondas pyrolyzed basado en bagazo carbón activado
Nota: La modificación de las dos muestras se realizó según la literatura29.
-
Nitrificación
- Mezclar 50 mL de concentrado sulfúrico y 50 mL de concentrado ácido nítrico en un vaso de precipitados a 0 ° C (en un baño de hielo).
PRECAUCIÓN: Cuando se mezcla la mezcla de ácido sulfúrico concentrado y ácido nítrico concentrado, el ácido sulfúrico concentrado debe lentamente añadido al ácido nítrico concentrado y agita con una varilla de vidrio y refrescado en el tiempo. - Añadir 10 g de EBAC/MBAC a la solución mezclada. Usar un agitador magnético para revolver la mezcla durante 120 min (a 200 rpm).
- Filtrar la EBAC/MBAC nitrificado por papel de filtro con la filtración de vacío. Lavar el carbón con agua desionizada hasta que el agua de lavado llegue a pH 6 y luego secarlo en un horno de secado a 90 ° C durante 24 h.
- Mezclar 50 mL de concentrado sulfúrico y 50 mL de concentrado ácido nítrico en un vaso de precipitados a 0 ° C (en un baño de hielo).
-
Modificación reductivo
- En un matraz de cuello de tres, añadir el 5,05 g del producto resultante, 50 mL de agua desionizada y 20 mL de solución de amoníaco (15 M). Revuelva la mezcla durante 15 min con un agitador magnético (a 200 rpm), luego añadir 28 g de Na2S2O4y dejar la mezcla en agitación a temperatura ambiente durante 20 h.
- Ajustar al matraz un refrigerante de reflujo y caliente la mezcla hasta 100 ° C usando un baño de aceite. Añadir 120 mL de CH3COOH (2,9 M) al matraz y deje que la mezcla se revuelve durante 5 h con un agitador magnético (a 200 rpm) bajo reflujo.
- Retirar del baño de aceite para permitir que la solución se enfríe a temperatura ambiente. La muestra de carbón del filtro y lavar con agua desionizada hasta la solución pH > 6. El EBAC/MBAC modificada a 90 ° C en seco y denotar como "EBAC/MBAC-N-N".
3. adsorbente caracterización
-
Estructural c haracterization — Isotermas de adsorción/desorción de nitrógeno
- Pesa un tubo de ensayo vacío. Añadir una muestra de carbón (~0.15 g) al tubo de muestras.
- Desgasificar la muestra a 110 ° C durante 5 h en el vacío. Pesar el tubo de muestra que contienen carbono. Calcular el peso de la muestra de carbón.
- Instale el tubo de muestra en el área de prueba del analizador de área de superficie y porosimetría con nitrógeno líquido para medir a-196 ° C30.
-
Caracterización química — Fourier transforma la espectroscopia infrarroja
- Compruebe la temperatura y el higrómetro y observar si el medio ambiente cumple con los requisitos: la temperatura debe ser 16-25 ° C y la humedad relativa 20% - 50%.
- Quitar el desecante y cubierta de polvo en el almacén de la muestra.
- Seque la muestra de carbono y el bromuro de potasio a 110 ° C durante 4 horas evitar el efecto de agua en el espectro. Mezcle la muestra de carbón con el bromuro de potasio y luego usar un mecanismo de prensa para preparar la muestra.
- Coloca la muestra en el área de prueba y ajustar los parámetros del software.
- Guarde los espectros y sacar la muestra. Realizar un procesamiento de datos requerido para el spectra31.
4. Cu (II)-los experimentos de adsorción
-
Isoterma de adsorción
- Coloque 0.05 g de adsorbente en cada uno de los matraces que contienen 25 mL de una solución de CuSO4 (pH 5) con una concentración inicial seleccionada (10, 20, 30, 40, 50, 60, 80 y 100 mg L-1). Use un 0,1 M HNO3 y la solución de NaOH de 0.1 M para ajustar el pH de cada solución de cobre.
Nota: Se diluye una solución con la concentración inicial seleccionada por una 1 g L-1 CuSO4 la solución, que se compone de un g 3,90625 disuelto de vitriolo azul sólida usando el Jarrón con un volumen de 1.000 mL. - Montar las tapas en los frascos cónicos y ponerlos en un agitador orbital termostato (con una tasa de agitación de 150 rpm) a 5 ° C/25 ° C/45 ° C durante 240 minutos.
- Utilice filtros de membrana de 0,22 μm para separar la solución de los adsorbentes.
- Utilice una espectrofotometría de absorción atómica de llama para determinar la concentración de cobre del filtrado.
Nota: Todos los experimentos se realizaron por triplicado y los datos fueron promediados. La capacidad de adsorción de Cu(II), qe, se calcula como sigue: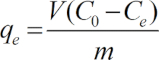 (1)
(1)
Aquí,
C0 = la concentración de cobre inicial (mg L-1),
Ce = concentración final (mg L-1),
V = volumen de la solución, y
m = peso de cada adsorbente (g).
- Coloque 0.05 g de adsorbente en cada uno de los matraces que contienen 25 mL de una solución de CuSO4 (pH 5) con una concentración inicial seleccionada (10, 20, 30, 40, 50, 60, 80 y 100 mg L-1). Use un 0,1 M HNO3 y la solución de NaOH de 0.1 M para ajustar el pH de cada solución de cobre.
-
Influencia del pH
- Coloque 0.05 g de adsorbente en cada uno de los matraces que contienen 25 mL de una solución de CuSO4 (40 mg L-1) con un pH inicial seleccionada (2, 3, 4, 5, 6 y 7).
- Coloque las tapas en los frascos cónicos y ponerlos en un agitador orbital termostato (con una tasa de agitación de 150 rpm) a 25 ° C por 24 h para alcanzar condiciones de equilibrio de adsorción.
- Repita el paso 4.1.3-4.1.4.
-
Cinética de adsorción
- Lugar 0,25 g de adsorbente en un vaso de precipitados que contiene 125 mL de una solución de CuSO4 (30 mg L-1 o 100 mg L-1, pH 5) en un baño de agua de 25 ° C con magnético removiendo (a 200 rpm).
- Usar pipetas para extraer 5 mL de la solución cuando el tiempo de contacto llega a 0.5, 1, 2.5, 5, 10, 30, 60, 120 y 180 min.
- Repita el paso 4.1.3-4.1.4.
Resultados
Isotermas de adsorción/desorción de nitrógeno de cuatro muestras se presentan en la figura 1. Todas las isotermas de adsorción muestran un aumento rápido en región de0 P/P baja y estas isotermas pertenecen al tipo IV (clasificación de la IUPAC) demostrando su estructura de poro que se compone de microporos y mesoporos dominante32.
Los parámetros físicos de superficie para todas las muestras obtenidas de las isotermas de adsorción de nitrógeno se muestran en la tabla 1. Microondas pirolisis y modificación que ambos contribuyen a una menor superficie de Brunauer-Emmett-Teller (BET) y total de los poros volumen, cambiar la morfología física de las muestras.
Fourier transforma infrarrojo (FTIR) los espectros de las cuatro muestras se dan en la figura 2. Bandas de MBAC en 1167 cm-1 [carbono (C) - O vibración de estiramiento], 1620 cm-1 (C = O vibración de estiramiento), 2852 cm-1 [N - hidrógeno (H) que se extiende la vibración], 2922 cm-1 (C - H vibración de estiramiento) y 3442 cm-1 (O - H vibración de estiramiento) son más intensos que EBAC. Estos pueden atribuirse a la pirolisis de microondas que grupos funcionales de más oxígeno a la superficie de BAC. Para EBAC-N y MBAC-N, bandas alrededor de 1573 cm-1 y 1400 cm-1 probablemente representan C = N y N - H grupos, respectivamente. Se puede encontrar que los materiales de carbono modificado obtenido grupos funcionales de diferentes de nitrógeno/oxígeno y el carbono microondas pyrolyzed obtiene más, que está de acuerdo con el análisis elemental como se muestra en la tabla 1. Puede ser especulado que microondas pirolisis es más adecuada para activar el precursor y la endecha raíz por más modificaciones que la pirolisis convencional de calefacción eléctrica. MBAC-N posee principalmente grupos funcionales hidroxilo y carboxilo, amino, imina.
La figura 3 muestra la capacidad de adsorción de las cuatro muestras bajo condiciones de pH diferentes. Los cuatro adsorbentes alcanzan la capacidad de adsorción óptima a pH 5, por lo que los experimentos de adsorción siguientes todos llevan a cabo a pH 5. Las muestras preparadas por pirolisis de microondas exhibieron mejor capacidad de adsorción de Cu(II) antes y después de la modificación, aunque tenían una menor superficie área y poro volumen específico. En general, la adsorbencia de adsorbentes depende de los grupos de funcional estructura y superficie de poro. Por lo tanto, la capacidad de adsorción alta de MBAC-N se atribuye a los más abundantes grupos de superficie N/O. Los resultados confirman que la pirolisis de microondas beneficia la introducción seguimiento de superficie grupos funcionales para mejorar la capacidad de adsorción más de pirolisis de la eléctrico-calefacción.
Las isotermas de adsorción de MBAC-N en Cu(II) a 5 ° C, 25 ° C y 45 ° C se muestran en la figura 4a. Las propiedades de adsorción de las muestras para Cu(II) a ser mejor cuando la temperatura aumenta. Al comparar los parámetros de la isoterma en la tabla 2, está claro que el modelo de la isoterma de Langmuir indica un mayor lineal coeficiente de correlación (R2) que es 0,99 (la línea de montaje en la Figura 4b) y la adsorción medida capacidad (q0mea) es igual con el calculado uno (q0cal). Por lo tanto, el modelo es más conveniente que los modelos de isotermas de Freundlich y Temkin, que indica que la absorción de Cu(II) es un proceso de adsorción química33.
Como se muestra en la figura 4C, MBAC-N puede alcanzar alrededor del 75% de la capacidad de adsorción de equilibrio Cu(II) dentro de 15 min, y puede alcanzar casi el equilibrio de adsorción de Cu(II) en unos 50 minutos a distintas concentraciones iniciales. Estos prueban que MBAC-N tiene propiedades excelente de la adsorción. Como puede verse en la tabla 3, el modelo de pseudo segundo orden es mejor que los modelos Lagergren y Elovich con R2 = 0.999 (la línea de montaje en la figura 4 d). Los resultados anteriores confirman que la adsorción de Cu(II) en MBAC-N es la absorción química. Por lo tanto, se propone el mecanismo de interacción química de Cu(II) por el carbón modificado en la figura 5. La tabla 4 compara la capacidad de adsorción de Cu(II) de biomasa carbón registrado en las últimas referencias34,35,36,37,38. Se encuentra que MBAC-N tiene una mayor capacidad de adsorción que otros adsorbentes divulgado en la literatura, demostrando como un prometedor adsorbente para la eliminación de Cu(II).

Figura 1: isotermas de adsorción/desorción de nitrógeno de carbones. El gráfico del recuadro en la figura 1 muestra el isoterma de adsorción/desorción de nitrógeno de MBAC-N en un rango menor de ordenadas. Los datos se obtuvieron desde el software soporte del área de superficie y porosimetría de analizador. Esta figura ha sido modificada desde Wan y Li27. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: espectros FTIR de EBAC, EBAC-N, MBAC y MBAC-N. Los espectros pueden confirmar las composiciones químicas y la superficie grupos funcionales de las muestras. Esta figura ha sido modificada desde Wan y Li27. Haga clic aquí para ver una versión más grande de esta figura.
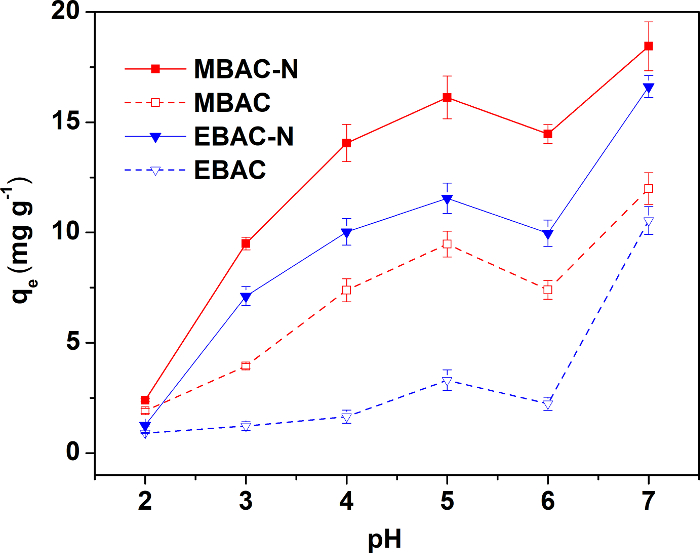
Figura 3: efecto del pH de solución sobre adsorción de Cu(II). La concentración de cobre en las soluciones es de 40 mg L-1. La prueba se lleva a cabo a 25 ° C y 150 rpm durante 24 h, para alcanzar el equilibrio de adsorción. Esta figura ha sido modificada desde Wan y Li27. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis de propiedades de adsorción representante de MBAC-N. (a) este panel muestra las isotermas de adsorción de Cu(II) en MBAC-N en 5 ° C, 25 ° C y 45 ° C. (b) este panel muestra el resultado apropiado para la adsorción de cobre mediante el uso del isoterma de Langmuir. (c) este panel muestra la cinética de Cu(II) de MBAC-N en la concentración inicial de 30 mg L-1 y 100 mg L-1. (d) este panel muestra el resultado apropiado para la adsorción de cobre a 25 ° C utilizando el modelo de Pseudo segundo orden. Esta figura ha sido modificada desde Wan y Li27. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: propuesta mecanismo de adsorción de Cu(II) por carbono modificado. En este proceso de reacción, la adsorción química implica principalmente el intercambio iónico y formación de complejos. Haga clic aquí para ver una versión más grande de esta figura.
| Adsorbentes | EBAC | EBAC-N | MBAC | MBAC-N |
| Parámetros de estructura de poro | ||||
| Área superficial BET (m2 g−1) | 978 | 609 | 543 | 61 |
| Volumen de poro total (cm3 g−1) | 1.22 | 0,59 | 0,68 | 0.13 |
| Mesoporosos volumen (cm3 g−1) | 1.09 | 0.47 | 0.58 | 0.11 |
| Significa tamaño DP (nm) | 4.97 | 3.84 | 5.01 | 8.89 |
| Mesoporosos tasa (%) | 89.52 | 80.24 | 85.32 | 84.61 |
| Contenido elemental (wt %) | ||||
| C | 92.23 | 79.31 | 87.28 | 72.44 |
| H | 1.76 | 1.26 | 1.65 | 1.12 |
| N | 0.08 | 4.01 | 0.58 | 5.52 |
| O | 5,82 | 15.15 | 10.33 | 20,54 |
| S | 0.11 | 0.27 | 0.16 | 0.38 |
| Rendimiento (%) | 53.35 | / | 57.23 | / |
Tabla 1: características estructurales y las composiciones elementales de EBAC, EBAC-N, MBAC y MBAC-N. Los datos texturales son analizados mediante el método de apuesta. El porcentaje de peso relativo de los elementos se calcula basándose en la base seca libre de cenizas. Esta tabla ha sido modificada desde Wan y Li27.
| MBAC-N | ||||
| Modelos de isotermas | Parámetros | 5 ° C | 25 ° C | 45 ° C |
| Langmuir | q0cal (mg g−1) | 20.82 | 24.09 | 25.97 |
| q0mea (mg g−1) | 20.23 | 23.47 | 25.12 | |
| b (mg L−1) | 0.73 | 0.51 | 0.49 | |
| R2 | 0.999 | 0.996 | 0.995 | |
| Freundlich | KF (mg L−1) | 8.802 | 9.65 | 10.56 |
| n | 3.937 | 3.902 | 4.032 | |
| R2 | 0,907 | 0.967 | 0.987 | |
| Temkin | T (mg L−1) | 29.57 | 32.3 | 49.8 |
| B (mg L−1) | 2.94 | 3.19 | 3.16 | |
| R2 | 0,969 | 0.985 | 0.955 | |
Tabla 2: parámetros de la isoterma de Cu(II) en MBAC-N a temperaturas diferentes. Los parámetros de armarios son de lineal modelos de adsorción de Langmuir, Freundlich y Temkin. Esta tabla ha sido modificada desde Wan y Li27.
| MBAC-N | |||
| Modelos cinéticos | Parámetros | 30 mg L−1 | 100 mg L−1 |
| Lagergren | k1 (min−1) | 0,037 | 0.045 |
| R2 | 0.714 | 0.934 | |
| qe, mea (mg g−1) | 13.39 | 22.69 | |
| Pseudo segundo orden | qe, cal (mg g−1) | 13.44 | 23.25 |
| k2 (g (mg min)−1) | 0.08676 | 0.03031 | |
| R2 | 0.999 | 0.999 | |
| qe, mea (mg g−1) | 13.39 | 22.69 | |
| Elovich | Α (g (mg min)−1) | 379.73 | 312.25 |
| ΒE (mg g−1) | 0.738 | 0.411 | |
| R2 | 0.799 | 0,901 | |
Tabla 3: parámetros cinéticos de Cu(II) en MBAC-N en las concentraciones iniciales diferentes. Los parámetros de armarios son de Lagergren linearizado, Pseudo segundo orden y los modelos de Elovich. Esta tabla ha sido modificada desde Wan y Li27.
| Adsorbentes | pH | qe (mg g−1) | Referencias |
| Carbón activado granular con base de madera | 5.5 | 6.016 | 34 |
| Derivados de la cáscara de la fruta del Baobab carbón activado | 6 | 3.0833 | 35 |
| Piedra verde oliva CA (COSAC) | 5 | 17.08 | 36 |
| Carbonfrom activado fecha piedras | 5.5 | 18.68 | 37 |
| Carbón activado de cáscara de nuez en | 5 | 9.3 | 38 |
| Plasma modificado carbón activado | 21.4 | ||
| MBAC-N | 5 | 25.12 | Este estudio |
Tabla 4: comparación de la capacidad de adsorción de Cu(II) de adsorbentes diferentes. La capacidad del carbón activado para eliminar Cu(II) es afectada significativamente por el pH de la solución, por lo que la capacidad de adsorción de los materiales de carbono de biomasa de contraste debe obtenerse cerca de pH 5.
Discusión
En este protocolo, uno de los pasos críticos es la exitosa preparación de carbón mesoporoso con mejores propiedades físico-químicas por el enfoque de un solo paso, en necesitan determinar las condiciones experimentales óptimas. Así, en un anterior estudio28, hemos realizado experimentos de pirólisis de microondas de matriz ortogonal, teniendo en cuenta el efecto de la relación de la impregnación de bagazo y ácido fosfórico, el tiempo de pirólisis, microondas potencia y tiempo de secado. Además, debe tenerse gran cuidado en tedioso Cu (II)-los experimentos de adsorción, especialmente cuando se ajusta el pH de la solución, porque el valor de pH tiene una gran influencia en la eliminación de Cu(II) por carbón activado (figura 3). Es imprescindible probar la real concentración de cobre de la solución de CuSO4 con una concentración inicial definida y utilizar este valor como C0 en la ecuación (1).
Pueden obtenerse una superficie específica más grande y mayor volumen de poros de carbón activado basada en biomasa por activación química. Sin embargo, la superficie específica y volumen total del poro disminuyen durante el proceso de la pirolisis y la modificación posterior, que es probablemente debido al colapso y la obstrucción de los poros27, resultando en una reducción de la capacidad de adsorción. Por lo tanto, más trabajo se requiere para preparar mesoporosos biomasa carbón con un área de superficie alta y abundante de grupos funcionales.
Microondas pirolisis se verifica más adecuadamente sintetizar carbono mesoporoso basado en biomasa con una mayor adsorción de nitrógeno/oxígeno-quelantes para Cu(II), que tiene muchas ventajas sobre los métodos de calentamiento convencional ampliamente utilizado. Sin embargo, no es posible controlar exactamente la temperatura instantánea durante el proceso de pirólisis de microondas. La biomasa es un material de absorción de microondas buena, cuya temperatura puede aumentar rápidamente bajo el efecto de microondas. Claramente, labor futura debe examinar cómo la temperatura de pirólisis afecta a las propiedades fisicoquímicas de la biomasa de carbono.
Una descripción detallada del mecanismo de modificación está fuera del alcance de este artículo, pero se puede encontrar en publicaciones anteriores27. La importancia potencial de la nitrificación y la reducción de modificación que efectivamente puede introducir más grupos funcionales de N/O al mismo tiempo en la superficie de las muestras de carbono vale la pena apreciar. Sin embargo, el proceso de modificación contiene numerosas medidas experimentales y la utilización de ácido fuerte concentrado peligroso. Un método de modificación de nitrógeno/oxígeno más simple y más eficaz puede ser probado y adoptado en otros estudios.
Han demostrado un método eficiente de respetuoso del medio ambiente para la preparación de carbón mesoporoso basado en biomasa por pirólisis de microondas y droga N/O grupos simultáneamente en carbón usando una ruta nitrificación y reducción. Tal carbón doble dopado N/O posee una mayor capacidad de adsorción de iones de metales pesados en una solución acuosa, que es aplicable para la remediación de las aguas residuales. Esperamos que el presente Protocolo proporcionará ideas para la preparación rápida de carbono alta adsorción de la biomasa por pirólisis de microondas-rápido, eficaz y se optimizará en el futuro.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen los fondos de Investigación Fundamental para las universidades Central de China (No.KYZ201562), Fondo de ciencia Postdoctoral de China (no. 2014 M 560429) y el plan de investigación y desarrollo de clave de la provincia de Jiangsu (no. BE2018708).
Materiales
| Name | Company | Catalog Number | Comments |
| All chemicals and reagents (phosphoric acid, etc.) | Nanjing Chemical Reagent Co., Ltd | Analytical grade | |
| Electric furnace | Luoyang Bolaimaite Experiment Electric Furnace Co., Ltd | ||
| Microwave oven | Nanjing Yudian Automation Technology Co., Ltd | 2.45 GHz frequency | |
| Surface-area and porosimetry analyzer | Beijing Gold APP Instrument Co., Ltd | Vc-Sorb 2800TP | |
| Fourier transform infrared (FTIR) spectrometer | Nicolet | 6700 | |
| Flame atomic absorption spectrophotometry | Beijing Purkinje General Instrument Corporation | A3 | |
| Element Analyzer | Germany Heraeus Co. | CHN-O-RAPID |
Referencias
- Saleh, T. A., Gupta, V. K. Processing methods, characteristics and adsorption behavior of tire derived carbons: a review. Advances in Colloid & Interface Science. 211, 93(2014).
- Mohammadi, N., Khani, H., Gupta, V. K., Amereh, E., Agarwal, S. Adsorption process of methyl orange dye onto mesoporous carbon material-kinetic and thermodynamic studies. Journal of Colloid & Interface Science. 362 (2), 457(2011).
- Saleh, T. A., Gupta, V. K. Column with CNT/magnesium oxide composite for lead(II) removal from water. Environmental Science & Pollution Research. 19 (4), 1224-1228 (2012).
- Asfaram, A., Ghaedi, M., Agarwal, S., Tyagi, I., Kumargupta, V. Removal of basic dye Auramine-O by ZnS:Cu nanoparticles loaded on activated carbon: optimization of parameters using response surface methodology with central composite design. RSC Advances. 5 (24), 18438-18450 (2015).
- Gupta, V. K., Saleh, T. A. Sorption of pollutants by porous carbon, carbon nanotubes and fullerene- an overview. Environmental Science and Pollution Research. 20 (5), 2828-2843 (2013).
- Ahmaruzzaman, M., Gupta, V. K. Rice Husk and Its Ash as Low-Cost Adsorbents in Water and Wastewater Treatment. Industrial & Engineering Chemistry Research. 50 (24), 13589-13613 (2011).
- Ahmed, M. J., Theydan, S. K. Adsorption of cephalexin onto activated carbons from Albizia lebbeck seed pods by microwave-induced KOH and K2CO3 activations. Chemical Engineering Journal. 211 (22), 200-207 (2012).
- Liew, R. K., et al. Production of activated carbon as catalyst support by microwave pyrolysis of palm kernel shell: a comparative study of chemical versus physical activation. Research on Chemical Intermediates. , 1-17 (2018).
- Lam, S. S., et al. Microwave-assisted pyrolysis with chemical activation, an innovative method to convert orange peel into activated carbon with improved properties as dye adsorbent. Journal of Cleaner Production. 162, 1376-1387 (2017).
- Jin, H., Wang, X., Gu, Z., Polin, J. Carbon materials from high ash biochar for supercapacitor and improvement of capacitance with HNO3 surface oxidation. Journal of Power Sources. 236, 285-292 (2013).
- Chen, H. Research Methods for the Biotechnology of Lignocellulose. Biotechnology of Lignocellulose: Theory and Practice. , Springer. Dordrecht, Netherlands. 403-510 (2014).
- Sayğılı, H., Güzel, F. High surface area mesoporous activated carbon from tomato processing solid waste by zinc chloride activation: process optimization, characterization and dyes adsorption. Journal of Cleaner Production. 113, 995-1004 (2016).
- Cao, Q., Xie, K. C., Lv, Y. K., Bao, W. R. Process effects on activated carbon with large specific surface area from corn cob. Bioresource Technology. 97 (1), 110-115 (2006).
- Xiao, X., et al. Adsorption behavior of phenanthrene onto coal-based activated carbon prepared by microwave activation. Korean Journal of Chemical Engineering. 32 (6), 1129-1136 (2015).
- Ge, X., et al. Adsorption of naphthalene from aqueous solution on coal-based activated carbon modified by microwave induction: Microwave power effects. Chemical Engineering & Processing Process Intensification. 91, 67-77 (2015).
- Yao, S., et al. Removal of Pb(II) from water by the activated carbon modified by nitric acid under microwave heating. Journal of Colloid and Interface Science. 463, 118-127 (2016).
- Ali, A., Idris, R. Utilization Of Low-cost Activated Carbon From Rapid Synthesis Of Microwave Pyrolysis For WC Nanoparticles Preparation. Advanced Materials Letters. 08 (1), 70-76 (2016).
- Puchana-Rosero, M. J., et al. Microwave-assisted activated carbon obtained from the sludge of tannery-treatment effluent plant for removal of leather dyes. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 504, 105-115 (2016).
- Du, Z. L., Zheng, T., Wang, P., Hao, L. L., Wang, Y. X. Fast microwave-assisted preparation of a low-cost and recyclable carboxyl modified lignocellulose-biomass jute fiber for enhanced heavy metal removal from water. Bioresource Technology. 201, 41-49 (2016).
- Ge, X., et al. Microwave-assisted modification of activated carbon with ammonia for efficient pyrene adsorption. Journal of Industrial & Engineering Chemistry. 39, 27-36 (2016).
- Ghaedi, M., et al. Modeling of competitive ultrasonic assisted removal of the dyes - Methylene blue and Safranin-O using Fe3O4 nanoparticles. Chemical Engineering Journal. 268, 28-37 (2015).
- Gupta, V. K., Nayak, A. Cadmium removal and recovery from aqueous solutions by novel adsorbents prepared from orange peel and Fe2O3 nanoparticles. Chemical Engineering Journal. 180 (3), 81-90 (2012).
- Robati, D., et al. Removal of hazardous dyes-BR 12 and methyl orange using graphene oxide as an adsorbent from aqueous phase. Chemical Engineering Journal. 284 (7), 687-697 (2016).
- Ali, I., Alothman, Z. A., Sanagi, M. M. Green Synthesis of Iron Nano-Impregnated Adsorbent for Fast Removal of Fluoride from Water. Journal of Molecular Liquids. 211, 457-465 (2015).
- Gupta, V. K., Kumar, R., Nayak, A., Saleh, T. A., Barakat, M. A. Adsorptive removal of dyes from aqueous solution onto carbon nanotubes: A review. Advances in Colloid & Interface Science. 193 (6), 24(2013).
- Mittal, A., Mittal, J., Malviya, A., Gupta, V. K. Adsorptive removal of hazardous anionic dye "Congo red" from wastewater using waste materials and recovery by desorption. Journal of Colloid and Interface Science. 340 (1), 16-26 (2009).
- Wan, Z., Li, K. Effect of pre-pyrolysis mode on simultaneous introduction of nitrogen/oxygen-containing functional groups into the structure of bagasse-based mesoporous carbon and its influence on Cu(II) adsorption. Chemosphere. 194, 370-380 (2018).
- Li, K., Li, J., Lu, M., Li, H., Wang, X. Preparation and amino modification of mesoporous carbon from bagasse via microwave activation and ethylenediamine polymerization for Pb(II) adsorption. Desalination and Water Treatment. 57 (50), 24004-24018 (2016).
- Yantasee, W., et al. Electrophilic Aromatic Substitutions of Amine and Sulfonate onto Fine-Grained Activated Carbon for Aqueous-Phase Metal Ion Removal. Separation Science and Technology. 39 (14), 3263-3279 (2004).
- Quantachrome Autosorb-1 Series User's Guide. , Available from: http://www.umich.edu/~techserv/gasAdsorp/Autosorb-1.pdf (2007).
- Nicolet FT-IR User's Guide. , Available from: http://chemistry.unt.edu/~verbeck/LIMS/Manuals/6700_User.pdf (2015).
- Li, Y. B., Li, K. Q., Wang, X. H., Li, J. Ethylenediamine Modification of Hierarchical Mesoporous Carbon for the Effective Removal of Pb (II) and Related Influencing Factors. International Journal of Material Science. 6 (1), 58-65 (2016).
- Georgakopoulos, E., Santos, R. M., Chiang, Y. W., Manovic, V. Two-way Valorization of Blast Furnace Slag: Synthesis of Precipitated Calcium Carbonate and Zeolitic Heavy Metal Adsorbent. Journal of Visualized Experiments. (120), e55062(2017).
- Loganathan, P., et al. Modelling equilibrium adsorption of single, binary, and ternary combinations of Cu, Pb, and Zn onto granular activated carbon. Environmental Science & Pollution Research. (15), 1-12 (2018).
- Vunain, E., Kenneth, D., Biswick, T. Synthesis and characterization of low-cost activated carbon prepared from Malawian baobab fruit shells by H3PO4 activation for removal of Cu(II) ions: equilibrium and kinetics studies. Applied Water Science. 7 (8), 4301-4319 (2017).
- Bohli, T., Ouederni, A., Villaescusa, I. Simultaneous adsorption behavior of heavy metals onto microporous olive stones activated carbon: analysis of metal interactions. Euro-Mediterranean Journal for Environmental Integration. 2 (1), 19(2017).
- Bouhamed, F., Elouear, Z., Bouzid, J., Ouddane, B. Multi-component adsorption of copper, nickel and zinc from aqueous solutions onto activated carbon prepared from date stones. Environmental Science & Pollution Research. 23 (16), 1-6 (2016).
- Wu, L., et al. Surface modification of phosphoric acid activated carbon by using non-thermal plasma for enhancement of Cu(II) adsorption from aqueous solutions. Separation & Purification Technology. 197, (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados