Polimerización
Visión general
Fuente: Vy M. Dong y Jan Riedel, Departamento de química, Universidad de California, Irvine, CA
Polímeros se hacen de macromoléculas, que se componen de unidades (las unidades monoméricas llamadas). En nuestro mundo moderno, polímeros juegan un papel importante. Uno de los primeros polímeros importantes era nylon, que es una poliamida. Encuentran uso extenso en cepillos de dientes y las medias.
Principios
Hay dos tipos principales de la polimerización. Una es la reacción en cadena de crecimiento, que se puede distinguir en la polimerización radical catiónica, aniónica y coordinativa. Polimerización de crecimiento de paso es el otro método principal para hacer polímeros. BI-funcional o multifuncionales monómeros reaccionan para finalmente formar polímeros. Polimerización de crecimiento de paso puede diferenciarse aún más en la polimerización de condensación y polimerización de adición.
En una polimerización de adición, monómeros se sumará a uno otro para formar el polímero. Mientras que en una polimerización de condensación, agregará dos monómeros en una reacción de condensación bajo el lanzamiento de agua u otro pequeñas moléculas como cloruro de hidrógeno.
En la siguiente síntesis de una poliamida, un cloruro de ácido dicarboxílico se condensa con una diamina para formar una poliamida, la liberación de cloruro de hidrógeno. La notación de en el nombre de poliamida 6,10 6,10 refleja el número de carbonos en el monomer de la diamina (seis en este caso) y el número de carbonos en el monómero de cloruro de ácido dicarboxílico (diez en este caso).
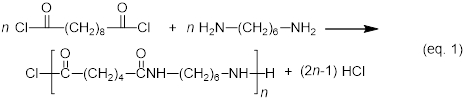
Una característica de una polimerización de crecimiento de paso es la dependencia de la longitud de la cadena y la conversión de la polimerización. Al principio de la reacción más monómeros se condensan a principalmente forma dímeros y trimers. Con nuevos avances, los dímeros y trimers combinará a oligómeros y sólo después de tasas de conversión alta, cuando la mayoría monómeros han reaccionado, los oligómeros se condensan para formar polímeros con un alto número de unidades monoméricas. Este fenómeno se ilustra en la figura 1.
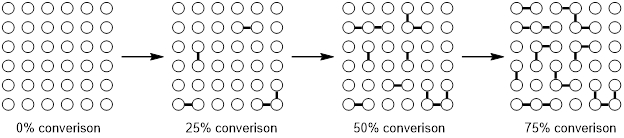
Figura 1. Polimerización de la condensación.
En este experimento, la poliamida se forma a través de una supuesto polimerización superficial. En una solución no homogénea, que consiste en una solución acuosa y orgánica, la polimerización llevará a cabo en la interfase de las dos capas. El monómero de la diamina se disuelve en agua, mientras que el ácido dicarboxílico se disuelve en un solvente orgánico.
Procedimiento
1. preparación
- Añadir a un vaso de precipitados de 250 mL, 3 mL (14 mmol) de cloruro de sebacoyl en 100 mL de n-hexano.
- Añadir a un vaso de precipitados de 150 mL, 4,4 g (38 mmol) de 1, 6-Diaminohexano en 50 mL de agua destilada.
- Añadir aproximadamente 5 gotas de una solución de fenolftaleína a la solución de 1, 6-Diaminohexano.
2. polimerización superficial
- Recubrimiento con cuidado la solución acuosa con la solución de cloruro de sebacoyl.
- Tenga en cuenta que forma una capa delgada en el interfaz de la solución acuosa y la orgánica solución.
- Tenga en cuenta que la fenolftaleína añadida hará la interfaz visible.
3. recoger el polímero
- Tire de la película de poliamida formada desde la interfaz con las pinzas y enróllela alrededor de una varilla de vidrio.
- Viento la poliamida de la varilla de vidrio.
- Lave el polímero con acetona y luego con abundante agua.
- Secar el polímero a 50 º C a presión reducida.
Resultados
Se obtiene un hueco, largo filamento de poliamida.
Aplicación y resumen
Este experimento presenta de manera vívida la síntesis de un polímero de manera simple. La polimerización de la condensación de 1, 6-Diaminohexano con cloruro de sebacoyl da una poliamida 6,10, que se polimeriza en la interfase de dos capas de líquido. Esta polimerización superficial formará un hueco filamento de poliamida, después de tirar el polímero de la interfaz y envolver alrededor de una varilla de vidrio para enrollarla.
Polímeros y poliamida encuentran una variedad de diferentes usos en nuestra vida cotidiana. Inicialmente utilizado para cepillos de dientes y medias. Hoy en día, la poliamida se utiliza en la producción de textiles, como capas de lluvia, ropa al aire libre, batas de laboratorio, chaquetas de vuelo. Debido a su dureza y resistencia, poliamidas se utilizan también en paracaídas, cuerdas para escalar y las velas. Estas aplicaciones hacen de poliamidas uno de los polímeros más importantes en uso hoy en día.
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Polimerización
Organic Chemistry II
94.5K Vistas

Limpieza de cristalería
Organic Chemistry II
123.8K Vistas

Sustitución nucleófila
Organic Chemistry II
99.6K Vistas

Agentes de reducción
Organic Chemistry II
43.1K Vistas

Reacción de Grignard
Organic Chemistry II
149.1K Vistas

Titulación de n-butilitio
Organic Chemistry II
48.0K Vistas

Aparato de Dean-Stark
Organic Chemistry II
100.6K Vistas

Ozonólisis de alquenos
Organic Chemistry II
67.1K Vistas

Organocatálisis
Organic Chemistry II
16.9K Vistas

Acoplamiento cruzado catalizado por paladio
Organic Chemistry II
34.6K Vistas

Síntesis en fase sólida
Organic Chemistry II
41.1K Vistas

Hidrogenación
Organic Chemistry II
49.6K Vistas

Punto de fusión
Organic Chemistry II
150.0K Vistas

Espectroscopia infrarroja
Organic Chemistry II
215.4K Vistas

Polarímetro
Organic Chemistry II
100.1K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados