Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Panoramica
Fonte: Arvin H. Soepriatna1, Kelsey A. Bullens2e Craig J. Goergen1
1 Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
2 Dipartimento di Biochimica, Purdue University, West Lafayette, Indiana
L'imaging a fluorescenza nel vicino infrarosso (NIRF) è un'entusiasmante tecnica ottica che utilizza sonde fluorescenti per visualizzare complessi assemblaggi biomolecolari nei tessuti. L'imaging NIRF presenta molti vantaggi rispetto ai metodi di imaging convenzionali per l'imaging non invasivo delle malattie. A differenza della tomografia computerizzata a emissione di singolo fotone (SPECT) e della tomografia ad emissione di positroni (PET), l'imaging NIRF è rapido, ad alto rendimento e non comporta radiazioni ionizzanti. Inoltre, i recenti sviluppi nell'ingegneria delle sonde fluorescenti target-specific e attivabili forniscono al NIRF un'elevata specificità e sensibilità, rendendolo una modalità interessante nello studio del cancro e delle malattie cardiovascolari. La procedura presentata è progettata per dimostrare i principi alla base dell'imaging NIRF e come condurre esperimenti in vivo ed ex vivo su piccoli animali per studiare una varietà di malattie. L'esempio specifico mostrato qui impiega una sonda fluorescente attivabile per la metalloproteinasi-2 della matrice (MMP2) per studiarne l'assorbimento in due diversi modelli di roditori di aneurismi dell'aorta addominale (AAA).
Principi
Come suggerisce il nome, l'imaging NIRF utilizza la luce all'interno della prima finestra nel vicino infrarosso, che va da 650 nm a 900 nm, per fornire fotoni nel tessuto. L'energia, E, di un fotone è caratterizzata dall'equazione 1, dove h è la costante di Planck, c è la velocità della luce nel vuoto e λ è la lunghezza d'onda della luce.
 =
=  (Equazione 1)
(Equazione 1)
Le molecole fluorescenti specifiche del bersaglio chiamate fluorofori vengono tipicamente introdotte nell'animale attraverso l'ingegneria genetica o tramite iniezione della vena della coda prima dell'imaging. Questi fluorofori assorbono l'energia fotona, che aumenta l'energia delle molecole dallo stato base, S0, allo stato instabile, eccitato S1'. A causa dell'instabilità dello stato S1', le molecole si rilassano al livello di energia vibrazionale più basso all'interno di quello stato e rilasciano energia sotto forma di calore. I fluorofori, ora nello stato rilassato, eccitato S1,ritornano quindi allo stato base S0,emettendo luce ad una specifica lunghezza d'onda. La luce emessa, che ha una lunghezza d'onda più lunga a causa della dissipazione di energia sotto forma di calore, viene quindi catturata e registrata utilizzando un sistema di imaging a fluorescenza. Lo spostamento fondamentale tra gli spettri di assorbimento e di emissione è chiamato spostamento di Stokes ed è importante in quanto consente di distinguere tra l'eccitazione e l'emissione di luce.
Procedura
La seguente procedura fornisce i passaggi dettagliati necessari per raccogliere immagini NIRF in vivo ed ex vivo da piccoli animali:
1. Configurazione sperimentale
- Collegare una sorgente luminosa in fibra ottica al sistema di imaging a fluorescenza utilizzando una guida luminosa in fibra ottica.
- Selezionare il filtro di eccitazione appropriato per l'esperimento. Il filtro di eccitazione determina la lunghezza d'onda della luce da consegnare al campione e deve essere scelto per corrispondere allo spettro di eccitazione del fluoroforo introdotto nel campione.
- Selezionare il filtro di emissione appropriato. Il filtro di emissione blocca i componenti spettrali indesiderati, che possono essere attribuiti all'autofluorescenza, e dovrebbe essere scelto per corrispondere allo spettro di emissione del fluoroforo.
2. Preparazione del campione
-
In vivo
- Anestetizzare l'animale in una camera di induzione utilizzando isoflurano ad una concentrazione del 3-4% sul quadrante del flussometro.
- Trasferire l'animale in un cono nasale fissato nella fase di imaging e mantenere l'isoflurano ad una concentrazione dell'1-2%. Una fonte di calore non è necessaria perché gli animali vengono in genere ripresi solo per un breve periodo di tempo (> 5 minuti) e la loro temperatura corporea non diminuisce sostanzialmente.
- Proteggi le zampe dell'animale per ridurre al minimo gli artefatti di movimento. Rimuovere i capelli dalla regione di interesse applicando una crema depilatoria.
- Applicare la crema depilatoria sulla più piccola area necessaria. Dopo 30 s, pulirlo con una garza. Pulire l'area una seconda volta con un tampone di garza inumidito con alcool etilico per rimuovere completamente la crema depilatoria.
- Applicare unguento oftalmico agli occhi per prevenire l'essiccazione delle cornee.
- Iniettare la sonda molecolare fluorescente attivabile nell'animale. Per questa specifica applicazione, le sonde attivabili MMP2 sono state iniettate per via endovenosa nella vena della coda. A questo punto, il mouse può essere ripreso. Procedere alla "Acquisizione immagini" di questo protocollo per continuare. Monitorare l'animale per una respirazione regolare durante la breve procedura.
-
Ex Vivo
- Dopo l'iniezione della sonda fluorescente, l'eutanasia dell'animale in modo umano secondo le linee guida AVMA del 2013 per l'eutanasia degli animali. L'overdose di anidride carbonica (CO2)è una pratica standard per l'eutanasia di piccoli animali.
- Estrarre chirurgicamente il tessuto o l'organo di interesse e rimuovere con cura il tessuto adiposo in eccesso con una pinza.
- Risciacquare il tessuto in soluzione salina tamponata con fosfato per rimuovere il sangue residuo e posizionare il campione direttamente sulla fase di imaging.
3. Acquisizione di immagini
- Aprire il software di imaging molecolare e accendere sia la sorgente luminosa a fibra ottica che il sistema di imaging a fluorescenza.
- Aprire la finestra di acquisizione e specificare il tipo di esposizione appropriato per lo studio. Le esposizioni disponibili includono: Esposizione standard per acquisire una singola immagine, Esposizione time lapse per acquisire una serie di immagini in un intervallo di tempo fisso ed Esposizione progressiva per acquisire una sequenza continua di esposizioni in tempi di esposizione diversi.
- Selezionare Transilluminazione UV come fonte di illuminazione.
- Utilizzando l'immagine in anteprima come riferimento, regolare la messa a fuoco dell'obiettivo, il campo visivo e l'f-stop/apertura nella camera del sistema di acquisizione per ottimizzare la qualità dell'immagine campionata. Regolare il tempo di esposizione e la posizione del campione.
- Chiudere la finestra di anteprima e assicurarsi che tutti i parametri nella finestra di acquisizione corrispondano alle impostazioni della fotocamera e del filtro.
- Fai clic su'Esponi'per acquisire e salvare l'immagine.
- Il software di imaging molecolare standard fornisce in genere una varietà di strumenti analitici, di misurazione e di correzione delle immagini per quantificare i segnali di fluorescenza per l'analisi delle immagini.
- Al termine della sessione di imaging, rimuovere il campione/animale, spegnere il sistema e pulire lo stadio di imaging per ridurre al minimo i danni al sistema.
Risultati
Immagini NIRF rappresentative in vivo ed ex vivo prese da roditori con aneurismi dell'aorta addominale (AAA) sono mostrate nelle Figure 1-2. Una sonda fluorescente attivabile è stata iniettata sistemicamente attraverso la vena della coda per visualizzare l'attività della metalloproteinasi-2 (MMP2) della matrice. MMP2 è un enzima elastolitico coinvolto nella degradazione della matrice extracellulare che svolge un ruolo importante nell'inizio e nella progressione dell'AAA. Tutte le immagini sono state acquisite utilizzando un filtro di eccitazione a 625 nm, un filtro di emissione a 700 nm e un tempo di esposizione di 60 secondi.
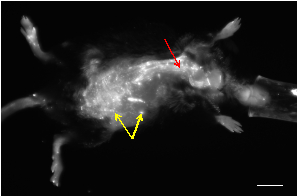
Figura 1: Un'immagine NIRF rappresentativa in vivo di un topo con deficit di apolipoproteina E che ha sviluppato un AAA dopo infusione di angiotensina-II. La maggior parte delle piccole macchie che mostrano un segnale elevato provengono dall'autofluorescenza della pelle (frecce gialle). La vascolarizzazione può essere visualizzata come strutture tubolari con segnali ad alta fluorescenza (freccia rossa). Scalebar: 1 cm.
La Figura 2 mostra un aumento dell'attività di MMP2 nella regione aneurismaca dell'aorta addominale, come osservato dall'aumento osservato dell'intensità del segnale rispetto alle regioni sane dell'aorta addominale. Questo risultato è coerente con i risultati in letteratura che mostrano livelli elevati di MMP2 all'interno degli AAA. Le sonde fluorescenti in eccesso sono state filtrate e accumulate nei reni, portando a segnali fluorescenti luminosi.

Figura 2: Immagini NIRF di AAA da due diversi modelli animali: (A) un AAA surrenale in topo carente di apolipoproteina-E infuso con angiotensina II e (B) un AAA infrarenale nel ratto infuso con elastasi pancreatica suina. Le frecce gialle puntano agli AAA. Scalebars: 3 mm.
Applicazione e Riepilogo
L'imaging NIRF si basa su sonde fluorescenti per quantificare e visualizzare assemblaggi biomolecolari nei tessuti. L'energia fotone assorbita dalla luce del vicino infrarosso eccita le molecole fluorescenti a uno stato di energia più elevato e la luce emessa con una lunghezza d'onda caratteristica più lunga viene catturata da un sistema di imaging a fluorescenza. Qui, l'applicazione dell'imaging NIRF per studiare l'attività di MMP2 negli aneurismi dell'aorta addominale è stata dimostrata in vivo ed ex vivo. A differenza di SPECT o PET, che sono considerati i gold standard nello studio dei processi metabolici nel corpo in modo non invasivo, l'imaging NIRF è una tecnica di imaging rapida e ad alto rendimento che non comporta radiazioni ionizzanti. Uno dei limiti di questa modalità è la sua profondità di penetrazione relativamente piccola. Sebbene questa limitazione renda difficile l'imaging clinico dei tessuti profondi, l'imaging NIRF svolge un ruolo importante nello studio dei tumori e delle malattie cardiovascolari nei piccoli animali.
Data la sonda fluorescente appropriata, molte strutture molecolari possono essere visualizzate utilizzando le procedure di imaging NIRF presentate per studiare sia l'inizio della malattia che la progressione in modelli di piccoli animali. Applicazioni specifiche ex vivo e in vivo includono 1) valutazione dell'attività MMP nella vascolarizzazione dei roditori, 2) diagnosi precoce del tumore in diversi tipi di tumori e 3) valutazione della farmacocinetica delle nanoparticelle e della biodistribuzione per applicazioni terapeutiche. Oltre all'aumento dell'attività MMP2 all'interno degli AAA, altre sonde fluorescenti MMP sono state utilizzate per studiare la progressione dell'aterosclerosi e per caratterizzare la composizione della matrice extracellulare cardiaca a seguito di un infarto miocardico. Inoltre, il fluoroforo verde indocianina è stato utilizzato per studiare la perfusione tissutale in modelli murini di ischemia degli arti posteriori. Per approfondire l'applicazione dell'imaging NIRF sulla diagnosi precoce del cancro, i coloranti NIRF mirati al tumore possono essere utilizzati per valutare i margini tumorali e assistere nelle procedure di resezione. L'integrazione dei fluorofori nel vicino infrarosso in nanoparticelle sviluppate per la somministrazione di farmaci consente agli scienziati di sviluppare terapie a base di nanoparticelle più efficaci per una varietà di malattie. Infine, la capacità di localizzare spazialmente il segnale fluorescente in animali interi o tessuti intatti è un chiaro vantaggio rispetto ad altri saggi enzimatici convenzionali (zimografia gel) e analisi proteica (western blot) che richiedono il sacrificio degli animali e l'omogeneizzazione dei tessuti.
Vai a...
Video da questa raccolta:

Now Playing
Imaging a fluorescenza nel vicino-infrarosso di aneurismi dell'aorta addominale
Biomedical Engineering
8.2K Visualizzazioni

Imaging di campioni biologici con microscopia ottica e confocale
Biomedical Engineering
35.7K Visualizzazioni

Imaging di campioni biologici con microscopio elettronico a scansione (SEM)
Biomedical Engineering
23.5K Visualizzazioni

Biodistribuzione dei vettori di nanofarmaci: applicazioni del microscopio elettronico a scansione (SEM)
Biomedical Engineering
9.3K Visualizzazioni

Imaging a ultrasuoni ad alta frequenza dell'aorta addominale
Biomedical Engineering
14.4K Visualizzazioni

Mappatura quantitativa della deformazione di un aneurisma dell'aorta addominale
Biomedical Engineering
4.6K Visualizzazioni

Tomografia fotoacustica per l'immagine di sangue e lipidi nell'aorta infrarenale
Biomedical Engineering
5.7K Visualizzazioni

Imaging a risonanza magnetica cardiaca
Biomedical Engineering
14.7K Visualizzazioni

Simulazioni fluidodinamiche computazionali del flusso sanguigno in un aneurisma cerebrale
Biomedical Engineering
11.7K Visualizzazioni

Tecniche non invasive di misurazione della pressione sanguigna
Biomedical Engineering
11.9K Visualizzazioni

Acquisizione e analisi di un segnale ECG (elettrocardiogramma)
Biomedical Engineering
104.8K Visualizzazioni

Resistenza alla trazione dei biomateriali riassorbibili
Biomedical Engineering
7.5K Visualizzazioni

Imaging micro-CT di un midollo spinale di topo
Biomedical Engineering
8.0K Visualizzazioni

Visualizzazione della degenerazione dell'articolazione del ginocchio dopo lesione del LCA non invasiva nei ratti
Biomedical Engineering
8.2K Visualizzazioni

Imaging combinato SPECT e CT per la visualizzazione della funzionalità cardiaca
Biomedical Engineering
11.0K Visualizzazioni