Method Article
Identifizierung von alternativem Spleißen und Polyadenylierung in RNA-seq-Daten
In diesem Artikel
Zusammenfassung
Alternative Spleißen (AS) und alternative Polyadenylierung (APA) erweitern die Vielfalt der Transkriptisoformen und ihrer Produkte. Hier beschreiben wir bioinformatische Protokolle zur Analyse von Bulk-RNA-seq und 3'-Endsequenzierungsassays, um AS und APA zu erkennen und zu visualisieren, die unter experimentellen Bedingungen variieren.
Zusammenfassung
Neben der typischen Analyse von RNA-Seq zur Messung der differentiellen Genexpression (DGE) unter experimentellen/biologischen Bedingungen können RNA-seq-Daten auch verwendet werden, um andere komplexe regulatorische Mechanismen auf Exon-Ebene zu erforschen. Alternative Spleißung und Polyadenylierung spielen eine entscheidende Rolle für die funktionelle Vielfalt eines Gens, indem sie verschiedene Isoformen erzeugen, um die Genexpression auf posttranskriptioneller Ebene zu regulieren, und die Beschränkung der Analysen auf die gesamte Genebene kann diese wichtige regulatorische Schicht übersehen. Hier demonstrieren wir detaillierte Schritt-für-Schritt-Analysen zur Identifizierung und Visualisierung der differentiellen Exon- und Polyadenylierungsstellennutzung über Bedingungen hinweg, wobei Bioconductor und andere Pakete und Funktionen wie DEXSeq, diffSplice aus dem Limma-Paket und rMATES verwendet werden.
Einleitung
RNA-seq wurde im Laufe der Jahre häufig verwendet, typischerweise zur Schätzung der differentiellen Genexpression und Genentdeckung1. Darüber hinaus kann es auch verwendet werden, um die unterschiedliche Nutzung auf Exon-Ebene aufgrund der Genexprimierung verschiedener Isoformen abzuschätzen, was zu einem besseren Verständnis der Genregulation auf posttranskriptioneller Ebene beiträgt. Die Mehrheit der eukaryotischen Gene erzeugt verschiedene Isoformen durch alternatives Spleißen (AS), um die Vielfalt der mRNA-Expression zu erhöhen. AS-Ereignisse können in verschiedene Muster unterteilt werden: Überspringen vollständiger Exons (SE), bei denen ein ("Kassetten") Exon zusammen mit seinen flankierenden Introns vollständig aus dem Transkript entfernt wird; alternative (Donor) 5'-Spleißstellenauswahl (A5SS) und alternative 3' (Akzeptor) Spleißstellenauswahl (A3SS), wenn zwei oder mehr Spleißstellen an beiden Enden eines Exons vorhanden sind; Beibehaltung von Introns (RI), wenn ein Intron innerhalb des reifen mRNA-Transkripts beibehalten wird, und gegenseitiger Ausschluss der Exon-Nutzung (MXE), wobei nur eines der beiden verfügbaren Exons gleichzeitig beibehalten werden kann 2,3. Die alternative Polyadenylierung (APA) spielt auch eine wichtige Rolle bei der Regulierung der Genexpression unter Verwendung alternativer Poly(A)-Stellen, um mehrere mRNA-Isoformen aus einem einzigen Transkriptzu erzeugen 4. Die meisten Polyadenylierungsstellen (pAs) befinden sich in der 3' untranslatierten Region (3' UTRs) und erzeugen mRNA-Isoformen mit unterschiedlichen 3' UTR-Längen. Da die 3' UTR die zentrale Drehscheibe für die Erkennung regulatorischer Elemente ist, können unterschiedliche 3' UTR-Längen die mRNA-Lokalisierung, Stabilität und Translation beeinflussen5. Es gibt eine Klasse von 3'-Endsequenzierungsassays, die für den Nachweis von APA optimiert sind und sich in den Details des Protokolls6 unterscheiden. Die hier beschriebene Pipeline ist für PolyA-seq ausgelegt, kann aber wie beschrieben für andere Protokolle angepasst werden.
In dieser Studie stellen wir eine Pipeline von differentiellen Exon-Analysemethoden7,8 (Abbildung 1) vor, die in zwei große Kategorien unterteilt werden können: exon-basiert (DEXSeq9, diffSplice 10) und ereignisbasiert (replicate Multivariate Analysis of Transcript Splicing (rMATS)11). Die Exon-basierten Methoden vergleichen die Faltenänderung über die Bedingungen einzelner Exons hinweg mit einem Maß für die gesamte Genfaltenänderung, um differentiell exprimierte Exon-Nutzung zu nennen, und berechnen daraus ein Maß für die AS-Aktivität auf Genebene. Ereignisbasierte Methoden verwenden Exon-Intron-Spanning-Junction-Lesevorgänge, um bestimmte Spleißereignisse wie Exon-Skipping oder Beibehaltung von Introns zu erkennen und zu klassifizieren und diese AS-Typen in Ausgabe3 zu unterscheiden. Somit bieten diese Methoden komplementäre Sichtweisen für eine vollständige Analyse von AS12,13. Wir haben DEXSeq (basierend auf dem DESeq214 DGE-Paket) und diffSplice (basierend auf dem Limma10 DGE-Paket) für die Studie ausgewählt, da sie zu den am häufigsten verwendeten Paketen für die differentielle Spleißanalyse gehören. rMATS wurde als beliebte Methode für die ereignisbasierte Analyse ausgewählt. Eine weitere beliebte ereignisbasierte Methode ist MISO (Mixture of Isoforms)1. Für APA adaptieren wir den Exon-basierten Ansatz.
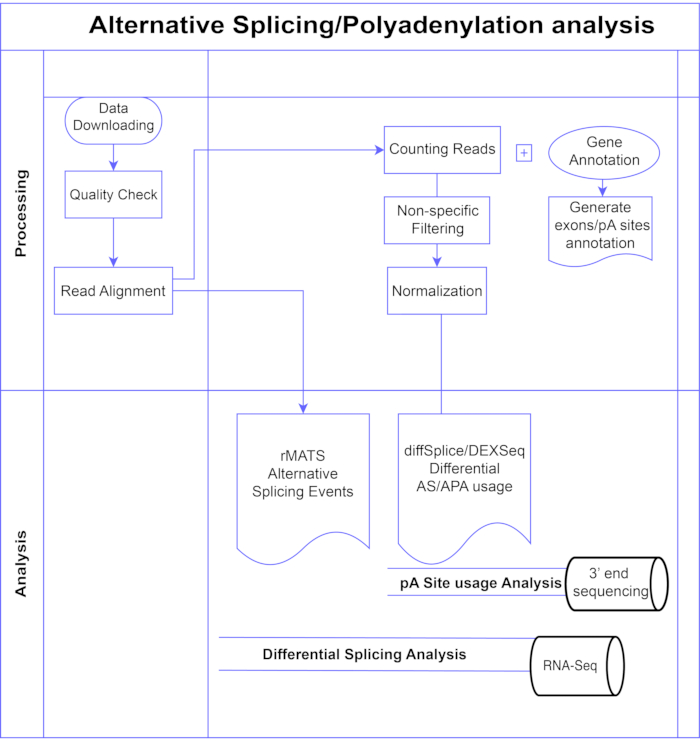
Abbildung 1. Analyse-Pipeline. Flussdiagramm der in der Analyse verwendeten Schritte. Zu den Schritten gehören: Abrufen der Daten, Durchführen von Qualitätsprüfungen und Leseausrichtung, gefolgt von Zählen von Lesevorgängen unter Verwendung von Anmerkungen für bekannte Exons, Introns und pA-Stellen, Filtern zur Entfernung niedriger Zählungen und Normalisierung. PolyA-seq-Daten wurden für alternative pA-Stellen mit diffSplice/DEXSeq-Methoden analysiert, Bulk-RNA-Seq wurde auf alternative Spleißung auf Exon-Ebene mit diffSplice/DEXseq-Methoden analysiert und AS-Ereignisse mit rMATS analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die in dieser Umfrage verwendeten RNA-seq-Daten stammen von Gene Expression Omnibus (GEO) (GSE138691)15. Wir verwendeten Maus-RNA-seq-Daten aus dieser Studie mit zwei Bedingungsgruppen: Wildtyp (WT) und Muskelblind-ähnlicher Typ-1-Knockout (Mbnl1 KO) mit jeweils drei Replikaten. Um die Analyse der differentiellen Polyadenylierungsstandortnutzung zu demonstrieren, erhielten wir PolyA-seq-Daten von Mausembryo-Fibroblasten (MEFs) (GEO Accession GSE60487)16. Die Daten haben vier Bedingungsgruppen: Wild-Typ (WT), Muskelblind-Typ 1/Typ 2 Doppel-Knockout (Mbnl1/2 DKO), Mbnl 1/2 DKO mit Mbnl3-Knockdown (KD) und Mbnl1/2 DKO mit Mbnl3-Kontrolle (Strg). Jede Bedingungsgruppe besteht aus zwei Replikaten.
| GEO-Beitritt | SRA-Ausführungsnummer | Name des Beispiels | Zustand | Replizieren | Gewebe | Sequenzierung | Leselänge | |
| RNA-Seq | GSM4116218 | SRR10261601 | Mbnl1KO_Thymus_1 | Mbnl1 Knockout | Wiederholung 1 | Thymus | Gepaartes Ende | 100 bp |
| GSM4116219 | SRR10261602 | Mbnl1KO_Thymus_2 | Mbnl1 Knockout | Wiederholung 2 | Thymus | Gepaartes Ende | 100 bp | |
| GSM4116220 | SRR10261603 | Mbnl1KO_Thymus_3 | Mbnl1 Knockout | Wiederholung 3 | Thymus | Gepaartes Ende | 100 bp | |
| GSM4116221 | SRR10261604 | WT_Thymus_1 | Wildtyp | Wiederholung 1 | Thymus | Gepaartes Ende | 100 bp | |
| GSM4116222 | SRR10261605 | WT_Thymus_2 | Wildtyp | Wiederholung 2 | Thymus | Gepaartes Ende | 100 bp | |
| GSM4116223 | SRR10261606 | WT_Thymus_3 | Wildtyp | Wiederholung 3 | Thymus | Gepaartes Ende | 100 bp | |
| 3P-Seq | GSM1480973 | SRR1553129 | WT_1 | Wildtyp (WT) | Wiederholung 1 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp |
| GSM1480974 | SRR1553130 | WT_2 | Wildtyp (WT) | Wiederholung 2 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp | |
| GSM1480975 | SRR1553131 | DKO_1 | Mbnl 1/2 Doppel-Knockout (DKO) | Wiederholung 1 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp | |
| GSM1480976 | SRR1553132 | DKO_2 | Mbnl 1/2 Doppel-Knockout (DKO) | Wiederholung 2 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp | |
| GSM1480977 | SRR1553133 | DKOsiRNA_1 | Mbnl 1/2 Doppel-Knockout mit Mbnl 3 siRNA (KD) | Wiederholung 1 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp | |
| GSM1480978 | SRR1553134 | DKOsiRNA_2 | Mbnl 1/2 Doppel-Knockout mit Mbnl 3 siRNA (KD) | Wiederholung 2 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 36 bp | |
| GSM1480979 | SRR1553135 | DKONTsiRNA_1 | Mbnl 1/2 Doppel-Knockout mit nicht-targetender siRNA (Ctrl) | Wiederholung 1 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp | |
| GSM1480980 | SRR1553136 | DKONTsiRNA_2 | Mbnl 1/2 Doppel-Knockout mit nicht-targetender siRNA (Ctrl) | Wiederholung 2 | Embryonale Fibroblasten (MEFs) der Maus | Single-End | 40 bp |
Tabelle 1. Zusammenfassung der RNA-Seq- und PolyA-seq-Datensätze, die für die Analyse verwendet wurden.
Protokoll
1. Installation von Tools und R-Paketen, die in der Analyse verwendet werden
- Conda ist ein beliebter und flexibler Paketmanager, der eine komfortable Installation von Paketen mit ihren Abhängigkeiten über alle Plattformen hinweg ermöglicht. Verwenden Sie 'Anaconda' (conda-Paketmanager), um 'conda' zu installieren, mit dem die für die Analyse erforderlichen Tools/Pakete installiert werden können.
- Laden Sie 'Anaconda' gemäß den Systemanforderungen von https://www.anaconda.com/products/individual#Downloads herunter und installieren Sie es, indem Sie den Anweisungen im grafischen Installationsprogramm folgen. Installieren Sie alle erforderlichen Pakete mit 'conda', indem Sie Folgendes in die Linux-Befehlszeile eingeben.
conda install -c daler sratoolkit
conda install -c conda-forge parallel
conda install -c bioconda star bowtie fastqc rmats rmats2sashimiplot samtools fasterq-dump cutadapt bedtools deeptools - Um alle im Protokoll verwendeten R-Pakete herunterzuladen, geben Sie den folgenden Code in die R-Konsole (gestartet in der Linux-Befehlszeile durch Eingabe von 'R') oder Rstudio-Konsole ein.
bioc_packages<- c("DEXSeq", "Rsubread", "EnhancedVolcano", "edgeR", "limma", "maser","GenomicRanges")
packages<- c("magrittr", "rtracklayer", "tidyverse", "openxlsx", "BiocManager")
#Install if not already installed
installed_packages<-packages%in% rownames(installed.packages())
installed_bioc_packages<-bioc_packages%in% rownames(installed.packages())
if(any(installed_packages==FALSE)) {
install.packages(packages[!installed_packages],dependencies=TRUE)
BiocManager::install(packages[!installed_bioc_packages], dependencies=TRUE)
}
HINWEIS: In diesem Berechnungsprotokoll werden Befehle entweder als R-Notebook-Dateien (Dateien mit der Erweiterung " angegeben. Rmd"), R-Codedateien (Dateien mit der Erweiterung ". R") oder Linux Bash Shell-Skripte (Dateien mit der Erweiterung ".sh"). R-Notebook-Dateien (Rmd) sollten in RStudio mit Datei| Öffnen Sie Datei..., und einzelne Codeblöcke (die R-Befehle oder Bash-Shell-Befehle sein können) werden dann interaktiv ausgeführt, indem Sie auf den grünen Pfeil oben rechts klicken. R-Code-Dateien können durch Öffnen in RStudio oder auf der Linux-Befehlszeile durch Voranstellen von "Rscript" ausgeführt werden, z.B. Rscript example.R. Shell-Skripte werden auf der Linux-Befehlszeile ausgeführt, indem dem Skript der Befehl "sh" vorangestellt wird.sh example.sh.
2. Alternative Spleißanalyse (AS) mittels RNA-seq
- Herunterladen und Vorverarbeiten von Daten
HINWEIS: Die unten kommentierten Codeausschnitte sind in der ergänzenden Codedatei "AS_analysis_RNASeq.Rmd", um die einzelnen Schritte interaktiv zu befolgen, und werden auch als Bash-Skript bereitgestellt, das im Batch auf der Linux-Befehlszeile ausgeführt werden kann (sh downloading_data_preprocessing.sh).- Herunterladen der Rohdaten.
- Laden Sie die Rohdaten aus dem Sequence Read Archive (SRA) mit dem Befehl 'prefetch' aus dem SRA-Toolkit (v2.10.8)17 herunter. Geben Sie die SRA-Zugangs-IDs im folgenden Befehl nacheinander an, um sie parallel mit dem GNU Parallel-Dienstprogramm18 herunterzuladen. Um SRA-Dateien der Beitritts-IDs von SRR10261601 auf SRR10261606 parallel herunterzuladen, verwenden Sie die folgenden Schritte in der Linux-Befehlszeile.
seq 10261601 10261606 | parallel prefetch SRR{} - Extrahieren Sie die fastq-Dateien aus dem Archiv mit der Funktion 'fastq-dump' aus dem SRA-Toolkit. Verwenden Sie GNU parallel und geben Sie die Namen aller SRA-Dateien zusammen an.
parallel -j 3 fastq-dump --gzip --skip-technical --read-filter pass --dumpbase --split-e --clip --origfmt {} ::: - Laden Sie das Referenzgenom und die Anmerkungen für Maus (Genomassembly GRCm39) von www.ensembl.org herunter, indem Sie die folgenden Schritte in der Linux-Befehlszeile verwenden.
wget -nv -O annotation.gtf.gz http://ftp.ensembl.org/pub/release-103/gtf/mus_musculus/Mus_musculus.GRCm39.103.gtf.gz \ && gunzip -f annotation.gtf.gz
wget -nv -O genome.fa.gz http://ftp.ensembl.org/pub/release-103/fasta/mus_musculus/dna/Mus_musculus.GRCm39.dna.primary_assembly.fa.gz \ && gunzip -f genome.fa.gz
GTF=$(readlink -f annotation.gtf)
GENOME=$(readlink -f genome.fa)
- Laden Sie die Rohdaten aus dem Sequence Read Archive (SRA) mit dem Befehl 'prefetch' aus dem SRA-Toolkit (v2.10.8)17 herunter. Geben Sie die SRA-Zugangs-IDs im folgenden Befehl nacheinander an, um sie parallel mit dem GNU Parallel-Dienstprogramm18 herunterzuladen. Um SRA-Dateien der Beitritts-IDs von SRR10261601 auf SRR10261606 parallel herunterzuladen, verwenden Sie die folgenden Schritte in der Linux-Befehlszeile.
- Vorverarbeitung und Zuordnung von Lesevorgängen zur Genomassemblierung
- Qualitätskontrolle. Bewerten Sie die Qualität von Rohlesevorgängen mit FASTQC (FASTQ Quality Check v0.11.9)19. Erstellen Sie einen Ausgabeordner und führen Sie fastqc parallel auf mehreren Eingabe-Fasta-Dateien aus. In diesem Schritt wird für jede Probe ein Qualitätsbericht erstellt. Überprüfen Sie die Berichte, um sicherzustellen, dass die Qualität der Lesevorgänge akzeptabel ist, bevor Sie weitere Analysen durchführen. (Informationen zu den Berichten finden Sie im Benutzerhandbuch unter https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)
mkdir fastqc_out
parallel "fastqc {} -o fastqc_out" ::: $RAW_DATA/*.fastq.gz
HINWEIS: Führen Sie bei Bedarf ein Adaptertrimmen mit 'cutadapt'20 oder 'trimmomatic'21 durch, um die Sequenzierung in flankierende Adapter zu entfernen, die je nach RNA-Fragmentgröße und Leselänge variiert. In dieser Analyse haben wir diesen Schritt übersprungen, da der Anteil der betroffenen Lesevorgänge minimal war. - Leseausrichtung. Der nächste Schritt in der Vorverarbeitung umfasst die Zuordnung der Lesevorgänge zum Referenzgenom. Erstellen Sie zunächst den Index für das Referenzgenom mit der Funktion "genomeGenerate" von STAR22 und richten Sie dann die Rohlesevorgänge an der Referenz aus (alternativ sind vorgefertigte Indizes auf der STAR-Website verfügbar und können direkt für die Ausrichtung verwendet werden). Führen Sie die folgenden Befehle in der Linux-Befehlszeile aus.
#Build STAR index
GDIR=STAR_indices
mkdir $GDIR
STAR --runMode genomeGenerate --genomeFastaFiles $GENOME --sjdbGTFfile $GTF --runThreadN 8 --genomeDir $GDIR
ODIR=results/mapping
mkdir -p $ODIR
#Align reads to the genome
for fq1 in $RAW_DATA/*R1.fastq.gz;
do
fq2=$(echo $fq1| sed 's/1.fastq.gz/2.fastq.gz/g');
OUTPUT=$(basename ${fq1}| sed 's/R1.fastq.gz//g');
STAR --genomeDir $GDIR \
--runThreadN 12 \
--readFilesCommand zcat \
--readFilesIn ${fq1}${fq2}\
--outFileNamePrefix $ODIR\/${OUTPUT} \
--outSAMtype BAM SortedByCoordinate \
--outSAMunmapped Within \
--outSAMattributes Standard
Done
HINWEIS: Der STAR Aligner generiert und sortiert BAM-Dateien (Binary Alignment Map) für jedes Sample nach dem Leseausrichtung. BAM-Dateien müssen sortiert werden, bevor Sie mit weiteren Schritten fortfahren.
- Qualitätskontrolle. Bewerten Sie die Qualität von Rohlesevorgängen mit FASTQC (FASTQ Quality Check v0.11.9)19. Erstellen Sie einen Ausgabeordner und führen Sie fastqc parallel auf mehreren Eingabe-Fasta-Dateien aus. In diesem Schritt wird für jede Probe ein Qualitätsbericht erstellt. Überprüfen Sie die Berichte, um sicherzustellen, dass die Qualität der Lesevorgänge akzeptabel ist, bevor Sie weitere Analysen durchführen. (Informationen zu den Berichten finden Sie im Benutzerhandbuch unter https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)
- Herunterladen der Rohdaten.
- Vorbereiten von Exon-Anmerkungen.
- Führen Sie die ergänzende Codedatei "prepare_mm_exon_annotation. R" mit der heruntergeladenen Annotation im GTF-Format (Gene transfer format), um die Annotationen vorzubereiten. Geben Sie zum Ausführen Folgendes in die Linux-Befehlszeile ein.
Rscript prepare_mm_exon_annotation.R annotation.gtf
HINWEIS: Die GTF-Datei enthält mehrere Exon-Einträge für verschiedene Isoformen. Diese Datei wird verwendet, um die mehreren Transkript-IDs für jedes Exon zu "reduzieren". Es ist ein wichtiger Schritt, Exon-Zählbehälter zu definieren.
- Führen Sie die ergänzende Codedatei "prepare_mm_exon_annotation. R" mit der heruntergeladenen Annotation im GTF-Format (Gene transfer format), um die Annotationen vorzubereiten. Geben Sie zum Ausführen Folgendes in die Linux-Befehlszeile ein.
- Lesevorgänge zählen. Der nächste Schritt besteht darin, die Anzahl der Lesevorgänge zu zählen, die verschiedenen Transkripten / Exons zugeordnet sind. Siehe Zusatzdatei: "AS_analysis_RNASeq.Rmd".
- Erforderliche Bibliotheken laden:
packages<- c("Rsubread","tidyverse", "magrittr", "EnhancedVolcano", "edgeR","openxlsx")
invisible(lapply(packages, library, character.only=TRUE)) - Laden Sie die verarbeitete Anmerkungsdatei, die Sie aus dem vorherigen Schritt (2.2) erhalten haben.
load("mm_exon_anno.RData") - Lesen Sie alle in Schritt 2.2.2 erhaltenen BAM-Dateien als Eingabe für 'featureCounts', um Lesevorgänge zu zählen. Lesen Sie den Ordner, der die BAM-Dateien enthält, indem Sie zuerst jede Datei aus dem Verzeichnis auflisten, das mit .bam endet. Verwenden Sie 'featureCounts' aus dem Rsubread-Paket, das bam-Dateien und verarbeitete GTF-Anmerkungen (Referenz) als Eingabe verwendet, um eine Matrix von Zählungen zu generieren, die jedem Feature zugeordnet sind, mit Zeilen, die Exons (Features) und Spalten darstellen, die Beispiele darstellen.
countData <- dir("bams", pattern=".bam$", full.names=T) %>%
featureCounts(annot.ext=anno,
isGTFAnnotationFile=FALSE,
minMQS=0,useMetaFeatures=FALSE,
allowMultiOverlap=TRUE,
largestOverlap=TRUE,
countMultiMappingReads=FALSE,
primaryOnly=TRUE,
isPairedEnd=TRUE,
nthreads=12) - Führen Sie als Nächstes eine unspezifische Filterung durch, um schwach exprimierte Exons zu entfernen ("unspezifisch" zeigt an, dass die experimentellen Zustandsinformationen nicht in der Filterung verwendet werden, um Selektionsverzerrungen zu vermeiden). Transformieren Sie die Daten von der Rohskala in Counts per Million (cpm) mit der cpm-Funktion aus dem Paket 'edgeR'23 und halten Sie Exons mit Zählungen über einem einstellbaren Schwellenwert (für diesen Datensatz wird ein cpm verwendet) in mindestens drei Stichproben. Entfernen Sie auch Gene mit nur einem Exon.
# Non-specific filtering: Remove the exons with low counts
isexpr<- rownames(countData$counts)[rowSums(cpm(countData$counts)>1) >=3]
countData$counts<-countData$counts[rownames(countData$counts) %in%isexpr, ]
anno<-anno%>% filter(GeneID%in% rownames(countData$counts))
# Remove genes with only 1 site and NA in geneIDs
dn<-anno%>%group_by(GeneID)%>%summarise(nsites=n())%>% filter(nsites>1&!is.na(GeneID))
anno<-anno%>% filter(GeneID%in%dn$GeneID)
countData$counts<-countData$counts[rownames(countData$counts) %in%anno$GeneID, ]
HINWEIS: Überprüfen Sie die erforderlichen Parameter für featureCounts, wenn Sie andere Daten verwenden, z. B. für Single-End-Lesevorgänge, setzen Sie 'isPairedEnd = FALSE'. Lesen Sie das RSubread-Benutzerhandbuch, um die Optionen für Ihre Daten auszuwählen, und lesen Sie den Abschnitt Diskussion unten.
- Erforderliche Bibliotheken laden:
- Differentielles Spleißen und Exon-Nutzungsanalyse. Wir beschreiben zwei Alternativen für diesen Schritt: DEXSeq und DiffSplice. Beide können verwendet werden und ähnliche Ergebnisse liefern. Wählen Sie aus Gründen der Konsistenz DEXSeq aus, wenn Sie ein DESeq2-Paket für DGE bevorzugen, und verwenden Sie DiffSplice für eine Limma-basierte DGE-Analyse. Siehe Zusatzdatei: "AS_analysis_RNASeq.Rmd".
- Verwendung des DEXSeq-Pakets für die differentielle Exon-Analyse.
- Laden Sie die Bibliothek und erstellen Sie eine Beispieltabelle, um den Versuchsentwurf zu definieren.
library(DEXSeq)
sampleTable<-data.frame(row.names= c("Mbnl1KO_Thymus_1", "Mbnl1KO_Thymus_2", "Mbnl1KO_Thymus_3", "WT_Thymus_1", "WT_Thymus_2", "WT_Thymus_3"), condition= rep(c("Mbnl1_KO", "WT"),c(3,3)), libType= rep(c("paired-end")))
Hinweis: Die Zeilennamen sollten mit den BAM-Dateinamen übereinstimmen, die von featureCounts zum Zählen der Lesevorgänge verwendet werden. sampleTable besteht aus Details jedes Beispiels, darunter: Bibliothekstyp und -bedingung. Dies ist erforderlich, um die Kontraste oder die Testgruppe zum Erkennen der differentiellen Verwendung zu definieren. - Bereiten Sie die Exon-Informationsdatei vor. Exon-Informationen in Form von GRanges (genomic ranges) Objekten (https://bioconductor.org/packages/release/bioc/html/GenomicRanges.html) werden als Eingabe benötigt, um das DEXSeq-Objekt im nächsten Schritt zu erstellen. Ordnen Sie die Gen-IDs den Lesezahlen zu, um das exoninfo-Objekt zu erstellen.
exoninfo<-anno[anno$GeneID%in% rownames(countData$counts),]
exoninfo<-GRanges(seqnames=anno$Chr,
ranges=IRanges(start=anno$Start, end=anno$End, width=anno$Width),strand=Rle(anno$Strand))
mcols(exoninfo)$TranscriptIDs<-anno$TranscriptIDs
mcols(exoninfo)$Ticker<-anno$Ticker
mcols(exoninfo)$ExonID<-anno$ExonID
mcols(exoninfo)$n<-anno$n
mcols(exoninfo)$GeneID<-anno$GeneID
transcripts_l= strsplit(exoninfo$TranscriptIDs, "\\,")
save(countData, sampleTable, exoninfo, transcripts_l, file="AS_countdata.RData") - Erstellen Sie das DEXSeq-Objekt mithilfe der DEXSeqDataSet-Funktion. Das DEXSeq-Objekt sammelt Leseanzahl, Exon-Feature-Informationen und Beispielinformationen. Verwenden Sie die in Schritt 3 generierten Lesezähler und die Exon-Informationen aus dem vorherigen Schritt, um das DEXSeq-Objekt aus der Zählmatrix zu erstellen. Das sampleData-Argument verwendet eine Datenrahmeneingabe, die die Beispiele (und ihre Attribute: Bibliothekstyp und -bedingung) definiert, 'design' verwendet sampleData, um eine Entwurfsmatrix für den differentiellen Test unter Verwendung der Modellformelnotation zu generieren. Beachten Sie, dass ein signifikanter Interaktionsterm, condition:exon, angibt, dass der Anteil der Reads über ein Gen, das auf ein bestimmtes Exon fällt, von der experimentellen Bedingung abhängt, dh es gibt AS. Eine vollständige Beschreibung des Festlegens der Modellformel für komplexere Versuchspläne finden Sie in der DEXSeq-Dokumentation. Für Merkmalsinformationen sind Exon-IDs, entsprechende Gene und Transkripte erforderlich.
dxd<-DEXSeqDataSet(countData$counts,sampleData=sampleTable, design=~sample+exon+condition:exon,featureID=exoninfo$ExonID,groupID=exoninfo$GeneID,featureRanges=exoninfo, transcripts=transcripts_l) - Normalisierung und Dispersionsschätzung. Führen Sie als Nächstes eine Normalisierung zwischen den Proben durch und schätzen Sie die Varianz der Daten aufgrund des Poisson-Zählrauschens aufgrund der diskreten Natur der RNA-seq und der biologischen Variabilität mit den folgenden Befehlen.
dxd %<>% estimateSizeFactors %>% estimateDispersions %T>% plotDispEsts - Testen Sie auf unterschiedliche Nutzung. Nach der Abschätzung der Variation testen Sie die differentielle Exon-Nutzung für jedes Gen und generieren die Ergebnisse.
dxd%<>%testForDEU%>%estimateExonFoldChanges(fitExpToVar=
"condition")#Estimate fold changes
dxr=DEXSeqResults(dxd) - Visualisieren Sie Spleißereignisse für ausgewählte Gene mit dem folgenden Befehl.
plotDEXSeq(dxr,"Wnk1", displayTranscripts=TRUE, splicing=TRUE,legend
=TRUE,cex.axis=1.2,cex=1.3,lwd=2)
Untersuchen Sie die R-Notebook-Datei "AS_analysis_RNASeq.Rmd", um zusätzliche Diagramme für Gene von Interesse zu generieren und Vulkandiagramme mit unterschiedlichen Schwellenwerten zu generieren.
- Laden Sie die Bibliothek und erstellen Sie eine Beispieltabelle, um den Versuchsentwurf zu definieren.
- Verwendung von diffSplice von Limma zur Identifizierung von differentiellem Spleißen. Folgen Sie der R-Notebook-Datei "AS_analysis_RNASeq.Rmd". Stellen Sie sicher, dass die Schritte 2.1-2.3 befolgt wurden, um Eingabedateien vorzubereiten, bevor Sie fortfahren.
- Bibliotheken laden
library(limma)
library(edgeR) - Unspezifische Filterung. Extrahieren Sie die Matrix der Lesezähler, die in 2.3 erhalten wurden. Erstellen Sie eine Liste von Features mit der Funktion 'DGEList' aus dem edgeR-Paket, wobei Zeilen Gene und Spalten Proben darstellen.
mycounts=countData$counts
#Change the rownames of the countdata to exon Ids instead of genes for unique rownames.
rownames(mycounts) = exoninfo$ExonID
dge<-DGEList(counts=mycounts)
#Filtering
isexpr<- rowSums(cpm(dge)>1) >=3
dge<-dge[isexpr,,keep.lib.sizes=FALSE]
#Extract the exon annotations for only transcripts meeting non-specific filter
exoninfo=anno%>% filter(ExonID%in% rownames(dge$counts))
#Convert the exoninfo into GRanges object
exoninfo1<-GRanges(seqnames=exoninfo$Chr,
ranges=IRanges(start=exoninfo$Start, end=exoninfo$End, width=exoninfo$Width),strand=Rle(exoninfo$Strand))
mcols(exoninfo1)$TranscriptIDs<-exoninfo$TranscriptIDs
mcols(exoninfo1)$Ticker<-exoninfo$Ticker
mcols(exoninfo1)$ExonID<-exoninfo$ExonID
mcols(exoninfo1)$n<-exoninfo$n
mcols(exoninfo1)$GeneID<-exoninfo$GeneID
transcripts_l= strsplit(exoninfo1$TranscriptIDs, "\\,")
HINWEIS: Als unspezifischer Filterschritt werden die Zählungen nach cpm < 1 in x aus n Stichproben gefiltert, wobei x die minimale Anzahl von Replikaten in einer beliebigen Bedingung ist. n = 6 und x = 3 für diese Beispieldaten. - Normalisieren Sie die Anzahl über Stichproben hinweg, mit der Funktion 'calcNormFactors' aus dem Paket 'edgeR' unter Verwendung des getrimmten Mittelwerts von M-Werten (TMM-Normalisierungsmethode)24 Es werden Skalierungsfaktoren berechnet, um Bibliotheksgrößen anzupassen.
dge<-calcNormFactors(dge) - Verwenden Sie sampleTable wie in Schritt 2.4.1.1 generiert, und erstellen Sie die Designmatrix. Die Designmatrix prägt das Design. Weitere Informationen zu Designmatrizen für fortgeschrittenere experimentelle Designs finden Sie im Limma User Guide (https://www.bioconductor.org/packages/devel/bioc/vignettes/limma/inst/doc/usersguide.pdf) Kapitel 8 & 9.
Treat<- factor(sampleTable$condition)
design<- model.matrix(~0+Treat)
colnames(design) <- levels(Treat) - Passen Sie ein lineares Modell pro Exon an. Führen Sie die 'voom'-Funktion des 'limma'-Pakets aus, um RNA-seq-Daten zu verarbeiten, um die Varianz zu schätzen und Präzisionsgewichte zur Korrektur des Poisson-Zählrauschens zu generieren, und transformieren Sie die Exon-Level-Zählungen in log2-counts per million (logCPM). Führen Sie dann eine lineare Modellierung mit der Funktion 'lmfit' aus, um lineare Modelle an die Ausdrucksdaten für jedes Exon anzupassen. Berechnen Sie empirische Bayes-Statistiken für das angepasste Modell mit der Funktion 'eBayes', um differentielle Exon-Expressionen zu erkennen. Als nächstes definieren Sie eine Kontrastmatrix für die experimentellen Vergleiche von Interesse. Verwenden Sie 'contrasts.fit', um Koeffizienten und Standardfehler für jedes Vergleichspaar zu erhalten.
v<-voom(dge,design,plot=FALSE)
fit<-lmFit(v,design)
fit<-eBayes(fit)
colnames(fit)
cont.matrix<-makeContrasts(
Mbnl1_KO_WT=Mbnl1_KO-WT,
levels=design)
fit2<-contrasts.fit(fit,cont.matrix) - Differentielle Spleißanalyse. Führen Sie 'diffSplice' auf dem angepassten Modell aus, um die Unterschiede in der Exon-Nutzung von Genen zwischen Wildtyp und Knockout zu testen und die Top-Ranking-Ergebnisse mit der 'topSplice'-Funktion zu untersuchen: test="t" ergibt eine Rangfolge von AS-Exons, test="simes" gibt eine Rangfolge von Genen.
ex<-diffSplice(fit2,geneid=exoninfo$GeneID,exonid=exoninfo$ExonID)
ts<-topSplice(ex,n=Inf,FDR=0.1, test="t", sort.by="logFC")
tg<-topSplice(ex,n=Inf,FDR=0.1, test="simes") - Visualisierung. Zeichnen Sie die Ergebnisse mit der Funktion 'plotSplice', wodurch das Gen von Interesse im Genid-Argument entsteht. Speichern Sie die Top-Ergebnisse sortiert nach Log Fold in ein Objekt und generieren Sie ein Vulkandiagramm, um die Exons auszustellen.
plotSplice(ex,geneid="Wnk1", FDR=0.1)
#Volcano plot
EnhancedVolcano(ts,lab=ts$ExonID,selectLab= head((ts$ExonID),2000), xlab= bquote(~Log[2]~'fold change'), x='logFC', y='P.Value', title='Volcano Plot', subtitle='Mbnl1_KO vs WT (Limma_diffSplice)', FCcutoff=2, labSize=4,legendPosition="right", caption= bquote(~Log[2]~"Fold change cutoff, 2; FDR 10%"))
- Bibliotheken laden
- Verwendung von rMATS
- Stellen Sie sicher, dass die neueste Version von rMATS v4.1.1 (aufgrund der reduzierten Verarbeitungszeit und des geringeren Speicherbedarfs auch als rMATS turbo bezeichnet) entweder mit conda oder github (https://github.com/Xinglab/rmats-turbo/releases/download/v4.1.1/rmats_turbo_v4_1_1.tar.gz) im Arbeitsverzeichnis installiert ist. Folgen Sie Abschnitt 4.3 in "AS_analysis_RNASeq.Rmd".
- Wechseln Sie zu dem Ordner, der die BAM-Dateien enthält, die nach dem Mapping abgerufen wurden, und bereiten Sie Textdateien, wie von rMATES gefordert, für die beiden Bedingungen vor, indem Sie den Namen der BAM-Dateien (zusammen mit dem Pfad) getrennt durch ',' kopieren. Die folgenden Befehle sollten in der Linux-Befehlszeile ausgeführt werden:
mkdir rMATS_analysis
cd bams/
ls -pd "$PWD"/*| grep "WT"| tr '\n'','> Wt.txt
ls -pd "$PWD"/*| grep "Mb"| tr '\n'','> KO.txt
mv *.txt ../rMATS_analysis - Führen Sie rmats.py mit den beiden im vorherigen Schritt generierten Eingabedateien zusammen mit der in 2.1.1.3 erhaltenen GTF-Datei aus. Dadurch wird ein Ausgabeordner 'rmats_out' generiert, der Textdateien enthält, die Statistiken (p-Werte und Einschlussstufen) für jedes Spleißereignis separat beschreiben.
python rmats-turbo/rmats.py --b1 KO.txt --b2 Wt.txt --gtf annotation.gtf -t paired --readLength 50 --nthread 8 --od rmats_out/ --tmp rmats_tmp --task pos
HINWEIS: Die Referenzanmerkung in Form einer GTF-Datei ist ebenfalls erforderlich. Überprüfen Sie die Parameter, wenn die Daten Single-End sind, und ändern Sie die Option -t entsprechend. - Untersuchen von rMATS-Ergebnissen. Verwenden Sie das Bioconductor-Paket 'maser'25 , um die rMATS-Ergebnisse zu untersuchen. Laden Sie die JCEC-Textdateien (Junction and Exon Counts) in das Maser-Objekt und filtern Sie das Ergebnis basierend auf der Abdeckung, indem Sie mindestens fünf durchschnittliche Lesevorgänge pro Spleißereignis einbeziehen.
library(maser)
mbnl1<-maser("/rmats_out/", c("WT","Mbnl1_KO"), ftype="JCEC")
#Filtering out events by coverage
mbnl1_filt<-filterByCoverage(mbnl1,avg_reads=5) - Visualisierung von rMATS-Ergebnissen. Wählen Sie die signifikanten Spleißereignisse mit der False Discovery Rate (FDR) 10% und der minimalen Änderung von 10% in Percent Spliced In (deltaPSI) mit der Funktion 'topEvents' aus dem Paket 'maser' aus. Als nächstes überprüfen Sie die Genereignisse für einzelne Gene von Interesse (Probengen-Wnk1) und zeichnen PSI-Werte für jedes Spleißereignis dieses Gens. Generieren Sie ein Vulkandiagramm, indem Sie den Ereignistyp angeben.
#Top splicing events at 10% FDR
mbnl1_top<-topEvents(mbnl1_filt,fdr=0.1, deltaPSI=0.1)
mbnl1_top
#Check the gene events for a particular gene
mbnl1_wnk1<-geneEvents(mbnl1_filt,geneS="Wnk1", fdr=0.1, deltaPSI=0.1)
maser::display(mbnl1_wnk1,"SE")
plotGenePSI(mbnl1_wnk1,type="SE", show_replicates
=TRUE)
volcano(mbnl1_filt,fdr=0.1, deltaPSI=0.1,type="SE")
+xlab("deltaPSI")+ylab("Log10 Adj. Pvalue")+ggtitle("Volcano Plot of exon skipping events") - Generieren Sie Sashimi-Plots für das mit rMATS erhaltene Spleißereignisergebnis in Form von Textdateien mit dem Paket 'rmats2shahimiplot'. Führen Sie das Python-Skript über die Linux-Befehlszeile aus.
python ./src/rmats2sashimiplot/rmats2sashimiplot.py --b1 ../bams/WT_Thymus_1.bam,../bams/WT_Thymus_2.bam,../bams/WT_Thymus_3.bam --b2 ../bams/Mbnl1KO_Thymus_1.bam,../bams/Mbnl1KO_Thymus_2.bam,../bams/Mbnl1KO_Thymus_3.bam -t SE -e ../rMATS_analysis/rmats_out/SE.MATS.JC.txt --l1 WT --l2 Mbnl1_KO --exon_s 1 --intron_s 5 -o ../rMATS_analysis/rmats2shasmi_output
HINWEIS: Dieser Prozess kann zeitaufwändig sein, da er das Sashimi-Diagramm für alle Ergebnisse in der Ereignisdatei generiert. Wählen Sie die Top-Ergebnisse (Gennamen und Exons), wie sie von der topEvents-Funktion aus 'maser' angezeigt werden, und visualisieren Sie das entsprechende Sashimi-Diagramm.
- Verwendung des DEXSeq-Pakets für die differentielle Exon-Analyse.
3. Alternative Polyadenylierung (APA) Analyse mittels 3'-Endsequenzierung
- Herunterladen und Vorverarbeiten von Daten
HINWEIS: Weitere Informationen finden Sie in der ergänzenden R-Notebook-Datei "APA_analysis_3PSeq_notebook. Rmd" für die vollständigen Befehle zum Herunterladen und Vorverarbeiten von Daten oder führen Sie die ergänzende Bash-Datei "APA_data_downloading_preprocessing.sh" auf der Linux-Befehlszeile aus.- Laden Sie Daten von SRA mit den Beitritts-IDs (1553129 bis 1553136) herunter.
- Trimmadapter und umgekehrtes Komplement, um die Sensorstrangsequenz zu erhalten.
HINWEIS: Dieser Schritt ist spezifisch für den verwendeten PolyA-seq-Assay. - Die Karte liest die Genomassemblierung der Maus mit dem Bowtie Aligner26.
- Vorbereiten von pA-Site-Anmerkungen.
HINWEIS: Die Verarbeitung der pA-Site-Annotationsdatei erfolgt zunächst unter Verwendung der ergänzenden R-Notebook-Datei "APA_analysis_3PSeq_notebook. Rmd" (2.1 - 2.6) und dann die Bash-Datei "APA_annotation_preparation.sh".- Laden Sie die pA-Site-Anmerkungen aus der PolyASite 2.0-Datenbankherunter 6.
- Wählen Sie pA-Site-Annotationen aus, um 3'-untranslatierte Region (UTR)-pA-Sites beizubehalten, die als Terminal Exon (TE) oder 1000 nt stromabwärts eines annotierten Terminal-Exons (DS) für die Downstream-Analyse annotiert sind.
- Ermitteln Sie pA-Site-Peaks. Ankern Sie an jeder pA-Spaltstelle und visualisieren Sie die durchschnittliche Leseabdeckung mit Bettwerkzeugen und Deeptools27,28. Die Ergebnisse zeigten, dass die Peaks der kartierten Lesevorgänge hauptsächlich innerhalb von ~60 bp stromaufwärts der Spaltstellen verteilt waren (Abbildung 5 und ergänzende Abbildung 5). Daher wurden die Koordinaten von pA-Standorten aus der Annotationsdatei auf 60 bp stromaufwärts ihrer Spaltstellen erweitert. Abhängig vom verwendeten spezifischen 3'-Endsequenzierungsprotokoll muss dieser Schritt für andere Assays als PolyA-seq optimiert werden.
- Zählen von Lesevorgängen
- Bereiten Sie die Anmerkungsdatei für pA-Sites vor.
anno<- read.table(file= "flanking60added.pA_annotation.bed",
stringsAsFactors=FALSE, check.names=FALSE, header=FALSE, sep="")
colnames(anno) <- c("chrom", "chromStart", "chromEnd", "name", "score", "strand", "rep", "annotation", "gene_name", "gene_id")
anno<- dplyr::select(anno,name,chrom, chromStart,chromEnd, strand,gene_id,gene_name,rep)
colnames(anno) <- c("GeneID", "Chr", "Start", "End", "Strand", "Ensembl", "Symbol", "repID") - Wenden Sie 'featureCounts' an, um Rohzählungen zu erfassen. Speichern Sie die Zähltabelle als RData-Datei "APA_countData.Rdata" für die APA-Analyse mit verschiedenen Tools.
countData<- dir("bamfiles", pattern="sorted.bam$", full.names=TRUE) %>%
# Read all bam files as input for featureCounts
featureCounts(annot.ext=anno, isGTFAnnotationFile= FALSE,minMQS=0,useMetaFeatures= TRUE,allowMultiOverlap=TRUE, largestOverlap= TRUE,strandSpecific=1, countMultiMappingReads =TRUE,primaryOnly= TRUE,isPairedEnd= FALSE,nthreads=12)%T>%
save(file="APA_countData.Rdata")
HINWEIS: Achten Sie darauf, einen der in der Funktion "featureCounts" aufgeführten Parameter zu ändern. Modifizieren Sie den Parameter 'strandSpecific', um sicherzustellen, dass er mit der Sequenzierungsrichtung des verwendeten 3'-Endsequenzierungsassays übereinstimmt (empirisch wird dies durch die Visualisierung der Daten in einem Genombrowser über Gene auf Plus- und Minussträngen verdeutlicht). - Wenden Sie eine unspezifische Filterung von countData an. Die Filterung kann die statistische Robustheit in differentiellen pA-Site-Nutzungstests erheblich verbessern. Zuerst entfernten wir jene Gene mit nur einer pA-Site, auf der die differentielle pA-Site-Nutzung nicht definiert werden kann. Zweitens wenden wir eine unspezifische Filterung basierend auf der Abdeckung an: Die Anzahl wird nach cpm gefiltert, die kleiner als 1 in x aus n Stichproben ist, wobei x die minimale Anzahl von Replikaten unter jeder Bedingung ist. N = 8 und x = 2 für diese Beispieldaten.
load(file= "APA_countData.Rdata")# Skip this step if already loaded
# Non-specific filtering: Remove the pA sites not differentially expressed in the samples
countData<-countData$counts%>%as.data.frame%>% .[rowSums(edgeR::cpm(.)>1) >=2, ]
anno%<>% .[.$GeneID%in% rownames(countData), ]
# Remove genes with only 1 site and NA in geneIDs
dnsites<-anno%>%group_by(Symbol)%>%summarise(nsites=n())%>% filter(nsites>1&!is.na(Symbol))
anno<-anno%>% filter(Symbol%in%dnsites$Symbol)
countData<-countData[rownames(countData) %in%anno$GeneID, ]
- Bereiten Sie die Anmerkungsdatei für pA-Sites vor.
- Nutzungsanalyse der differentiellen Polyadenylierungsstelle mit DEXSeq- und diffSplice-Pipelines.
- Verwenden des DEXSeq-Pakets
HINWEIS: Da für die DEXSeq-Pipeline keine Kontrastmatrix definiert werden kann, muss die differentielle APA-Analyse von jeweils zwei experimentellen Bedingungen separat durchgeführt werden. Die differentielle APA-Analyse der Bedingung WT und der Bedingung DKO wird beispielhaft zur Erläuterung des Verfahrens durchgeführt. Siehe ergänzende Datei "APA_analysis_3PSeq_notebook. Rmd" für den Schritt-für-Schritt-Workflow dieses Abschnitts und die differentielle APA-Analyse anderer Kontraste.- Laden Sie die Bibliothek und erstellen Sie eine Beispieltabelle, um den Versuchsentwurf zu definieren.
c("DEXSeq", "GenomicRanges") %>% lapply(library, character.only=TRUE) %>%invisible
sampleTable1<- data.frame(row.names= c("WT_1","WT_2","DKO_1","DKO_2"),
condition= c(rep("WT", 2), rep("DKO", 2)),
libType= rep("single-end", 4)) - Bereiten Sie die Informationsdatei für pA-Standorte mit dem Bioconductor-Paket GRanges vor.
# Prepare the GRanges object for DEXSeqDataSet object construction
PASinfo <- GRanges(seqnames = anno$Chr,
ranges = IRanges(start = anno$Start, end = anno$End),strand = Rle(anno$Strand))
mcols(PASinfo)$PASID<-anno$repID
mcols(PASinfo)$GeneEns<-anno$Ensembl
mcols(PASinfo)$GeneID<-anno$Symbol
# Prepare the new feature IDs, replace the strand information with letters to match the current pA site clusterID
new.featureID <- anno$Strand %>% as.character %>% replace(. %in% "+", "F") %>% replace(. %in% "-", "R") %>% paste0(as.character(anno$repID), .) - Verwenden Sie die in Schritt 3.3 generierten Lesezähler und die pA-Siteinformationen aus dem vorherigen Schritt, um das DEXSeq-Objekt zu erstellen.
# Select the read counts of the condition WT and DKO
countData1<- dplyr::select(countData, SRR1553129.sorted.bam, SRR1553130.sorted.bam, SRR1553131.sorted.bam, SRR1553132.sorted.bam)
# Rename the columns of countData using sample names in sampleTable
colnames(countData1) <- rownames(sampleTable1)
dxd1<-DEXSeqDataSet(countData=countData1,
sampleData=sampleTable1,
design=~sample+exon+condition:exon,
featureID=new.featureID,
groupID=anno$Symbol,
featureRanges=PASinfo) - Definieren Sie das Kontrastpaar, indem Sie die Ebenen der Bedingungen im DEXSeq-Objekt definieren.
dxd1$condition<- factor(dxd1$condition, levels= c("WT", "DKO"))
# The contrast pair will be "DKO - WT" - Normalisierung und Dispersionsschätzung. Ähnlich wie bei RNA-seq-Daten führen 3'-Endsequenzierungsdaten eine Normalisierung zwischen Proben (spaltenweiser Median der Verhältnisse für jede Probe) mit der Funktion "estimateSizeFactors" durch und schätzen die Variation der Daten mit der Funktion "estimateDispersions" und visualisieren dann das Ergebnis der Dispersionsschätzung mit der Funktion "plotDispEsts".
dxd1 %<>% estimateSizeFactors %>% estimateDispersions %T>% plotDispEsts - Differentielle pA-Site-Nutzungstests für jedes Gen mit der Funktion 'testForDEU', dann Schätzung der Faltenänderung der pA-Site-Nutzung mit der Funktion 'estimateExonFoldChanges'. Überprüfen Sie die Ergebnisse mit der Funktion 'DEXSeqResults' und legen Sie 'FDR < 10%' als Kriterium für signifikant differentielle pA-Standorte fest.
dxd1 %<>% testForDEU %>% estimateExonFoldChanges(fitExpToVar = "condition")
dxr1 <- DEXSeqResults(dxd1)
dxr1
mcols(dxr1)$description
table(dxr1$padj<0.1) # Check the number of differential pA sites (FDR < 0.1)
table(tapply(dxr1$padj<0.1, dxr1$groupID, any)) # Check the number of gene overlapped with differential pA site - Visualisierung der differentiellen pA-Site-Nutzungsergebnisse mit differentiellen APA-Diagrammen, die von der Funktion 'plotDEXSeq' und volcano plot von der Funktion 'EnhancedVolcano' generiert werden.
# Select the top 100 significant differential pA sites ranked by FDR
topdiff.PAS<- dxr1%>%as.data.frame%>%rownames_to_column%>%arrange(padj)%$%groupID[1:100]
# Apply plotDEXSeq for the visualization of differential polyA usage
plotDEXSeq(dxr1,"S100a7a", legend=TRUE, expression=FALSE,splicing=TRUE, cex.axis=1.2, cex=1.3,lwd=2)
# Apply perGeneQValue to check the top genes with differential polyA site usage
dxr1%<>% .[!is.na(.$padj), ]
dgene<- data.frame(perGeneQValue= perGeneQValue (dxr1)) %>%rownames_to_column("groupID")
dePAS_sig1<-dxr1%>% data.frame() %>%
dplyr::select(-matches("dispersion|stat|countData|genomicData"))%>%
inner_join(dgene)%>%arrange(perGeneQValue)%>%distinct()%>%
filter(padj<0.1)
# Apply EnhancedVolcano package to visualise differential polyA site usage
"EnhancedVolcano"%>% lapply(library, character.only=TRUE) %>%invisible
EnhancedVolcano(dePAS_sig1, lab=dePAS_sig1$groupID, x='log2fold_DKO_WT',
y='pvalue',title='Volcano Plot',subtitle='DKO vs WT',
FCcutoff=1,labSize=4, legendPosition="right",
caption= bquote(~Log[2]~"Fold change cutoff, 1; FDR 10%"))
- Laden Sie die Bibliothek und erstellen Sie eine Beispieltabelle, um den Versuchsentwurf zu definieren.
- Verwenden des diffSplice-Pakets. Weitere Informationen finden Sie in der ergänzenden R Notebook-Datei "APA_analysis_3PSeq_notebook. Rmd" für den schrittweisen Workflow dieses Abschnitts.
- Definieren Sie Kontraste, die für die Analyse der differentiellen pA-Nutzung von Interesse sind.
Hinweis: Dieser Schritt sollte nach der Konstruktion und Verarbeitung des DGEList-Objekts ausgeführt werden, das in der R-Notebook-Datei "APA_analysis_3PSeq_notebook. Rmd".contrast.matrix<-makeContrasts(DKO_vs_WT=DKO-
WT,Ctrl_vs_DKO=Ctrl-DKO,
KD_vs_Ctrl=KD-Ctrl,KD_vs_DKO=KD-DKO,levels=design)
fit2<-fit%>%contrasts.fit(contrast.matrix)%>%eBayes
summary(decideTests(fit2))
ex<-diffSplice(fit2,geneid=anno$Symbol,exonid=new.featureID)
topSplice(ex) #Check the top significant results with topSplice - Visualisieren Sie das Ergebnis von Kontrasten von Interesse (hier "DKO - WT") mit differentiellen APA-Diagrammen mit der Funktion 'plotSplice' und Vulkandiagrammen mit der Funktion 'EnhancedVolcano'. Weitere Informationen finden Sie in der R-Notebook-Datei "APA_analysis_3PSeq_notebook. Rmd" 4.2.7 - 4.2.9 zur Visualisierung anderer Kontrastpaare.
sig1<-topSplice(ex,n=Inf,FDR=0.1,coef=1, test="t", sort.by="logFC")
sig1.genes<-topSplice(ex,n=Inf,FDR=0.1,coef=1, test="simes")
plotSplice(ex, coef=1,geneid="S100a7a", FDR = 0.1)
plotSplice(ex,coef=1,geneid="Tpm1", FDR = 0.1)
plotSplice(ex,coef=1,geneid="Smc6", FDR = 0.1)
EnhancedVolcano(sig1, lab=sig1$GeneID,xlab= bquote(~Log[2]~'fold change'),
x='logFC', y='P.Value', title='Volcano Plot', subtitle='DKO vs WT',
FCcutoff=1, labSize=6, legendPosition="right")
- Definieren Sie Kontraste, die für die Analyse der differentiellen pA-Nutzung von Interesse sind.
- Verwenden des DEXSeq-Pakets
Ergebnisse
Nach dem Ausführen des obigen Schritt-für-Schritt-Workflows werden die AS- und APA-Analyseausgaben und repräsentativen Ergebnisse in Form von Tabellen und Datendiagrammen erstellt, die wie folgt generiert werden.
WIE:
Die Hauptergebnisse der AS-Analyse (Zusatztabelle 1 für diffSplice; Tabelle 2 für DEXSeq) ist eine Liste von Exons, die eine unterschiedliche Nutzung über Bedingungen hinweg zeigen, und eine Liste von Genen, die eine signifikante Gesamtspleißaktivität eines oder mehrerer seiner konstituierenden Exons aufweisen, geordnet nach statistischer Signifikanz. Ergänzende Tabelle 1, Registerkarte 2 zeigt signifikante Exons, wobei Spalten den differentiellen FC von Exon versus Rest, den unbereinigten p-Wert pro Exon und den bereinigten p-Wert (Benjamini-Hockberg-Korrektur) zeigen. Der Schwellenwert für die angepassten p-Werte ergibt eine Reihe von Exons mit definiertem FDR. Ergänzende Tabelle 1, Registerkarte 3 zeigt eine Rangliste von Genen, die die Signifikanz der gesamten Spleißaktivität zeigt, mit einer Spalte mit dem angepassten p-Wert auf Genebene, der mit der Simes-Methode berechnet wurde. Ähnliche Daten sind in Tabelle 2 für DEXSeq dargestellt. Die ergänzende Abbildung 1 und die ergänzende Abbildung 2 zeigen ein differentielles Spleißmuster in den Genen Mbnl1, Tcf7 und Lef1, die in dem veröffentlichten Artikel mit den Daten15 experimentell validiert wurden. Die Autoren haben eine experimentelle Validierung von fünf Genen gezeigt - Mbnl1, Mbnl2, Lef1, Tcf7 und Ncor2. Unser Ansatz erkannte differentielle Spleißmuster in all diesen Genen. Hier präsentieren wir die FDR-Spiegel für jedes Gen unter Verwendung von DEXSeq, diffSplice und rMATS, wie sie in den Zusatztabellen 1-3 erhalten wurden: Mbnl1 (0, 6.6E-61 ,0), Mbnl2 (0,0.18,0), Lef1 (1.4E-10, 1.3E-04, 0), Tcf7 (0, 1.1E-6, 0) und Ncor2 (9.2E-11, 1.6E-06, 0).
Abbildung 2 zeigt einen Vergleich zwischen den Ergebnissen von drei verschiedenen Werkzeugen und veranschaulicht alternative Spleißmuster im Wnk1-Gen . Die Vulkandiagramme sind in Abbildung 2A (diffSplice) und Abbildung 2B (DEXSeq) dargestellt. Weitere drei hochrangige Gene sind in Supplementary Figure 1 (diffSplice) und Supplementary Figure 2 (DEXSeq) dargestellt. Die y-Achse zeigt die statistische Signifikanz (-log10 P-Werte) und die x-Achse zeigt die Effektgröße (Faltenänderung). Gene, die sich im oberen linken oder rechten Quadranten befinden, deuten auf substanzielle FC und starke statistische Beweise für echte Unterschiede hin.

Abbildung 2. Vergleich alternativer Spleißergebnisse aus diffSplice, DEXSeq und rMATS. |
(A) Vulkandiagramm (links) der RNA-Seq aus der Limma-diffSplice-Analyse: Die x-Achse zeigt die logarithmische Exonfaltenänderung; Die y-Achse zeigt -log10 p-Wert. Jeder Punkt entspricht einem Exon. Horizontale gestrichelte Linie bei p-Wert=1E-5; vertikale gestrichelte Linien bei zweifachem Wechsel (FC). Rote Exons zeigen eine beträchtliche FC- und statistische Signifikanz. Differential Splicing Plot (rechts): Spleißmuster werden für ein Beispielgen Wnk1 gezeigt, bei dem die x-Achse Exon-ID pro Transkript anzeigt; Die y-Achse zeigt die relative Log-Faltungsänderung des Exons (die Differenz zwischen logFC des Exons und dem gesamten logFC für alle anderen Exons). Rot markierte Exons zeigen eine statistisch signifikante differentielle Expression (FDR < 0,1).
(B) Vulkandiagramm (links) und differentielle Exon-Nutzung (rechts) von RNA-Seq aus der DEXSeq-Analyse. Das Wnk1-Gen zeigt eine signifikante differentielle Verwendung von Exons zwischen WT- und Mbnl1-Knock-out, die rosa hervorgehoben sind und den gleichen differentiellen Exons in (A) entsprechen.
(C) Vulkandiagramm (links) und Sashimi-Diagramm (rechts) für Wnk1 aus der rMATS-Analyse. Vulkandiagramm, das ein signifikantes übersprungenes (Kassetten-) Exonereignis (SE) im Wildtyp im Vergleich zum Knockout bei 10% FDR mit Änderung des Prozentsatzes in (PSI oder ΔΨ) > 0,1 darstellt. Die x-Achse zeigt Änderungen der PSI-Werte über Bedingungen hinweg, und die y-Achse zeigt den logarithmischen P-Wert. Das Sashimi-Diagramm zeigt ein übersprungenes Exonereignis im Wnk1-Gen , das einem signifikanten differentiellen Exon in (A) und (B) entspricht. Jede Zeile repräsentiert eine RNA-Seq-Probe: drei Replikate von Wildtyp- und Mbnl1-Knock-out. Die Höhe zeigt die Leseabdeckung in RPKM und die Verbindungsbögen zeigen Verbindungslesevorgänge über Exons hinweg. Annotierte alternative Isoformen des Genmodells sind am unteren Rand des Diagramms dargestellt. Das untere Feld von C zeigt Junction-Lesevorgänge, die zur Berechnung der PSI-Statistik verwendet werden.
(D) Venn-Diagramm zum Vergleich der Anzahl signifikanter differentieller Exons, die mit den verschiedenen Methoden erhalten wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 2 Ein (rechtes Bild) zeigt eine schematische Darstellung der Exon-Unterschiede eines der am besten bewerteten Gene, die logFC auf der y-Achse und die Exon-Nummer auf der x-Achse zeigt. Dieses Beispiel zeigt ein Kassettenexon, das zwischen den Bedingungen für das Gen Wnk1 variiert. Das Differential-Exon-Nutzungsdiagramm von DEXSeq zeigt Hinweise auf differentielles Spleißen an fünf Exon-Standorten in der Nähe von Wnk1.6.45. Die hervorgehobenen Exons in rosa werden wahrscheinlich in Mbnl1 KO-Proben im Vergleich zu WT ausgespleißt. Diese Exons ergänzen die Ergebnisse von diffSplice, das ein ähnliches Muster an der spezifischen genomischen Position zeigt. Weitere Beispiele sind in der ergänzenden Abbildung 1 und der ergänzenden Abbildung 2 dargestellt. Eine detailliertere Ansicht zur Bestätigung interessanter Ergebnisse kann durch den Vergleich von Abdeckungsspuren (Wiggle) in RPM-Einheiten (Reads per million) in den UCSC (University of Santa Cruz) oder IGV (Integrative Genomics Viewer) Genombrowsern (nicht gezeigt) gegeben werden, zusammen mit visueller Korrelation mit anderen Spuren von Interesse, wie bekannten Genmodellen, Konservierung und anderen genomweiten Assays.
Die rMATS-Ausgabetabelle listet signifikante alternative Spleißereignisse nach Typ kategorisiert auf (Zusatztabelle 3). Abbildung 2C zeigt ein Vulkandiagramm von Genen, die alternativ gespleißt sind, wobei die Effektstärke anhand der differentiellen Statistik "Percent Spliced In" (PSI oder ΔΨ) von11 gemessen wird.
PSI bezieht sich auf den Prozentsatz der Lesevorgänge, die mit der Einbeziehung eines Kassettenexons übereinstimmen (d. h. Lesevorgänge, die dem Kassettenexon selbst zugeordnet werden, oder Sperrschichtlesevorgänge, die das Exon überlappen) im Vergleich zu Lesevorgängen, die mit dem Exon-Ausschluss konsistent sind, d. h. Verbindungslesevorgänge über benachbarte stromaufwärts und stromabwärts gelegene Exons (Das untere Feld von Abbildung 2C). Das rechte Feld von Abbildung 2C zeigt das Sashimi-Diagramm des Wnk1-Gens mit differentiellem Spleißereignis, das auf Abdeckungsspuren für das Gen überlagert ist, mit einem übersprungenen Exon in Mbnl1 KO. Arcs, die Exons verbinden, zeigen die Anzahl der Junction-Lesevorgänge (Lesevorgänge, die ein gespleißtes Intron überqueren). Verschiedene Registerkarten der Zusatztabelle 3 zeigen signifikante Lesevorgänge für jeden Ereignistyp, der Verbindungen mit Exon-Grenzen überspannt (Junction Counts und Exon Counts (JCEC)). Abbildung 2D vergleicht die signifikanten differentiell gespleißten Exons, die von den drei Werkzeugen erkannt wurden.

Abbildung 3. Alternative Spleißereignisse, die durch rMATS-Analyse erfasst werden. A) Arten von AS-Ereignissen. Diese Abbildung stammt aus der rMATS-Dokumentation11, die das Spleißereignis mit konstitutiven und alternativ gespleißten Exons erklärt. Beschriftet mit der Nummer jedes Ereignisses bei FDR 10%. B) Sashimi-Diagramm des Add3-Gens, das übersprungenes Exon (SE) aufweist. C) Sashimi-Diagramm des Baz2b-Gens mit alternativer 5'-Spleißstelle (A5SS). D) Sashimi-Diagramm des Lsm14b-Gens mit alternativer 3'-Spleißstelle (A3SS). E) Sashimi-Diagramm des Mta1-Gens, das sich gegenseitig ausschließende Exons (MXE) aufweist. F) Sashimi-Diagramm des Arpp21-Gens mit Retained Intron (RI). Rote Zeilen stellen drei Replikate von Wildtyp-Replikaten dar, und orangefarbene Reihen stellen Mbnl1-Knockout-Replikate dar. Die x-Achse entspricht genomischen Koordinaten und Stranginformationen, die y-Achse zeigt die Abdeckung in RPKM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 3 zeigt Arten von Spleißereignissen SE, A5SS, A3SS, MXE und RI mit Hilfe von Sashimi-Diagrammen der wichtigsten Gene dieser Ereignisse. Beim Vergleich der drei Replikate von WT und Mbnl1_KO wurden insgesamt 1272 SE-Ereignisse, 130 A5SS-, 116 A3SS-, 215 MXE- und 313 RI-Ereignisse bei FDR 10% detektiert. Das Sashimi-Diagramm veranschaulicht die Art des Ereignisses am Beispiel der Top-Gene.
APA:
Die Ausgabe der APA-Analyse ähnelt der AS-Analyse auf Exon-Ebene. Eine Tabelle der Top-Gene, geordnet nach differentieller APA-Aktivität in der 3'UTR, wird bereitgestellt (Zusatztabelle 4 und Zusatztabelle 5). Abbildung 4A zeigt die Vulkandiagramme von Genen durch differentielle APA-Aktivität in 3'UTRs, die mit diffSplice und DEXSeq separat erzeugt wurden. Abbildung 4B zeigt das Venn-Diagramm, in dem die signifikant unterschiedlichen pA-Standortnutzungsergebnisse verschiedener Pipelines verglichen werden. Abbildung 4C und 4D zeigen die schematische Darstellung der differentiellen pA-Standortnutzung in der 3'UTR von Gen Fosl2 (Abbildung 4C) und Papola (Abbildung 4D), die sowohl mit diffSplice als auch mit DEXSeq erzeugt wurden, die experimentell validiert sind, um eine signifikante distale zu proximale Verschiebung (Fosl2) und signifikante proximale zu distale Verschiebung (Papola) der pA-Standortnutzung in DKO zu zeigen. beziehungsweise. Weitere Beispiele sind in der ergänzenden Abbildung 3 und der ergänzenden Abbildung 4 dargestellt.

Abbildung 4. Alternative Polyadenylierungsplots von diffSplice und DEXSeq. A) Vulkandiagramme von PolyA-seq-Daten, die mit diffSplice und DEXSeq generiert wurden. X-Achse zeigt log pA Site Fold Änderung; y-Achse zeigt -log10 p-Wert. Jeder Punkt entspricht einem pA-Standort. Horizontale gestrichelte Linie bei p-Wert=1E-5; vertikale gestrichelte Linien bei 2-fachem FC. Rote Exons zeigen eine beträchtliche FC- und statistische Signifikanz. B) Venn-Diagramm vergleicht die signifikanten unterschiedlichen pA-Standortnutzungsergebnisse, die von verschiedenen Pipelines erfasst wurden. C-D) Differentielle APA-Diagramme , die mit diffSplice und DEXSeq generiert wurden und die proximalen, internen und distalen pA-Stellen für das Fosl2 - und Papola-Gen zeigen. Die Zahlen werden mit der gleichen Funktion wie Abbildung 2 (B) erzeugt, jedoch mit pA-Stellen, die Exons ersetzen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Abbildung 5 ist ein diagnostisches Diagramm zur Bestätigung der erwarteten Leseverteilung um annotierte pA-Spaltstellen für den verwendeten PolyA-seq-Assay. Es zeigt die mittlere Abdeckung in flankierenden Regionen, die an bekannten pA-Spaltungsstellen auf genomweiter Ebene verankert sind. In diesem Fall wird die erwartete Anhäufung von Lesevorgängen vor den Standorten visualisiert. Die an pA-Standorten verankerten Leseverteilungen für alle PolyA-seq-Proben sind in der ergänzenden Abbildung 5 dargestellt.

Abbildung 5. Mittleres Abdeckungsdiagramm um pA-Spaltstellen. Die Spaltstelle für PolyA-seq-Daten wird durch eine vertikale gestrichelte Linie dargestellt. X-Achse zeigt die Basisposition relativ zu pA-Spaltstellen, bis zu 100 Nukleotide stromaufwärts und stromabwärts; Die y-Achse zeigt die mittlere Leseabdeckung über alle pA-Spaltstellen, normalisiert durch die Bibliotheksgröße in CPM. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Die differentiellen APA-Ergebnisse verschiedener Kontraste, die von derselben Pipeline erzeugt werden, können verglichen und verifiziert werden, indem die Leseabdeckung repräsentativer signifikant differentieller pA-Stellen im Genombrowser visualisiert wird. Abbildung 6A zeigt das Venn-Diagramm, das die signifikant unterschiedliche pA-Standortnutzung verschiedener Kontraste vergleicht, die von diffSplice erfasst wurden. Abbildung 6B-D sind die IGV-Schnappschüsse der Leseabdeckung an pA-Stellen für verschiedene Gene, die die Muster zeigen, die mit denen übereinstimmen, die in der APA-Analyse mit diffSplice entdeckt wurden. Abbildung 6B validiert die signifikante proximale bis distale Verschiebung der pA-Standortnutzung für das Gen Paip2, die eindeutig im Kontrast DKO vs WT nachgewiesen wird, aber nicht in den beiden anderen Kontrasten KD vs WT und Ctr vs WT. Abbildung 6C validiert die signifikante distale zu proximale Verschiebung der pA-Standortnutzung für das Gen Ccl2, das eindeutig im Kontrast KD vs WT nachgewiesen wurde. Abbildung 6D validiert die signifikante differentielle pA-Verwendung aller Kontraste für das Gen Cacna2d1.
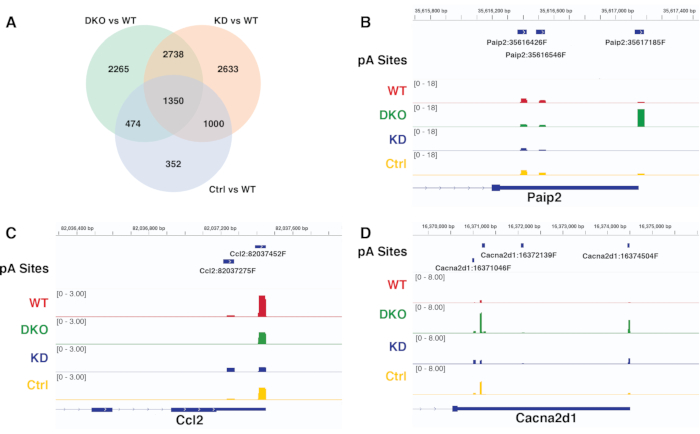
Abbildung 6. Kontrastvergleich und Überprüfung der diffSplice-Ergebnisse. A) Venn-Diagramm zum Vergleich signifikanter differentieller pA-Standortnutzungsergebnisse verschiedener Kontraste, die von diffSplice erfasst wurden. B-D) IGV-Schnappschuss zur Visualisierung von pA-Spitzen deckt die Gene Paip2, Ccl2 und Cacna2d1 unter verschiedenen Bedingungen ab. Jede Spur repräsentiert die Leseabdeckung in einem bestimmten Zustand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Abbildung 1. RNA-Seq-Analyse des differentiellen Spleißens mit Limma diffSplice. (A) Vulkandiagramm der RNA-Seq aus der Limma diffSplice Analyse: Die x-Achse zeigt log Exonfaltenänderung; Die y-Achse zeigt -log10 p-Wert. Jeder Punkt entspricht einem Exon. Horizontale gestrichelte Linie bei p-Wert=1E-5; vertikale gestrichelte Linien bei zweifachem Wechsel (FC). Rote Exons zeigen eine beträchtliche FC- und statistische Signifikanz. (B-D) Differentialspleißdiagramme: Spleißmuster werden beispielsweise die Gene Mbnl1, Tcf7 bzw. Lef1 gezeigt, wobei die x-Achse die Exon-ID pro Transkript anzeigt; Die y-Achse zeigt die relative Log-Faltungsänderung des Exons (die Differenz zwischen logFC des Exons und dem gesamten logFC für alle anderen Exons). Rot markierte Exons zeigen eine statistisch signifikante differentielle Expression (FDR < 0,1). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2. RNA-Seq-Analyse der differentiellen Exon-Nutzung mit DEXSeq. (A) Vulkan-Plot. (B-D) Differentielle Exon-Nutzung der RNA-Seq aus der DEXSeq-Analyse. Die Gene Mbnl1, Tcf7 und Lef1 zeigen eine signifikante differentielle Verwendung von Exons zwischen WT- und Mbnl1-Knock-out, die rosa hervorgehoben sind, was den gleichen differentiellen Exons in Supplementary Abbildung 1 entspricht. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3. Alternative Polyadenylierungsdiagramme durch diffSplice. A) Vulkandiagramme von PolyA-seq-Daten, die mit diffSplice in drei Kontrastpaaren generiert wurden, die aus den PolyA-seq-Daten der Maus erhalten wurden, einschließlich Double Knockout (DKO) vs Wild-Type (WT), Knock-down (KD) vs WT und Control (Ctrl) vs WT. X-Achse zeigt log pA Site Fold Change; y-Achse zeigt -log10 p-Wert. Jeder Punkt entspricht einem pA-Standort. Horizontale gestrichelte Linie bei p-Wert=1E-5; vertikale gestrichelte Linien bei 2-fachem FC. Rote pA-Standorte weisen eine beträchtliche FC- und statistische Signifikanz auf. B) Differentielle APA-Diagramme, die mit diffSplice generiert wurden und die proximalen, internen und distalen pA-Stellen für die hochrangigen Gene S100a7a, Tpm1 und Smc6 zeigen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4. Differentielle pA-Nutzungsanalyse durch DEXSeq-Pipeline. A) Vulkandiagramme von PolyA-seq-Daten, die mit DEXSeq in drei Paaren generiert wurden, die aus den PolyA-seq-Daten der Maus erhalten wurden, einschließlich Double Knockout (DKO) vs Wild-Type (WT), Knock-down (KD) vs WT und Control (Ctrl) vs WT. X-Achse zeigt log pA Site Fold Change; y-Achse zeigt -log10 p-Wert. Jeder Punkt entspricht einem pA-Standort. Horizontale gestrichelte Linie bei p-Wert=1E-5; vertikale gestrichelte Linien bei 2-fachem FC. Rote pA-Standorte weisen eine beträchtliche FC- und statistische Signifikanz auf. B) Differentielle APA-Diagramme, die mit DEXSeq generiert wurden und die proximalen, internen und distalen pA-Stellen für die hochrangigen Gene S100a7a, Tpm1 und Smc6 zeigen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5. Mittleres Abdeckungsdiagramm und Heatmaps um pA-Spaltstellen. Die Abdeckung wurde für vier Bedingungen gezeigt, wobei die Gene auf den Vorwärts- und Rückwärtssträngen separat dargestellt wurden. X-Achse zeigt die Basisposition relativ zu pA-Spaltstellen, bis zu 100 Nukleotide stromaufwärts und stromabwärts; y-Achse bezieht sich auf die mittlere Abdeckung an entsprechenden relativen Basispositionen über alle pA-Spaltstellen. Heatmaps bieten eine alternative Ansicht, wobei jede pA-Spaltungsstelle als separate Zeile auf der x-Achse angezeigt wird, geordnet nach Abdeckung. Die Intensität zeigt die Leseabdeckung an (siehe Legende). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1. diffSplice-Ausgabe der AS-Analyse. Die erste Registerkarte definiert die Spaltennamen für die ursprünglichen Ausgaben, die auf der zweiten (Exon-Ebene) und dritten Registerkarte (Genebene) angezeigt werden. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 2. DEXSeq-Ausgabe der AS-Analyse. Die erste Registerkarte definiert die Spaltennamen für die ursprüngliche Ausgabe, die auf der zweiten (Exon-Ebene) und dritten Registerkarte (Genebene) angezeigt wird. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 3. rMATS-Ausgabe der AS-Analyse. Die erste Registerkarte definiert die Spaltennamen für die Zusammenfassungsdatei (Registerkarte 2) und die JCEC-Dateien für jedes Ereignis (Registerkarte 3-7). Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 4. diffSplice-Ausgabe der APA-Analyse. Die erste Registerkarte definiert die Spaltennamen für die ursprüngliche Ausgabe, die in der zweiten (pA-Site-Ebene) und dritten (Genebene) Registerkarte angezeigt wird. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 5. DEXSeq-Ausgabe der APA-Analyse. Die erste Registerkarte definiert die Spaltennamen für die ursprüngliche Ausgabe, die in der zweiten (pA-Site-Ebene) und dritten (Genebene) Registerkarte angezeigt wird. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 6. Eine Zusammenfassung der Anzahl der signifikant geänderten Exons für AS- und pA-Standorte für APA. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Tabelle 7. Eine Zusammenfassung der in der AS/APA-Analyse verwendeten Werkzeuge und Pakete. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
In dieser Studie evaluierten wir Exon-basierte und ereignisbasierte Ansätze zum Nachweis von AS und APA in Bulk-RNA-Seq- und 3'-Endsequenzierungsdaten. Die Exon-basierten AS-Ansätze erzeugen sowohl eine Liste differentiell exprimierter Exons als auch ein Ranking auf Genebene, geordnet nach der statistischen Signifikanz der gesamten differentiellen Spleißaktivität auf Genebene (Tabellen 1-2, 4-5). Für das diffSplice-Paket wird die differentielle Nutzung bestimmt, indem gewichtete lineare Modelle auf Exonebene angepasst werden, um die differentielle Log-Faltenänderung eines Exons gegen die durchschnittliche Log-Faltenänderung der anderen Exons innerhalb desselben Gens (pro Exon FC genannt) abzuschätzen. Die statistische Signifikanz auf Genebene wird berechnet, indem einzelne Exon-Level-Signifikanztests zu einem Gen-weisen Test mit der Simes-Methode10 kombiniert werden. Dieses Ranking nach differentieller Spleißaktivität auf Genebene kann anschließend verwendet werden, um eine Gensatzanreicherungsanalyse (GSEA) der beteiligten Schlüsselwege durchzuführen10. DEXSeq verwendet eine ähnliche Strategie, indem es ein verallgemeinertes lineares Modell zur Messung der differentiellen Exon-Nutzung anpasst, obwohl es sich in bestimmten Schritten wie Filterung, Normalisierung und Dispersionsschätzung unterscheidet. Beim Vergleich der Top-500-Exons, die AS-Aktivität und APA mit DEXSeq und DiffSplice zeigten, fanden wir eine Überlappung von 310 Exons bzw. 300 pA-Standorten, was die Übereinstimmung der beiden Exon-basierten Ansätze zeigt, die auch in einer früheren Studie gezeigt wurde 29. Es wird empfohlen, eine Kombination aus einem Exon-basierten (entweder DEXSeq oder diffSplice) und einem ereignisbasierten Ansatz für die umfassende Erkennung und Klassifizierung von AS zu verwenden. Für APA können Benutzer entweder DEXSeq oder diffSplice wählen: Beide Methoden haben sich in einer Vielzahl von Transkriptomik-Experimenten als gut erwiesen29.
Bei der Vorbereitung der RNA-seq-Bibliothek für eine AS-Analyse ist es wichtig, ein strangspezifisches Bulk-RNA-seq-Protokoll8 zu verwenden, da sich ein großer Teil der Gene in Wirbeltiergenomen auf verschiedenen Strängen überlappt und ein nicht-strangspezifisches Protokoll nicht in der Lage ist, diese überlappenden Regionen zu unterscheiden, was die endgültige Exon-Erkennung verwirrt. Eine weitere Überlegung ist die Lesetiefe, wobei Spleißanalysen eine tiefere Sequenzierung erfordern als DGE, z. B. 30-60 Millionen Lesevorgänge pro Probe gegenüber 5-25 Millionen Lesevorgängen pro Probe für DGE (https://sapac.support.illumina.com/bulletins/2017/04/considerations-for-rna-seq-read-length-and-coverage-.html). Alle im Protokoll demonstrierten Tools unterstützen sowohl Single-End- als auch Paired-End-Sequenzierungsdaten. Wenn nur bekannte Genannotationen verwendet werden, um Junction-Reads zu erkennen, können Single-ended-kürzere Reads (≥ 50 bp) verwendet werden, obwohl de novo die Detektion neuartiger Spleißverbindungen von gepaarten und längeren (≥ 100bp) Lesevorgängen profitiert30,31. Die Wahl des RNA-Extraktionsprotokolls - entweder PolyA-Selektion oder rRNA-Depletion - hängt von der Qualität der RNA und der experimentellen Frage ab - siehe31 für eine Diskussion. Abhängig von den Details des Bibliotheksaufbaus sind Änderungen an den hier angegebenen Beispielskripten für die Parameter Leseausrichtung, Feature-Zählung und rMATS erforderlich. Bei der Berechnung der anfänglichen Exon-Level-Lesezahlen mit featureCounts oder ähnlichen Methoden muss darauf geachtet werden, dass die Funktionsoptionen für Zählungen und Strandedness korrekt konfiguriert werden: In featureCounts setzen wir das Argument "strandSpecific" entsprechend für das verwendete strangspezifische RNA-seq-Protokoll; und für die Quantifizierung auf Exon-Ebene wird erwartet, dass ein Lesevorgang benachbarte Exons abbildet, und daher setzen wir den allowMultiOverlap-Parameter auf TRUE. Für APA gibt es verschiedene 3'-Endsequenzierungsprotokolle6, die sich in der genauen Position der Peaks relativ zur pA-Stelle unterscheiden. Für unsere Beispieldaten bestimmen wir, dass der Peak 60 bp stromaufwärts der pA-Site liegt, wie in Abbildung 5 gezeigt, und diese Analyse muss für andere 3'-Endsequenzierungsprotokolle angepasst werden.
In diesem Protokoll beschränken wir den Umfang auf die Diskussion von Differentialanalysen auf der Ebene einzelner Exons und Spleißereignisse, die aus benachbarten Exon-Intron-Kombinationen bestehen. Wir diskutieren nicht die Klasse von Analysen, die auf der Isoform-de-novo-Rekonstruktion basieren, wie Manschettenknöpfe, Manschettendiff32, RSEM 33, Kallisto34, die darauf abzielen, die absolute und relative Expression ganzer alternativer Isoformen zu erkennen und zu quantifizieren. Die Exon- und ereignisbasierten Methoden sind empfindlicher für die Erkennung einzelner Spleißereignisse30 und liefern in vielen Fällen alle Informationen, die für die weitere Analyse benötigt werden, ohne dass eine Quantifizierung auf Isoformebene erforderlich ist.
Die neueste Version der Quelldateien in diesem Protokoll finden Sie unter https://github.com/jiayuwen/AS_APA_JoVE
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Studie wurde von einem Australian Research Council (ARC) Future Fellowship (FT16010043) und ANU Futures Scheme unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Not relevent for computational study |
Referenzen
- Katz, Y., Wang, E. T., Airoldi, E. M., Burge, C. B. Analysis and design of RNA sequencing experiments for identifying isoform regulation. Nature Methods. 7 (12), 1009-1015 (2010).
- Wang, Y., et al. Mechanism of alternative splicing and its regulation. Biomedical Reports. 3 (2), 152-158 (2015).
- Mehmood, A., et al. Systematic evaluation of differential splicing tools for RNA-seq studies. Briefings in Bioinformatics. 21 (6), 2052-2065 (2020).
- Movassat, M., et al. Coupling between alternative polyadenylation and alternative splicing is limited to terminal introns. RNA Biology. 13 (7), 646-655 (2016).
- Tian, B., Manley, J. L. Alternative polyadenylation of mRNA precursors. Nature Reviews Molecular Cell Biology. 18 (1), 18-30 (2017).
- Herrmann, C. J., et al. PolyASite 2.0: a consolidated atlas of polyadenylation sites from 3' end sequencing. Nucleic Acids Research. 48 (1), 174-179 (2020).
- Liu, R., Loraine, A. E., Dickerson, J. A. Comparisons of computational methods for differential alternative splicing detection using RNA-seq in plant systems. BMC Bioinformatics. 15 (1), 364(2014).
- Conesa, A., et al. A survey of best practices for RNA-seq data analysis. Genome Biology. 17 (1), 13(2016).
- Anders, S., Reyes, A., Huber, W. Detecting differential usage of exons from RNA-seq data. Genome Research. 22 (10), 2008-2017 (2012).
- Ritchie, M. E., et al. limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Research. 43 (7), 47(2014).
- Shen, S., et al. rMATS: Robust and flexible detection of differential alternative splicing from replicate RNA-Seq data. Proceedings of the National Academy of Sciences. 111 (51), 5593-5601 (2014).
- Mehmood, A., et al. Systematic evaluation of differential splicing tools for RNA-seq studies. Briefings in bioinformatics. 21 (6), 2052-2065 (2020).
- Kanitz, A., et al. Comparative assessment of methods for the computational inference of transcript isoform abundance from RNA-seq data. Genome biology. 16 (1), 1-26 (2015).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (12), 550(2014).
- Sznajder, L. J., et al. Loss of MBNL1 induces RNA misprocessing in the thymus and peripheral blood. Nature Communications. 11, 1-11 (2020).
- Batra, R., et al. Loss of MBNL leads to disruption of developmentally regulated alternative polyadenylation in RNA-mediated disease. Molecular Cell. 56 (2), 311-322 (2014).
- Leinonen, R., Sugawara, H., Shumway, M., et al. The sequence read archive. Nucleic acids research. 39, suppl_1 19-21 (2010).
- Tange, O. GNU parallel-the command-line power tool. 36, 42-47 (2011).
- Andrews, S. FastQC: a quality control tool for high throughput sequence data. Bioinformatics. , Available from: http://www.bioinformatics.babraham.ac.uk/projects/fastqc/2010 (2011).
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet journal. 17 (1), 10-12 (2011).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Dobin, A., et al. STAR: ultrafast universal RNA-seq aligner. Bioinformatics. 29 (1), Oxford, England. 15-21 (2013).
- Robinson, M. D., McCarthy, D. J., Smyth, G. K. edgeR: a Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics. 26 (1), 139-140 (2010).
- Robinson, M. D., Oshlack, A. A scaling normalization method for differential expression analysis of RNA-seq data. Genome Biology. 11 (3), 25(2010).
- Veiga, D. F. T. maser: Mapping Alternative Splicing Events to pRoteins. R package version 1.4.0. , (2019).
- Langmead, B., Trapnell, C., Pop, M., Salzberg, S. L. Ultrafast and memory-efficient alignment of short DNA sequences to the human genome. Genome Biology. 10 (13), 25(2009).
- Quinlan, A. R., Hall, I. M. BEDTools: a flexible suite of utilities for comparing genomic features. Bioinformatics. 26 (6), 841-842 (2010).
- Ramírez, F., Dündar, F., Diehl, S., Grüning, B. A., Manke, T. deepTools: a flexible platform for exploring deep-sequencing data. Nucleic acids research. 42 (1), 187-191 (2014).
- Merino, G. A., Conesa, A., Fernández, E. A. A benchmarking of workflows for detecting differential splicing and differential expression at isoform level in human RNA-seq studies. Briefings in bioinformatics. 20 (2), 471-481 (2019).
- Chhangawala, S., Rudy, G., Mason, C. E., Rosenfeld, J. A. The impact of read length on quantification of differentially expressed genes and splice junction detection. Genome biology. 16 (1), 1-10 (2015).
- Conesa, A., et al. A survey of best practices for RNA-seq data analysis. Genome Biol. 17, 13(2016).
- Trapnell, C., et al. Differential gene and transcript expression analysis of RNA-seq experiments with TopHat and Cufflinks. Nat Protoc. 7 (3), 562-578 (2012).
- Li, B., Dewey, C. N. RSEM: accurate transcript quantification from RNA-Seq data with or without a reference genome. BMC Bioinformatics. 12, 323(2011).
- Bray, N. L., Pimentel, H., Melsted, P., Pachter, L. Near-optimal probabilistic RNA-seq quantification. Nat Biotechnol. 34 (5), 525-527 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten